Tạo tôm càng xanh toàn đực Macrobrachium rosenbergii nhờ bất hoạt gen Insulin-Like tuyến đực qua công nghệ can thiệp RNA
TÓM TẮT
Nhu cầu cấp thiết về nguồn tôm giống càng xanh toàn đực (Macrobrachium rosenbergii) đang
là mối quan tâm hàng đầu của người dân nuôi trồng thủy sản ở Việt Nam. Giải pháp công nghệ
sinh học mới có thể đáp ứng được nhu cầu thị trường và xã hội hóa là công nghệ can thiệp RNA
nhằm bất hoạt việc giải mã hormone được sinh ra từ tuyến đực cho mục đích tạo ra con tôm cái giả
(neo-female) để sản xuất con giống tôm càng xanh toàn đực. Kết quả hiện đạt được nghiên cứu là
tổng hợp thành công sợi đôi double-stranded RNA (dsRNA) trình tự mRNA mã hoá gen tuyến đực
Androgenic Gland Hormone. Tôm post càng xanh toàn đực có độ tuổi càng nhỏ thì hiệu quả chuyển
cái càng cao. Tôm chuyển cái thành công thì sau 3,5 tháng tính từ thời điểm bắt đầu tiêm sẽ thành
thục sinh dục và tham gia sinh sản. Tỷ lệ chuyển cái sau 2,5 – 3 tháng tiêm hiện đạt 88-92%, tần xuất
tiêm sợi đôi dsRNA cho hiệu quả chuyển cái cũng như cho tỷ lệ sống

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5
Trang 6

Trang 7

Trang 8

Trang 9
Tóm tắt nội dung tài liệu: Tạo tôm càng xanh toàn đực Macrobrachium rosenbergii nhờ bất hoạt gen Insulin-Like tuyến đực qua công nghệ can thiệp RNA

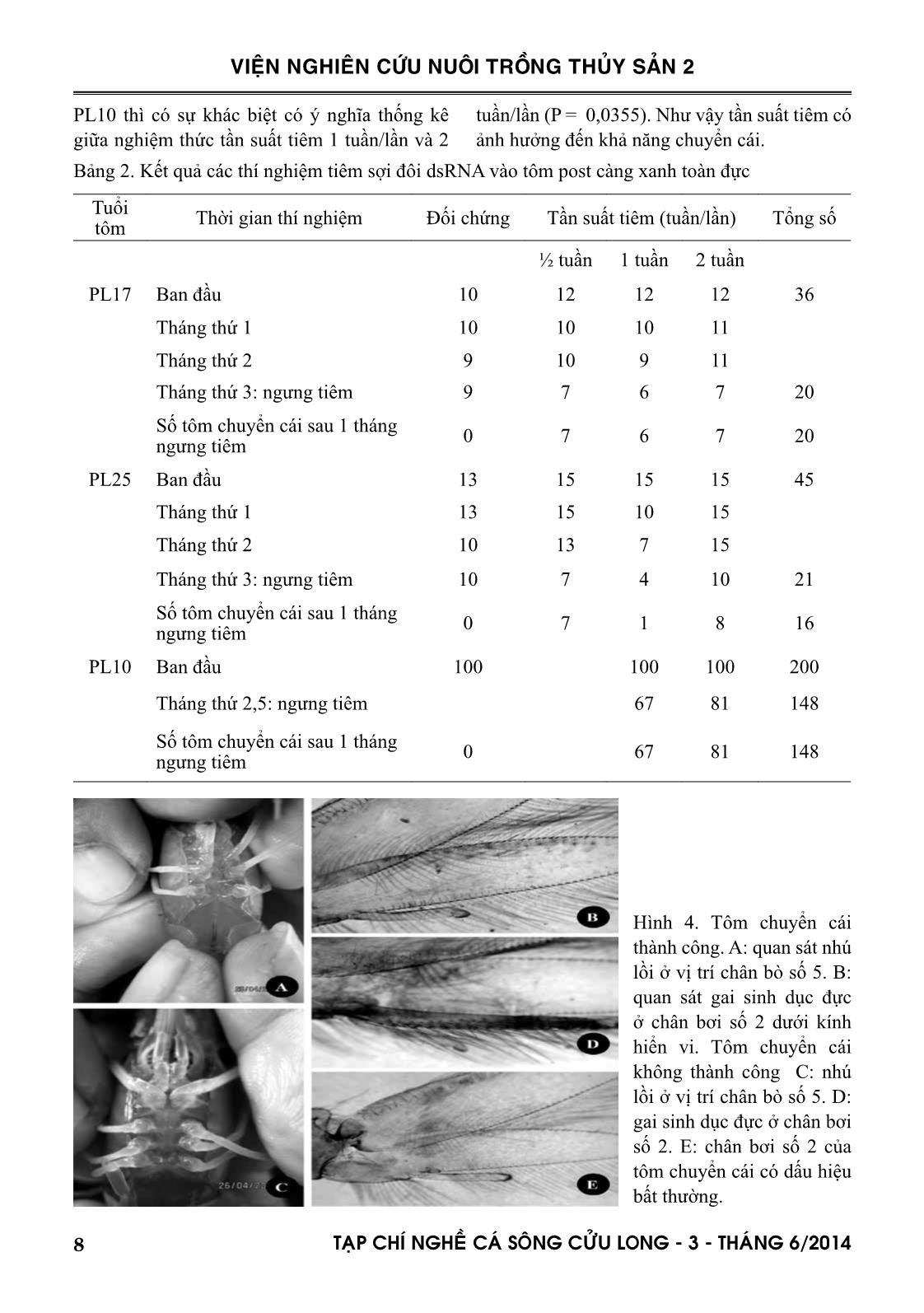
chuyển cái thành công ở các nghiệm thức trong các thí nghiệm tiêm tôm. III. KẾT QUẢ 3.1. Tổng hợp Mr-IAG dsRNA 3.1.1. Tổng hợp các sợi đơn sense và antisense RNA Sản phẩm các sợi đơn sense và antisense RNA đúng kích thước 560 bp và sau đó được tinh sạch trước khi cho vào lai ủ để tạo sợi đôi dsRNA. Hình 2. Sợi sense và antisen RNA. Bên trái thang DNA là sản phẩm sau khi tinh sạch: giếng S là sợi sense, giếng AS là sợi antisense. Bên phải thang DNA là sản phẩm trước khi tinh sạch:giếng S là sợi sense, giếng AS là sợi antisense 3.1.2. Kiểm tra chất lượng sợi đôi dsRNA Ở bước này, nghiên cứu kiểm chứng lại một lần nữa là trình tự gen đích (dsRNA/Mr- IAG) có được tổng hợp thành công để chuyển thành sợi đôi dsRNA hay không. Các mẫu được pha loãng 50 lần để thực hiện bước kiểm tra chất lượng. 7TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Hình 3. Kết quả xử lý các sợi sense, antisense, sRNA bằng các loại enzyme, mẫu được pha loãng 50 lần Các giếng bên trái thang DNA là các giếng thể hiện phản ứng kiểm tra sợi đơn. Giếng S là sợi đơn RNA sense, giếng D là sợi đơn RNA sense xử lý với DNase, giếng R là sợi đơn RNA sense xử lý với RNase, giếng D + R là sợi sense được xử lý với hai loại enzyme DNase và Rnase. Bên phải thang DNA là các thử nghiệm kiểm tra sợi đôi double – stranded RNA (dsRNA). Giếng DS là sợi đôi dsRNA sau khi lai hai mạch sense và antisense, giếng D là sợi đôi dsRNA được xử lý với DNase, giếng R là sợi đôi dsRNA được xử lý với RNase, giếng D + R là sợi đôi dsRNA được xử lý với hai enzyme DNase và RNase, giếng RIII là sợi đôi dsRNA được xử lý với RNase III, giếng C là Positive control. Khi xử ký kiểm tra sợi dsRNA thì do nó là sợi đôi nên không bị phân giải bởi RNase. Tuy nó là sợi đôi nhưng bản chất nó không phải là DNA nên cũng không bị phân giải bởi DNase. Khi xử lý bằng hỗn hợp hai enzyme DNase và RNase thì cũng không bị phân giải. Cho nên tất cả các giếng này đều cho băng hình kích thước khoảng 560 bp trên agrose 1.5%. Tuy nhiên khi được xử lý bằng RNase III - một loại enzyme có khả năng phân giải RNA sợi đôi thì trên gel điện di không cho băng hình sản phẩm double – stranded RNA. Positive control cho kết quả trên gel điện di với kích thước khoảng 1000 bp. Bên trái thang DNA là các thử nghiệm kiểm tra sợi đơn single - stranded RNA (ss RNA). Khi kiểm tra xử lý sợi single - stranded RNA (sense hoặc antisense) với RNase, sợi này sẽ bị phân hủy bởi enzyme này nên khi điện di sẽ không cho vạch xuất hiện trên gel. Nhưng khi xử lý nó với DNase thì nó vẫn không bị phân giải do đó có băng hình xuất hiện trên gel với kích thước khoảng 560 bp. Khi nó được xử lý với hỗn hợp hai enzyme DNase và RNase thì do có sự hiện diện của RNase nên kết quả sau điện di cũng không cho băng hình nào trên bảng gel. 3.2. Thử nghiệm tiêm sợi đôi dsRNA vào tôm Kết quả các thí nghiệm tiêm sợi đôi dsRNA vào tôm post càng xanh toàn đực được thể hiện theo 3 độ tuổi tôm post toàn đực khác nhau: PL17, PL25 và PL10 được thể hiện ở bảng 2 và một số hình ảnh tôm thí nghiệm chuyển cái được minh họa ở hình 4. Trong thí nghiệm tiêm tôm ở tuổi PL17, tổng số lượng tôm tiêm là 36 con chia đều 3 nghiệm thức tiêm. Số lượng tôm chuyển cái còn lại đến tháng thứ 4 sau khi loại trừ số tôm hao hụt và tôm chuyển cái không thành công là 20 con. Tương tự cho trường hợp thí nghiệm tiêm tôm ở tuổi PL25, tổng số lượng tôm tiêm là 45 con, số tôm chuyển cái cuối cùng là 16 con. Nhìn chung, kết quả tỷ lệ chuyển cái thành công ở hai thí nghiệm này có khác biệt nhau (tỷ lệ này khoảng 55% ở thí nghiệm tôm PL17 và 35% trong thí nghiệm tôm PL25). Tuy nhiên khi sử dụng thống kê Fisher exact test (two-tailed) so sánh kết quả hai thí nghiệm tiêm tôm PL17 và PL25 thấy không khác biệt có ý nghĩa (P = 0,1147). Khi so sánh kết quả thí nghiệm tiêm tôm ở tuổi tôm PL17 và PL10 thì thống kê Fisher exact test (two-tailed) cho kết quả tỷ lệ chuyển cái thành công ở hai thí nghiệm này là khác biệt có ý nghĩa (P = 0,0291). Đồng thời kết quả tỷ lệ chuyển cái thành công ở hai thí nghiệm tuổi tôm PL25 và PL10 là có sự khác biệt có ý nghĩa lớn (P < 0,0001). Căn cứ trên yếu tố tần suất tiêm thì ở cả hai thí nghiệm tôm PL17 và PL25 thì không có sự khác biệt có ý nghĩa ở cả 3 nghiệm thức tiêm (P > 0,05). Chỉ trong thí nghiệm tiêm tôm ở tuổi 8 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 PL10 thì có sự khác biệt có ý nghĩa thống kê giữa nghiệm thức tần suất tiêm 1 tuần/lần và 2 tuần/lần (P = 0,0355). Như vậy tần suất tiêm có ảnh hưởng đến khả năng chuyển cái. Bảng 2. Kết quả các thí nghiệm tiêm sợi đôi dsRNA vào tôm post càng xanh toàn đực Tuổi tôm Thời gian thí nghiệm Đối chứng Tần suất tiêm (tuần/lần) Tổng số ½ tuần 1 tuần 2 tuần PL17 Ban đầu 10 12 12 12 36 Tháng thứ 1 10 10 10 11 Tháng thứ 2 9 10 9 11 Tháng thứ 3: ngưng tiêm 9 7 6 7 20 Số tôm chuyển cái sau 1 tháng ngưng tiêm 0 7 6 7 20 PL25 Ban đầu 13 15 15 15 45 Tháng thứ 1 13 15 10 15 Tháng thứ 2 10 13 7 15 Tháng thứ 3: ngưng tiêm 10 7 4 10 21 Số tôm chuyển cái sau 1 tháng ngưng tiêm 0 7 1 8 16 PL10 Ban đầu 100 100 100 200 Tháng thứ 2,5: ngưng tiêm 67 81 148 Số tôm chuyển cái sau 1 tháng ngưng tiêm 0 67 81 148 Hình 4. Tôm chuyển cái thành công. A: quan sát nhú lồi ở vị trí chân bò số 5. B: quan sát gai sinh dục đực ở chân bơi số 2 dưới kính hiển vi. Tôm chuyển cái không thành công C: nhú lồi ở vị trí chân bò số 5. D: gai sinh dục đực ở chân bơi số 2. E: chân bơi số 2 của tôm chuyển cái có dấu hiệu bất thường. 9TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 IV. THẢO LUẬN Sản phẩm sợi đôi dsRNA Mr-IAG cho kết quả ở kích thước khoảng 550bp và trình tự tương đồng cao (99%: phân tích giải trình tự từ kết quả trước của đề tài) với trình tự công bố của tác giả Ventura (2009). Đồng thời qua việc kiểm tra chất lượng dsRNA Mr-IAG ( kiểm tra, xử lý bằng 3 loại enzyme đặc thù) cho thấy sản phẩm sợi đôi dsRNA Mr-IAG tổng hợp được là RNA mạch đôi và đứng trình tự công bố và sẵng sàng cho việc thử nghiệm tiêm sợi dsRNA vào tôm. Kết quả tiêm tôm cho thấy, trong cả ba thí nghiệm trên 3 độ tuổi tôm post toàn đực khác nhau: PL17, PL25 và PL10 thì đều cho kết quả chuyển cái. Tuy nhiên ở độ tuổi càng lớn PL25 thì hiệu quả chuyển cái thấp (ở đây không báo cáo số liệu chi tiết về số tôm không chuyển cái là do tôm bị hao hụt và một phần do tôm đã chuyển cái nhưng bị quay trở lại giới tính ban đầu là tôm đực – ‘lại đực’). Tuy nhiên trong quá trình thí nghiệm, tôm lớn PL25, rất dễ tiêm, tỷ lệ sống cao, ít hao hụt nhưng tôm ở tuổi này đã có dấu hiệu biệt hoá giới tính nên khả năng ức chế hoạt động phát triển của hormone sinh dục đực của sợi dsRNA là không đạt hiệu quả cao. Ngược lại, tôm nhỏ PL10, khi tiêm thì chỉ có số liệu tôm do hao hụt còn tỷ lệ ‘lại đực’ gần như không có. Trong thí nghiệm tiêm tôm PL10, sự khác biệt có ý nghĩa giữa hai tần suất tiêm chủ yếu là do khi giảm tần suất tiêm sẽ giảm tỷ lệ hao hụt vì tiêm nhiều lần, tôm yếu và dễ chết dẫn đến tỷ lệ tôm còn lại chuyển cái thành công thấp. V. KẾT LUẬN Chất lượng sợi đôi dsRNA có hiệu quả chuyển đổi giới tính cho tôm càng xanh hậu ấu trùng đực. Tuổi tôm ảnh hưởng rất lớn đến sự chuyển cái của tôm thí nghiệm tiêm sợi đôi dsRNA, tuổi tôm càng nhỏ thì hiệu quả chuyển cái càng cao và tỷ lệ tôm lại đực sẽ không xảy ra. Tần suất tiêm không ảnh hưởng nhiều đến tỷ lệ tôm chuyển cái thành công, nhưng tần suất tiêm càng dày thì tôm phát triển kém hoặc tăng tỷ lệ chết do tôm yếu khi tiêm nhiều lần. LỜI CÁM ƠN Nhóm thực hiện đề tài xin chân thành cám ơn đến Vụ KHCN&MT, Ban lãnh đạo Viện Nghiên cứu Nuôi trồng Thủy sản II, Trung tâm Quốc gia Giống Thủy sản Nước ngọt Nam Bộ và các thành viên đề tài đã tận tình định hướng kịp thời, đóng góp ý kiến chiến lược để đề tài có kết quả thành công. TÀI LIỆU THAM KHẢO Aigner A., 2007. Nonviral in vivo delivery of therapeu- tic small interfering RNAs. Curr. Opin. Mol. Ther. 9, pp 345–352. Davis M.E., Zuckerman, Chung Hang J., Choi, David Seligson, Anthony Tolcher, Christopher A., Alabi, Yun Yen, Jeremy D., Heidel & Antoni Ribas, 2010. Evidence of IRNA in humans from systemically administered siRNA via targeted nanoparticles. Nature. 2010 Apr 15; 464(7291):1067–70. Epub 2010 Mar 21. Fingerman M., 1997. Role of neurotransmitters in regulating reproductive hormon release and gonadal maturation in decapods crustaceans, Invertebrate Reproduction and Development 31, pp 47– 74. Galvani A., and Sperling L., 2002. RNA interference by feeding in Paramecium. Trends Genet 18, 11–12. Guan, Haoji, 2006. Double–stranded RNA induced gene silencing of neuropeptide genes in sand shrimp, Metapenaeus ensis and development of crustacean primary cell culture. Hong Kong University. Nagamine C., Knight W., Maggeneti A., and Paxman, G., 1980. Masculinization of female Macrobrachium rosenbergii (de Man) (Decapoda, Palaemonidae) by androgeneic gland implantation, General and comparative endrocrinology 31(4), 442–457. 10 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Ongvarrasopone C., Roshorm Y., and Panyim S., 2007. A Simple and Cost Effective Method to Generate dsRNA for IRNA Studies in Invertebrates. Science Asia 33, 35–39. Paddison P.J., Caudy A.A., Bernstein E., Hannon G.J., Conklin D.S., 2002. Short hairpin RNAs (shRNAs) induce sequence–specific silencing in mammalian cells. Genes Dev. 16, 948–958. Peng Y., Lu J.X., Shen X.F., 2007. shRNA driven by Pol II/T7 dual–promoter system effectively induce cell–specific RNA interference in mammalian cells. Biochem. Biophys. Res. Commun. 360, 496–500. Plasterk, 2002. RNA silencing: the geneome’s immune system. Science 17 May 2002: Vol. 296 no. 5571 pp. 1263–1265. Sachiko Suzuki, 1999. Androgeneic gland hormon is a sex–reversing factor but cannot be a sex– determining factor in the female Crustacean Isopods Armadillidium vulgare. General and comparartive endrocrinology 115(3), 370–378. Sagi A., and Afalo E.D., 2005. The androgeneic gland and monosex culture of freshwater prawn Macrobrachium Rosenbergii (De Man):a biotechnological perspective. Aquaculture Research 36, 231–237. Sagi Amir, Cohen Dan, Milner Yoram, 1989. Effect of androgene gland ablation on morphotypic differentiation and sexual characteristics of male Freshwater Prawn, Macrobrachium rosenbergii, General and comparative endocrinology 77, 15 – 22. Sagi A., Milstein A., Eran Y., Joseph D., Khaila I., Abdu U., Harpaz S., and Karplis I., 1997. Culture of the Australian redclaw crayfish (Cherax quadricarinatus) in Israel, II. Second growout season of overwintered populations. Israelli Journal of Aquaculture–Bamidgeh 59, 222–229. Sagi A., Khalaila I., Barki I., Hulata G., and Karplus I., 1996. Intersex red claw crayfish, Cherax quadricarinatu (Von martens): functional males with pre–viellogeneic ovaries. Biol.Bull 190, 16–23. Sagi Amir, Snir Eviatar and Khalaila Isam, 1995. Sexual differentiation in decapods crustaceans: role of the androgeneic gland. Invertenrate Reproduction an Development 31 (1–3), 55 – 61. Sagi A., and Ra`ana Z., 1988. Morphotypic differentiation of males of freshwater prawn Macrobrachium rosengergii: changes in the midgut glands and the reproductive system. Journal of crustacean biology 8, 43–47. Sanders B., 1983. Insulin–like peptides in the lobster Homarus americanus.I. insulin immunoreactivity. General and Comparative Endocrinology 50, 366–373. Spence R. Malecha, Patricia, Nevin A., Phyllis Ha, Loena E. Barck, Yara Lamadrid–Rose, Scott Masuno and Dennis Hedgecock, 1992. Sex– ratios and sex–determination in progeney from crosses of surgically sex–reversed freshwater prawns, Macrobrachium rosenbergii. Aquaculture 105(3–4), pp 201–218. Tabara H., Grishok, A., Mello, C., 1998. IRNA in C.elegans: Soaking in the Geneome Sequence. Science 16 October 1998: Vol. 282 no. 5388, pp. 430–431. The Nobel Prize in Physiology ỏ Medicin, 2006. RNA interference, pp 1–10. T., Ramos L., Huberman A., 2007. Effect of RNA interference on gene functions of aquatic organisms. Biotecnologia Aplicada Vol. 24, No. 2. Ventura T., Manor R., Aflalo E.D., Weil S., Raviv S., Glazer L., and Sagi A., 2009. Temporal silencing of an androgeneic gland–specific insulin–like gene affecting phenotypical geneder differences and spermatogenesis. Department of Life. General Endocrinology 150, 1278–1286. Zamore P.D., Tuschl T., Sharp P.A., and Bartel D.P., 2000. IRNA: Double–stranded RNA directs the ATP–dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell. 101, 25–33. 11TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 ALL MALE REPRODUCTION OF Macrobrachium rosenbergii BY INSULIN- LIKE GENE SILENCING IN THE ANDROGENIC GLAND THROUGH RNA INTERFERENCE Bui Thi Lien Ha1, Nguyen Duc Minh1, Le Thi Hoai Oanh1, Tran Thanh Vo1, Nguyen Dien1, Le Chinh1, Nguyen Viet Dung2, Nguyen Van Hao3 ABSTRACT Within the aquaculture industry in Vietnam, the demand of the all male prawn Macrobrachium rosenbergii seed is one of overriding importance. Macrobrachium rosenbergii is an important freshwater prawn species having commercial importance in Vietnam. The all male prawn farming brings most highly profitable for farmers; therefore seed demand for popular culture is always very high. Lasted technology called RNA interference for creating neo-female is inactivated a single IAG-encoding gene of male insulin-like prawn (Macrobrachium rosenbergii insulin-like androgeneic gland, Mr-IAG) for producing all male seed is being successfully implemented at the Research Institute for Aquaculture No. 2. The currently result has achieved with double-stranded RNA (dsRNA) synthesis to mRNA encodes Androgenic Gland. The important factor for success is very young shrimp age at the time of the first injection, period and time of injections. Sex reversal rate after two to three months injection is 88-92% female, dsRNA of injection time around 2 months; frequency of dsRNA injection is 2 weeks. Keywords: fresh water prawn, sex-reversal, iRNA. Người phản biện: ThS. Nguyễn Thị Hiền Ngày nhận bài: 10/02/2014 Ngày thông qua phản biện: 28/02/2014 Ngày duyệt đăng: 01/4/2014 1 Department of Experimental Biology, Research Institute for Aquaculture No 2. Email: lienha09@gmail.com 2 Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No 2. 3 Research Institute for Aquaculture No 2.
File đính kèm:
 tao_tom_cang_xanh_toan_duc_macrobrachium_rosenbergii_nho_bat.pdf
tao_tom_cang_xanh_toan_duc_macrobrachium_rosenbergii_nho_bat.pdf

