Phát triển quy trình đặc hiệu PCR chẩn đoán IHHNV cho type lây nhiễm trên tôm sú nuôi ở đồng bằng sông Cửu Long
TÓM TẮT
Virus gây bệnh nhiễm trùng và hoại tử tế bào máu (IHHNV) là nguyên nhân gây chết trên tôm xanh
và hội chứng biến dạng và còi cọc chậm lớn trên tôm thẻ chân trắng và tôm sú nuôi. Để chẩn đoán
virus này có rất nhiều phương pháp đã được ứng dụng như mô học, lai in situ, kính hiển vi điện
tử . Phương pháp PCR được xem là một trong những phương pháp hiện đại, nhanh chóng và đặc
hiệu để chẩn đoán virus IHHN lây nhiễm trên tôm. Thiết kế mồi IHHNVvn F2/IHHNVvn R1 đặc
hiệu bộ gen IHHNV type lây nhiễm (AF218266) ở vị trí 218-512 mà không bắt cặp với bộ gen của
IHHNV type 3A/B (type chèn vào gen tôm). Thử nghiệm quy trình đặc hiệu cho type lây nhiễm
IHHNV và không khuếch đại với các virus gây bệnh khác WSSV, MBV, HPV và vi khuẩn Vibrio
sp. Độ nhạy của quy trình là 4 bản sao/ μl dịch ly trích DNA và giới hạn phát hiện tương đương
với quy trình OIE công bố và bộ kít nested IQ 2000. Dòng hóa được plasmid mang gen IHHNV có
kích thước 2590 bp để sử dụng làm bản mẫu chứng dương và khảo sát giới hạn phát hiện cho các
qui trình PCR mà OIE công bố. Từ những kết quả đạt được, qui trình PCR này có thể sử dụng trong
chẩn đoán IHHNV nhiểm trên tôm sú nuôi ở Đồng bằng sông Cửu Long (ĐBSCL).

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5
Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Phát triển quy trình đặc hiệu PCR chẩn đoán IHHNV cho type lây nhiễm trên tôm sú nuôi ở đồng bằng sông Cửu Long

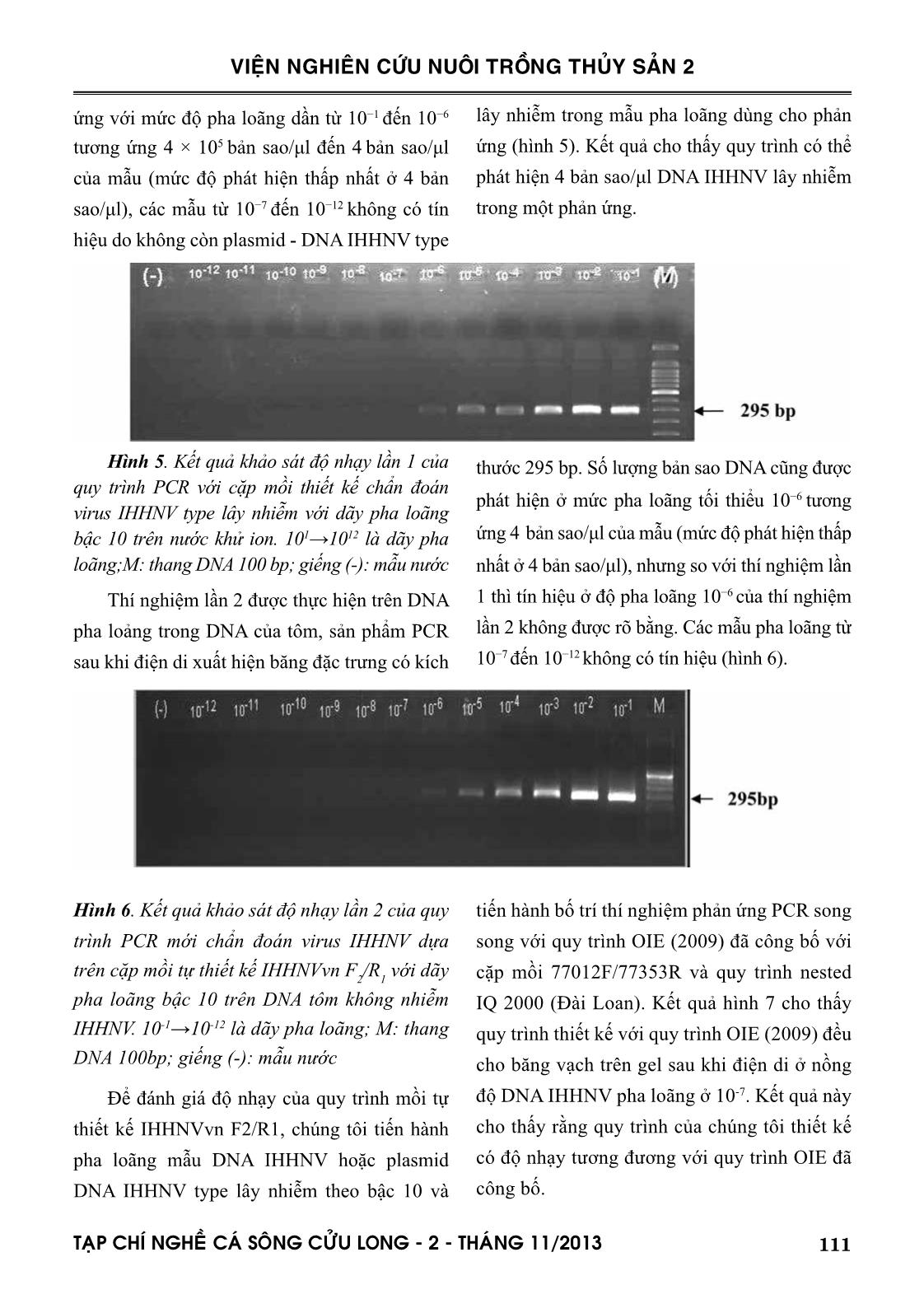
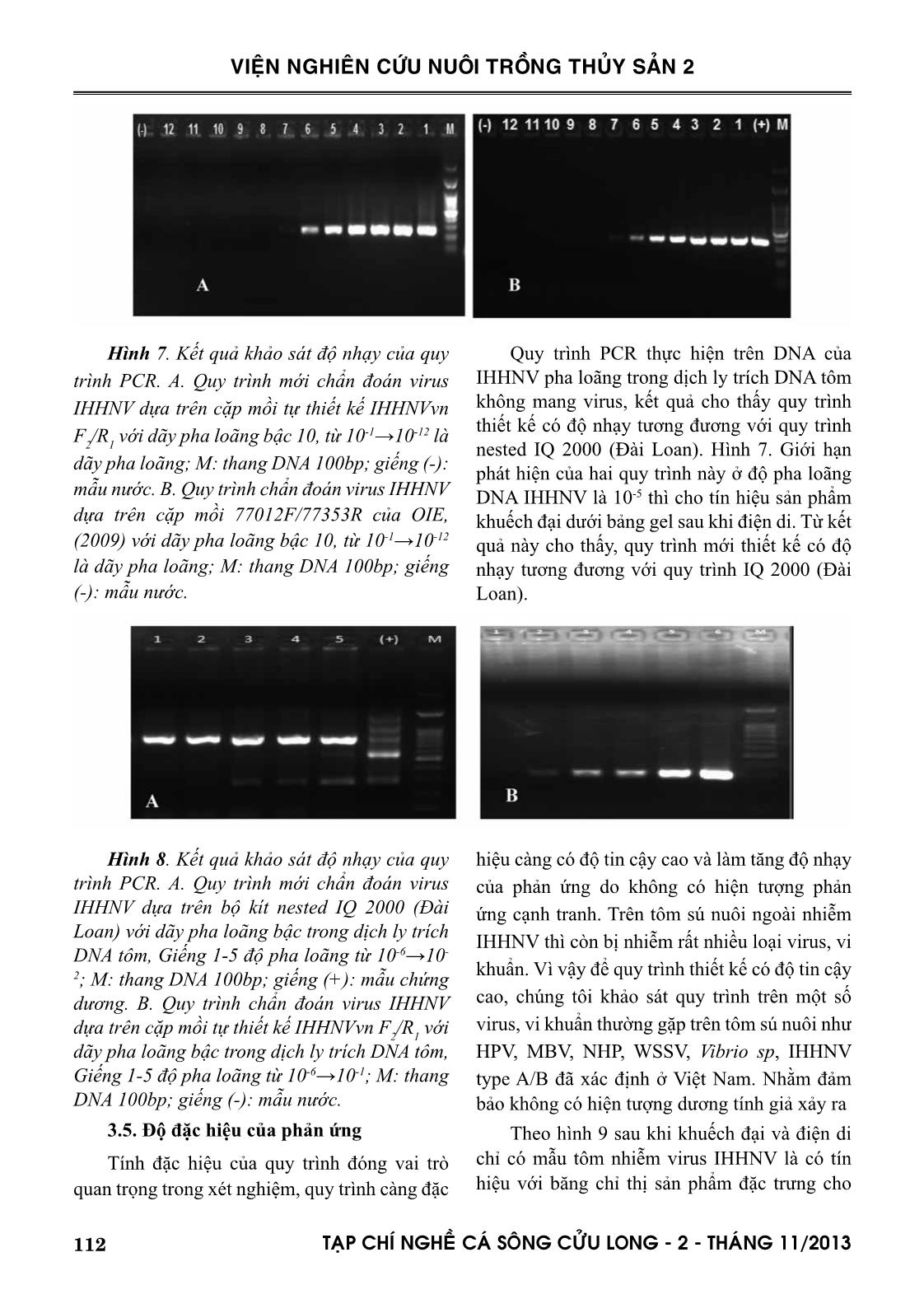
Í NGHEÀ CAÙ SOÂNG CÖÛU LONG - 2 - THAÙNG 11/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 virus IHHN type lây nhiễm có kích thước (295 bp). Các mẫu còn lại không có tín hiệu. Chứng tỏ quy trình mới với cặp mồi thiết kế phản ứng đặc hiệu cho virus IHHNV, không khuếch đại bộ gen của các virus HPV, MBV, NHP, WSSV, IHHNV type A đã xác định được ở trên, Vibrio sp là những virus, vi khuẩn thường gặp trên tôm. Vậy trong phạm vi nghiên cứu này, quy trình hoàn toàn đặc hiệu với IHHNV type lây nhiễm. Hình 9. Kết quả điện di sản phẩm khuếch đại trong thí nghiệm kiểm tra độ đặc hiệu của quy trình PCR đã tối ưu. M: thang DNA 100 bp; Mẫu (+): mang DNA virus IHHN; giếng1: IHHNV typeA/B; giếng 2: HPV; giếng 3: WSSV; giếng 4: Vibrio.sp; giếng 5: NHP. 295 bp 3.6. Ứng dụng kiểm tra IHHNV type lây nhiễm trên mẫu thực Tiến hành áp dụng quy trình trên 160 mẫu tôm thương phẩm, 116 mẫu tôm giống, 15 mẫu tôm bố mẹ. Trong số 160 mẫu tôm thương phẩm trên có 26 mẫu cho kết quả dương tính với IHHNV type lây nhiễm, 116 mẫu tôm giống thì cho kết quả dương tính 31 mẫu. Trên tôm bố mẹ thì 4 trong tổng số 15 mẫu cho kết quả dương tính với IHHNV type lây nhiễm. Kết quả của các thí nghiệm kiểm tra độ nhạy, độ đặc hiệu và ứng dụng quy trình kiểm tra IHHNV type lây nhiễm trên mẫu thực khẳng định: đã phát triển thành công quy trình PCR phát hiện IHHNV type lây nhiễm tại phòng thí nghiệm. Quy trình PCR đã tối ưu có thể áp dụng trong thực tế. Nghiên cứu đã chỉ rõ tính khả dụng của quy trình, mức độ nhiễm virus IHHNV có thể phát hiện (4 bản sao DNA virus/ μl dịch ly trích) và quy trình đặc hiệu với virus IHHNV type lây nhiễm. THẢO LUẬN Quản lý bệnh do virus trên nuôi tôm là một thách thức của ngành nuôi tôm công nghiệp vì thiếu các phương pháp phát hiện độ nhạy cao và đặc hiệu. Những năm gần đây, chẩn đoán sự hiện diện virus trong tôm nuôi chủ yếu dựa trên phương pháp sinh học và mô học, bao gồm lai tạo tại chỗ sử dụng đoạn gen đặc hiệu. Giới hạn phát hiện của những phương pháp này có độ nhạy thấp so với PCR mất nhiều thời gian. Những báo cao gần đây cho thấy sự hiện diện của 2 type IHHNV A và B gắn vào bộ gen của tôm sú thì việc chẩn đoán IHHNV rất phức tạp bởi các biến thể di truyền của virus trong các khu vực địa lý khác nhau (Tang và Lightner., 2006). Do đó việc lựa chọn quy trình PCR ứng dụng trên tôm sú phải được cân nhắc do có sự tương đồng rất lớn về vật liệu di truyền giữa các type IHHNV (trình tự 2.9 kb nucleoti- de của type A/B không lây nhiễm tương đồng 90−96% so với 4.1 kb của type IHHNV lây nhiễm) (Saksmerprome và ctv., 2010). Một số kết quả gần đây ở Úc và Châu Phi khi nghiên 114 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 2 - THAÙNG 11/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 cứu một đoạn DNA IHHNV trên P. monodon cho thấy có sự tích hợp IHHNV type A/B trong hệ gen của chúng (Tang và Lightner., 2006). Do đó xét nghiệm PCR có thể cho kết quả dương tính giả đối với virus truyền nhiễm IHHNV type lây nhiễm trên P. monodon nếu mồi được thiết kế thuộc khu vực IHHNV type A/B chèn vào hệ gen tôm (Tang và ctv., 2003; Krabsetsve và ctv., 2004; Tang và Lightner., 2006). Như vậy kết quả phân tích không thể phân biệt được mẫu mang virus IHHN có khả năng gây bệnh (type 1, type 2) hay mẫu mang IHHNV không gây bệnh (type A/ B). Điều này ảnh hưởng đến khâu chọn con giống ban đầu, giá trị thương phẩm của tôm nuôi. Gần đây một số quy trình PCR cho phép phát hiện và phân biệt IHHNV truyền nhiễm trên tôm sú dựa trên việc thiết kế mồi khuếch đại vùng vật liệu di truyền không có ở IHHNV type A/B (Tang và ctv., 2007; Saksmerprome và ctv., 2010). Tổ chức sức khỏe động vật thế giới (OIE., 2009) cũng đưa ra nhiều quy trình chẩn đoán IHHNV gây bệnh và không gây bệnh. Hiện nay cặp mồi khuếch đại IHHNV là 309F/R (Tang và ctv., 2007), 77012F/77353R (OIE., 2009) và cặp mồi IHHNV 279F/940R (Saks- merprome và ctv., 2010) phát hiện IHHNV type truyền nhiễm được đánh giá cao. Tuy nhiên theo phân tích của Tang và ctv (2007) thì cặp mồi IHHNV 309F /R có những trình tự nucleotide ở đầu 3’ có thể bắt cặp được với type A hoặc type B. Thêm vào đó, sự chèn trình tự IHHNV ngẫu nhiên vào bộ gen tôm sú thường xảy ra mà những cặp mồi do 309F/R và IQ 2000 của Đài Loan có thể bắt cặp trong phản ứng. Dẫn đến kết quả chẩn đoán dương tính giả khi sử dụng cặp mồi này hoặc bộ kít nested IQ2000TM (Saks- merprome và ctv., 2011). Một nghiên cứu khác ở Ấn Độ cho thấy khi sử dụng cặp mồi IHHNV 77012F/77353R để khuếch đại DNA IHHNV type lây nhiễm, khi phân tích lai 2 cặp mồi này với trình tự IHHNV type B hoặc type A, kết quả cho thấy mồi xuôi tương đồng với type B 100% và chỉ khác biệt có 4 nucleotide so với type A, khi đó mồi ngược tương đồng rất cao với type A và type B và chỉ có 1 nucleotide khác biệt, thêm vào đó cặp mồi IHHNV 77012F/77353R được phỏng đoán là không đủ nhạy để phát hiện tất cả các biến thể di truyền của IHHNV (Rai và ctv., 2009). Ngoài ra theo nghiên cứu của Úc, khi xét nghiệm PCR chẩn đoán IHHNV với cặp mồi IHHNV 279F/940R (Saksmerprome và ctv., 2010), với kích thước sản phẩm khuếch đại là 662 bp. Tuy nhiên, sản phẩm khuếch đại thu được có kích thước là 496 bp. Dựa trên gen mục tiêu ở vị trí 279 − 940 của chuỗi trình tự IHHNV AF218266, mà từ đó các mồi được thiết kế. Sau khi phân tích trình tự AF218266 đã phát hiện một đoạn trình tự trùng lặp có kích thước 165 bp bắt đầu từ vị trí 363 và kết thúc ở vị trí 693 (tức là 2 × 165 = 330 bp tổng chiều dài). Cho nên khi đọc kết quả dễ bị sai khi kích thước khuếch đại không cho ra chính xác như mong đợi, ảnh hưởng đến kết quả chẩn đoán bệnh. Do đó trong đề tài này chúng tôi phát triển quy trình PCR mới chẩn đoán IHHNV type lây nhiễm với cặp mồi tự thiết kế IHHNVvn F2/R1, không thuộc vùng trình tự tương đồng với IHHNV type A/B, nhằm phát triển quy trình chẩn đoán IHHNV đặc hiệu type lây nhiễm, có độ nhạy cao. Giới hạn phát hiện đóng vai trò quan trọng trong phát triển các quy trình PCR chẩn đoán bệnh virus. Thông thường các kỹ thuật PCR 115TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 2 - THAÙNG 11/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 một bước cho phép phát hiện số lượng DNA IHHNV trong mẫu trên một phản ứng là khoảng 200 bản sao (Dhar và ctv., 2001). Thêm vào đó, sự ảnh hưởng nồng độ DNA đến độ nhạy của phản ứng. Vì vậy để khảo sát giới hạn phát hiện của phản ứng PCR thiết kế, chúng tôi tiến hành kiểm tra độ nhạy của phản ứng và thử nghiệm được lặp lại 2 lần. Lần 1, tiến hành phản ứng PCR quy trình mới với dãy pha loãng Plasmid pGEM T-easy - IHHNV trong nước khử ion. Lần 2, chúng tôi lặp lại thí nghiệm lần 1 trên với dãy pha loãng tương tự trong dung dịch ly trích DNA tôm không mang virus IHHNV đã chuẩn bị. Kết quả cho thấy qui trình PCR có thể phát hiện ở độ nhạy 4 bản sao DNA IHHNV/ phản ứng mẫu trên cả 2 mẫu pha loãng ở nước cất. Tuy nhiên trên mẫu DNA IHHNV pha loãng trong DNA tôm có độ sáng bang vạch không rõ hơn (hình 5 và 6) so với DNA pha loãng trong nước. Kết quả trên cho thấy, khi pha loãng mẫu trong nước độ nhạy phản ứng cao hơn pha loãng trong DNA tôm không nhiễm virus IHHNV. Nguyên nhân có thể do trong nước không có DNA của tôm còn trong mẫu tôm không bệnh vẫn tồn tại DNA từ tôm. Khi pha loãng plas- mid-DNA IHHNV type lây nhiễm với dịch ly trích mẫu không bệnh, tổng lượng DNA ban đầu trong một phản ứng sẽ tăng lên gây trở ngại cho phản ứng PCR. Còn pha loãng trong nước khử ion, tổng lượng plasmid-DNA IHHNV ban đầu trong hỗn hợp pha loãng giảm xuống, tạo điều kiện môi trường thuận lợi cho phản ứng diễn ra, do đó làm độ nhạy quy trình tăng lên. Vậy có thể nói nồng độ DNA tôm cao ảnh hưởng đến độ nhạy phản ứng. Do đó khi ly trích DNA virus làm thí nghiệm cần chú ý đến lượng DNA tôm trong mỗi phản ứng. KẾT LUẬN Nghiên cứu đã phát triển thành công quy trình PCR chẩn đoán IHHNV đặc hiệu cho type lây nhiễm trên tôm sú nuôi ở ĐBSCL bằng hóa chất hiện có tại phòng thí nghiệm. Nghiên cứu cũng đã xác định được độ đặc hiệu của quy trình và độ nhạy cao. Bên cạnh đó, chúng tôi đã dòng hóa được plasmid mang gene IHHNV có kích thước 2590 bp dùng cho khảo sát cho quy trình PCR chẩn đoán IHHNV type lây nhiễm mà OIE (2009) công bố và đồng thời dùng làm bản mẫu dương cho quy trình mới thiết kế. Với quy trình PCR mới phát triển có thể phát hiện 4 bản sao DNA IHHNV type lây nhiễm trong một phản ứng khuếch đại. Có thể áp dụng quy trình trong thực tế để phát hiện IHHNV type lây nhiễm trên tôm nuôi. Ngoài ra trong nghiên cứu đã chứng minh nồng độ DNA tôm ảnh hưởng đến độ nhạy phản ứng của quy trình mới phát triển. So sánh đánh giá quy trình PCR thiết kế và quy trình OIE (2009) công bố với cặp mồi 77012F/77353R, nested IQ 2000 (Đài Loan) để chẩn đoán IHHNV type lây nhiễm, thì quy trình thiết kế có độ nhạy tương đương với quy trình OIE công bố và bộ kít nested IQ 2000. TÀI LIỆU THAM KHẢO Phạm Văn Hùng, Nguyễn Tẫn Bình, Nguyễn Đăng Ninh, Phạm Hùng Vân, Phạm Thành Hổ. 2009. Sự phổ Biến của Virus Gây Bệnh Hoại Tử Dưới Vỏ Và Cơ Quan Tạo Máu Trên Tôm Sú Nuôi Tại Việt Nam. Tạp chí Y Học TP. Hồ Chí Minh. Tập 13 (2). Trang 234-238 Phan Đặng Thiên An, Phạm Văn Hùng; Hoàng Hiếu Ngọc, Phạm Hùng Vân. 2009. Giải Trình Tự Bộ Gen Infectious Hypodermal And Haematopoietic 116 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 2 - THAÙNG 11/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Necrosis Virus (IHHNV) Gây Bệnh Hoại Tử Trên Tôm. Tạp chí Y Học TP. Hồ Chí Minh. Tập 13 (2). Trang 129-137. Bonami J.R, Trumper B, Mari J, Brehelin M, and Lightner D.V., 1990. Purification and characterization of IHHN virus of penaeid shrimps. J. Gen. Virol; 71, 2657–2664. Krabsetsve K; Cullen B.R., Owens L., 2004. Rediscovery of the Australian strain ofinfectious hypodermal and haematopoietic necrosis virus. Dis. Aquat. Org. 61, 153–158. Dhar, A.K., Roux, M.M., Klimpel, K.R., 2001. Detection and quantifi-cation of infectious hypodermal and hematopoietic necrosis virus and white spot virus in shrimp using real-time quantitative PCR and SYBR green chemistry. J. Clin. Microbiol. 39 (8), 2835–2845 Mari J, Bonami J.R., Lightner D.V., 1993. Partial cloning of the genome of infectious hypodermal and hematopoietic necrosis virus, an unusual parvovirus pathogenic for penaeid shrimps; diagnosis of the disease using a specific probe. J. Gen. Viro, 74, 2637–2643. OIE, 2009. Diagnostic Manual for Aquatic Animal Diseases 6th Edition. Office International des Epizooties (OIE), Paris. Chapter 2.2.2. Infectious Hypodermal and Hematopoietic Necrosis. pp. 78- 95 Rai, Pradeep, Safeena, Karunasagar I, Karunasagar I., 2009. Simultaneous presence of infectious hypodermal and hematopoietic necrosis virus (IHHNV) and Type A virus-related sequence in Penaeus monodon from India. Aquaculture, 295, 168–174. Saksmerprome V, Puiprom O., Noonin C., Flegel T.W., 2010. Detection of infectious hypodermal and haematopoietic necrosis virus (IHHNV) in farmed Australian Penaeus monodon by PCR analysis and DNA sequencing. Aquaculture 298, 190–193 Saksmerpromea V, Jitrakorna S., Chayaburakul K., Laiphromd S., Boonsuad K., Flegel T.W., 2011. Additional random, single to multiple genome fragments of Penaeus stylirostris densovirus in the giant tiger shrimp genome have implications for viral disease diagnosis. Virus Research 160, 180–190. Shike H., Dhar, A.K., Burns J.C., Shimizu C., Jousset F.X., Klimple K.R., Bergoin M., 2000. Infectious hypodermal and hematopoietic necrosis virus of shrimp is related to mosquito brevidensoviruses. Virology 277, 167–177. Tang K.F.J. và Lightner D.V. 2006. Infectious hypodermal and hematopoietic necrosis virus (IHHNV) in the genome of the black tiger prawn Penaeus monodon from Africa and Australia. Virus Res; 118, 185–191. Tang K.F.J., Navarro S.A. and Lightner D.V. 2007. A PCR assay for discriminating between infectious hypodermal and hematopoietic necrosis virus (IHHNV) and the virus-related sequences in the genome of Penaeus monodon. Dis. Aquat. Org; 74, 165–170. Tang K.F.J., Poulos B.T., Wang J., Redman R.M., Shih H.H. and Lightner D.V. 2003. Geographic variations among infectious hypodermal and hematopoietic necrosis virus (IHHNV) isolates and characteristics of their infection. Dis. Aquat. Org; 53, 91–99. Các website tham khảo: book 1 117TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 2 - THAÙNG 11/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 DEVELOPMENT OF THE SPECIFIC PCR ASSAY FOR DETECTION OF INFECTIOUS HYPODERMAL AND HEMATOPOIETIC NECROSIS VIRUS (IHHNV), SPECIFIC INFECTED TYPE IN BLACK TIGER SHRIMP (Peneaus monodon) IN MEKONG DELTA Cao Thanh Trung1, Nguyen Thi Kim My2, Nguyen Viet Dung1 ABSTRACT Infectious hypodermal and hematopoietic necrosis virus (IHHNV) is cause of mass mortality in blue shrimp Litopenaeus stylirostris and causes growth reduction and runt deformity syndrome (RDS) in Pacific white shrimp Litopenaeus vannamei and black tiger shrimp (Peneaus monodon). To detect virus, many methods have been used such as In situ hybridization, histopathology, trans- mission electronic microcopy (TEM) and Polymerase chain reaction (PCR). PCR offers many ad- vantages over other methods, including simple procedures and short detection time, and is specific. The specific pair of primers, IHHNVvn F2/IHHNVvn R1, were designed from a complete IHHNV genomic sequence (GenBank AF218266) and targeted the nucleotide positions 218–512 for which matching sequences have not been reported from inserted IHHNV type 3A/B. The PCR assay was highly specific for IHHNV and did not cross-react with other shrimp viruses including Hepatopan- creatic Parvovirus (HPV), Monodon Baculovirus (MBV), White Spot Syndrome Virus (WSSV) and Vibrio infected shrimp. Detection limits of the IHHNV using the PCR assay was 4 copies of genomic IHHNV per PCR reaction and was the sensitive as conventional PCR (OIE) and IQ 2000 PCR kit in detecting the viral pathogen from infected samples. These results considered that PCR is a simple and sensitive diagnostic technique that has potential application for routine detection of IHHNV infections in shrimp in the Mekong Delta. Keywords: Infectious hypodermal and hematopoietic necrosis virus (IHHNV), Polymerase chain reaction (PCR), Mekong Delta. Người phản biện: ThS. Ngô Thị Ngọc Thủy Ngày nhận bài: 12/9/2013 Ngày thông qua phản biện: 25/9/2013 Ngày duyệt đăng: 15/10/2013 1 Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No2. E-mail: thanhtrung77@yahoo.com 2 University of Science Ho Chi Minh City
File đính kèm:
 phat_trien_quy_trinh_dac_hieu_pcr_chan_doan_ihhnv_cho_type_l.pdf
phat_trien_quy_trinh_dac_hieu_pcr_chan_doan_ihhnv_cho_type_l.pdf

