Tác động của việc bổ sung chitin vào thức ăn lên khả năng kháng lại Vibrio parahaemolyticus của tôm thẻ chân trắng (Litopenaeid vannamei)
TÓM TẮT Đánh giá tác động của việc bổ sung chitin vào thức ăn đến khả năng kháng lại Vibrio parahaemolyticus của tôm thẻ chân trắng (khối lượng trung bình 2,34 ± 0,22g) được thực hiện với 6 nghiệm thức bổ sung chitin vào thức ăn ở các mức 0%; 0,1%; 1%; 2%; 4% và 8%. Mỗi nghiệm thức thí nghiệm được lặp lại 3 lần. Sau 2 tuần nuôi, vi khuẩn Vibrio parahaemolyticus được cho trực tiếp vào môi trường nuôi với nồng độ là 104,54cfu/ mL. Kết quả thí nghiệm cho thấy tỉ lệ chết tích lũy của tôm thẻ chân trắng ở nghiệm thức cho ăn thức ăn có bổ sung 1% và 2% chitin là 25% thấp hơn (P=0,002) so với tỉ lệ chết tích lũy của tôm ở nghiệm thức đối chứng. Tỉ lệ chết tích lũy của tôm thẻ ở các nghiệm thức còn lại so với đối chứng không có sự khác biệt (P>0,05)

Trang 1

Trang 2
Trang 3
Trang 4

Trang 5

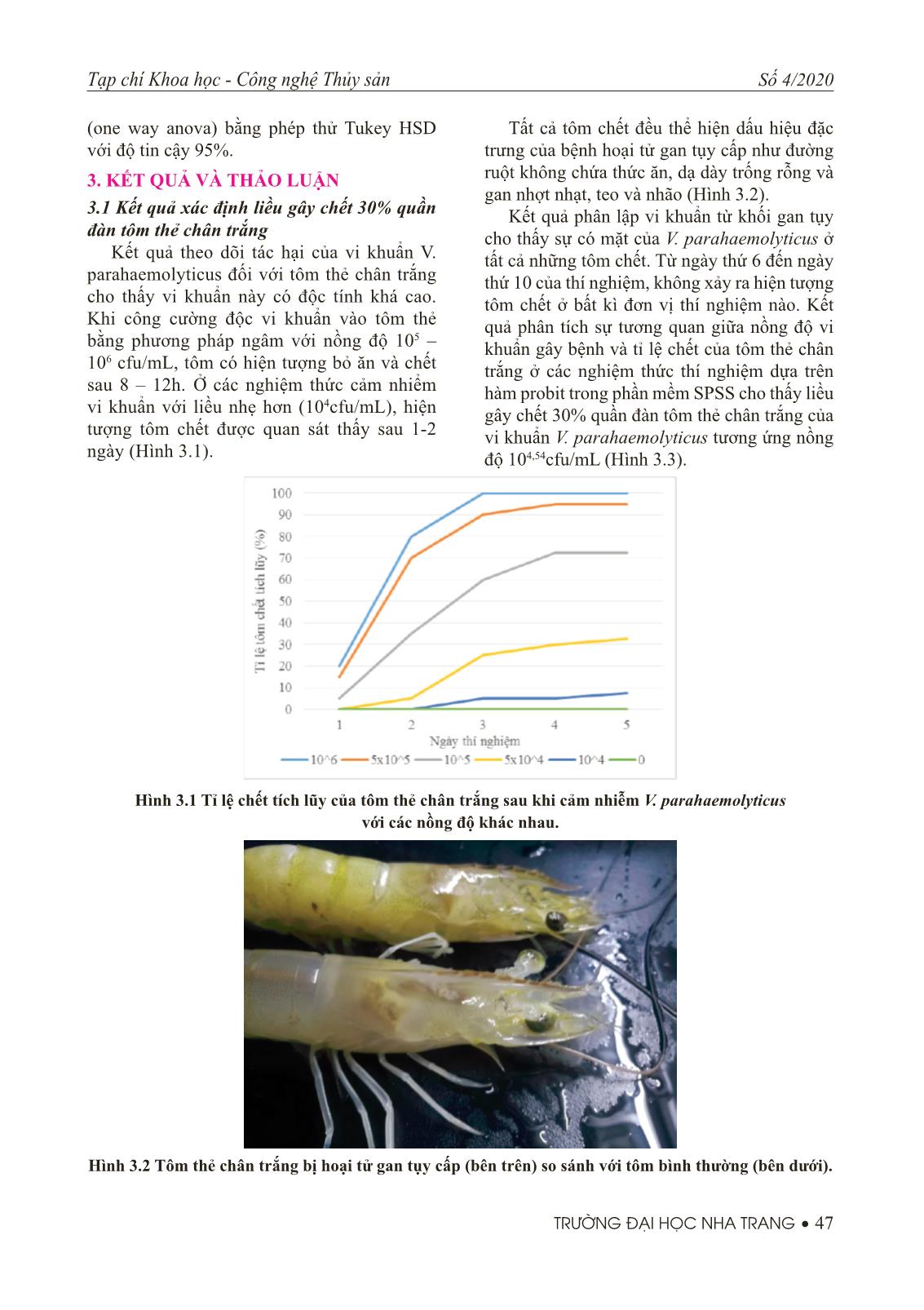
Trang 6
Tóm tắt nội dung tài liệu: Tác động của việc bổ sung chitin vào thức ăn lên khả năng kháng lại Vibrio parahaemolyticus của tôm thẻ chân trắng (Litopenaeid vannamei)

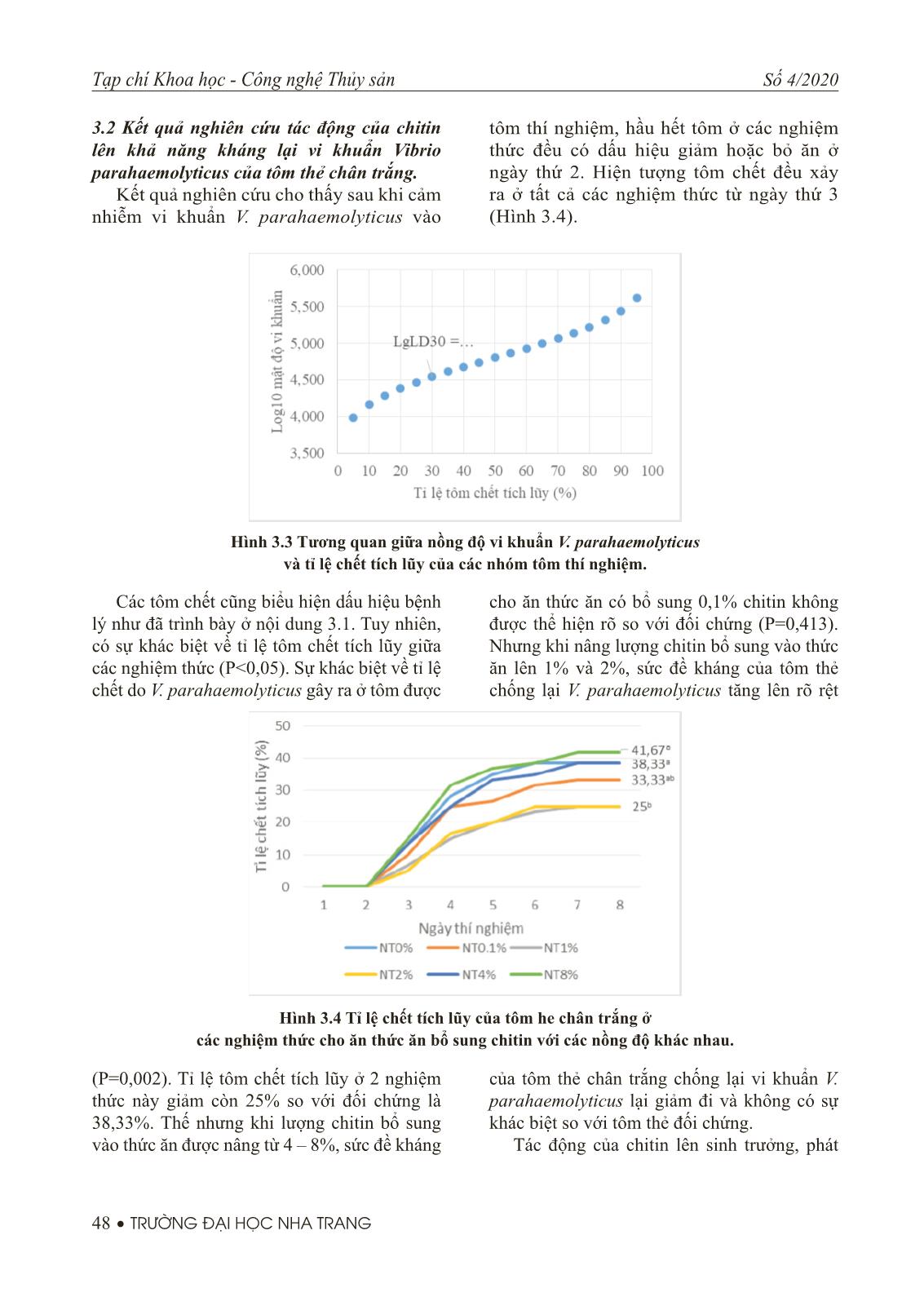
,1%; 1%; 2%; 4% và 8%. Mỗi nghiệm thức thí nghiệm được lặp lại 3 lần. Sau 2 tuần nuôi, vi khuẩn Vibrio parahaemolyticus được cho trực tiếp vào môi trường nuôi với nồng độ là 104,54cfu/ mL. Kết quả thí nghiệm cho thấy tỉ lệ chết tích lũy của tôm thẻ chân trắng ở nghiệm thức cho ăn thức ăn có bổ sung 1% và 2% chitin là 25% thấp hơn (P=0,002) so với tỉ lệ chết tích lũy của tôm ở nghiệm thức đối chứng. Tỉ lệ chết tích lũy của tôm thẻ ở các nghiệm thức còn lại so với đối chứng không có sự khác biệt (P>0,05). Từ khóa: Tôm thẻ chân trắng, cỡ hạt chitin, tế bào máu, hoạt tính thực bào ABSTRACT Evaluation of the protective of dietary chitin supplementation to Vibrio parahaemolyticus in white leg shrimp Litopenaeus vannamei was performed with 6 treatments. Shrimp (mean weight 1.74 ± 0.22g) were fed diets supplemented with chitin at concentrations of 0%, 0.1%, 1%, 2%, 4% and 8% in triplicate for 2 weeks. Shrimp in all treatments were challenged by adding V. parahaemolyticus at the dose of 104,54cfu/mL directly to the culture tank. The experimental results showed that the cumulative mortality of the white leg shrimp in the treatment fed with 1% and 2% chitin supplement were 25% lower (P = 0.002) than the cumulative mortality of shrimp in the control treatment. There was no difference in cumulative mortality of white shrimp in the remaining treatments compared with control treatment (P>0.05). Key words: Litopenaeus vannamei, chitin size, haemocyte, phagocytic activity. 1. ĐẶT VẤN ĐỀ Bệnh hoại tử gan tụy cấp (Acute hepatopancreatic necrosis syndrome - AHPNS) là một trong những bệnh nguy hiểm thường gặp ở tôm he nuôi. Bệnh lần đầu tiên xuất hiện ở Việt Nam vào năm 2010 với tên gọi Hội chứng chết sớm (Đặng Thị Hoàng Oanh và Nguyễn Thanh Phương, 2012). Tác nhân gây bệnh được xác định là chủng vi khuẩn Vibrio parahaemolyticus có mang gen độc tố PirA và PigB ở plasmid (Lai và cộng sự, 2015; Theethakaew và cộng sự, 2017). Việc sử dụng kháng sinh trong điều trị bệnh AHPNS là một trong những giải pháp thường được sử dụng nhưng nhiều nghiên cứu đã chỉ ra rằng giải pháp này không bền bởi dư lượng kháng sinh trên tôm cũng như sự xuất hiện ngày ngày nhiều chủng vi khuẩn kháng thuốc. Một số giải pháp khác thay thế kháng sinh như sử dụng thảo dược như dịch chiết từ cây chó đẻ thân xanh, lá trầu không, lá và hạt sim (Trần Vinh Phương và cộng sự, 2019; Đặng Thị Lụa và cộng sự, 2015), sử dụng probiotic hay các chất kích thích miễn dịch không đặc hiệu cũng đã được nghiên cứu và chứng minh là có hiệu quả. Chitin là một polysacarit tự nhiên được tìm thấy nhiều ở vỏ động vật giáp xác, côn trùng và nấm. Nó được biết đến như là một chất kích 46 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 4/2020 thích miễn dịch (immunostimulants) làm tăng khả năng đáp ứng miễn dịch không đặc hiệu và tỉ lệ sống của động vật thủy sản (Maqsood và cộng sự, 2011). Hiệu quả của việc sử dụng chitin trong việc làm tăng tốc độ sinh trưởng và tỉ lệ sống ở giáp xác đã được chứng minh ở tôm sú Penaeus monodon (Niu và cộng sự 2013; Shiau và Yu 1998), Tôm thẻ chân trắng Litopenaeus vannamei (Wang và Chen 2005), tôm càng nhỏ Procambarus clarkii (Zhu và cộng sự 2010). Nghiên cứu này được thực hiện nhằm đánh giá tác động của việc bổ sung chitin vào thức ăn lên khả năng kháng lại bệnh hoại tử gan tụy cấp do vi khuẩn Vibrio parahaemolyticus gây ra ở tôm thẻ chân trắng. 2. PHƯƠNG PHÁP NGHIÊN CỨU 2.1 Chuẩn bị tôm Tôm thẻ chân trắng postlarvae 15 (PL15) với số lượng là 1500 con được đưa về nuôi dưỡng trong bể 2000L cho đến khi khối lượng trung bình đạt 1,61 ± 0,21g. Tôm được bố trí vào 6 nghiệm thức, mỗi nghiệm thức gồm 3 bể nuôi có thể tích 250L chứa 200L nước biển với mật độ là 100 con /bể. Ở nghiệm thức đối chứng, tôm được cho ăn bằng thức ăn V992 (protein 40%, lipid 6-8%, tro 16%, Xơ 4%, độ ẩm 11%) của công ty Uni president trong khi ở các nghiệm thức NT0,1%, NT1%, NT2%, NT4% và NT8%, thức ăn V992 cho tôm ăn có bổ sung chitin với hàm lượng lần lượt là 0,1; 1; 2; 4 và 8% chitin bằng cách xác đưa lượng chitin cần thiết vào dầu mực và trộn đều vào thức ăn, để khô trong 20 phút ở nơi ẩm mát. Trong quá trình thuần dưỡng, tôm được nuôi ở độ mặn 28-30ppt, pH: 8-8.1, oxy hòa tan (DO): >5mg/L, nhiệt độ: 28-29oC. Tôm được cho ăn 4 lần/ngày với lượng thức ăn khoảng 10% khối lượng thân. Hàng ngày các thức ăn thừa và vỏ tôm lột được si phon ra khỏi bể và thay nước 60%. 2.2 Chuẩn bị vi khuẩn Chủng vi khuẩn Vibrio parahaemolyticus (V.para NT13) lưu giữ tại Trung tâm Nghiên cứu giống và dịch bệnh, trường Đại học Nha Trang được phân lập từ tôm thẻ chân trắng nuôi tại Ninh Thuận có biểu hiện đặc trưng của hội chứng gan tụy cấp được sử dụng trong nghiên cứu này. Chủng V.para NT13 được nuôi cấy trên môi trường TSA (Tryptic soy agar bổ sung 1,5% NaCl) ở nhiệt độ 28ºC trong 24h trước khi chuyển sang môi trường TSB (tryptic soy broth bổ sung 1,5% NaCl) nuôi ở nhiệt độ tương tự trong 24h. 2.3 Xác định liều vi khuẩn gây chết 30% quần đàn tôm thẻ (LD30) Thí nghiệm được tiến hành với 6 nghiệm thức. Mỗi nghiệm thức gồm 3 bể chứa 50L nước biển và bố trí 20 tôm thẻ chân trắng/bể. Các điều kiện môi trường nuôi được duy trì tương tự nội dung 2.1. Lần lượt cho vi khuẩn đã nuôi cấy ở môi trường TSB vào các nghiệm thức với mật độ vi khuẩn cuối cùng trong bể nuôi từ nghiệm thức 1 đến nghiệm thức 6 lần lượt là 0, 104, 5×104, 105, 5×105 và 106 cfu/ml. Theo dõi và ghi nhận số lượng tôm chết cho đến khi tôm dừng chết liên tục 5 ngày. Tất cả các tôm chết trong quá trình thí nghiệm đều được phân lập vi khuẩn trên môi trường TCBS để xác định sự có mặt của vi khuẩn V. para NT13. Sử dụng hàm probit trong phần mềm SPSS statistics 22 để xác định LD30. 2.4 Nghiên cứu tác động của chitin lên khả năng kháng lại vi khuẩn Vibrio parahaemolyticus của tôm thẻ chân trắng. Sau khi cho tôm ăn thức ăn có bổ sung chitin như đã trình bày ở phần 2.1 được 2 tuần, thu 20 tôm ở mỗi bể nuôi chuyển sang bể chứa 50L nước biển. Duy trì các điều kiện môi trường nuôi tương tự nội dung 2.1. Cho vào môi trường nuôi vi khuẩn V. parahaemolyticus với liều gây chết khoảng 30% quần đàn tôm nuôi (liều LD30 của vi khuẩn đối với tôm nuôi cần được xác định ở mục 2.3). Quan sát hoạt động của tôm hàng ngày và thu lấy các tôm chết để kiểm tra sự có mặt của vi khuẩn V. parahaemolitycus. Thí nghiệm kết thúc khi sau 5 ngày mà không có tôm chết ở bất kỳ nghiệm thức nào. 2.5. Phương pháp phân tích và xử lý số liệu Các số liệu thu thập từ thí nghiệm được xử lý thống kê dựa trên phần mềm SPSS statistics 22. Sử dụng hàm probit để xác định liều gây chết 30% của vi khuẩn đối với tôm thẻ. Tỉ lệ chết tích lũy ở các nghiệm thức được so sánh dựa trên việc phân tích phương sai một yếu tố Tạp chí Khoa học - Công nghệ Thủy sản Số 4/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 47 (one way anova) bằng phép thử Tukey HSD với độ tin cậy 95%. 3. KẾT QUẢ VÀ THẢO LUẬN 3.1 Kết quả xác định liều gây chết 30% quần đàn tôm thẻ chân trắng Kết quả theo dõi tác hại của vi khuẩn V. parahaemolyticus đối với tôm thẻ chân trắng cho thấy vi khuẩn này có độc tính khá cao. Khi công cường độc vi khuẩn vào tôm thẻ bằng phương pháp ngâm với nồng độ 105 – 106 cfu/mL, tôm có hiện tượng bỏ ăn và chết sau 8 – 12h. Ở các nghiệm thức cảm nhiểm vi khuẩn với liều nhẹ hơn (104cfu/mL), hiện tượng tôm chết được quan sát thấy sau 1-2 ngày (Hình 3.1). Tất cả tôm chết đều thể hiện dấu hiệu đặc trưng của bệnh hoại tử gan tụy cấp như đường ruột không chứa thức ăn, dạ dày trống rỗng và gan nhợt nhạt, teo và nhão (Hình 3.2). Kết quả phân lập vi khuẩn từ khối gan tụy cho thấy sự có mặt của V. parahaemolyticus ở tất cả những tôm chết. Từ ngày thứ 6 đến ngày thứ 10 của thí nghiệm, không xảy ra hiện tượng tôm chết ở bất kì đơn vị thí nghiệm nào. Kết quả phân tích sự tương quan giữa nồng độ vi khuẩn gây bệnh và tỉ lệ chết của tôm thẻ chân trắng ở các nghiệm thức thí nghiệm dựa trên hàm probit trong phần mềm SPSS cho thấy liều gây chết 30% quần đàn tôm thẻ chân trắng của vi khuẩn V. parahaemolyticus tương ứng nồng độ 104,54cfu/mL (Hình 3.3). Hình 3.1 Tỉ lệ chết tích lũy của tôm thẻ chân trắng sau khi cảm nhiễm V. parahaemolyticus với các nồng độ khác nhau. Hình 3.2 Tôm thẻ chân trắng bị hoại tử gan tụy cấp (bên trên) so sánh với tôm bình thường (bên dưới). 48 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 4/2020 Hình 3.3 Tương quan giữa nồng độ vi khuẩn V. parahaemolyticus và tỉ lệ chết tích lũy của các nhóm tôm thí nghiệm. Hình 3.4 Tỉ lệ chết tích lũy của tôm he chân trắng ở các nghiệm thức cho ăn thức ăn bổ sung chitin với các nồng độ khác nhau. 3.2 Kết quả nghiên cứu tác động của chitin lên khả năng kháng lại vi khuẩn Vibrio parahaemolyticus của tôm thẻ chân trắng. Kết quả nghiên cứu cho thấy sau khi cảm nhiễm vi khuẩn V. parahaemolyticus vào tôm thí nghiệm, hầu hết tôm ở các nghiệm thức đều có dấu hiệu giảm hoặc bỏ ăn ở ngày thứ 2. Hiện tượng tôm chết đều xảy ra ở tất cả các nghiệm thức từ ngày thứ 3 (Hình 3.4). Các tôm chết cũng biểu hiện dấu hiệu bệnh lý như đã trình bày ở nội dung 3.1. Tuy nhiên, có sự khác biệt về tỉ lệ tôm chết tích lũy giữa các nghiệm thức (P<0,05). Sự khác biệt về tỉ lệ chết do V. parahaemolyticus gây ra ở tôm được cho ăn thức ăn có bổ sung 0,1% chitin không được thể hiện rõ so với đối chứng (P=0,413). Nhưng khi nâng lượng chitin bổ sung vào thức ăn lên 1% và 2%, sức đề kháng của tôm thẻ chống lại V. parahaemolyticus tăng lên rõ rệt (P=0,002). Tỉ lệ tôm chết tích lũy ở 2 nghiệm thức này giảm còn 25% so với đối chứng là 38,33%. Thế nhưng khi lượng chitin bổ sung vào thức ăn được nâng từ 4 – 8%, sức đề kháng của tôm thẻ chân trắng chống lại vi khuẩn V. parahaemolyticus lại giảm đi và không có sự khác biệt so với tôm thẻ đối chứng. Tác động của chitin lên sinh trưởng, phát Tạp chí Khoa học - Công nghệ Thủy sản Số 4/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 49 triển và sức đề kháng của giáp xác đã được công bố bởi một số khoa học (Fox, 1993; Niu và cộng sự 2013; Wang và Chen 2005; Zhu và cộng sự, 2010). Nghiên cứu của Zhu và cộng sự (2010) cho thấy việc bổ sung chitin vào thức ăn cho tôm càng nhỏ Procambarus clarkii với lượng 0,5% sẽ nâng cao sức đề kháng của tôm kháng lại virus gây bệnh đốm trắng. Shiau và Yu (1998) đã thực hiện thí nghiệm bổ sung chitin vào thức ăn cho tôm sú với các hàm lượng 2%, 5% và 10% và chỉ ra rằng việc bổ sung 5% chitin vào thức ăn giúp cho tôm sú tăng trưởng nhanh nhất. Nghiên cứu của Wang và Chen (2005) cũng đã chứng minh hiệu quả của chitin trong việc nâng cao sức đề kháng của tôm thẻ chân trắng chống lại vi khuẩn Vibrio alginolyticus. Tuy nhiên, nghiên cứu của Fox (1993) được thực hiện với 4 mức bổ sung chitin vào thức ăn 4%, 8%, 12% và 16% cho thấy chitin không ảnh hưởng gì đến tăng trưởng và tỉ lệ sống của tôm sú. Nghiên cứu của Niu và các cộng sự (2013) lại chỉ ra rằng bổ sung chitin vào thức ăn ở mức 0,4% là phù hợp nhất cho tôm sú. Trong nghiên cứu này, những kết quả thu thập được đã chỉ ra mức bổ sung chitin vào thức ăn cho tôm thẻ chân trắng phù hợp nhất là 1-2%. Điều này có thể được lý giải như sau: chitin khi vào hệ thống tiêu hóa của tôm thẻ có thể được biến đổi thành những dẫn xuất khác nhau và tác động khác nhau lên sức đề kháng của tôm thẻ. Tuy nhiên, với những gì đã được công bố, chitin là một immunostimulant, vì thế sự khác nhau về thời gian sử dụng chitin có thể là nguyên nhân gây ra sự khác biệt về kết quả nghiên cứu như đã nêu trên. 4. KẾT LUẬN Việc bổ sung 1-2% chitin vào thức ăn cho tôm sú trong 2 tuần có tác dụng làm tăng khả năng kháng bệnh hoại tử gan tụy cấp do Vibrio parahaemolyticus gây ra ở tôm sú. LỜI CẢM ƠN Nghiên cứu này được tài trợ bởi đề tài nghiên cứu khoa học trường Đại học Nha Trang (mã số: TR2019-13-17) và Công ty TNHH sản xuất thương mại xuất nhập khẩu Đông Dương. Xin chân thành cảm ơn sự hỗ trợ quý báu đó. TÀI LIỆU THAM KHẢO Tiếng Việt 1. Đặng Thị Lụa, Nguyễn Thị Hạnh, Hoàng Hải Hà, Trương Thị Mỹ Hạnh và Phan Thị Vân, 2015. Tác dụng diệt khuẩn in vitro của dịch chiết lá trầu không (Piper betle L.) và dịch chiết lá ổi (Psidium guajava) đối với vi khuẩn gây bệnh hoại tử gan tụy cấp trên tôm nuôi nước lợ. Tạp chí Nông nghiệp và phát triển Nông thôn tập 11, 92 – 97. 2. Đặng Thị Hoàng Oanh và Nguyễn Thanh Phương, 2012. Các bệnh nguy hiểm trên tôm nuôi ở Đồng bằng song Cửu Long. Tạp chí Khoa học Trường Đại học Cần Thơ. 106 – 118. 3. Trần Vinh Phương, Hoàng Thị Ngọc Hân, Đặng Thanh Long, Phạm Thị Hải Yến và Nguyễn Quang Linh, 2019. Hoạt tính kháng khuẩn của dịch chiết từ cây chó đẻ thân xanh (Phyllanthus amarus) đối với vi khuẩn vibrio parahaemolyticus và vibrio sp. gây bệnh hoại tử gan tụy cấp trên tôm chân trắng (Litopenaeus vannamei). Tạp chí Khoa học đại học Huế: Khoa học tự nhiên tập 128. 99-106. 50 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 4/2020 Tiếng Anh 4. Fox CJ, 1993. The effect of dietary chitin on the growth, survival and chitinase levels in the digestive of juvenile (Penaeus monodon). Aquaculture 109, 39–49 5. Lai HC, Ng TH, Ando M, Lee CT, Chen IT, Chuang JC, Mavichak R, Chang SH, Yeh MD, Chiang YA, Takeyama H, Hamaguchi H, Lo CF, Aoki T and Wang HC, 2015. Pathogenesis of acute hepatopancreatic necrosis disease (AHPND) in shrimp. Fish and Shellfi sh Immunology. 47(2). 1006 – 1014 6. Maqsood S, Singh P, Samoon MH and Munir K, 2011. Emerging role of immunostimulants in combating the disease outbreak in aquaculture. International aquatic research 3. 147 – 163. 7. Niu J, Lin H, Jiang S, Chen X, Wu K, Liu Y, Wang, Tian L, 2013. Comparison of effect of chitin, chitosan, chitosan oligosaccharide and N-acetyl-D-glucosamine on growth performance, antioxidant defenses and oxidative stress status of Penaeus monodon. Aquaculture 372–375,1-8 8. Shiau SY, Yu YP, 1998. Chitin but not chitosan supplementation enhance the growth of grass shrimp, Penaeus monodon. Journal of Nutrition 128, 908–912. 9. Theethakaew C, Nakamura S, Motooka D, Matsuda S, Kodama T, Chonsin K, Suthienkul O and Iida T, 2017. Plasmid dynamics in Vibrio parahaemolyticus strains related to shrimp acute Hepatopancreatic necrosis syndrome (AHPNS). Infection, Genetics and Evolution. 51: 211-218 10. Wang SH, Chen JC, 2005. The protective effect of chitin and chitosan against Vibrio alginolyticus in white shrimp Litopenaeus vannamei. Fish and Shellfi sh Immunology 19, 191–204. 11. Zhu F, Quan H, Du H and Xu Z, 2010. The Effect of dietary chitosan and chitin supplementation on the survival and immune reactivity of crayfi sh, Procambarus clarkia. Journal of the world aquaculture society. Vol 41 284-290.
File đính kèm:
 tac_dong_cua_viec_bo_sung_chitin_vao_thuc_an_len_kha_nang_kh.pdf
tac_dong_cua_viec_bo_sung_chitin_vao_thuc_an_len_kha_nang_kh.pdf

