Nghiên cứu vi khuẩn không thuộc nhóm Vibrio có khả năng kết hợp với Vibrio parahaemolyticus gây bệnh hoại tử gan tụy cấp trên tôm thẻ chân trắng ở Thái Lan
TÓM TẮT
Bệnh hoại tử gan tụy cấp tính (Acute Hepatopancreatic Necrosis Disease: AHPND) ở tôm nuôi
nước lợ đã được báo cáo ở Thái Lan từ năm 2012. Phân tích đoạn trình tự của gen 16S rRNA thu
được từ các mẫu tôm bình thường và tôm bệnh cho thấy có sự hiện diện một số vi khuẩn khác nhóm
Vibrio, bao gồm Ralstonia sp., Delftia sp., Pelomonas sp., Acidovorax sp., Sphingomonas sp., Leifsonia sp., và Rhodococcus sp. ở ao tôm bị AHPND nhiều hơn so với ao tôm bình thường. Trong
nghiên cứu này, chúng tôi đã chọn Delftiaacidovorans (NCCB 28024) làm chủng tham khảo (RDA)
được mua từ Viện CBS của Hà Lan để so sánh với 2 phân lập Delftia giả định (Sh2-4 và So1-40)
được sàn lọc từ các trại nuôi tôm ở Thái Lan bằng nuôi cấy và phân tích PCR. Kết quả phân tích
trình tự một phần đoạn gen 16S rRNA cho thấy có sự tương đồng cao giữa phân lập Sh2-4 và RDA
(92,6%), điều này cho thấy rằng phân lập này có thể là loài Delftia mới. Ngược lại, So1-40 chỉ có tỷ
lệ tương đồng 78,9%, có thể là một chủng khác. Đối với cảm nhiễm kết hợp, tôm được tiêm Sh2-4
với mật độ 103 CFU/3g tôm được theo dõi 7 ngày, sau đó được ngâm với Vibrio parahaemolyticus
(VPAHPND) ở mật độ 104 CFU/ml (thấp hơn 10 lần so với LC50=105 CFU/ml). Kết quả cho thấy phân
lập này có thể nhiễm cộng hợp với VPAHPND nhưng gây ra dấu hiệu mô bệnh học khác với AHPND
(với biểu hiện bong tróc hàng loạt của các tế bào biểu mô của ống gan tụy). Các dấu hiệu này bao
gồm các tế bào biểu mô của ống gan tụy bị tan vỡ, hình thành các không bào trong tế bào E của ống
gan tụy và không bào trong tế bào kẻ của cơ quan lymphô, và có sự hiện diện của các thể vùi bắt
màu eosin trong tế bào chất của các tế bào thuộc mô tạo máu.

Trang 1

Trang 2

Trang 3
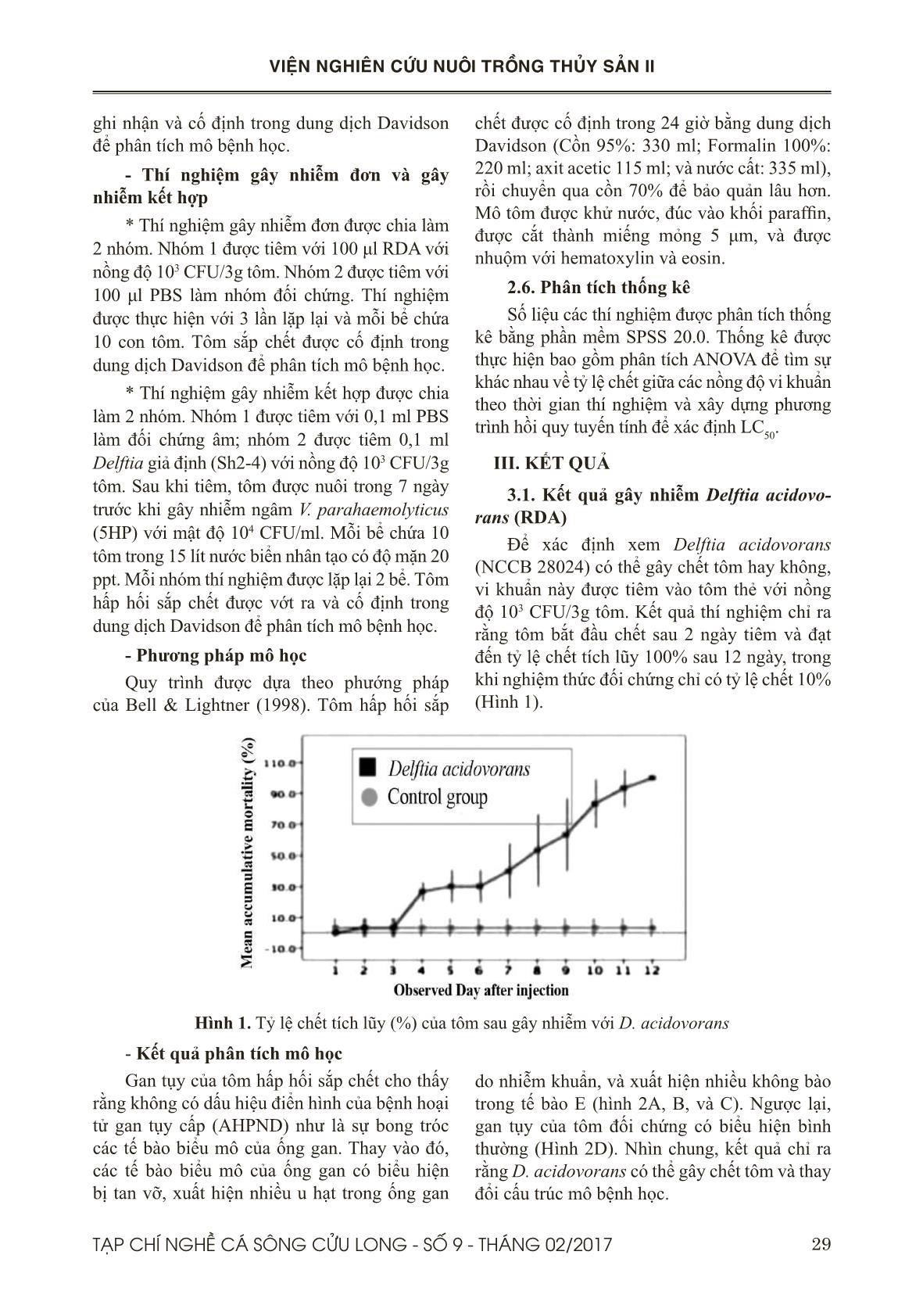
Trang 4

Trang 5

Trang 6
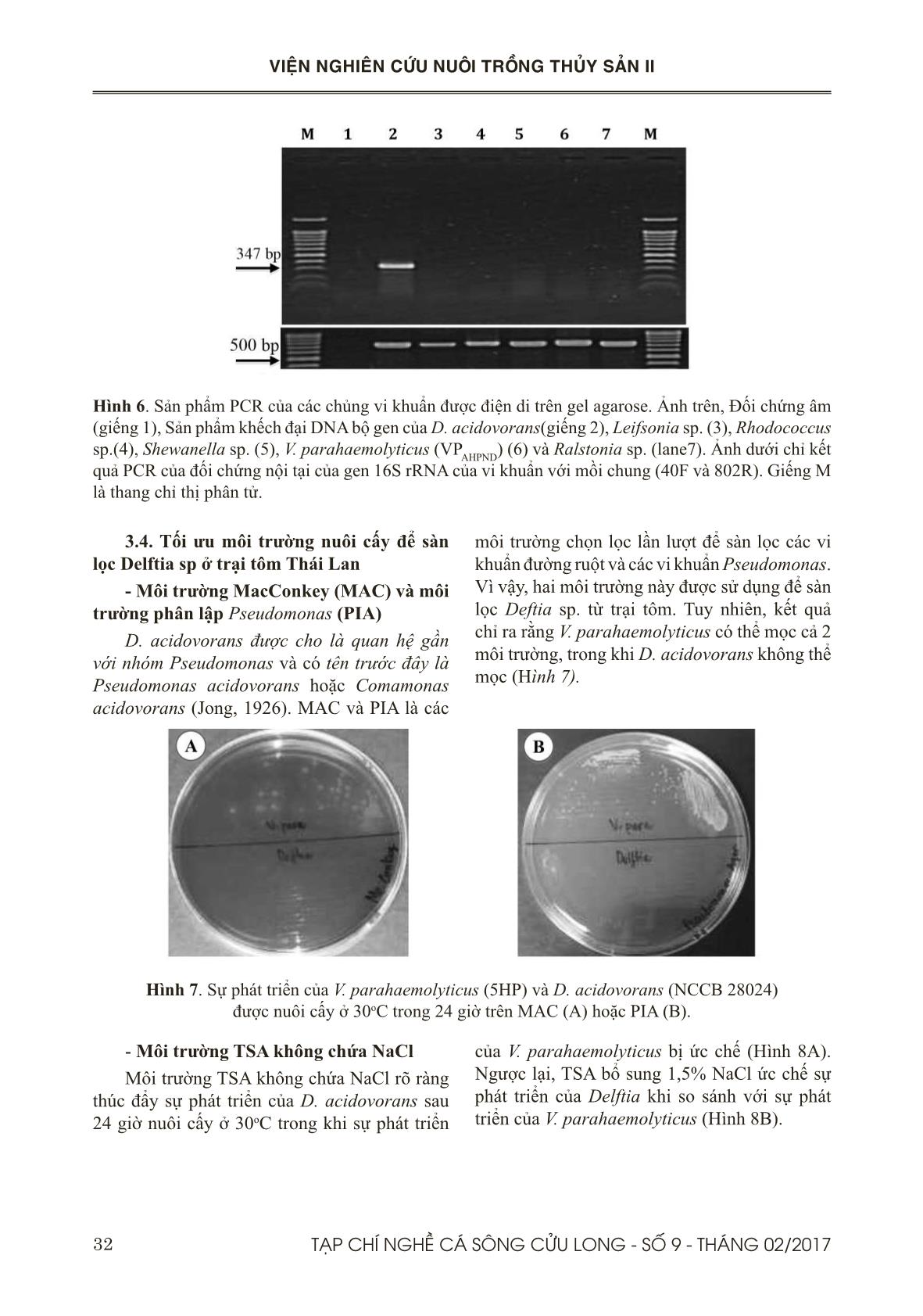
Trang 7

Trang 8

Trang 9
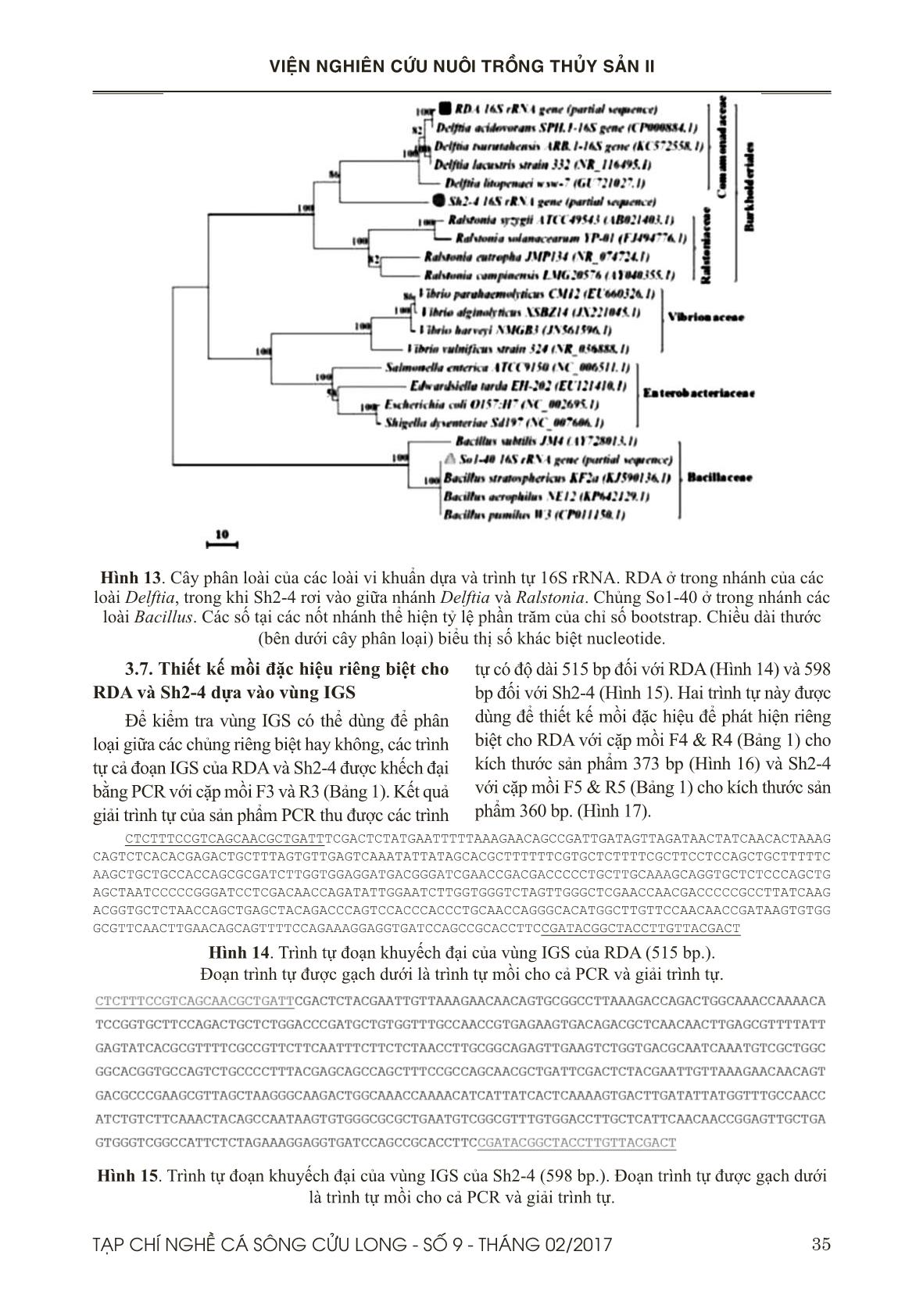
Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Nghiên cứu vi khuẩn không thuộc nhóm Vibrio có khả năng kết hợp với Vibrio parahaemolyticus gây bệnh hoại tử gan tụy cấp trên tôm thẻ chân trắng ở Thái Lan

h 22B), và sự xuất hiện của các thể vùi bắt màu eosin trong tế bào chất của các tế bào thuộc mô tạo máu (Hình 23B). Ngoài ra, Tế bào E bị không bào hoá xuất hiện trong tất cả các nhóm thí nghiệm, bao gồm cả nhóm đối chứng âm. Tuy nhiên, ở nhóm đối chứng âm có cường độ và tỷ lệ thấp hơn (Hình 24A và 24B). Ở nhóm chỉ ngâm 5HP ở 104 CFU/ ml, gan tụy của tôm hấp hối có dấu hiệu bong tróc các tế bào biểu mô của ống gan (hình 2C), tế bào E có dấu hiệu của bệnh AHPND (Hình 24C). Tuy nhiên, cơ quan lymphô (Hình 22C) và mô tạo máu (Hình 23C) có dấu hiệu bình thường. Hình 19. Mô bệnh học của nghiệm thức ngâm 105 CFU/ml5HP. Sự bong tróc của các tế bào biểu mô của ống gan được quan sát dưới kính hiển vi với độ phóng đại 10X (A) và 40X (B). 38 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 9 - THÁNG 02/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II Hình 21. Mô học của gan tụy. (A) Gan tụy bình thường của tôm không gây nhiễm có nhiều tế bào B và tế bào R, (B) Nhóm kết hợp giữa Sh2-4 và 5HP có dấu tế bào biểu mô bị tan vỡ, và (C) Nhóm 5HP chỉ ra tế bào biểu mô bị bong tróc. Độ phóng đại 10X. Hình 22. Mô học của cơ quan lymphô. (A) Lymphô bình thường ở nhóm không gây nhiễm, (B) Nhóm kết hợp giữa Sh2-4 và 5HP có nhiều không bào trong tế bào kẻ (mũi tên), và (C) Nhóm 5HP chỉ ra lymphô bình thường. Độ phóng đại 40X. Hình 23. Mô học của mô tạo máu. (A) Mô tạo máu bình thường ở nhóm không gây nhiễm, (B) Nhóm kết hợp giữa Sh2-4 và 5HP có nhiều thể vùi bắt màu eosin trong tế bào chất (mũi tên), và (C) Nhóm 5HP chỉ ra mô tạo máu bình thường. Hình A và B (độ phóng đại 40X); hình C (độ phóng đại 100X). Hình 24. Mô học của vùng tế bào E. (A) Tế bào E ở nhóm không gây nhiễm có ít không bào (mũi tên). (B) Nhóm kết hợp giữa Sh2-4 và 5HP có nhiều không bào (mũi tên), và (C) Nhóm 5HP chỉ ra tế bào E bị bong tróc (mũi tên). Độ phóng đại 40X. 39TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 9 - THÁNG 02/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II IV. THẢO LUẬN Dữ liệu từ kết quả phân tích gen 16S rRNA của tôm bị nhiễm AHPND so với tôm khoẻ khám phá ra rằng khả năng vi khuẩn thuộc bộ Burkholdeirales có thể liên quan đến AHPND ở ô tôm nuôi ở Thái Lan (Prachumwat và ctv., 2012). Tuy nhiên, chưa có báo cáo nào trước đây trình bày về các vi khuẩn thuộc bộ Burkholderiales gây bệnh trên tôm. Nghiên cứu này là đầu tiên chỉ ra rằng vi khuẩn thuộc giống Delftia (bộ Burkholderiales) có thể gây chết tôm thẻ chân trắng. Kiểm tra sơ bộ với chủng Delftia acidovorans mua từ Viện CBS của Hà Lan khám phá ra rằng tỷ lệ chết của tôm có thể bị gây ra bởi vi khuẩn này với nồng độ tiêm 103CFU/3g tôm. Các tôm hấp hối sắp chết có dấu hiệu mô bệnh học khác với dấu hiệu mô bệnh học của AHPND như là sự tan vỡ của các tế bào biểu mô của ống gan tụy và sự không báo hoá các tế bào E. Ngoài ra, những đặc tính phụ không được mô tả ở tôm bị AHPND bao gồm sự có sự hiện những không bào bất thường trong gan tụy và cơ quan lymphô và các thể vùi trong tế bào chất bắt màu eosin hiện diện ở mô tạo máu. Bởi vì chủng D. acidovorans tham khảo được mua từ CBS, nó không thể phản ánh bản chất thực sự của Delftia giả định mà được chỉ ra trong phân tích PCR từ các trại tôm địa phương ở Thái Lan. Đối với chủng phân lập của tác nhân gây bệnh hoại tử gan tụy cấp (AHPND), môi trường TSA được sử dụng để phân lập và nó mang lại thành công trong phân lập Vibrio parahaemolytius gây AHPND (VP AHPND ) ở Thái Lan (Joshi và ctv., 2014). Một đặc tính của V. parahaemolyticus là mọc rất mạnh khi được nuôi cấy trên TSA có bổ sung 1,5% NaCl. Sự phát triển nhanh chóng của V. parahaemolyticus có thể lấn át các loài khác. Điều này có thể dẫn đến thất bại trong việc phân lập các loài vi khuẩn liên quan khác như là các vi khuẩn đã khám phá từ phân tích gen 16S rRNA. Để tránh vấn đề như vậy, việc sàn lọc các chủng Delftia từ các trại tôm được chia thành hai bước bao gồm sàn lọc bằng môi trường chọn lọc cho Delftia sp. và kết hợp với sàn lọc bằng PCR. Môi trường TSA không chứa NaCl có thể ức chế tốt đối với V. parahaemolyticus trong khi nó cho phép các vi khuẩn khác phát triển. Các vi khuẩn này được tiếp tục sàn lọc bằng PCR với các mồi đặc hiệu để khuyếch đại vùng IGS của D. acidovorans. Cường độ vạch sản phẩm PCR thu được từ các chủng phân lập khi được so sánh với đối chứng dương (D. acidovorans) là tương đối thấp. Giải thích cho điều này thì không rõ ràng nhưng có thể do có sự khác biệt một số nucleotide trong trình tự mồi nên số lượng bản sao của đoạn trình tự đích cho khuyếch đại PCR bị thấp. Hai chủng phân lập Sh2-4 và So1-40 được chọn cho nghiên cứu sâu hơn. Theo phân tích hoá sinh bằng kít API 20 NE, hai chủng này được xác định là gần nhất với Pseudomonas luteola (kết quả không trình bày). Tuy nhiên, phân tích trình tự gen 16S rRNA chỉ ra rằng chủng phân lập Sh2-4 tương đồng vi khuẩn không được nuôi cấy, trong khi So1-40 thì tương đồng với chủng Bacillus. Kết quả này cho thấy sự hạn chế trong phân tích hoá sinh do số vi khuẩn cố định trong cơ sở dữ liệu của API. Theo so sánh trình tự một phần của gen 16S rRNA, sự giống nhau trình tự giữa D. acidovorans và Sh2-4 (92,6%) cao hơn sự giống nhau trình tự giữa D. acidovorans và So1-40 (78,9%). Kết quả này có thể đề nghị rằng Sh2-4 có thể là một thành viên của giống Delftia. Xây dựng cây phát sinh loài dựa vào trình tự một phần của gen 16S rRNA chỉ ra rằng Sh2-4 nằm ở vị trí giữa nhánh Delftia và Ralstonia. Kết quả này gợi ý rằng Sh2-4 có thể là một loài Delftia thuộc họ Comamonadaceae, bộ Burkhodariales với chỉ số bootstrap 86%. Theo Felsenstein (1985) chỉ số bootstrap nói lên độ tin cậy của sự quan hệ gần gũi giữa các thành viên của nhóm trong cây phân loài. Ngược lại, So1-40 nằm cùng nhánh với họ Bacillaceae. Vì vậy, So1-40 không được tiếp tục nghiên cứu sâu hơn. Thí nghiệm sinh học bằng cách sử dụng chủng tham khảo D. acidovorans (RDA) cho kết quả chết tôm khác nhau ở các lần thí 40 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 9 - THÁNG 02/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II nghiệm. Hiện tượng này có thể được giải thích do trạng thái sức khoẻ của tôm ở các đợt thí nghiệm bởi vì chúng có thể khác nhau ở các lô tôm. Tỷ lệ chết ở tôm cũng xảy ra tương tự khi quan sát thí nghiệm cảm nhiễm của VP AHPND (dữ liệu không trình bày). Ở thí nghiệm gây nhiễm kết hợp, tôm được tiêm Sh2-4 trước khi ngâm V. parahaemolyticus (5HP). Tôm chết nhanh hơn ở nhóm kết hợp khi so sánh với nhóm chỉ ngâm 5HP. Ở mức độ mô học, tôm hấp hối sắp chết của nhóm gây nhiễm kết hợp không có biểu hiện của bong tróc cấp tính của các tế bào biểu mô của ống gan tụy như đặc tính của AHPND. Thay vào đó, mô tôm có biểu hiện tan vỡ các tế bào biểu mô cùng với những dấu hiệu mô bệnh học bao gồm xuất hiện nhiều không bào trong các tế bào kẻ của cơ quan lymphô và có sự hình thành các thể vùi bắt màu eosin trong tế bào chất của các tế bào thuộc mô tạo máu. Cùng với đó, kết quả này cho thấy rằng Sh2-4 có thể nhiễm cộng hợp với V. parahaemolyticus (5HP). Điều này có thể dẫn đến một sự đánh giá thấp về tần suất xuất hiện AHPND trong việc chẩn đoán bệnh. Những quan sát gần đây cũng cho thấy rằng mẫu tôm từ các ao bị EMS thường thiếu các dấu hiệu bong tróc các tế bào trong ống gan tụy, nhưng thay vào đó nó có dấu hiệu tan vỡ của tế bào biểu mô. V. KẾT LUẬN VÀ ĐỀ XUẤT 5.1. Kết luận Các kết quả cho thấy rằng loài Delftia có thể liên quan đến EMS ở tôm nuôi. Chúng tôi đã thiết lập được phương pháp PCR phát hiện đặc hiệu cho Delftia sp. và Delftia acidovorans dựa vào trình tự của vùng IGS (intergenic spacer). Chủng phân lập Delftia giả định mà sàn lọc từ các trại tôm địa phương được thực hiện thí nghiệm sinh học bằng phương pháp gây nhiễm kết hợp với VP (AHPND) (5HP). Kết quả cho thấy rằng Delftia sp. có liên quan đến EMS/AHPND do nó có tác động bổ trợ đến tỷ lệ chết của tôm. Thời gian gây chết 50% (LT50) của nhóm kết hợp giữa Sh2-4 và 5HP là 1 ngày, trong khi LT50 của 5HP là 4 ngày. Ở mức độ mô học, tôm hấp hối sắp chết của nhóm gây nhiễm kết hợp không có biểu hiện của bong tróc cấp tính của các tế bào biểu mô của ống gan tụy như đặc tính của AHPND. Thay vào đó, mô tôm có biểu hiện tan vỡ các tế bào biểu mô cùng với những dấu hiệu mô bệnh học bao gồm xuất hiện nhiều không bào trong các tế bào kẻ của cơ quan lymphô và có sự hình thành các thể vùi bắt màu eosin trong tế bào chất của các tế bào thuộc mô tạo máu. 5.2. Đề xuất Để hiểu sâu hơn mối tương quan giữa dấu hiệu mô bệnh học riêng biệt và sự hiện diện của D. acidovorans ở trong các mô tương ứng, thì kỹ thuật lai in situ với mẫu dò phân tử đặc hiệu cho Delftia nên được thực hiện. Kế hoạch thí nghiệm trong tương lai nên thực hiện gây nhiễm kết hợp bằng phương pháp ngâm cả hai vi khuẩn để khẳng định có tác động bổ trợ hay không. Ngoài ra, để nghiên cứu đặc tính sâu hơn đối với Sh2-4, thì cần thiết phải giải trình tự toàn bộ chiều dài của gen 16S rRNA hoặc giải toàn bộ trình tự của bộ gen. LỜI CẢM ƠN Đề tài này được sự hỗ trợ bởi học bổng Công nghệ Sinh học của Chính Phủ Việt Nam (Số 1254/QĐ-BGDĐT), Trung tâm Quốc gia Công nghệ Di truyền và Công nghệ Sinh học Thái Lan (BIOTECH Thái Lan), và Hội đồng Nghiên cứu Quốc gia Thái Lan. TÀI LIỆU THAM KHẢO Bell, T. A., & Lightner, D. V., 1998. Technique. In A Handbook of Normal Penaeid Shrimp Histology. Baton Rouge, Louisiana: World Aquaculture Society. Chen, W.-M., Lin, Y.-S., Sheu, D.-S., Sheu, S.- Y., 2011. Delftia litopenaei sp. nov., a poly- β-hydroxybutyrate-accumulating bacterium isolated from a freshwater shrimp culture pond. International Journal of Systematic and Evolutionary Microbiology, 62(Pt 10), 2315– 21. FAO., 2013. Report of FAO/MARD Technical Workshop on Early Mortality Syndrome (EMS) or Acute Hepatopancreatic Necrosis Syndrome 41TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 9 - THÁNG 02/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II (AHPNS) of Cultured Shrimp (under TCP/ VIE/3304). Hanoi, Viet Nam, 25–27 June 2013 Felsenstein, J., 1985. Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39:783 – 791 . Flegel, T. W., 2012. Historic emergence, impact and current status of shrimp pathogens in Asia. Journal of Invertebrate Pathology, 110(2), 166–73. Joshi, J., Srisala, J., Truong, V. H., Chen, I.- T., Nuangsaeng, B., Suthienkul, O., Thitamadee, S., 2014. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture, 428-429, 297–302. Leaño, E. M., Mohan, C., 2012. Early mortality syndrome threatens Asia’s shrimp farms. Global Aquaculture Advocate, July/Aug 2012:38−39. Lightner, D. V., Redman, R. M., Pantoja, C. R., Tang, K. F. J., Noble, B. L., Schofield, P., Mohney L. L., Nunan L. M., Navarro, S. A., 2012. Historic emergence, impact and current status of shrimp pathogens in the Americas. Journal of Invertebrate Pathology, 110(2), 174–83. Mooney, A., 2012. An emerging shrimp disease in Vietnam, microsporidiosis or liver disease? Available at: http:// aquatichealth.net/ issues/38607 (accessed 24 Feb 2012). NACA-FAO., 2011. Network of Aquaculture Centers in Asia- Pacific — Food and Agriculture Organization of the United Nations) (2011). Quarterly Aquatic Animal Disease Report (Asia and Pacific Region), 2011/2, April-June 2011. NACA, Bangkok, (April). Prachumwat, A., Thitamadee, S., Sriurairatana, S., Chuchird, N., Limsuwan, C., Jantratit, W., Chaiyapechara, S., Flegel, T. W., 2012. Shotgun Sequencing of Bacteria from AHPNS A New Shrimp Disease Threat for Thailand. , Poster, National Institute for Aquaculture Biotechnology, Mahidol University, Bangkok, Thailand (Poster available for free download at www.enaca.org). Sambrook, J., Fritsch, E. F. and Maniatis, T., 1989. Molecular Cloning: A Laboratory Manual, 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, USA. Tran, L., Nunan, L., Redman, R. M., Mohney, L. L., Pantoja, C. R., Fitzsimmons, K., Lightner, D. V., 2013. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Diseases of Aquatic Organisms, 105, 45–55. 42 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 9 - THÁNG 02/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II STUDY OF NON-Vibrio BACTERIA AS POTENTIAL ASSOCIATES OF Vibrio parahaemolyticus IN CAUSING AHPND IN WHITE-LEG SHRIMP IN THAILAND Trương HongViet1*, Ajaree Nilawongse2, Kallaya Sritunyalucksana3, Timothy W. Flegel2, Siripong Thitamadee2,3 ABSTRACT Acute Hepatopancreatic Necrosis Disease (AHPND) in penaeid shrimp has been reported in Thai- land since 2012. Analysis of PCR amplified 16S rRNA gene fragments obtained from normal ver- sus diseased shrimp samples revealed several bacterial candidates including Ralstonia sp., Delftia sp., Pelomonas sp., Acidovorax sp., Sphingmonas sp., Leifsonia sp., and Rhodococcus sp. were proportionally higher in EMS ponds than in normal ponds. In this study, we selected a reference Delftia acidovorans (NCCB 28024) (RDA) purchased from a culture collection to compare with two putative Delftia isolates (Sh2-4 and So1-40) screened from local Thai farms by culture and PCR screening. The 16S rRNA gene analysis revealed high similarity between the 16S rRNA gene sequence of Sh2-4 and that of D. acidovorans (92.6%) indicating that it may be a new Delftia spe- cies. In contrast, So1-40 showed an alignment score of only 78.9%, suggesting that it was from a different genus. For co-challenge tests, shrimp were injection-challenged with Sh2-4 at concentra- tions of 103 CFU per 3 gram shrimp followed by culture for 7 days before immersion challenge with Vibrio parahaemolyticus (VP AHPND ) at 104 CFU/ml (101 lower than the normal LC50 quantity). The co-challenge test results suggested that this isolate exhibited increased the virulence of VP AHPND but gave histopathologies different from AHPND (with sloughed signals of hepatopancreatic epithelial cells). These consisted of collapsed hepatopancreatic epithelial cells, vacuole formation in E cells of the hepatopancreas and lymphoid organ, and the presence of eosinophilic cytoplasmic inclusions in hematopoietic tissue. Keywords: 16S rRNA, AHPND, EMS, Delftiaacidovorans, Vibrio parahaemolyticus Người phản biện: TS. Lê Hồng Phước Ngày nhận bài: 25/11/2016 Ngày thông qua phản biện: 13/12/2016 Ngày duyệt đăng: 05/01/2017 1 Southern Monitoring Center for Aquaculture Environment &Epidemic, Research Institute for Aquaculture No.2 2 Faculty of Biotechnology - Mahidol University - Thailand 3 Faculty of Biotechnology - Mahidol University - Thailand * Email: truonghongviet@yahoo.com
File đính kèm:
 nghien_cuu_vi_khuan_khong_thuoc_nhom_vibrio_co_kha_nang_ket.pdf
nghien_cuu_vi_khuan_khong_thuoc_nhom_vibrio_co_kha_nang_ket.pdf

