Effects of dietary Mannan oligosaccharide (MOS) on grown, survival rate, intestinal morphology and blood cell count of the golden trevally fish (Gnathanodon specious)
Abstract
The golden trevally fishes (Gnathanodon specious) (2.19 ± 0.23 g) were cultured in glass tanks with density
of 20 fishes/tank and they were fed supplemental diets of different MOS concentrations (0; 0.2; 0.4 and
0.6%) for 90 days. Collected data included growth rate, survival rate and some hematological characteristics
of this fish. The results demonstrated that MOS supplementation did not affect growth performance,
erythrocyte density and blood cell size, however the survival rate was significantly increased. On the other
hand, the total number of white blood cells (BC) on the 60th day in the fish fed with MOS supplements
(5.78–6.96 × 104 TB/mm3) was higher than that in the control group (only 5.43 × 104 TB/mm3) with the
largest total leukocytes (6.96 ± 0.50 × 104 TB /mm3) at 0.2% MOS (p <>

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Effects of dietary Mannan oligosaccharide (MOS) on grown, survival rate, intestinal morphology and blood cell count of the golden trevally fish (Gnathanodon specious)

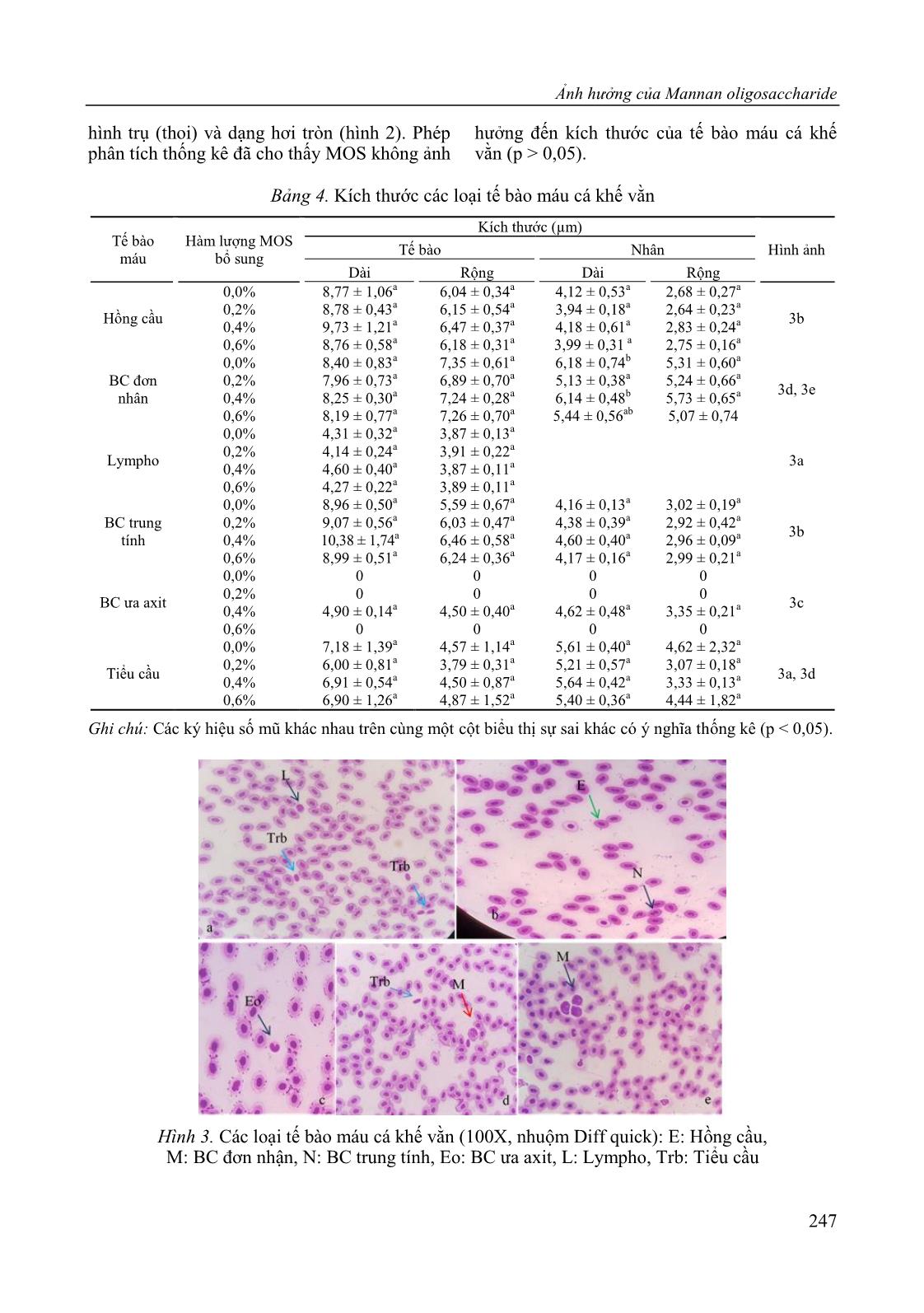
uả trên đối tượng cá tầm (Huso huso) [11] cho rằng không có sự khác biệt về số lượng RBC và WBC của cá cho ăn bằng thức ăn bổ sung MOS ở các nồng độ khác nhau, hay cá hồi (Oncorhynchus mykiss) [23] và cá tráp (Sparus aurata) [9]. Ngược lại, cũng có nghiên cứu cho thấy MOS có ảnh hưởng đến mật độ hồng cầu của cá rô phi sông Nin (Oreochromis niloticus) [13]. Một số nghiên cứu khác đối với cá tráp Sparus aurata [2], cá chẽm Dicentrachus labrax [10], cá rohu (Labeo rohita) [29], cũng ghi nhận có sự cải thiện đáng kể về số lượng WBC, RBC và Hb ở nhóm cá cho ăn thức ăn bổ sung MOS. Bảng 3. Số lượng và tần suất bắt gặp của các loại bạch cầu và tiểu cầu trong máu cá khế vằn trong thí nghiệm nuôi bằng thức ăn bổ sung MOS Loại tế bào Hàm lượng MOS bổ sung Tần suất bắt gặp (%) 0 % 0,2% 0,4% 0,6% BC đơn nhân (%) 0,89 ± 0,38a 1,33 ± 0,67a 2,00 ± 0,67a 1,78 ± 0,38a 100 BC ưa axit (%) 0 0 0,22 ± 0,38 0 13,89 BC trung tính (%) 6,44 ± 2,52a 6,89 ± 1,01a 6,22 ± 1,68a 7,66 ± 2,03a 100 Lympho (%) 1,78 ± 0,38a 2,00 ± 1,15ab 5,33 ± 2,31b 2,89 ± 0,38ab 100 Tiểu cầu (%) 90,89 ± 2,03a 89,78 ± 2,78a 88,44 ± 3,00a 87,92 ± 2,38a 100 Ghi chú: Các k hiệu số mũ khác nhau trên cùng một hàng biểu thị sự sai khác có nghĩa thống kê (p < 0,05). Theo số liệu bảng 3, không có sự khác biệt thống kê giữa các nghiệm thức thí nghiệm so với đối chứng về số lượng BC đơn nhân, BC trung tính và tiểu cầu có trong máu cá khế vằn (p > 0,05). Tuy nhiên, kết quả thí nghiệm ghi nhận sự xuất hiện của tế bào lympho cao nhất (đạt 5,33 ± 2,31%) ở nhóm cá ăn thức ăn bổ sung 0,4% MOS và có sự khác biệt thống kê so với nhóm đối chứng (1,78 ± 0,38%). Tương tự, kết quả nghiên cứu bổ sung MOS vào thức ăn đối với cá tầm (Huso huso) trong 46 ngày nuôi, MOS không ảnh hưởng đến số lượng RBC, WBC, PCV, Hb, MCV, MCH, MCHC, bạch cầu trung tính và bạch cầu đơn nhân (p > 0,05); nhưng có sự sai khác thống kê về tỉ lệ % của BC ưa axit và lympho bào ở 0,2% và 0,4% MOS [17]. Trong thí nghiệm đối với cá hồi, số lượng lympho cao nhất (91,66 ± 2,51a) và cũng không có sự sai khác về BC trung tính và BC ưa axit giữa các nghiệm thức ở chế độ ăn bổ sung MOS 0,1% [11]. Mặt khác không có sai khác về số lượng hồng cầu, bạch cầu, BC trung tính và BC đơn nhân của lô thí nghiệm 0,2% và 0,4% MOS so với đối chứng. Một nghiên cứu khác đối với cá tầm, tế bào lympho trong máu khá cao (64,33–76,33%), trong đó số lượng lympho bào ở nghiệm thức đối chứng cao hơn cả so với cá được bổ sung MOS [11]. Ngoài ra, một số nghiên cứu khác cũng chỉ ra rằng MOS không ảnh hưởng đến các thông số của tế bào máu sinh vật nuôi, ví dụ đối với cá rô phi (Oreochromis niloticus) [28] và cá trắm cỏ (Ctenopharyngodon idella) [29]. Ở tất cả các nghiệm thức, số lượng tiểu cầu chiếm đa số. Đây có thể do thời điểm thu mẫu cũng như nồng độ và thời gian bổ sung MOS chưa phù hợp gây ảnh hưởng đến kết quả. Số lượng các loại tế bào BC trong máu cá khế vằn khá thấp, và không bắt gặp BC ưa kiềm ở tất cả các nghiệm thức. Loại BC ưa axit chỉ bắt gặp ở máu cá bổ sung 0,4% MOS với tần suất khá thấp (13,89%). Như vậy, ảnh hưởng MOS bổ sung trong thức ăn đối với các chỉ số tế bào máu cá thí nghiệm khá khác nhau, thậm chí trái ngược nhau. Sự sai khác này có thể do các chỉ số tế bào máu có thể chịu ảnh hưởng bởi nhiều nhân tố khác nhau như đặc tính của từng loài, hàm lượng MOS bổ sung và thời gian cho ăn bổ sung [11, 31]. Theo số liệu Bảng 4, kích thước của hồng cầu dao động từ 8,76–9,73 × 0,04–6,48 µm. Trong máu cá khế vằn, tế bào lympho xuất hiện dưới hai dạng là lympho nhỏ (4,14–4,60 µm) và vừa (6,25–6,85 µm); tiểu cầu cũng có dạng Ảnh hưởng của Mannan oligosaccharide 247 hình trụ (thoi) và dạng hơi tròn (hình 2). Phép phân tích thống kê đã cho thấy MOS không ảnh hưởng đến kích thước của tế bào máu cá khế vằn (p > 0,05). Bảng 4. Kích thước các loại tế bào máu cá khế vằn Tế bào máu Hàm lượng MOS bổ sung Kích thước (µm) Hình ảnh Tế bào Nhân Dài Rộng Dài Rộng Hồng cầu 0,0% 8,77 ± 1,06a 6,04 ± 0,34a 4,12 ± 0,53a 2,68 ± 0,27a 3b 0,2% 8,78 ± 0,43a 6,15 ± 0,54a 3,94 ± 0,18a 2,64 ± 0,23a 0,4% 9,73 ± 1,21a 6,47 ± 0,37a 4,18 ± 0,61a 2,83 ± 0,24a 0,6% 8,76 ± 0,58a 6,18 ± 0,31a 3,99 ± 0,31 a 2,75 ± 0,16a BC đơn nhân 0,0% 8,40 ± 0,83a 7,35 ± 0,61a 6,18 ± 0,74b 5,31 ± 0,60a 3d, 3e 0,2% 7,96 ± 0,73a 6,89 ± 0,70a 5,13 ± 0,38a 5,24 ± 0,66a 0,4% 8,25 ± 0,30a 7,24 ± 0,28a 6,14 ± 0,48b 5,73 ± 0,65a 0,6% 8,19 ± 0,77a 7,26 ± 0,70a 5,44 ± 0,56ab 5,07 ± 0,74 Lympho 0,0% 4,31 ± 0,32a 3,87 ± 0,13a 3a 0,2% 4,14 ± 0,24a 3,91 ± 0,22a 0,4% 4,60 ± 0,40a 3,87 ± 0,11a 0,6% 4,27 ± 0,22a 3,89 ± 0,11a BC trung tính 0,0% 8,96 ± 0,50a 5,59 ± 0,67a 4,16 ± 0,13a 3,02 ± 0,19a 3b 0,2% 9,07 ± 0,56a 6,03 ± 0,47a 4,38 ± 0,39a 2,92 ± 0,42a 0,4% 10,38 ± 1,74a 6,46 ± 0,58a 4,60 ± 0,40a 2,96 ± 0,09a 0,6% 8,99 ± 0,51a 6,24 ± 0,36a 4,17 ± 0,16a 2,99 ± 0,21a BC ưa axit 0,0% 0 0 0 0 3c 0,2% 0 0 0 0 0,4% 4,90 ± 0,14a 4,50 ± 0,40a 4,62 ± 0,48a 3,35 ± 0,21a 0,6% 0 0 0 0 Tiểu cầu 0,0% 7,18 ± 1,39a 4,57 ± 1,14a 5,61 ± 0,40a 4,62 ± 2,32a 3a, 3d 0,2% 6,00 ± 0,81a 3,79 ± 0,31a 5,21 ± 0,57a 3,07 ± 0,18a 0,4% 6,91 ± 0,54a 4,50 ± 0,87a 5,64 ± 0,42a 3,33 ± 0,13a 0,6% 6,90 ± 1,26a 4,87 ± 1,52a 5,40 ± 0,36a 4,44 ± 1,82a Ghi chú: Các k hiệu số mũ khác nhau trên cùng một cột biểu thị sự sai khác có nghĩa thống kê (p < 0,05). Hình 3. Các loại tế bào máu cá khế vằn (100X, nhuộm Diff quick): E: Hồng cầu, M: BC đơn nhận, N: BC trung tính, Eo: BC ưa axit, L: Lympho, Trb: Tiểu cầu Đặng Trần Tú Trâm và nnk. 248 KẾT LUẬN Bổ sung Mannan oligosaccharide (MOS) vào thức ăn ở các hàm lượng 0,2%, 0,4% và 0,6% không ảnh hưởng đến tốc độ tăng trưởng và một số chỉ tiêu huyết học của cá khế vằn trong 90 ngày thí nghiệm. Tuy nhiên, ở hàm lượng bổ sung 0,6% MOS lại có tác dụng cải thiện tỷ lệ sống của đối tượng này. Lời cảm ơn: Chúng tôi xin chân thành cảm ơn Viện Hải dương học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam đã tạo điều kiện cơ sở vật chất trong thời gian nghiên cứu. Nhóm tác giả cũng cảm ơn TS. Huỳnh Minh Sang, phòng Công nghệ Nuôi trồng, Viện Hải dương học đã giúp đỡ trong quá trình thực hiện thí nghiệm. TÀI LIỆU THAM KHẢO [1] Staykov, Y., Spring, P., Denev, S., and Sweetman, J., 2007. Effect of a mannan oligosaccharide on the growth performance and immune status of rainbow trout (Oncorhynchus mykiss). Aquaculture International, 15(2), 153– 161. [2] Dimitroglou, A., Merrifield, D. L., Spring, P., Sweetman, J., Moate, R., and Davies, S. J., 2010. Effects of mannan oligosaccharide (MOS) supplementation on growth performance, feed utilisation, intestinal histology and gut microbiota of gilthead sea bream (Sparus aurata). Aquaculture, 300(1–4), 182–188. [3] Akrami, R., Chitsaz, H., Hezarjaribi, A., and Ziaei, R., 2012. Effect of dietary mannan oligosaccharide (MOS) on growth performance and immune response of Gibel carp juveniles (Carassius auratus gibelio). J. Vet. Adv, 2(10), 507–513. [4] Gibson, G. R., Probert, H. M., Van Loo, J., Rastall, R. A., and Roberfroid, M. B., 2004. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutrition research reviews, 17(2), 259–275. [5] Teitelbaum, J. E., and Walker, W. A., 2002. Nutritional impact of pre-and probiotics as protective gastrointestinal organisms. Annual review of nutrition, 22(1), 107–138. [6] Dimitroglou, A., Davies, S., and Sweetman, J., 2008. The effect of dietary mannan oligosaccharides on the intestinal histology of rainbow trout (Oncorhynchus mykiss). Comparative Biochemistry and Physiology, Part A, 150(3), S63. [7] Grisdale-Helland, B., Helland, S. J., and Gatlin III, D. M., 2008. The effects of dietary supplementation with mannanoligosaccharide, fructooligosaccharide or galactooligosaccharide on the growth and feed utilization of Atlantic salmon (Salmo salar). Aquaculture, 283(1–4), 163–167. [8] Gültepe, N., Salnur, S., Hoşsu, B., and Hisar, O., 2011. Dietary supplementation with Mannanoligosaccharides (MOS) from Bio‐Mos enhances growth parameters and digestive capacity of gilthead sea bream (Sparus aurata). Aquaculture Nutrition, 17(5), 482–487. [9] Gelibolu, S., Yanar, Y., Genc, M. A., and Genc, E., 2018. The effect of mannan- oligosaccharide (MOS) as a feed supplement on growth and some blood parameters of Gilthead Sea Bream (Sparus aurata). Turkish Journal of Fisheries and Aquatic Sciences, 18(6), 817–823. [10] Torrecillas, S., Makol, A., Caballero, M. J., Montero, D., Ginés, R., Sweetman, J., and Izquierdo, M., 2011. Improved feed utilization, intestinal mucus production and immune parameters in sea bass (Dicentrarchus labrax) fed mannan oligosaccharides (MOS). Aquaculture Nutrition, 17(2), 223–233. [11] Akrami, R., Razeghi Mansour, M., Ghobadi, S., Ahmadifar, E., Shaker Khoshroudi, M., and Moghimi Haji, M. S., 2013. Effect of prebiotic mannan oligosaccharide on hematological and blood serum biochemical parameters of cultured juvenile great sturgeon (Huso huso Linnaeus, 1754). Journal of Applied Ichthyology, 29(6), 1214–1218. [12] Peterson, B. C., Bramble, T. C., and Manning, B. B., 2010. Effects of Bio‐Mos® on growth and survival of Ảnh hưởng của Mannan oligosaccharide 249 channel catfish challenged with Edwardsiella ictaluri. Journal of the World Aquaculture Society, 41(1), 149–155. [13] Ahmad, M. H., El-Mousallamy, A., Awad, S. M. M., and El-Naby, A. A., 2013. Evaluation of Bio-Mos® as a feed additive on growth performance, physiological and immune responses of Nile tilapia, Oreochromis niloticus (L). Journal of applied sciences research, 9(13), 6441–6449. [14] Đỗ Hữu Hoàng, Hoàng Đức Lư, Phạm Xuân Kỳ, Đặng Trần Tú Trâm, Nguyễn Thị Kim Bích, Hồ Sơn Lâm, Trần Văn Huynh, Đào Việt Hà, Nguyễn Thu Hồng, Phan Bảo Vi, 2014. Ảnh hưởng của Oligosaccharide bổ sung vào thức ăn lên protein trong cơ, hình thái ruột và tế bào máu của cá khoang cổ nemo, Amphiprion ocellaris. Tạp chí Khoa học và Công nghệ biển, 14(2), 155–162. [15] Alit, A. A., 2013. Growth and survival rate of golden trevally, gnathannodon speciosus forsskal with different length size. Jurnal Ilmu dan Teknologi Kelautan Tropis, 5(2), 401–408. [16] Wedemeyer, G. A., 1997. Effects of rearing conditions on the health and physiological quality of fish in intensive culture. Fish stress and health in aquaculture, 35–71. [17] Mansour, M. R., Akrami, R., Ghobadi, S. H., Denji, K. A., Ezatrahimi, N., and Gharaei, A., 2012. Effect of dietary mannan oligosaccharide (MOS) on growth performance, survival, body composition, and some hematological parameters in giant sturgeon juvenile (Huso huso Linnaeus, 1754). Fish physiology and biochemistry, 38(3), 829–835. [18] Pryor, G. S., Royes, J. B., Chapman, F. A., and Miles, R. D., 2003. Mannanoligosaccharides in fish nutrition: effects of dietary supplementation on growth and gastrointestinal villi structure in Gulf of Mexico sturgeon. North American journal of aquaculture, 65(2), 106–111. [19] de Azevedo, R. V., da Silva-Azevedo, D. K., dos Santos-Júnior, J. M., Fosse-Filho, J. C., de Andrade, D. R., Tavares-Braga, L. G., and Vidal-Júnior, M. V., 2016. Effects of dietary mannan oligosaccharide on the growth, survival, intestinal morphometry and nonspecific immune response for Siamese fighting fish (Betta splendens Regan, 1910) larvae. Latin American Journal of Aquatic Research, 44(4), 800–806. [20] Salze, G., McLean, E., Schwarz, M. H., and Craig, S. R., 2008. Dietary mannan oligosaccharide enhances salinity tolerance and gut development of larval cobia. Aquaculture, 274(1), 148–152. [21] Azevedo, R. V., Fosse Filho, J. C., Pereira, S. L., Andrade, D. R., and Júnior, V., 2016. Prebiótico, probiótico e simbiótico para larvas de Trichogaster leeri (Bleeker, 1852, Perciformes, Osphronemidae). Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 68(3), 795–804. [22] Staykov, Y., Denev, S., Spring, P., and Flos, R., 2005. The effects of mannan oligosaccharide (Bio-Mos) on the growth rate and immune function of rainbow trout (Salmo gairdneri irideus G.) growth in net cages. Lessons from the past to optimise the future. European Aquaculture Society, Special Publication, (35), 427–432. [23] Blaxhall, P. C., and Daisley, K. W., 1973. Routine haematological methods for use with fish blood. Journal of fish biology, 5(6), 771–781. [24] Mahious, A. S., Gatesoupe, F. J., Hervi, M., Metailler, R., and Ollevier, F., 2006. Effect of dietary inulin and oligosaccharides as prebiotics for weaning turbot, Psetta maxima (Linnaeus, C. 1758). Aquaculture International, 14(3), 219–229. [25] Yilmaz, E., Genc, M. A., and Genc, E., 2007. Effects of dietary mannan oligosaccharides on growth, body composition, and intestine and liver histology of rainbow trout, Oncorhynchus mykiss. Israeli Journal of Aquaculture- Bamidgeh, 59(3), 182–158. Đặng Trần Tú Trâm và nnk. 250 [26] Samrongpan, C., N. Areechn, R. Yoonpundh, and P. Srisapoome, 2008. Effects of mannn oligosaccharide growth performance, survival and desistance of Nile tilapia (Oreochromis niloticus L) fry. International symposium on Tilapia in Aquaculture. [27] Denji, K. A., Mansour, M. R., Akrami, R., Ghobadi, S., Jafarpour, S. A., and Mirbeygi, S. K., 2015. Effect of Dietary Prebiotic Mannan Oligosaccharide (MOS) on Growth Performance, Intestinal Microflora, Body Composition, Haematological and Blood Serum Biochemical Parameters of Rainbow Trout (Oncorhynchus mykiss) Juveniles. Journal of Fisheries and Aquatic Science, 10(4), 255–265. [28] Andrews, S. R., Sahu, N. P., Pal, A. K., and Kumar, S., 2009. Haematological modulation and growth of Labeo rohita fingerlings: effect of dietary mannan oligosaccharide, yeast extract, protein hydrolysate and chlorella. Aquaculture research, 41(1), 61–69. [29] Hisano, H., Barros, M. M., and Pezzato, L. E., 2018. Levedura e zinco como pró- nutrientes em rações para tilápia-do-nilo (Oreochromis niloticus): aspectos hematológicos. Boletim do Instituto de Pesca, 33(1), 35–42. [30] Shaker Khoshroudi, M., 2011. Effect of dietary mannan oligosaccharide on growth performance, survival, some haematological and serum biochemical parameters of grass carp (Ctenopharyngodon idella) juveniles. Doctoral dissertation, MA thesis, Islamic Azad University, Babol branch, Iran. [31] Tavares-Dias, M., and Oliveira, S. R., 2009. A review of the blood coagulation system of fish. Brazilian Journal of Biosciences, 7(2), 205–224.
File đính kèm:
 effects_of_dietary_mannan_oligosaccharide_mos_on_grown_survi.pdf
effects_of_dietary_mannan_oligosaccharide_mos_on_grown_survi.pdf

