Ảnh hưởng của các liều Heat shock protein lên các thông số miễn dịch của tôm sú
TÓM TẮT
Nghiên cứu này được thực hiện nhằm đánh giá ảnh hưởng của các liều khác nhau của protein sốc nhiệt ly
trích từ vi khuẩn (DnaK) lên đáp ứng miễn dịch của tôm sú. Khả năng đáp ứng miễn dịch của tôm được
kiểm tra bằng phản ứng Phenoloxidase thực hiện trên cuvet, so màu bằng quang phổ kế ở bước sóng
492nm và phản ứng định lượng Real-time PCR. DnaK được ly trích từ chủng vi khuẩn E. coli có khả
năng biểu hiện DnaK gắn với hexahistidine sau đó được tinh sạch bằng bộ kít dưới tác dụng của các hạt
từ Dynabead. Lượng DnaK ly trích được kiểm tra bằng phương pháp Bradford. DnaK sau đó được trộn
với dung dịch đệm nạp mẫu và điện di trên bản gel 10% SDS-PAGE. Gel sau khi điện di được nhuộm
với Bio-safe Coomassie stain (phản ứng SDS-PAGE) hoặc chuyển qua màng lai cho phản ứng với kháng
thể đặc hiệu cho DnaK (phản ứng Western Blot). Tôm sú có trọng lượng trung bình 10-12g được tiêm
với các liều khác nhau của DnaK (2, 4, 6, 8, 10 hoặc 15µg/tôm), máu tôm được thu ở các thời điểm 2, 4,
7 và 10 giờ sau khi tiêm DnaK. Biểu hiện của gen prophenoloxidase được kiểm tra bằng phản ứng định
lượng real-time PCR. Tôm được tiêm với 8 hoặc 10 µg DnaK làm tăng biểu hiện của Prophenoloxidase
(proPO) tại thời điểm 2 và 4 giờ sau khi tiêm và khác biệt có ý nghĩa thống kê so với các nghiệm thức
khác (p < 0,05).="" kết="" quả="" này="" cho="" phép="" kết="" luận="" dnak="" có="" khả="" năng="" điều="" khiển="" đáp="" ứng="" miễn="" dịch="">
tôm sú.

Trang 1

Trang 2
Trang 3

Trang 4

Trang 5

Trang 6
Trang 7
Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Ảnh hưởng của các liều Heat shock protein lên các thông số miễn dịch của tôm sú

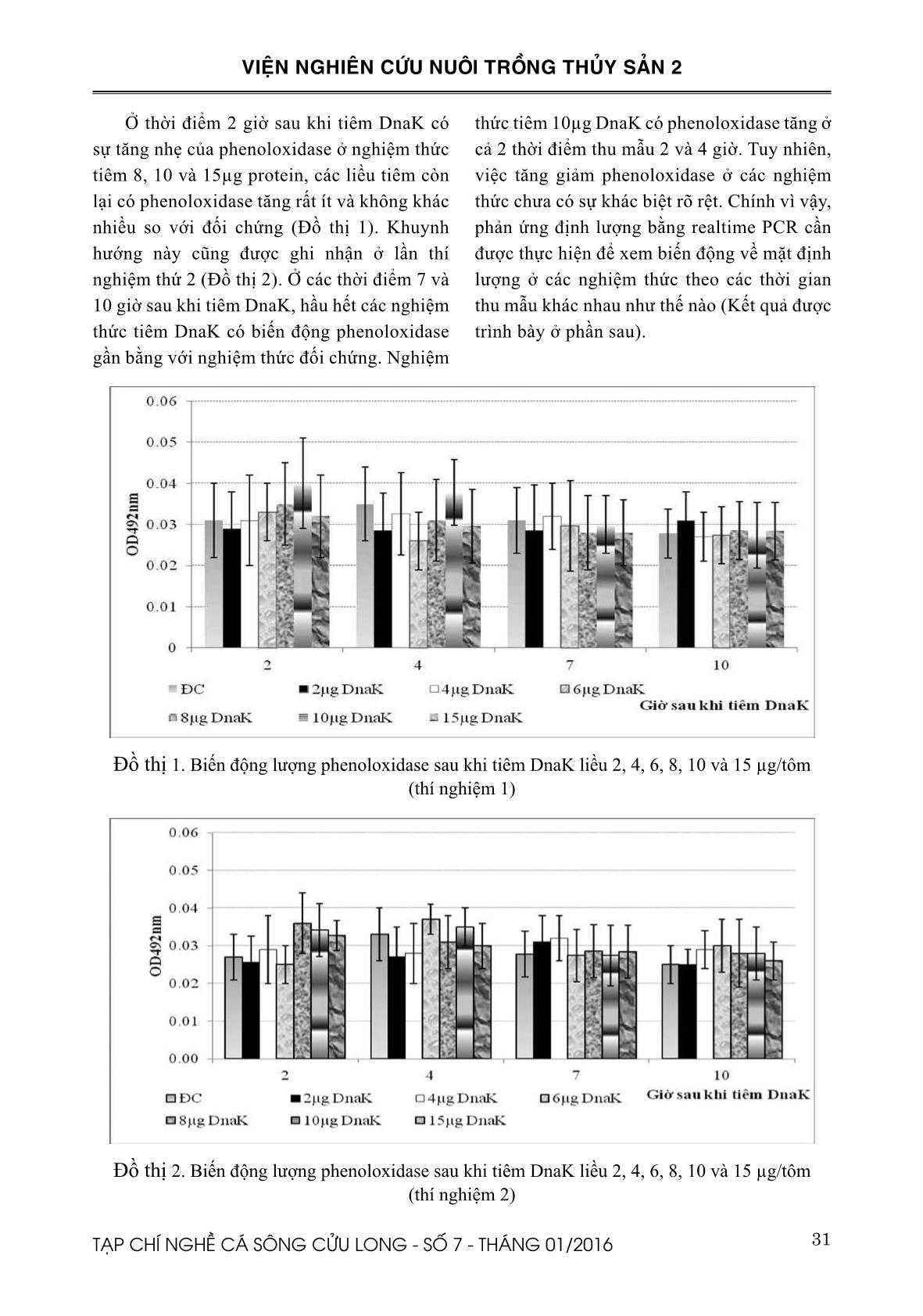
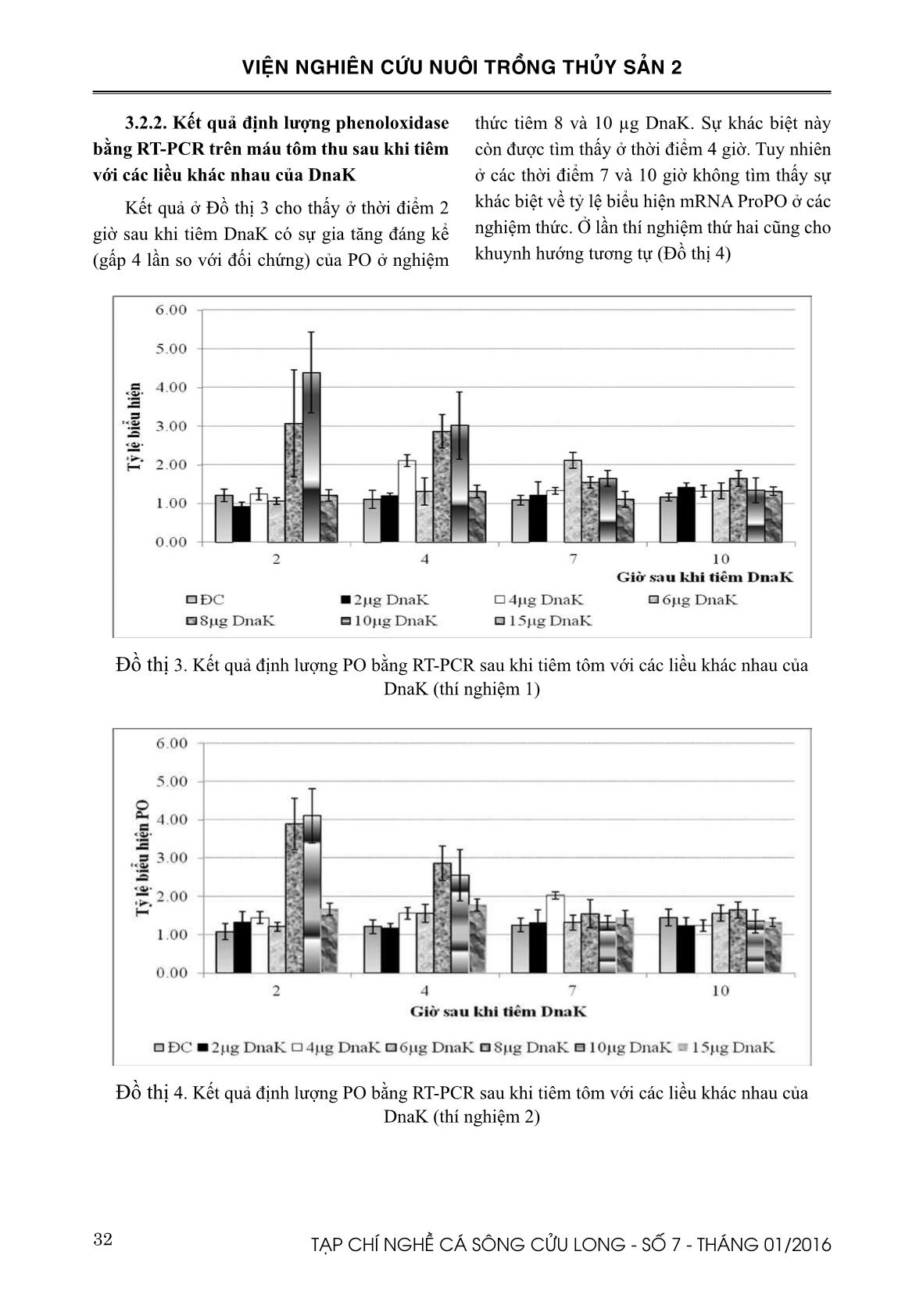
ssie Biosafe; M = thang protein) (hình trái). DnaK được xác định sau khi thực hiện phản ứng Western Blot (hình phải) Hình 6. Máu tôm được thu và chứa trong dung dịch kháng đông, giữ lạnh Hình 7. Phản ứng PO assay được thực hiện trong cuvet 31TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Ở thời điểm 2 giờ sau khi tiêm DnaK có sự tăng nhẹ của phenoloxidase ở nghiệm thức tiêm 8, 10 và 15µg protein, các liều tiêm còn lại có phenoloxidase tăng rất ít và không khác nhiều so với đối chứng (Đồ thị 1). Khuynh hướng này cũng được ghi nhận ở lần thí nghiệm thứ 2 (Đồ thị 2). Ở các thời điểm 7 và 10 giờ sau khi tiêm DnaK, hầu hết các nghiệm thức tiêm DnaK có biến động phenoloxidase gần bằng với nghiệm thức đối chứng. Nghiệm thức tiêm 10µg DnaK có phenoloxidase tăng ở cả 2 thời điểm thu mẫu 2 và 4 giờ. Tuy nhiên, việc tăng giảm phenoloxidase ở các nghiệm thức chưa có sự khác biệt rõ rệt. Chính vì vậy, phản ứng định lượng bằng realtime PCR cần được thực hiện để xem biến động về mặt định lượng ở các nghiệm thức theo các thời gian thu mẫu khác nhau như thế nào (Kết quả được trình bày ở phần sau). Đồ thị 1. Biến động lượng phenoloxidase sau khi tiêm DnaK liều 2, 4, 6, 8, 10 và 15 µg/tôm (thí nghiệm 1) Đồ thị 2. Biến động lượng phenoloxidase sau khi tiêm DnaK liều 2, 4, 6, 8, 10 và 15 µg/tôm (thí nghiệm 2) 32 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 3.2.2. Kết quả định lượng phenoloxidase bằng RT-PCR trên máu tôm thu sau khi tiêm với các liều khác nhau của DnaK Kết quả ở Đồ thị 3 cho thấy ở thời điểm 2 giờ sau khi tiêm DnaK có sự gia tăng đáng kể (gấp 4 lần so với đối chứng) của PO ở nghiệm thức tiêm 8 và 10 µg DnaK. Sự khác biệt này còn được tìm thấy ở thời điểm 4 giờ. Tuy nhiên ở các thời điểm 7 và 10 giờ không tìm thấy sự khác biệt về tỷ lệ biểu hiện mRNA ProPO ở các nghiệm thức. Ở lần thí nghiệm thứ hai cũng cho khuynh hướng tương tự (Đồ thị 4) Đồ thị 3. Kết quả định lượng PO bằng RT-PCR sau khi tiêm tôm với các liều khác nhau của DnaK (thí nghiệm 1) Đồ thị 4. Kết quả định lượng PO bằng RT-PCR sau khi tiêm tôm với các liều khác nhau của DnaK (thí nghiệm 2) 33TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 IV. THẢO LUẬN Hsp70 là một loại protein được nhận định là thường hiện hữu trong hầu hết các loại tế bào, tăng mạnh khi đáp ứng với các điều kiện stress hay yếu tố lạ và tôm sú cũng không phải là điều ngoại lệ. Ở liều tiêm 8 và 10 μg DnaK đã kích thích biểu hiện PO cao gấp 4 lần ở thời điểm 2 giờ sau khi tiêm. Lượng PO vẫn còn cao ở nghiệm thức này tại thời điểm 4 giờ nhưng sau đó giảm đáng kể ở các thời điểm thu mẫu còn lại. Có thể là do bản chất DnaK hay đáp ứng miễn dịch của tôm chỉ biểu hiện và kéo dài trong một khoảng thời gian ngắn. Ở các thời điểm sau 4 giờ có thể là do sự bình ổn của hệ miễn dịch nên không thấy tăng giảm PO đáng kể. Đã có rất nhiều nghiên cứu cho rằng HSP70 đóng vai trò như yếu tố hoạt hóa hệ miễn dịch tự nhiên (Pockley, 2003; Tsan, 2004) cụ thể là kích thích hoạt động của các tế bào trong hệ miễn dịch. Nghiên cứu đầu tiên về ứng dụng HSP70 tái tổ hợp cho thấy HSP70 có khả năng kích thích sự sản sinh cytokines như IL-1 hay TNF-α từ bạch cầu đơn nhân lớn ở người hay đại thực bào ở chuột trong điều kiện in vitro (Basu và ctv., 2002; Galdiero và ctv., 1997). Prophenoloxidase đóng vai trò quan trọng trong đáp ứng miễn dịch ở giáp xác. Các nghiên cứu cho thấy ProPO có vai trò quan trọng trong cơ chế miễn dịch chống lại các bệnh nhiễm khuẩn hay ký sinh trùng (Cerenius và Söderhäll, 2004). Hiện tại chưa thấy công bố nghiên cứu về ảnh hưởng của tiêm Hsp70 lên PO trên tôm sú. Tuy nhiên, ảnh hưởng kết hợp của Hsp70 và vi khuẩn Vibrio campbellii lên PO trên Artemia đã được Baruah và ctv., (2011) nghiên cứu. Theo nhóm tác giả này khi cho Artemia nuôi trong điều kiện vô trùng ăn Hsp70 từ Artemia hoặc Hsp70 được kích thích sinh ra từ E. coli tiếp theo đó là gây nhiễm bằng V. campbellii cho thấy tăng cường hệ thống ProPO được chứng minh bằng mRNA và ở mức độ protein. Nghiên cứu này cho thấy rằng Hsp70 có nguồn gốc từ prokaryotic hay eukaryotic đều là nguồn khơi dậy tác dụng bảo hộ miễn dịch ở Artemia chống lại tác nhân gây bệnh bằng cách hoạt hóa hệ thống ProPO. Đây là một trong những nghiên cứu đầu tiên về hoạt động hoạt hóa của Hsp70 ở động vật không xương sống. Theo Ryckaert và ctv., (2010) thì Hsp70 tái tổ hợp khi tiêm vào playfish (Xiphophorus maculates) có vai trò kích thích miễn dịch kháng lại tác nhân gây bệnh Yersinia ruckeri. Tuy nhiên, hiệu quả bảo hộ vẫn chưa so sánh được với vaccine. Trong nghiên cứu này, các nghiệm thức tiêm Hsp70 liều 2, 4, 6 µg DnaK hầu như không có sự khác biệt lớn về phenoloxidase so với nhóm đối chứng ở các thời điểm thu mẫu. Theo các nghiên cứu trước đây thì lượng PO sinh ra có liên quan đến chu kỳ lột xác của tôm. Liu và ctv., (2004) nghiên cứu trên tôm thẻ chân trắng 8,0–14,4 g ở các giai đoạn lột xác khác nhau cho thấy tổng số tế bào máu cao nhất ở giai đoạn sau lột xác lớp vỏ đã cứng (intermoult) nhưng thấp nhất ở giai đoạn vừa sau lột xác. Hoạt động phenoloxidase cao nhất ở giai đoạn intermoult và thấp nhất ở giai đoạn vừa sau lột xác. Hoạt động thực bào của tôm với Vibrio alginolyticus giảm một cách đáng kể ở giai đoạn vừa sau lột xác và giai đoạn tiền lột xác. Trong một thí nghiệm khác, khi tiêm tôm thẻ chân trắng ở các giai đoạn lột xác khác nhau với 105 CFU V. alginolyticus cho thấy sau 10 giờ tiêm cho thấy tỷ lệ chết ở nhóm vừa sau lột xác cao hơn và có ý nghĩa so với nhóm ở giai đoạn intermoult. Sau 48-120 giờ theo dõi cho thấy nhóm tôm ở giai đoạn vừa sau lột xác có tỷ lệ chết cao nhất và nhóm intermoult cho tỷ lệ chết thấp nhất. Vì vậy để loại trừ khả năng ảnh hưởng của các giai đoạn lột xác đến phenoloxidase sau khi tiêm với các liều khác nhau của DnaK, trong nghiên cứu này chúng 34 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 tôi đã chọn lựa tôm đồng đều về giai đoạn lột xác trước khi tiến hành thí nghiệm. Theo Sung (2014) khi cho ấu trùng tôm thẻ chân trắng ăn E. coli YS 2 có khả năng sản sinh DnaK khi kích thích bằng Arabinose làm tăng cường khả năng đề kháng khi gây nhiễm với V. harveyi. Bằng phương pháp Realtime PCR nhóm tác giả này tìm thấy ở nhóm cho ăn E. coli tăng crustin mRNA gấp 7 lần so với nhóm đối chứng. Tuy nhiên nhóm tác giả này không tìm thấy sự khác biệt so với nhóm đối chứng về các chỉ tiêu miễn dịch khác như ProPO, penaeidin, hemocyanin và peroxinectin. Theo kết quả nghiên cứu của Hu và ctv., (2014) cho thấy DnaK có khả năng kích thích hệ thống miễn dịch của tôm thẻ chân trắng. Sau khi tiêm tôm thẻ chân trắng với DnaK tinh sạch liều 5 µg/tôm nhóm tác giả này tìm thấy có sự tăng có ý nghĩa thống kê đối với chỉ tiêu transglutaminases và prophenoloxidases ở tôm thẻ chân trắng tại thời điểm 3 giờ sau khi tiêm DnaK. Ngoài sự tăng PO còn có sự tăng giảm của các gen liên quan đến miễn dịch trên tôm thẻ chân trắng như Penaeidin (PEN), Transgluminase (TGase-1), endogenous HSP70 (lvHSP70) (lv = left ventricular). Tuy nhiên, không phải tất cả các gen điều hòa miễn dịch đều tăng sau khi tiêm DnaK và chỉ giới hạn ở một số và ở các điểm thời gian nhất định. V. KẾT LUẬN Tiêm tôm với 8, 10 µg DnaK làm tăng biểu hiện của proPO tại thời điểm 2 và 4 giờ sau khi tiêm, điều này được xác định bằng phản ứng định lượng RT-PCR. Kết quả kiểm tra hoạt tính của phenoloxidase bằng phản ứng Phenoloxidase được thực hiện trên cuvet chưa thấy sự khác biệt lớn về hoạt tính phenoloxidase khi tiêm tôm với DnaK. Tuy nhiên với kết quả định lượng cho thấy sự khác biệt có ý nghĩa thống kê ở một số thời điểm thu mẫu. LỜI CÁM ƠN Nghiên cứu này được thực hiện trong nội dung chương trình nghiên cứu song phương Việt Bỉ với kinh phí từ Quỹ phát triển Khoa học và Công nghệ Quốc gia. Nhóm tác giả chân thành cảm ơn sự tài trợ của Quỹ cũng như sự giúp đỡ của các giáo sư thuộc Laboratory of Aquaculture & Artemia Reference Center (Gent, Belgium). 35TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 TÀI LIỆU THAM KHẢO Basu, N., Todgham, A.E., Ackerman, P.A., Bibeau, M.R., Nakano, K., Schulte, P.M., Iwama, G.K., 2002. Heat shock protein genes and their functional significance in fish. Gene 295: 173–183. Baruah, K., Ranjan, J., Sorgeloos, P. and Bossier, P., 2010. Efficacy of heterologous and homologous heat shock protein 70s as protective agents to Artemia franciscana challenged with Vibrio campbellii. Fish & Shellfish Immunology 29: 733-739 Baruah, K., Ranjan, J., Sorgeloos, P., Macrae, T.H. and Bossier, P., 2011. Primming the prophenoloxidase system of Artemia Franciscana by heat shock proteins protects against Vibrio campbellii challenge. Fish & Shellfish Immunology 31(1):134-41 Cerenius, L., Soderhall, K., 2004. The prophenoloxidase- activating system in invertebrates. Immunology Review 198: 116–126. Galdiero, M., de l’Ero, G.C., Marcatili, A., 1997. Cytokine and adhesion molecule expression in human monocytes and endothelial cells stimulated with bacterial heat shock proteins. Infecion and Immunity 65 (2): 699-707 Hu, B., Phuoc, L.H., Sorgeloos, P., Bossier, P., 2014. Bacterial HSP70 (DnaK) is an efficient immune stimulator in Litopenaeus vannamei. Aquaculture, 418–419, 87–93. Ji, P-F., Yao, C-L., Wang, Z-Y., 2009. Immune response and gene expression in shrimp (Litopenaeus vannamei) hemocytes and hepatopancreas against some pathogen-associated molecular patterns. Fish & Shellfish Immunology 27: 563-570 Lindquist, S., and Craig, E. A., 1988. The heat shock proteins. Annual Review Genetic 22: 631-637. Liu, C-H., Yeh, S-T., Cheng, S-Y., and Chen, J-C., 2004. The immune response of the white shrimp Litopenaeus vannamei and its susceptibility to Vibrio infection in relation with the moult cycle. Fish & Shellfish Immunology 16: 151–161 Liu, C.H., Yeh, S.P., Kuo, C.M., Cheng, W., Chou, C.H., 2006. The effect of sodium alginate on the immune response of tiger shrimp via dietary administration: activity and gene transcription. Fish & Shellfish Immunology 21:442-253. Pockley, A. G., 2003. Heat shock proteins as regulators of the immune response. The Lancet 362: 469- 476. Pockley, A.G., 2005. Heat shock proteins as regulators of the immune response. The Lancet 362: 469–476. Ryckaert, J., Pasmans, F., Tobback, E., Duchateau, L., Decostere, A., Haesebrouck, F., 2010. Heat shock proteins protect platyfish (Xiphophorus maculatus) from Yersinia ruckeri induced mortality. Fish & Shellfish Immunology 28: 228–231. Sergio, H. M., Pablo, C., Marcela, Z., Jorge, O., Fernando, G., Patricio, C., and Vitalia, H., 2007. Immunological characterization of a bacterial protein isolated from salmonid fish naturally infected with Piscirickettsia salmonis. Vaccine 25: 2095–2102. Singh, V., and Aballay, A., 2006. Heat-shock transcription factor (HSF)-1 pathway required for Caenorhabditis elegans immunity. Proceedings of the National Academy of Sciences USA 103: 13092-13097. Sritunyalucksana, K., sithisarn, P., withayachumnarnkul, B., and flegel, T.W., 1999. Activation of prophenoloxidase, agglutinin and antibacterial activity in haemolymph of the black tiger prawn, Penaeus monodon, by immunostimulants. Fish & Shellfish Immunology 9: 21–30. Sung, H.H., Chang, H.J., Her, C.H., Chang, J.C., Song, Y.L., 1998. Phenoloxidase activity of hemocytes derived from Penaeus monodon and Macrobrachium rosenbergii. Journal of Invertebrate Pathology 71(1): 26-33. Sung, Y.Y., 2014. Heat Shock Proteins: An Alternative to Control Disease in Aquatic Organism. Journal of Marine Science: Research & Development 4:e126. doi: 10.4172/2155-9910.1000e126. Tsan, M.F., 2004. Cytokine function of heat-shock proteins. AJP: Cell Physiology, 286, 739-744. Yeong, Y.S., Van Damme, E. J.M., Sorgeloos, P., and Bossier, P., 2007. Non-lethal heat shock protect gnotobiotic Artemia franciscana larvae against virulent Vibrios. Fish & Shellfish Immunology 22: 318-326. Yeong, Y. S., Pineda, C., MacRae, T. H., Sorgeloos, P., and Bossier, P., 2008. Exposure of gnotobiotic Artemia franciscana larvae to abiotic stress promotes heat shock protein 70 synthesis and enhances resistance to pathogenic Vibrio campbellii. Cell Stress Chaperones 13(1): 59-66. Yeong, Y.S, Ashame, M.S., Chen, S., MacRae, T.H., Sorgeloos, P. and Bossier, P., 2009. Feeding Artemia franciscana (Kellogg) larvae with bacterial heat shock protein, protects from Vibrio campbellii infection. Journal of Fish Diseases 32 (8): 675-685. 36 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 EFFECT OF DIFFERENT DOSE OF HEAT SHOCK PROTEINS ON IMMUNE PARAMETERS OF BLACK TIGER SHRIMP (Penaeus monodon) Le Hong Phuoc1*, Nguyen Hong Loc1, Nguyen Thi Hien1, Vo Hong Phuong1 ABSTRACT This study was conducted to evaluate the effect of different doses of bacterial heat shock protein (DnaK) on immune response of black tiger shrimp (Penaeus monodon). Shrimp’s immune response was tested by carrying out phenoloxidase reaction in cuvet, then measuring OD492nm by photospectrometer and quantification of mRNA by Real-time PCR. DnaK was extracted from E. coli strain overexpressing DnaK with a hexahistidine-tag. After extraction DnaK was purified by Dynabead manegtic beads. The concentration of purified recombinant DnaK was determined by Bradford assay. DnaK sample was then combined with loading buffer and electrophoresed in 10% SDS-PAGE gels. Gels were either stained with Bio-safe Coomassie stain (SDS-PAGE) or transferred to polyvinylidene fluoride membranes for antibody probing (Western Blot). The juvenile P. monodon shrimp (mean body weight = 10-12g) were injected with DnaK at a dose of 2, 4, 6, 8, 10 or 15 µg shrimp-1. Haemolymph were collected at 2, 4, 7, and 10 hours post DnaK injection. The expression of prophenoloxidases gene was monitored via quantitative RT-PCR. Shrimps injected with 8 or 10 µg DnaK resulted in significantly increase in PO at 2 and 4 hours post injection compared to other treatments (p < 0.05). This result suggests that DnaK is able to modulate immune responses in P. monodon. Keywords: DnaK, shrimp, prophenoloxidase, HSP 70. Người phản biện: TS. Nguyễn Thị Ngọc Tĩnh Ngày nhận bài: 18/11/2015 Ngày thông qua phản biện: 18/12/2015 Ngày duyệt đăng: 25/12/2015 1. Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No2. * Email: lehongphuoc@yahoo.com
File đính kèm:
 anh_huong_cua_cac_lieu_heat_shock_protein_len_cac_thong_so_m.pdf
anh_huong_cua_cac_lieu_heat_shock_protein_len_cac_thong_so_m.pdf

