Thiết kế và vận hành hệ thống kín quang phản ứng sinh học để nuôi thâm canh vi tảo biển
TÓM TẮT
Hai kiểu hệ thống kín quang phản ứng sinh học khác nhau được thiết kế tại Trung tâm Quốc gia
Giống hải sản Nam bộ, Viện Nghiên cứu Nuôi trồng Thủy sản 2. Hệ thống tấm bao gồm 12 đơn vị
nuôi, mỗi đơn vị nuôi có thể tích 72 lít, đường dẫn ánh sáng 10cm. Hệ thống ống bao gồm 6 đơn vị
nuôi, thể tích 85 lít cho mỗi đơn vị nuôi, được thiết kế bằng ống nhựa acrylic Ф60mm. Cả hai hệ
thống được vận hành thử nghiệm trên vi tảo biển, loài Nannochloropsis oculata. Ở hệ thống tấm,
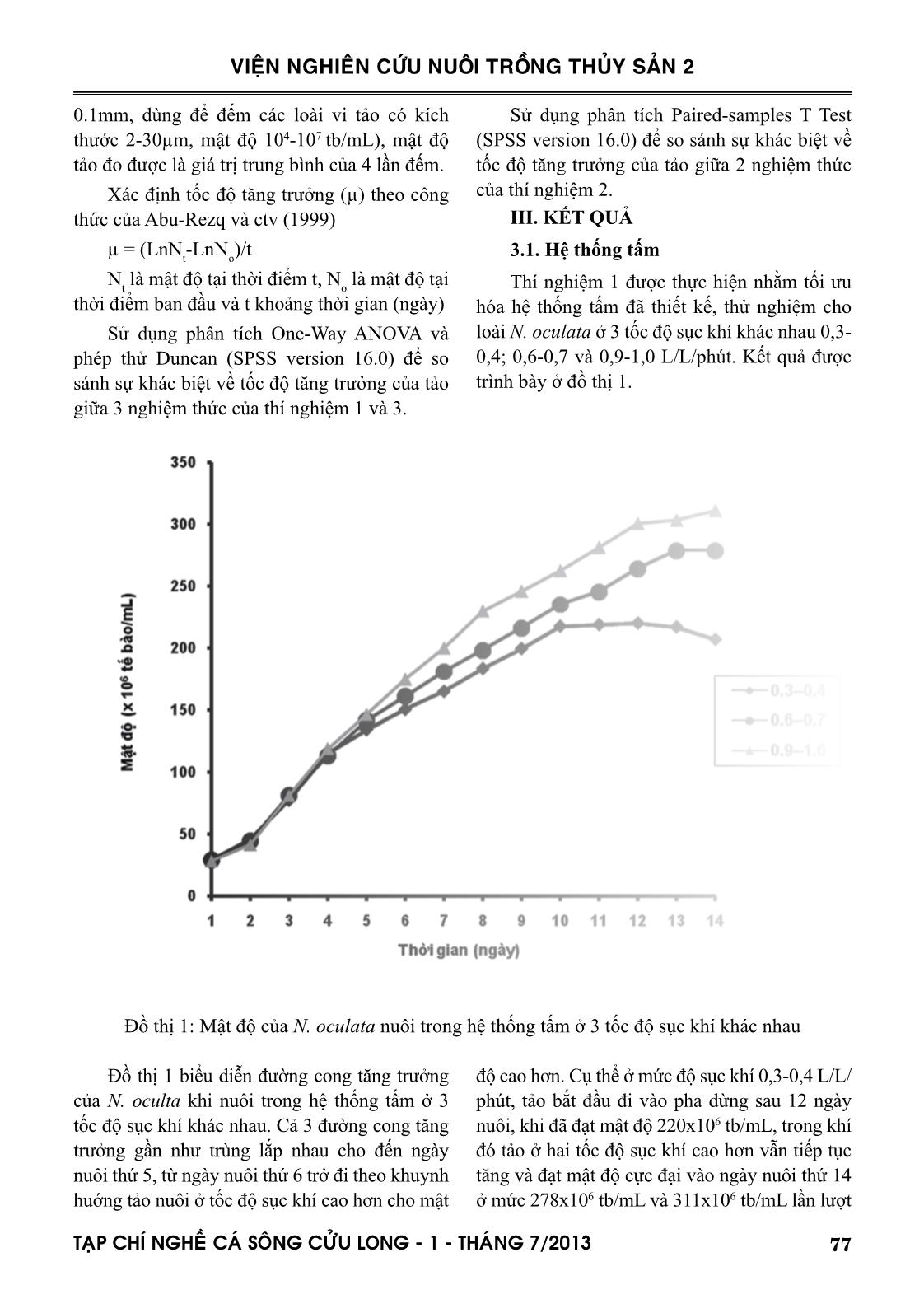
tốc độ sục khí tối ưu ở 0,9-1,0 L/L/phút, tảo đạt mật độ 311x106 tb/mL. Ở hệ thống ống, khí CO2
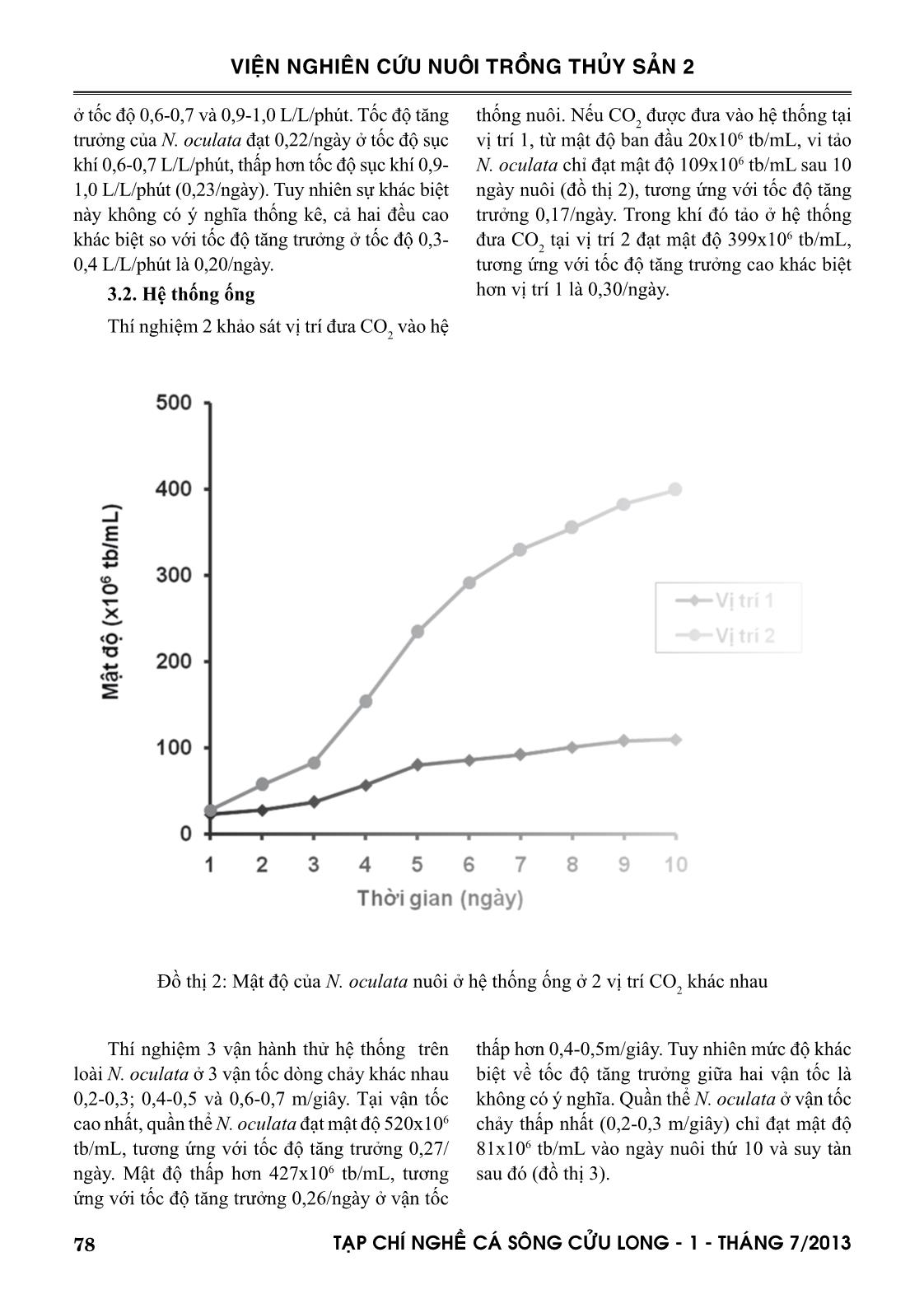
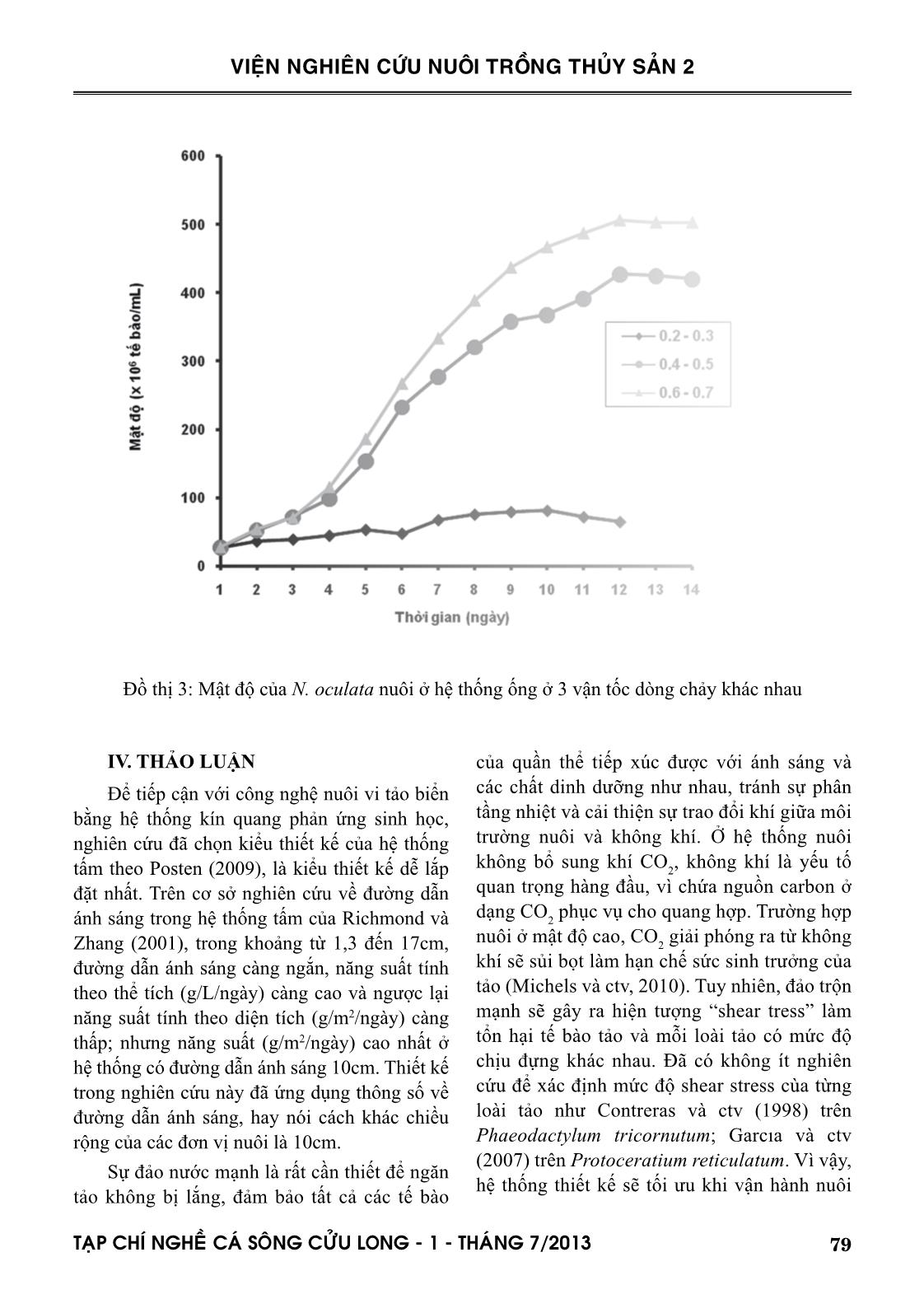
đưa vào hệ thống tại điểm giữa đầu bơm và ống ở vị trí thấp nhất, dòng chảy tối ưu ở vận tốc 0,6-0,7
m/s, tảo đạt đến mật độ 520x106 tb/mL. Kết quả nghiên cứu cho thấy cả hai hệ thống đã thiết kế có
thể ứng dụng để nuôi thâm canh N. oculata nói riêng và các loài vi tảo biển nói chung nhằm phục
vụ sản xuất giống hải sản chất lượng cao.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5
Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Thiết kế và vận hành hệ thống kín quang phản ứng sinh học để nuôi thâm canh vi tảo biển

hang và ctv (2001). Nguyên nhân là do hệ thống tấm trong nghiên cứu này chưa bổ sung CO 2 so sánh với hệ thống của hai tác giả nêu trên được bổ sung 1,5% CO 2 . Hệ thống tấm có đường dẫn ánh sáng hẹp 1,4cm của Zou và ctv (2000) cho năng suất lên đến 2,9g trọng lượng khô/L/ngày. Hệ thống ống trong nghiên cứu này được lắp đặt bằng ống acrylic Ф60mm. Posten (2009) và nhiều tác giả khác đã kết luận rằng để đạt được mật độ cao, đường kính ống càng mỏng càng tốt, thậm chí đường kính chỉ bằng 12mm, 24mm và 30 mm lần lượt theo thiết kế của Lee và Low (1991); Borowitzka (1997) và Molina Grima và ctv (1996). Khác với hệ thống tấm, ở đó sự đảo trộn là sục khí nên vi tảo nuôi có thể sử dụng carbon từ thành phần CO 2 trong không khí, hệ thống ống là dòng chảy tuần hoàn của nước nuôi, nên việc cung cấp CO 2 cho quang hợp là điều không thể thiếu. Nhu cầu CO 2 cần thiết theo Posten (2009) là khoảng 1,85 gCO 2 /g sinh khối hoặc cao hơn. Nghiên cứu này đã đưa CO 2 tinh khiết vào hệ thống thiết kế tại 2 vị trí khác nhau như đã mô tả ở phần phương pháp nghiên cứu. Công bố của Doucha và ctv (2005) và Spalding (2008) là lời giải thích cho kết quả khác biệt về tốc độ tăng trưởng và mật độ đạt được của N. oculata. Để đảm bảo tế bào tảo có thể sử dụng được nguồn carbon, áp lực nước nuôi 0,1-0,2 kPa là cần thiết. Tuy hạn chế của nghiên cứu này là chưa đo được áp lực nước nuôi tại các điểm khác nhau trong suốt vòng tuần hoàn trong hệ thống ống, nhưng chắn chắn là áp lực nước trong hệ thống đã thiết kế sẽ khác nhau do chênh lệch về độ cao và do đầu bơm hút đẩy gây ra, vị trí 2 sẽ có áp lực cao hơn vị trí 1. Đối với việc tối ưu hóa hệ thống ống dẫn, ngoài việc cung cấp CO 2 , vận tốc dòng chảy và trao đổi khí là cực kỳ quan trọng. Theo Weissman và ctv (1988), việc thải O 2 ra khỏi hệ thống ống còn khó khăn nhiều hơn so với việc cung cấp CO 2 . Đối với bất kỳ hệ thống ống, O 2 tạo ra từ quá trình quang hợp sẽ được tích tụ trong nước nuôi cho đến khi dòng chảy đến chỗ trao đổi khí, nơi đó O 2 sẽ được tách ra vào không khí. Vận tốc dòng chảy và tốc độ thải O 2 ra khỏi hệ thống ống có liên quan mật thiết với nhau (Molina và ctv, 2001). Vì vậy, hệ thống ống trong nghiên cứu này, sau khi lắp đặt cũng đã vận hành thử trên loài N. oculata ở 3 vận tốc dòng chảy khác nhau 0,2-0,3; 0,4-0,5 và 0,6-0,7 m/giây. 81TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 1 - THAÙNG 7/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Giải thích nguyên nhân quần thể không đạt được mật độ cực đại và suy tàn tại vận tốc dòng chảy thấp 0,2-0,3m/giây, là do giá trị DO của nước nuôi cao, dao động trong khoảng 350-400 % mức bão hòa, tương ứng với nồng độ 27-33mg/L. Bởi vì hàm lượng O 2 trên mức bão hòa (0,2247 mol O 2 /m3 tại 20°C) sẽ ức chế quang hợp của hầu hết các loài tảo, cho dù hàm lượng CO 2 được duy trì ở mức tối ưu (Aiba, 1982). Thật vậy, Tredici và ctv (1992) đã dẫn chứng rằng năng suất của Spirulina được cải thiện rõ rệt khi giảm hàm lượng O 2 hòa tan từ 35mg/L xuống 20mg/L. Molina và ctv (2001) kết luận rằng hàm lượng O 2 cao kết hợp với cường độ ánh sáng cao sẽ làm tổn hại tế bào tảo do sự oxi hóa bằng ánh sáng (photooxidation). Giá trị DO của nước nuôi ở 2 vận tốc dòng chảy cao hơn, dao động trong khoảng 120-200%, tương ứng 8-15mg/ L. Giá trị DO tỷ lệ nghịch với vận tốc dòng chảy. Như vậy, vận tốc dòng chảy lớn hơn có khuynh hướng tốt hơn cho sinh trưởng của quần thể tảo, do giảm hàm lượng O 2 tích tụ xuống dưới mức ức chế quang hợp. Tuy nhiên vận tốc dòng chảy lớn quá giới hạn cho phép không những giảm sản lượng thu hoạch mà còn làm tổn hại tế bào tảo, như Carlozzi và Torzillo (1996) đã quan sát khi nuôi Spirulina trong hệ thống ống với vận tốc dòng chảy cao (0,97 m/giây). Mới đây, Norsker và ctv (2011) cũng đã kết luận rằng nồng độ O 2 cao sẽ làm giảm năng suất tảo, và việc loại bỏ khí O 2 là một trong những vấn đề cần nghiên cứu khi tối ưu hóa hệ thống thiết kế. Như vậy với hệ thống ống đã thiết kế, vị trí đưa CO 2 vào hệ thống tại điểm giữa đầu bơm và ống ở vị trí thấp nhất, vận tốc dòng chảy 0,6-0,7 m/giây, đạt mật độ 520x106 tb/mL. Khi so sánh với hệ thống ống của Bùi Bá Trung và ctv (2009) bao gồm 10 ống thủy tinh Ф32mm, chiều dài 1270mm, đạt mật độ 61x106 tb/mL, mật độ trong nghiên cứu này cao gấp 9 lần và hoàn toàn có thể so sánh với hệ thống ống của các tác giả ngoài nước, đạt mật độ từ 108 đến 109 tb/mL, tùy thuộc vào đường kính ống (Lubian và ctv, 2000). V. KẾT LUẬN VÀ ĐỀ XUẤT 1. Tốc độ sục khí trong hệ thống tấm có ảnh hưởng đến tốc độ tăng trưởng và mật độ cực đại của loài nuôi thử nghiệm N. oculata. Tốc độ sục khí 0,3-0,4 L/L/phút là không tối ưu khi so sánh với 0,6-0,7 và 0,9-1,0 L/L/phút, sự khác biệt giữa hai tốc độ 0,6-0,7 và 0,9-1,0 L/L/phút không có ý nghĩa thống kê. 2. Hệ thống tấm đã thiết kế có thể tích 72 lít cho mỗi đơn vị nuôi, đường dẫn ánh sáng 10cm, cho mật độ N. oculata 311x106 tb/mL. 3. Vị trí đưa CO 2 vào hệ thống và vận tốc dòng chảy có ảnh hưởng đến tốc độ tăng trưởng và mật độ cực đại của loài nuôi thử nghiệm N. oculata. Ở vị trí CO 2 không phù hợp, quần thể N. oculata phát triển nhưng không đạt được cực đại. Ở vận tốc dòng chảy 0,2-0,3 m/giây, quần thể N. oculata không phát triển và suy tàn. Quần thể N. oculata đạt cực đại ở mức cao hơn khi vận tốc dòng chảy cao và nằm giữa hai giá trị 0,4-0,5 và 0,6-0,7 m/giây, tuy nhiên sự khác biệt là không có ý nghĩa thống kê. 4. Hệ thống ống đã thiết kế có chiều dài 34m, thể tích nuôi 85 lít, đường dẫn ánh sáng 6cm, cho mật độ N. oculata 520x106 tb/mL. 5. Cả hai hệ thống tấm và ống đã thiết kế và lắp đặt rất có tiềm năng để thay thế hoàn toàn phương pháp nuôi vi tảo biển theo kiểu truyền thống, chẳng những phục vụ cho ngành nuôi trồng thủy sản, mà còn có thể phục vụ cho các ngành công nghiệp khác như nuôi tảo Spirulina làm nguồn cung cấp chất dinh dưỡng cho người, nuôi các loài vi tảo để ly trích astaxanthin, DHA, EPA. LỜI CẢM ƠN Tác giả chân thành cảm ơn Chương trình Công nghệ sinh học Nông nghiệp, Thủy sản của Bộ NN & PTNT đã cấp kinh phí, các bạn cộng tác viên của đề tài và Ban lãnh đạo Viện Nghiên cứu Nuôi Trồng Thủy sản 2 đã tạo mọi điều kiện thuận lợi cho nghiên cứu thành công. 82 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 1 - THAÙNG 7/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 TÀI LIỆU THAM KHẢO Abu-Rezq, T.S., Al-Musallam, L., Al-Shimmari, J., Dias, P., 1999. Optimum production conditions for different high-quality marine algae. Hydrobiologia 403, 97-107. Aiba, S., 1982. Growth kinetics of photosynthetic microorganisms. Adv. Biochem. Eng, 23, 85- 156. Alias, C.B., Lopez, M.C.G.M., Acien Fernandez, F.G.A., Sevilla, J.M.G. , Sanchez, J.L.G., Grima, E.M., 2004. Influence of power supply in the feasibility of Phaeodactylum tricornutum cultures. Biotechnol. Bioeng, 87(6), 723-733. Borowitzka, M.A., 1997. Microalgae for aquaculture: opportunities and constraints. J. Appl. Phycol, 9, 393-401. Brown, M., Robert, R., 2002. Preparation and assessment of microalgal concentrates as feeds for larval and juvenile Pacific oyster (Crassostrea gigas). Aquaculture 207, 289-309. Bùi Bá Trung, Hoàng Thị Bích Mai, Nguyễn Hữu Dũng, Cái Ngọc Bảo Anh, 2009. Ảnh hưởng của mật độ ban đầu và tỷ lệ thu hoạch lên sinh trưởng vi tảo Nannochloropsis oculata nuôi trong hệ thống ống dẫn trong suốt nước chảy liên tục. Tạp chí Khoa học-Công nghệ Thủy sản, số 1/2009. Carlozzi, P., Torzillo, G., 1996. Productivity of Spirulina in a strongly curved outdoor tubular photobioreactor. Appl. Microbiol. Biotech. 45, 18-23. Chini Zittelli, G., Lavista, F., Bastianini, A., Rodolfi, L., Vincenzini, M., Tredici M.R., 1999. Production of eicosapentaenoic acid by Nannochloropsis sp. cultures in outdoor tubular photobioreactors. J. Biotech. 70, 299-312. Chini Zittelli, G., Pastorelli, R., Tredici M.R., 2000. A modular flat panel photobioreactor (MFPP) for indoor mass cultivation of Nannochloropsis sp. under artificial illumination. J. Appl. Phycol. 12, 521-526. Chini Zittelli, G., Rodolfi, L., Tredici, M.R., 2003. Mass cultivation of Nannochloropsis sp. in annular reactors. J. Appl. Phycol. 15, 107-114. Contreras, A., Garcıa, F., Molina, E., Merchuk, J.C., 1998. Interaction between CO2-mass transfer, light availability, and hydrodynamic stress in the growth of Phaeodactylum tricornutum in a concentric tube airlift photobioreactor”. Biotechnol. Bioeng. 60, 17-325. Đặng Tố Vân Cầm, Nguyễn Thị Kim Vân, Trần Kim Đồng, Nguyễn Hữu Thanh, Nguyễn Xuân Toản, Lâm Văn Đức, 2009. Công nghệ sinh sản nhân tạo cá măng (Chanos chanos, Forskal 1775). Tuyển tập nghề cá sông Cửu Long, 133-143. Doucha, J., Straka, F., Livansky, K., 2005. Utilization of flue gas for cultivation of microalgae (Chlorella sp.) in an outdoor open thin-layer photobioreactor. J. Appl. Phycol. 17(5), 403-412. Garcıa, C.F., Gallardo, R.J.J., Sanchez, M.A., Ceron, G.M.C., Belarbi, E.H., Molina Grima, E., 2007. Determination of shear stress thresholds in toxic dinoflagellates cultured in shaken flasks. Process Biochem. 42, 1506-1515. Gitelson, A.A., Grits, Y.A., Etzion, D., Ning, Z., Richmond, A., 2000. Optical properties of Nannochloropsis sp and their application to remote estimation of cell mass. Biotechnol. Bioeng. 69(5), 516-525. Guillard, R.R.L., Ryther, J.H., 1962. Studies on marine planktonic diatoms. Gran. Can. J. Microbiol. 8, 229-239. Korstad, J., Neyts, A., Danielsen, T., Overrein, I., Olsen, Y., 1995. Use of swimming speed and egg ratio as predictors of the status of rotifer cultures in aquaculture. Hydrobiologia 313/314, 395-398. Le Xan, Do Xuan Hai, 2004. Effect of temperature, salinity and stocking density on development of mass culture of Isochrysis galbana and Nannochloropsis oculata for breeding. Increasing aquaculture productivity. Lee, Y.K., Low, C.S. ,1991. Effect of photobioreactor inclination on the biomass productivity of an outdoor algal culture. Biotechnol. Bioeng. 38, 995-1000. Lubian, L.M., Montero, O., Moreno-Garrido, I., Emma Huertas, I., Sobrino, C., 2000. Nannochloropsis (Eustigmatophyceae) as source of commercially valuable pigments. J. Appl. Phycol. 12, 249-255. Michels, M.H.A., Goot, A.G., Norsker, N.H., Wijffels, R.H., 2010. Effects of shear stress on the microalgae Chaetoceros muelleri. Bioprocess. Biosyst. Eng. 33, 921-927. Molina Grima, E., Sanchez Perez, J.A., Garcia Camacho, F., Fernandez Sevilla, J.M., Acien Fernandez, F.G., 1996. Productivity analysis of outdoor chemostat cultures in tubular airlift photobioreactors. J. Appl. Phycol. 8, 369-380. Molina Grima, E., Fernandez, J., Acien, F.G., Chisti, 83TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 1 - THAÙNG 7/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Y., 2001. Tubular photobioreactor design for algal cultures. J. Biotech. 92, 113-131. Muller-Feuga, A., 2004. Microalgae for aquaculture. The current global situation and future trends, 352-364. Nguyễn Thị Xuân Thu, Nguyễn Thị Bích Ngọc và Nguyễn Thị Hương, 2004. Tình hình sử dụng tảo đơn bào làm thức ăn cho động vật thủy sản. Norsker, N.H., Barbosa, M.J., Vermuë, M.H., Wijffels, R.H., 2011. Microalgal production - A close look at the economics. Biotech. Adv. 29, 24-27. Posten, C., 2009. Design principles of photo-bioreactors for cultivation of microalgae. Eng. Life Sci. 9 (3), 165-177. Pulz, O., 2001. Photobioreactors: production systems for phototrophic microorganisms. Appl. Microbiol. Biotech, 57, 287-293. Richmond, A., 2000. Microalgal biotechnology at the turn of the millennium: a personal view. J. Appl. Phycol. 12, 441-451. Richmond, A., Zhang, C.W., 2001. Optimization of a flat plate glass reactor for mass production of Nannochloropsis sp. outdoors. J. Biotech, 85, 259-269. Spalding, M.H. , 2008. Microalgal carbon-dioxide- concentrating mechanisms: Chlamydomonas inorganic carbon transporters. J. Exp. Bot, 59, 1463-1473. Tredici, M.R., Zitelli, G.C., Biagiolini, S. , 1992. Influence of turbulence and areal density on the productivity of Spirulina platensis grown outdoor in a vertical alveolar panel. In: First European Workshop on Microalgal Biotechnology, 58-60. Wang, C.H., Sun, Y.Y., Xing, R.L., Sun, L.Q. , 2005. Effect of liquid circulation velocity and cell density on the growth of Parietochloris incisa in flat plate photobioreactors. Biotechnol. Bioproc. Eng. 10(2), 103-108. Zhang, C.W., Zmora, O., Kopel, R., Richmond, A. , 2001. An industrial-size flat plate glass reactor for mass production of Nannochloropis sp. (Eustigmatophyceae). Aquaculture 195, 35-49. Zou N., Zhang C.W., Cohen Z. and Richmond A. , 2000. Production of cell mass and eicosapentaenoic acid (EPA) in ultrahigh cell density cultures of Nannochloropsis sp. (Eustigmatophyceae). Eur. J. Phycol, 35, 127-133. DESIGNING AND OPERATING PHOTOBIOREACTOR FOR INTENSIVE CULTURE OF MARINE MICROALGAE Dang To Van Cam1, Trinh Trung Phi1, Dieu Pham Hoang Vy1, Le Thanh Huan1, DangThi Nguyen Nhan1, Tran Thi Tuyet Lan2 ABSTRACT Two different types of photobioreactor were designed at the National Breeding Center for Southern Marine Aquaculture, Research Institure for Aquaculture No.2. Flat plate glass reactor has a volume of 72L with a light-path of 10cm, this type of photobioreactor were produced in twelve units. Tubu- lar photobioreactor made of acrylic pipe 60cm in diameter has a volume of 85L and was produced in six units. Both of the designed systems were experimentally operated on a marine microalgae species, Nannochloropsis oculata, in order to optimize the designs. The flat plate glass reactor was optimized at air flow rate of 0.9-1.0 L/L/min, obtaining the density of N. oculata at 311x106 cells/ mL. The tubular photobioreactor was optimized at position of CO 2 injection between the pump and lowest pipe and liquid velocity at 0.6-0.7m/s, obtaining the density of N. oculata at 520x106 84 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 1 - THAÙNG 7/2013 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 1 National Breeding Center for Southern Marine Aquaculture, Research Institute for Aquaculture No.2 Email: camdtv.ria2@mard.gov.vn 2 Directorate of Fisheries cells/mL. The results show that it is potential to use the designed systems for intensive culture of N.oculata in particular and marine microalgae in general for a high quality marine seed production. Key words: Flat plate glass reactor; Nannochloropsis oculata; photobioreactor; tubular photobioreactor Người phản biện: TS. Nguyễn Thị Ngọc Tĩnh Ngày nhận bài: 10/6/2013 Ngày thông qua phản biện: 24/6/2013 Ngày duyệt đăng: 8/7/2013
File đính kèm:
 thiet_ke_va_van_hanh_he_thong_kin_quang_phan_ung_sinh_hoc_de.pdf
thiet_ke_va_van_hanh_he_thong_kin_quang_phan_ung_sinh_hoc_de.pdf

