Phân lập, xác định tính kháng nguyên và độc lực của các chủng Streptococcus agalactiae gây bệnh ở cá rô phi tại 7 tỉnh, thành trong cả nước
TÓM TẮT Kết quả phân lập và xác định tính kháng nguyên, độc lực của các chủng vi khuẩn Streptococcus spp. gây bệnh ở cá rô phi tại 7 tỉnh/thành: Hà Nội, Hải Dương, Quảng Ninh, Đồng Tháp, Tiền Giang,Vĩnh Long, An Giang cho thấy tỷ lệ mẫu bệnh phân lập được vi khuẩn Streptococcus spp. là 96%. Trong số 296 chủng vi khuẩn S. agalactiae phân lập được, các chủng: NS5; NS13; LX7; LX8; LX9; LX10; ĐN8; ĐN9; ĐN10; ĐN12; ĐN17; O2; TP3; TP4 có tính kháng nguyên. Độc lực của các chủng vi khuẩn S.agalactiae (TP4; O2; ĐN12; LX8 và NS5) là rất mạnh

Trang 1

Trang 2

Trang 3
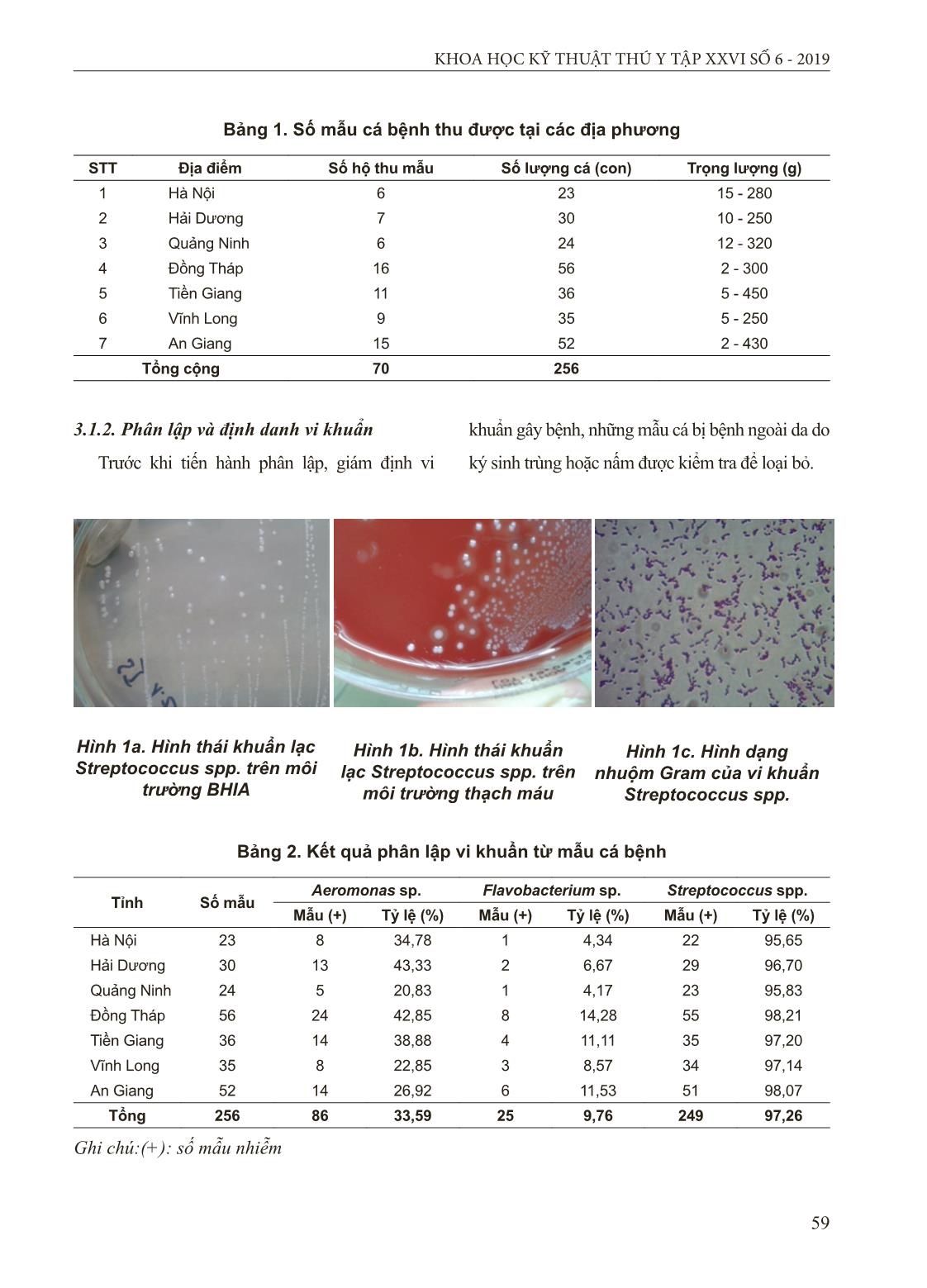
Trang 4

Trang 5
Trang 6
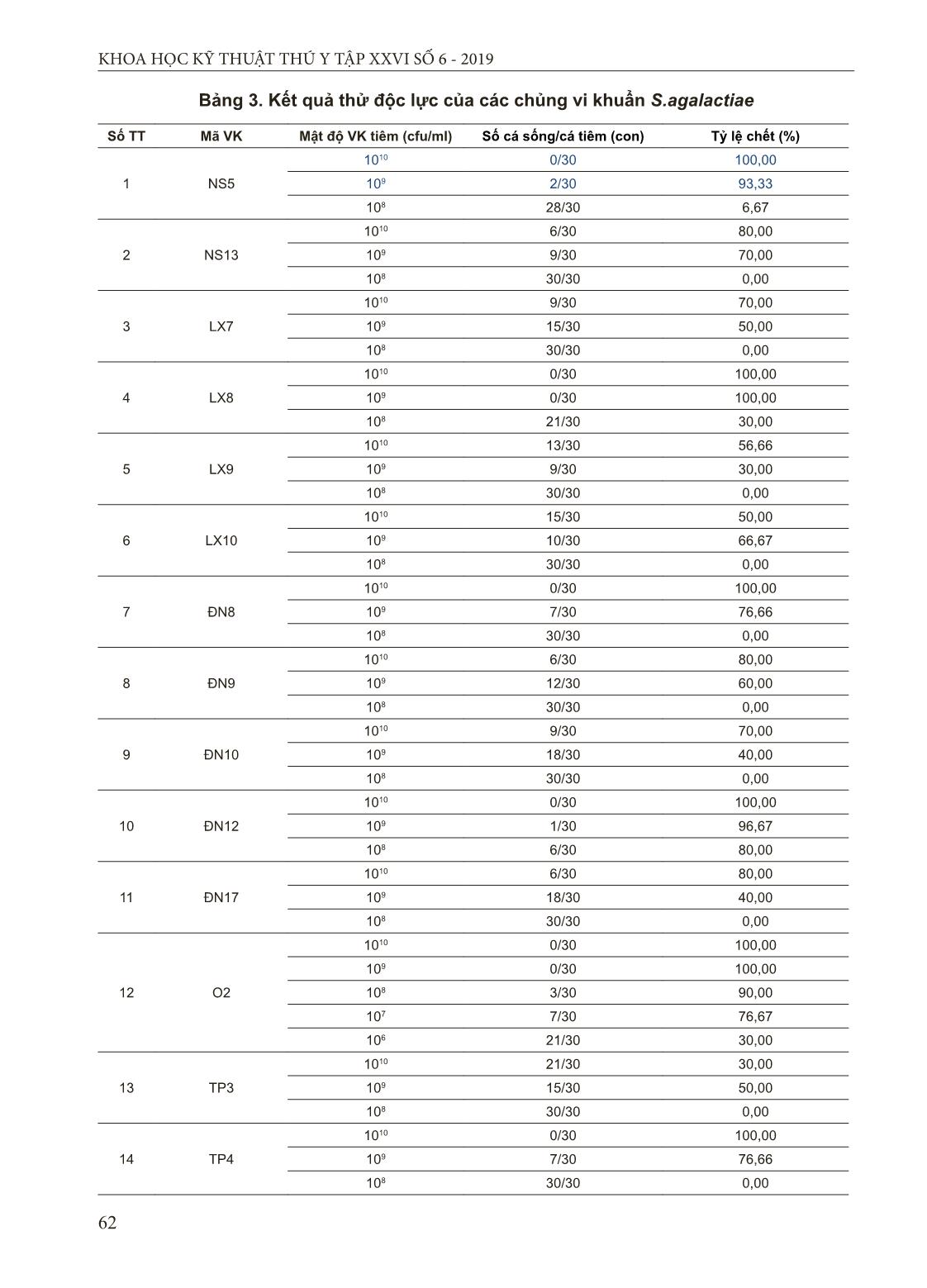
Trang 7

Trang 8
Bạn đang xem tài liệu "Phân lập, xác định tính kháng nguyên và độc lực của các chủng Streptococcus agalactiae gây bệnh ở cá rô phi tại 7 tỉnh, thành trong cả nước", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Phân lập, xác định tính kháng nguyên và độc lực của các chủng Streptococcus agalactiae gây bệnh ở cá rô phi tại 7 tỉnh, thành trong cả nước

bạc màu. - Cá rô phi dùng thí nghiệm: Cá rô phi (vằn) giống khỏe mạnh, sạch bệnh, có trọng lượng trung bình 10g/con, cá rô phi (diêu hồng) giống khỏe mạnh, sạch bệnh, có trọng lượng trung bình 2,5g/con. Trước khi làm thí nghiệm, cá được nuôi và cho thích nghi với môi trường 3 ngày. - Các loại môi trường nuôi cấy: BHI broth (Brain heart infusion broth - Merck), BHI agar (Brain heart infusion agar - Merck), BHI có bổ sung 5% máu cừu, nước muối sinh lý 0,85%, kit API20 Strep (BioMerieux, Pháp). - Thuốc gây mê, bơm tiêm, đĩa lồng nuôi cấy và các trang thiết bị phòng thí nghiệm khác. 2.2. Địa điểm nghiên cứu - PhòngThủy sản - Trung tâm Nghiên cứu và Sản xuất sinh phẩm - Công ty cổ phần Dược và Vật tư thú y (Hanvet). - Trung tâm Thú y vùng 6, và một số phòng thí nghiệm khác. - Trung tâm giống nông nghiệp Hậu Giang - Các vùng nuôi cá rô phi tại các tỉnh/thành: Hà Nội, Hải Dương, Quảng Ninh, Đồng Tháp, Tiền Giang, Vĩnh Long, An Giang. 2.3. Nội dung nghiên cứu - Thu mẫu cá bệnh từ các địa phương và phân lập, định danh vi khuẩn Streptococcus spp. - Lựa chọn chủng vi khuẩn Streptococcus spp. có tính kháng nguyên. - Lựa chọn chủng vi khuẩn Streptococcus spp. có độc lực cao. 2.4. Phương pháp nghiên cứu 2.4.1. Thu mẫu, phân lập và định danh vi khuẩn Thu mẫu cá bệnh Thu mẫu cá rô phi vằn và rô phi đỏ bị bệnh tại các tỉnh/thành: Hà Nội, Hải Dương, Hải Phòng, Quảng Ninh, Đồng Nai, Tiền Giang, Vĩnh Long, An Giang, Đồng Tháp. Mẫu cá bệnh đang còn sống hoặc mới chết. Cơ quan sử dụng để nuôi cấy phân lập vi khuẩn gồm: Gan, thận, lách, não và mắt vì đây là những cơ quan đích của vi khuẩn Streptococcus spp. Phân lập và định danh vi khuẩn Streptococcus spp. Nuôi cấy và phân lập vi khuẩn Streptococcus spp. ở cá rô phi bằng phương pháp nghiên cứu vi khuẩn của Frerich G.N. (1984, 1993). Vi khuẩn được phân lập từ các cơ quan đích trên môi trường BHIA, chuyển về phòng thí nghiệm để phân lập và sàng lọc khuẩn tạp, từ đó chọn ra được các chủng vi khuẩn mang đặc điểm đặc trưng của vi khuẩn Streptococcus spp. 58 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 6 - 2019 Dựa vào hình thái khuẩn lạc có đặc điểm tròn, đường kính nhỏ 1-2mm, hơi lồi và có màu trắng hơi đục. Khuẩn lạc được chọn, tiến hành soi tươi, nhuộm Gram và quan sát trên kính hiển vi ở vật kính 100X, kiểm tra đặc điểm dung huyết trên môi trường thạch máu cừu 5%. Thử các đặc tính sinh hóa bằng kít API20 Strep (BioMerieux, Pháp). 2.4.2. Lựa chọn chủng vi khuẩn Streptococcus spp. có tính kháng nguyên Chế tạo kháng nguyên cho từng chủng vi khuẩn: Sau 24 giờ vi khuẩn tăng sinh mạnh, sau đó bất hoạt vi khuẩn bằng formalin 38%, sử dụng với tỷ lệ 0,5%. Bảo quản trong điều kiện 40C khoảng 24 - 48 giờ. Sau khi bất hoạt bằng formalin, vi khuẩn được thu nhận bằng cách ly tâm môi trường đã nuôi tăng sinh vi khuẩn. Sau đó phần cô đặc nằm dưới đáy ống ly tâm, có màu trắng được thu lại. Thực hiện ly tâm 5000 vòng/phút trong vòng 15 phút. Phần cô đặc được rửa bằng nước muối sinh lý 3 lần. Sau mỗi lần rửa, ly tâm lại để rửa sạch hết formalin. Phần cô đặc nằm dưới ống ly tâm được pha với nước muối sinh lý. Bảo quản ở nhiệt độ 4 -100C. Kháng nguyên của từng chủng vi khuẩn sau khi chế tạo, được tiêm miễn dịch cho cá rô phi với 106 - 109 CFU/ml /con cá vào xoang bụng, mỗi chủng tiêm cho 10 con cá (lặp lại 3 lần). Sau 21 ngày tiến hành lấy máu và xác định hiệu giá kháng thể của huyết thanh. Mẫu máu sau khi lấy để ở nhiệt độ phòng 3 giờ rồi ly tâm 2500 vòng/5 phút để thu huyết thanh. Tiến hành phản ứng ngưng kết trên phiến kính. Nếu phản ứng có nhiều ngưng kết màu trắng đục, nhỏ li ti chứng tỏ là có kháng thể kháng vi khuẩn Streptococcus spp. 2.4.3. Lựa chọn chủng độc lực Dùng các chủng có kháng nguyên đã lựa chọn để gây nhiễm cho cá với LC70 (Lethal Concentration 70). Dựa vào LC70 gây chết cá để đánh giá độc lực của mỗi chủng vi khuẩn. - Nuôi cấy tăng sinh các dòng vi khuẩn đã lựa chọn trên môi trường BHI ở 30oC trong vòng 18 giờ (Hernandez và cs., 2009). - Định lượng vi khuẩn bằng phương pháp đếm khuẩn lạc. Gây nhiễm ở các nồng độ vi khuẩn khác nhau, đối chứng bằng nước muối sinh lý. Mỗi nồng độ vi khuẩn được tiêm cho 30 con cá có trọng lượng 20g ± 5 với liều 0,2 ml/con cá (thí nghiệm được lặp lại 3 lần). - Cảm nhiễm bệnh nhân tạo bằng phương pháp tiêm xoang bụng sau khi cá đã được gây mê. - Theo dõi thí nghiệm, ghi chép số lượng cá chết và kết thúc thí nghiệm sau khi cá ngừng chết 3 ngày liên tục. - Phân lập vi khuẩn từ mẫu cá bệnh sau khi cảm nhiễm bệnh trên môi trường BHIA, kiểm tra hình thái vi khuẩn, thử phản ứng sinh hóa và kit API20 Strep để khẳng định cá bị bệnh do vi khuẩn cảm nhiễm gây ra. III. KẾT QUẢ VÀ THẢO LUẬN 3.1. Kết quả thu mẫu, phân lập và định danh vi khuẩn 3.1.1. Kết quả thu mẫu cá bệnh Chúng tôi tiến hành phân lập vi khuẩn Streptococcus agalactiae từ 256 mẫu cá bệnh có trọng lượng từ 2g đến 450g tại các tỉnh/thành Hà Nội, Hải Dương, Quảng Ninh, Đồng Tháp, Tiền Giang, Vĩnh Long, An Giang. Hầu hết các mẫu cá bệnh thu được đều có triệu chứng và bệnh tích điển hình: bơi lờ đờ, mất phương hướng; mắt lồi và đục; xuất huyết ở nắp mang, thân, gốc vây ngực và vây bụng; mang tái nhạt, bụng trướng to, xoang bụng có chứa dịch màu vàng, nội tạng bị xuất huyết, mềm nhũn. Kết quả được trình bày ở bảng 1. 59 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 6 - 2019 Bảng 1. Số mẫu cá bệnh thu được tại các địa phương STT Địa điểm Số hộ thu mẫu Số lượng cá (con) Trọng lượng (g) 1 Hà Nội 6 23 15 - 280 2 Hải Dương 7 30 10 - 250 3 Quảng Ninh 6 24 12 - 320 4 Đồng Tháp 16 56 2 - 300 5 Tiền Giang 11 36 5 - 450 6 Vĩnh Long 9 35 5 - 250 7 An Giang 15 52 2 - 430 Tổng cộng 70 256 3.1.2. Phân lập và định danh vi khuẩn Trước khi tiến hành phân lập, giám định vi khuẩn gây bệnh, những mẫu cá bị bệnh ngoài da do ký sinh trùng hoặc nấm được kiểm tra để loại bỏ. Hình 1a. Hình thái khuẩn lạc Streptococcus spp. trên môi trường BHIA Hình 1b. Hình thái khuẩn lạc Streptococcus spp. trên môi trường thạch máu Hình 1c. Hình dạng nhuộm Gram của vi khuẩn Streptococcus spp. Bảng 2. Kết quả phân lập vi khuẩn từ mẫu cá bệnh Tỉnh Số mẫu Aeromonas sp. Flavobacterium sp. Streptococcus spp. Mẫu (+) Tỷ lệ (%) Mẫu (+) Tỷ lệ (%) Mẫu (+) Tỷ lệ (%) Hà Nội 23 8 34,78 1 4,34 22 95,65 Hải Dương 30 13 43,33 2 6,67 29 96,70 Quảng Ninh 24 5 20,83 1 4,17 23 95,83 Đồng Tháp 56 24 42,85 8 14,28 55 98,21 Tiền Giang 36 14 38,88 4 11,11 35 97,20 Vĩnh Long 35 8 22,85 3 8,57 34 97,14 An Giang 52 14 26,92 6 11,53 51 98,07 Tổng 256 86 33,59 25 9,76 249 97,26 Ghi chú:(+): số mẫu nhiễm 60 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 6 - 2019 Bảng 2 cho thấy, trên tổng số 256 mẫu cá rô phi bị bệnh, xuất hiện 3 loại vi khuẩn là: Aeromonas sp., Flavobacterium sp. và Streptococcus spp. Trong đó, số mẫu có vi khuẩn Streptococcus spp. cao nhất 249/256 mẫu, chiếm tỷ lệ 97,26%; số mẫu có vi khuẩn Aeromonas sp. là 86/256, chiếm tỷ lệ 33,59%; số mẫu xuất hiện Flavobacterium sp. là 9,76%. Kết quả nghiên cứu của chúng tôi tương đồng với các công bố trước đây của Phạm Hồng Quân và cs, (2013), có 74/86 mẫu dương tính với vi khuẩn Streptococcus spp. chiếm tỷ lệ 86,05% (Nguyễn Viết Khuê và cs, 2009); tỷ lệ dương tính với vi khuẩn này là 90% (Liu và cs, 2012). Sau khi định danh bằng kit API20 Strep, chúng tôi xác định được cả 249 mẫu vi khuẩn Streptococcus spp. phân lập được ở trên đều là S. agalactiae. Các mẫu vi khuẩn này được giữ trong tủ nhiệt độ -800C để các đặc tính của vi khuẩn ít bị biến đổi. 3.2. Kết quả lựa chọn chủng kháng nguyên Với mục đích lựa chọn được chủng vi khuẩn đưa vào nghiên cứu sản xuất vacxin ở quy mô công nghiệp, ứng dụng thực tiễn nên cần thiết phải lựa chọn những chủng vi khuẩn có tính kháng nguyên ổn định, có khả năng kích thích cơ thể cá sinh đáp ứng miễn dịch cao, có khả năng bảo hộ rộng. Đánh giá tính kháng nguyên của các chủng vi khuẩn dựa trên phản ứng ngưng kết với nguyên tắc của sự liên kết giữa kháng nguyên và kháng thể có thể nhìn thấy được ở dạng kết khối. Kết quả thể hiện ở bảng 2. + Các chủng vi khuẩn có phản ứng dương tính: kháng nguyên bị ngưng kết thành từng đám lấm tấm trên phiến kính. Hình 3. Cụm ngưng kết quan sát dưới kính hiển vi Hình 2. Kết quả phản ứng ngưng kết nhanh trên phiến kính A: Âm tính; B: Dương tính với vi khuẩn sống; C: Dương tính với vi khuẩn bất hoạt A B C 61 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 6 - 2019 + Các chủng vi khuẩn có phản ứng âm tính: không có hiện tượng ngưng kết thì loại bỏ. Kết quả kiểm tra phản ứng ngưng kết, chúng tôi thu được 14/246 mẫu vi khuẩn có tính kháng nguyên là các chủng S. agalactiae có các ký hiệu NS5, NS13, LX7, LX8, LX9, LX10, ĐN8, ĐN9, ĐN10, ĐN12, ĐN17, O2, TP3, TP4. 3.3. Kết quả lựa chọn chủng độc lực Từ 14 chủng vi khuẩn có tính kháng nguyên, chúng tôi tiến hành kiểm tra độc lực trên cá rô phi có trọng lượng 20g ± 5 ở nồng độ từ 106 đến 1010 CFU/ml. Mỗi nồng độ tiêm cho 30 cá với liều 0,2 ml/con (thí nghiệm được lặp lại 3 lần). Sau 24 giờ gây nhiễm, hầu hết các lô cá thử độc lực với liều 0,2 x 108 - 1010 cfu/ml/con có biểu hiện bệnh với dấu hiệu và bệnh lý điển hình là xuất huyết, lồi mắt, cá chết sau 36 giờ gây nhiễm; riêng chủng O2, cá thử độc lực ở liều 106 đã có các biểu hiện trên và chết sau 36 giờ gây nhiễm. Hình 4. Dấu hiệu bệnh lý của cá sau khi công bằng vi khuẩn S. agalactiae độc lực Kết quả ở bảng 3 cho thấy, ngoài chủng O2 có cá chết 30% ở nồng độ vi khuẩn 106CFU/ ml, còn các chủng khác không có biểu hiện bệnh hoặc chết khi công cường độc ở nồng độ vi khuẩn 106 - 107 CFU/ml. Ở nồng độ vi khuẩn 108 CFU/ml, có một số vi khuẩn gây chết cá nhưng tỷ lệ không cao. Ở nồng độ vi khuẩn 109 CFU/ml, có 5 chủng gây chết với tỷ lệ >70% cá thí nghiệm là các chủng TP4, O2, ĐN12, LX8 và NS5, các lô đối chứng không có cá chết. So sánh với báo cáo của Bromage (1999) thì độc lực của các chủng thí nghiệm thấp hơn độc lực của chủng vi khuẩn S. iniae phân lập từ cá chẽm và cá rô phi đỏ nuôi ở Úc (LC 50 = 3,2 x 104CFU) (vaccine Adjuvants , 2010) và ở Thái Lan (LC 50 = 1,08 x 104CFU) (Suanyuk, 2010). Những cá có dấu hiệu bệnh hoặc chết sau khi cảm nhiễm tại các lô thí nghiệm đều được giải phẫu để kiểm tra, quan sát sự biến đổi bệnh lý của các cơ quan nội tạng. Sau đó tiến hành tái phân lập vi khuẩn từ gan, thận, mắt và não cá trên môi trường BHIA ở nhiệt độ 30oC, trong 24 giờ, thấy khuẩn lạc ở các đĩa môi trường BHIA có màu sắc và hình thái giống với khuẩn lạc của vi khuẩn Streptococcus spp. phân lập từ mẫu cá rô phi lúc thu mẫu. 62 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 6 - 2019 Bảng 3. Kết quả thử độc lực của các chủng vi khuẩn S.agalactiae Số TT Mã VK Mật độ VK tiêm (cfu/ml) Số cá sống/cá tiêm (con) Tỷ lệ chết (%) 1 NS5 1010 0/30 100,00 109 2/30 93,33 108 28/30 6,67 2 NS13 1010 6/30 80,00 109 9/30 70,00 108 30/30 0,00 3 LX7 1010 9/30 70,00 109 15/30 50,00 108 30/30 0,00 4 LX8 1010 0/30 100,00 109 0/30 100,00 108 21/30 30,00 5 LX9 1010 13/30 56,66 109 9/30 30,00 108 30/30 0,00 6 LX10 1010 15/30 50,00 109 10/30 66,67 108 30/30 0,00 7 ĐN8 1010 0/30 100,00 109 7/30 76,66 108 30/30 0,00 8 ĐN9 1010 6/30 80,00 109 12/30 60,00 108 30/30 0,00 9 ĐN10 1010 9/30 70,00 109 18/30 40,00 108 30/30 0,00 10 ĐN12 1010 0/30 100,00 109 1/30 96,67 108 6/30 80,00 11 ĐN17 1010 6/30 80,00 109 18/30 40,00 108 30/30 0,00 12 O2 1010 0/30 100,00 109 0/30 100,00 108 3/30 90,00 107 7/30 76,67 106 21/30 30,00 13 TP3 1010 21/30 30,00 109 15/30 50,00 108 30/30 0,00 14 TP4 1010 0/30 100,00 109 7/30 76,66 108 30/30 0,00 63 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 6 - 2019 IV. KẾT LUẬN - Từ 256 mẫu cá bệnh trên 7 tỉnh/thành Hà Nội, Hải Dương, Quảng Ninh, Đồng Tháp, Tiền Giang, Vĩnh Long, An Giang, đã phân lập được 249 chủng vi khuẩn S. agalactiae (chiếm 96 %). - 14 chủng S. agalactiae có tính kháng nguyên là NS5, NS13, LX7, LX8, LX9, LX10, ĐN8, ĐN9, ĐN10, ĐN12, ĐN17, O2, TP3, TP4. - Từ 14 chủng có tính kháng nguyên, chọn được 5 chủng có độc lực mạnh TP4, O2, ĐN12, LX8 và NS5. TÀI LIỆU THAM KHẢO 1. Bromage E. S., Thomas A. and Owens L. (1999) Streptococcus iniae, a bacterial infection in barramundi Lates calcarifer. Diseases of Aquatic Organisms, 36: 177-181 2. Frerichs, G.N & Millar (1993). Manual for the isolation and identification of fish bacterial pathogens. Pisces Press. Stirling, pp. 58 3. Hernandez, E., J. Figueroa and C. Iregui, (2009). Streptococcosis on a red tilapia, Oreochromis sp., farm: A case study. J. Fish Dis., 32: 247-252. 4. Khan, M., Khan, S., Miyan, K. (2011) Aquaculture as a food production system: A review. Biol Med. 3, 291-302. 5. Liu Liping, Zhang Zongfeng, Zhang Wembo, Francis Murray, David Little, 2012. Tilapia aquaculture in China: Low market prices, other issues challenge as sector seeks sustainability. Global Aquaculture Advocate, Vo 15. Issue 2, March/ April 2012, pp.20-21 6. Nguyễn Viết Khuê, Trương Thị Mỹ Hạnh, Đồng Thanh Hà, Nguyễn Thị Hà, Phạm Thành Đô, Bùi Ngọc Thanh, Nguyễn Thị Nguyện, Nguyễn Hải Xuân, Phạm Thái Giang và Nguyễn Thị Thu Hà (2009). “Xác định nguyên nhân gây chết hàng loạt cá rô phi nuôi thương phẩm tại một số tỉnh miền Bắc”, Báo cáo khoa học Viện Nghiên cứu Nuôi trồng Thủy sản 1. 7. Phạm Hồng Quân, Hồ Thu Thủy, Nguyễn Hữu Vũ, Huỳnh Thị Mỹ Lệ, Lê Văn Khoa, 2013. Một số đặc tính sinh học của vi khuẩn Streptococcus spp. gây bệnh xuất huyết ở cá rô phi nuôi tại một số tỉnh miền Bắc. Tạp chí khoa học phát triển tập 11số 4-2013, trang 506-513. 8. Sarter, S., Kha, N. H. N., Hung, L.T., Jérôme Lazard, J. & Montet, D. 2007 Antibiotic resistance in Gram-negative bacteria isolated from farmed catfish. Food Control 18: 1391- 1396 9. Toranzo, A.E., Magarin B., Romalde J.L (2005). A review of the main bacterial fish diseases mariculture systems. Aquaculture 246: 37-61. 10. Vacxin Adjuvants: Methods and Protocols Edited by Gwyn Davies., 2010. Humana Press © Springer Science Business Media, LLC 2010. ISSN 1064-3745. pp 314 11. VASEP (2018). Tổng quan ngành thủy sản Việt Nam. Onecontent/tong-quan-nganh.htm. Ngày nhận 13-5-2019 Ngày phản biện 17-7-2019 Ngày đăng 1-9-2019
File đính kèm:
 phan_lap_xac_dinh_tinh_khang_nguyen_va_doc_luc_cua_cac_chung.pdf
phan_lap_xac_dinh_tinh_khang_nguyen_va_doc_luc_cua_cac_chung.pdf

