Độ an toàn của cao chiết khổ sâm (Croton tonkinensis) đối với tôm thẻ (Penaeus vannamei) ở điều kiện in vitro
TÓM TẮT
Các loại thảo mộc và cây thuốc hứa hẹn sẽ trở thành nguồn cung cấp các liệu pháp chữa bệnh cho
nuôi tôm cá vì các sản phẩm này cung cấp với giá rẻ hơn để điều trị và không gây độc. Dịch chiết
từ cây khổ sâm (Croton tonkinensis) được cho là có chứa các lớp chất chủ yếu là các hợp chất hữu
cơ như flavonoid, alkaloid, polyphenol. Mục tiêu của nghiên cứu này là kiểm tra tính an toàn của
cao chiết khổ sâm trong điều kiện in vitro để làm cở sở ứng dụng trong ao nuôi. Thí nghiệm kiểm
tra độc tính của cao chiết khổ sâm qua đường ăn được thực hiện với các nồng độ trộn vào thức ăn
từ 0 đến 45% (450 g/kg thức ăn). Đối với thí nghiệm ngâm cao chiết vào nước nuôi tôm được thực
hiện với các nồng độ từ 0 đến 160 ppm. Kết quả nghiên cứu cho thấy cao chiết khổ sâm gây độc yếu
đối với tôm nuôi qua đường ăn. Ở nồng độ cao chiết 45%, tỷ lệ trung bình tôm bị chết sau 48 giờ là
15% và tỷ lệ trung bình tôm chết là 21,67% sau 96 giờ. Đối với thí nghiệm ngâm cao chiết khổ sâm
vào nước nuôi tôm cho thấy ở nồng độ 20 ppm, tôm sống 100% sau 96 giờ tiếp xúc với cao chiết
và tỷ lệ tôm chết 100% sau 96 giờ ở nồng độ 150 ppm. Giá trị LC50 của cao chiết khi cho trực tiếp
vào nước nuôi tôm được xác định ở các thời điểm 48, 72 và 96 giờ rất cao, với nồng độ lần lượt là
93,02; 81,25, và 81,25 ppm. Trong khi LC50 của các nồng cao chiết được trộn vào thức ăn không
được xác định do tỷ lệ gây chết tôm thí nghiệm < 50%.="" từ="" các="" kết="" quả="" trên,="" chúng="" tôi="" kết="" luận="">
chiết khổ sâm an toàn đối với tôm thẻ chân trắng ở điều kiện in vitro

Trang 1

Trang 2

Trang 3
Trang 4

Trang 5

Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Độ an toàn của cao chiết khổ sâm (Croton tonkinensis) đối với tôm thẻ (Penaeus vannamei) ở điều kiện in vitro

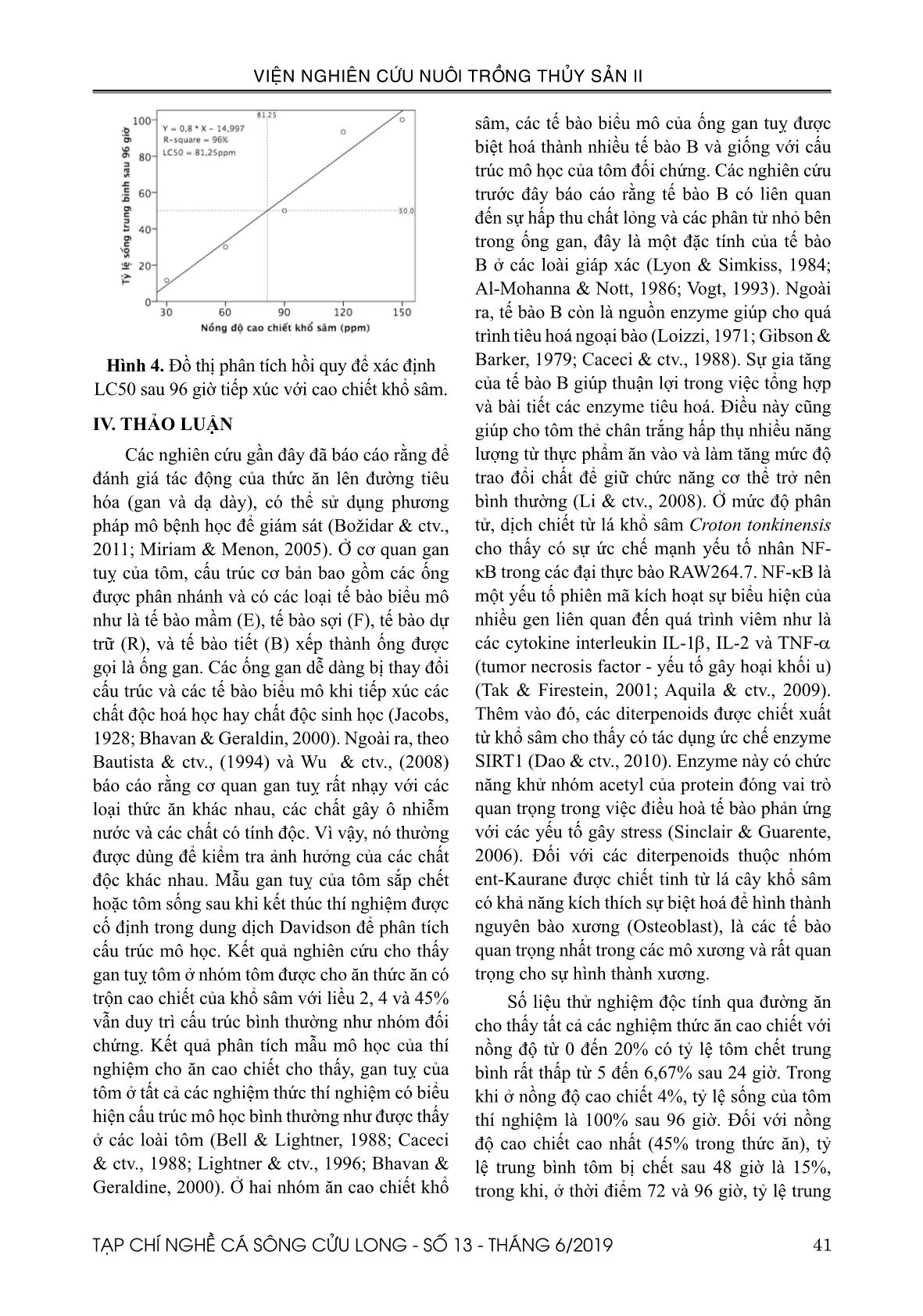
ấp. Hình 2. Đồ thị phân tích hồi quy để xác định LC50 sau 48 giờ tiếp xúc với cao chiết khổ sâm. Hình 3. Đồ thị phân tích hồi quy để xác định LC50 sau 72 giờ tiếp xúc với cao chiết khổ sâm. 41TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II Hình 4. Đồ thị phân tích hồi quy để xác định LC50 sau 96 giờ tiếp xúc với cao chiết khổ sâm. IV. THẢO LUẬN Các nghiên cứu gần đây đã báo cáo rằng để đánh giá tác động của thức ăn lên đường tiêu hóa (gan và dạ dày), có thể sử dụng phương pháp mô bệnh học để giám sát (Božidar & ctv., 2011; Miriam & Menon, 2005). Ở cơ quan gan tuỵ của tôm, cấu trúc cơ bản bao gồm các ống được phân nhánh và có các loại tế bào biểu mô như là tế bào mầm (E), tế bào sợi (F), tế bào dự trữ (R), và tế bào tiết (B) xếp thành ống được gọi là ống gan. Các ống gan dễ dàng bị thay đổi cấu trúc và các tế bào biểu mô khi tiếp xúc các chất độc hoá học hay chất độc sinh học (Jacobs, 1928; Bhavan & Geraldin, 2000). Ngoài ra, theo Bautista & ctv., (1994) và Wu & ctv., (2008) báo cáo rằng cơ quan gan tuỵ rất nhạy với các loại thức ăn khác nhau, các chất gây ô nhiễm nước và các chất có tính độc. Vì vậy, nó thường được dùng để kiểm tra ảnh hưởng của các chất độc khác nhau. Mẫu gan tuỵ của tôm sắp chết hoặc tôm sống sau khi kết thúc thí nghiệm được cố định trong dung dịch Davidson để phân tích cấu trúc mô học. Kết quả nghiên cứu cho thấy gan tuỵ tôm ở nhóm tôm được cho ăn thức ăn có trộn cao chiết của khổ sâm với liều 2, 4 và 45% vẫn duy trì cấu trúc bình thường như nhóm đối chứng. Kết quả phân tích mẫu mô học của thí nghiệm cho ăn cao chiết cho thấy, gan tuỵ của tôm ở tất cả các nghiệm thức thí nghiệm có biểu hiện cấu trúc mô học bình thường như được thấy ở các loài tôm (Bell & Lightner, 1988; Caceci & ctv., 1988; Lightner & ctv., 1996; Bhavan & Geraldine, 2000). Ở hai nhóm ăn cao chiết khổ sâm, các tế bào biểu mô của ống gan tuỵ được biệt hoá thành nhiều tế bào B và giống với cấu trúc mô học của tôm đối chứng. Các nghiên cứu trước đây báo cáo rằng tế bào B có liên quan đến sự hấp thu chất lỏng và các phân tử nhỏ bên trong ống gan, đây là một đặc tính của tế bào B ở các loài giáp xác (Lyon & Simkiss, 1984; Al-Mohanna & Nott, 1986; Vogt, 1993). Ngoài ra, tế bào B còn là nguồn enzyme giúp cho quá trình tiêu hoá ngoại bào (Loizzi, 1971; Gibson & Barker, 1979; Caceci & ctv., 1988). Sự gia tăng của tế bào B giúp thuận lợi trong việc tổng hợp và bài tiết các enzyme tiêu hoá. Điều này cũng giúp cho tôm thẻ chân trắng hấp thụ nhiều năng lượng từ thực phẩm ăn vào và làm tăng mức độ trao đổi chất để giữ chức năng cơ thể trở nên bình thường (Li & ctv., 2008). Ở mức độ phân tử, dịch chiết từ lá khổ sâm Croton tonkinensis cho thấy có sự ức chế mạnh yếu tố nhân NF- κB trong các đại thực bào RAW264.7. NF-κB là một yếu tố phiên mã kích hoạt sự biểu hiện của nhiều gen liên quan đến quá trình viêm như là các cytokine interleukin IL-1β, IL-2 và TNF-α (tumor necrosis factor - yếu tố gây hoại khối u) (Tak & Firestein, 2001; Aquila & ctv., 2009). Thêm vào đó, các diterpenoids được chiết xuất từ khổ sâm cho thấy có tác dụng ức chế enzyme SIRT1 (Dao & ctv., 2010). Enzyme này có chức năng khử nhóm acetyl của protein đóng vai trò quan trọng trong việc điều hoà tế bào phản ứng với các yếu tố gây stress (Sinclair & Guarente, 2006). Đối với các diterpenoids thuộc nhóm ent-Kaurane được chiết tinh từ lá cây khổ sâm có khả năng kích thích sự biệt hoá để hình thành nguyên bào xương (Osteoblast), là các tế bào quan trọng nhất trong các mô xương và rất quan trọng cho sự hình thành xương. Số liệu thử nghiệm độc tính qua đường ăn cho thấy tất cả các nghiệm thức ăn cao chiết với nồng độ từ 0 đến 20% có tỷ lệ tôm chết trung bình rất thấp từ 5 đến 6,67% sau 24 giờ. Trong khi ở nồng độ cao chiết 4%, tỷ lệ sống của tôm thí nghiệm là 100% sau 96 giờ. Đối với nồng độ cao chiết cao nhất (45% trong thức ăn), tỷ lệ trung bình tôm bị chết sau 48 giờ là 15%, trong khi, ở thời điểm 72 và 96 giờ, tỷ lệ trung 42 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II bình tôm chết là tương đương nhau (21,67%), các tỷ lệ này không khác biệt ý nghĩa thống kê (P > 0,05) giữa các nghiệm thức cho tôm ăn các nồng độ cao chiết trong suốt 96 giờ thí nghiệm. Do các kết quả tỷ lệ tôm chết < 50%, nên số liệu này không xác định được giá trị LC 50 ở các thời điểm quan sát. Điều này cho thấy cao chiết khổ sâm được trộn vào thức ăn có tính an toàn cao đối với tôm nuôi khi được phòng trị bệnh AHPND trong phòng thí nghiệm cũng như trong ao nuôi (liều hiệu quả 2%). Đối với thử nghiệm qua đường nước nuôi. Kết quả cho thấy, ở nồng độ 20 ppm, tôm sống 100% sau 96 giờ tiếp xúc với dịch chiết và tỷ lệ tôm chết 100% sau 72 và 96 giờ ở nồng độ 150 ppm. Ở các nồng cao 90, 120 và 150 ppm, tỷ lệ trung bình tôm chết sau 24 giờ lần lượt là 18,33; 18,33 và 28,33%, và các tỷ lệ tôm chết này không có khác biệt ý nghĩa thống kê (P > 0,05). Ở các thời điểm 48, 72, và 96 giờ thí nghiệm, tỷ lệ trung bình tôm chết của nghiệm thức cho tôm ăn các nồng độ cao chiết có khác biệt ý nghĩa thống kê (P < 0,05). Giá trị LC 50 được xác định ở các thời điểm 48, 72 và 96 giờ rất cao lần lượt là 93,02; 81,25; và 81,25 ppm. Điều này cho thấy cao chiết khổ sâm gây độc yếu đối với tôm thẻ chân trắng. Theo Giang & ctv., (2005) các diterpenoids tinh được tinh sạch từ lá khổ sâm Việt Nam có hoạt tính gây độc yếu hoặc không gây độc đối với Artemia. Từ các cơ sở trên, nghiên cứu này đề xuất rằng cao chiết khổ sâm an toàn và có thể ứng dụng phòng bệnh trên tôm nuôi ở quy mô trang trại. V. KẾT LUẬN Cao chiết khổ sâm không gây độc đối với tôm nuôi qua đường ăn ở nồng độ 4% trộn vào thức ăn (tỷ lệ sống của tôm thí nghiệm 100% sau 96 giờ). Kết quả thử nghiệm cho thấy ở nồng độ cao chiết lên đến 45% (450g/kg thức ăn), tỷ lệ trung bình tôm bị chết sau 48 giờ là 15% và 21,67% sau 96 giờ ăn cao chiết. Giá trị LC 50 không được xác định do tỷ lệ gây chết tôm của cao chiết qua đường ăn < 50%. Cao chiết khổ sâm không gây độc hoặc gây độc yếu đối với tôm nuôi khi tiếp xúc trực tiếp trong nước. Ở nồng độ 20 ppm, tôm sống 100% sau 96 giờ tiếp xúc với cao chiết và tỷ lệ tôm chết 100% sau 96 giờ ở nồng độ 150 ppm. Giá trị LC 50 được xác định ở các thời điểm 48, 72 và 96 giờ với nồng độ rất cao lần lượt là 93,02; 81,25; và 81,25 ppm. LỜI CẢM ƠN Đề tài này được thực hiện từ kinh phí của hợp đồng đề tài nhánh số 02/HĐ-TS với Viện Hoá học và các Hợp chất Thiên nhiên. TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Đỗ Tất Lợi, 2004. Những cây thuốc và vị thuốc Việt Nam, Nhà xuất bản Y học. Tài liệu tiếng Anh Al-Mohann, S.Y. and Nott, J.A., 1986. B-cells and digestion in the hepatopancreas of Penaeussemisulcatus (Crustacea, Decapoda). J. Mar. Biol. Assoc. U. K, 66, 403–414. APHA, 2005. Standard methods for examination of water and waste water. Edited by Eaton, A. D., Cleseri, L. S., Rice, E. W., Greenberg, A. E., Publish Health Assosiation, Washington DC. Aquila, S., Weng, ZY., Zeng, YQ., Sun, HD., Rios, JL., 2009. Inhibition of NF-κB activation and iNOS induction by ent-kaurane diterpenoids in LPS-stimulated RAW264.7 murine macrophages. J Nat Prod, 72:1269–1272. ASTM, 1993. Standard practice for using brine shrimp nauplii as food for test animals in aquatic toxicology. ASTM E1191-90, American Society for Testing and Materials, Philadelphia. PA. Bautista, M.N., Lavilla-Pitogo, C., Subosa, P.F., Begino, E.T., 1994. Aflatoxin B1 contamination of shrimp feeds and its effect on growth and hepatopancreas of preadult Penaeus monodon. J. Sci. Food Agricult, 65, 5–11. Bell, T.A. and Lightner, D.V., 1988. A Handbook of Normal Penaeid Shrimp Histology, World Aquaculture Society, Baton Rouge, LA. Bhavan, P.S., and Geraldine, P., 2000. Histopathology of the hepatopancreas and gills of the prawn Macrobrachium malcolmsonii exposed to endosulfan. Aquat. Toxicol, 50, 331–339. Božidar S. B. Marko, Z. Zoran and Vesna D., 2011. Histological methods in the assessment of different feed effects on liver and intestine of 43TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II fish. Journal of Agr. Sc., 56:87-100. Caceci, T., Neck, K.F., Lewis, D.H., and Sis, R.F., 1988. Ultrastructure of the hepatopancreas of the Pacific white. shrimp, Penaeus vannamei (Crustacea: Decapoda). J. Mar. Biol. Assoc, U. K. 68, 323–327. Citarasu T, Babu, M.M., Punitha, S.M.J., Venketramalingam, K. and Marian, M.P., 2001. Control of pathogenic bacteria using herbal biomedicinal products in the larviculture system of Penaeus monodon. International Conference on Advanced Technologies in Fisheries and Marine Sciences, MS University, India. Citarasu, T., Venkatramalingam, K., , Micheal babu, M., Raja jeya sekar, R., & Petermarian, M., 2003. Influence of the antibacterial herbs, Solanum trilobatum, Andrographis paniculata and Psoralea corylifolia on the survival, growth and bacterial load of Penaeus monodon post larvae. Aquaculture International, 11: 583–595. Dao, T. T.; Le, T. V. T.; Nguyen, P. H.; Thuong, P. T.; Minh, P. T. H.; Woo, E. R.; Lee, K. Y.; and Oh, W. K. Planta Med., 2010. SIRT1 Inhibitory Diterpenoids from the Vietnamese Medicinal Plant Croton tonkinensis. J. Nat. Prod. 76. 1011− 1014. Giang, P. M., Son, P. T., Hamada, Y., and Otsuka, H., 2005. Cytotoxic Diterpenoids from Vietnamese Medicinal Plant Croton tonkinensis GAGNEP. Chem. Pharm. Bull, 53(3) 296—300. Gibson, R. and Barker, P. L., 1979. “The decapod hepatopancreas”, Oceanography and Marine Biology, 17: 285-346. Jacobs, W., 1928. Untersuchungen Ã1⁄4berdie Cytologie der Sekretbildung in der Mitteldarmdriise von Astacus leptodactylus. Zeitschrift fuer Zellforschung und mikroskopische Anatomic, 8: 1-62. Lee, J-Y. and Gao, Y., 2012. Review of the application of garlic, Allium sativum in aquaculture. World Aquaculture Society, P447-458. V43 (4). Lightner, D.V., Hasson, K.W., White, B.L., and Redman, R.M., 1996. Chronic toxicity and histopathological studies with Benlate, a commercial grade of benomyl, in Penaeus vannamei (Crustacea: Decapoda). Aquat. Toxicol, 34, 105–118. Loizzi, R. F., 1971. Interpretation of crayfish hepatopancreatic function based on fine structural analysis of epithelial cell lines and muscle network. Zeitschrift fuer Zellforschung und mikroscopische Anatomic, 113: 420-440. Lyon, R. and Simkiss, K., 1984. The ultrastructure and metal-containing inclusions of mature cell types in the hepatopancreas of a crayfish. Tissue and Cell, Volume 16, issue 5. Page 805 - 817. Available online 2005. Madhuri, S., Mandloi, A. K., Govind, P. and Sahni, Y.P., 2012. Antimicrobial activity of some medicinal plants against fish pathogens. IRJP, 3 (4). ISSN. 2230-8407. Miriam P. and Menon N. R., 2005. Histopathological changes in the hepatopancreas of the penaeid shrimp Metapenaeus dobsoni exposed to petroleum hydrocarbons. J. Mar: Biol. Ass, India, 47 (2) : 160 – 168. Sinclair, DA. and Guarente, L., 2006. Unlocking the Secrets of Longevity Genes. Scientific American. 294 (3): 48–51. 54–7. Stephan, CE and Rodgers, JW., 1985. Advantages of using regression analysis to calculate results of chronic toxicity tests. In: Bahner RC. Hansen DJ (eds) Aquatic toxicology and hazard assessment. Eight Symposium. ASTM STP 891, American Society for Testing and Materials. Philadelphia. pp 328–338. Syahidah, A., 2014. Status and potential of herbal applications in aquaculture. Iranian Journal of Fisheries Sciences, 14, 27-44. Tak, PP. and Firestein, GS., 2001. NF-κB: A key role in inflammatory diseases. J Clin Invest, 107:7– 11. doi: 10.1172/JCI11830. Venketramalingam, K., Christopher, J. G., and Citarasu, T., 2007. Zingiber officinalis an herbal appetizer in the tiger shrimp Penaeus monodon (Fabricius) larviculture. Aquac Nutr, 13(6):439–443. Vogt, G., 1993. Differentiation of B-cells in the hepatopancreas of the prawn Penaeus monodon. Acta Zool, 74: 51-60. Vuddhakul, V., Bhoopong, P., Hayeebilan, F., and Subhadhirasakul, S., 2007. Inhibitory activity of Thai condiments on pandemic strain of Vibrio parahaemolyticus. Food Microbiology, 24, 413- 418. Wu, J.P., Chen, H.H., and Huang, D.J., 2008. Histopathological and biochemical evidence of hepatopancreatic toxicity caused by cadmium and zinc in the white shrimp, Litopenaeus vannamei. Chemosphere, 73. 1019–1026. 44 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II SAFETY OF CROTON TONKINENSIS EXTRACT WITH RESPECT TO WHITE-LEG SHRIMP (Penaeus vannamei) UNDER IN VITRO Truong Hong Viet1 *, Do Thi Cam Hong1, Tran Bui Truc Quan2, Vu Thien An1 ABSTRACT Herbs and medicinal plants promise to be a source of therapeutic supply for shrimp and fish culture because these products are cheaper cost to treat and non-toxic. The extract of Croton tonkinensis plant was thought to contain mainly organic compounds such as flavonoids, alkaloids, polyphenols... The aim of this study is to investigate the safety of crude extract of C. tonkinensis under in vitro. The toxicity test of the Croton extract via oral was performed with concentrations from 0 to 45% (450g/kg feed). For the extract immersion experiments into the culture water was carried out at concentrations from 0 to 160 ppm. The results showed that the Croton extract is not toxic to white- leg shrimp via oral treatment. At 45% concentration, the average shrimp mortality is 15% and 21.67% after 48 and 96 hours, respectively. For the experiment of soaking extract in shrimp water, shrimp survive 100% after 96 hours of exposure to the extract at 20 ppm concentration and the 100% dead shrimp after 96 hours at 150 ppm concentration. The high relative LC 50 values of Croton extract which was immersed into shrimp culture water, were determined as 93.02; 81.25; and 81.25 ppm, at 48, 72 and 96 hours, respectively. While LC 50 values of Croton extract which was mixed into shrimp feed were not computed due to the experimental shrimp mortality < 50%. From the above results, we conclude that the extract is safe for white-leg shrimp under in vitro. Keywords: AHPND, Croton tonkinensis, Extract, LC 50 , White-leg shrimp. Người phản biện: TS. Lê Hồng Phước Ngày nhận bài: 15/5/2019 Ngày thông qua phản biện: 17/6/2019 Ngày duyệt đăng: 26/6/2019 1 Southern Monitoring Center for Aquaculture Environment and Epidemics, Research Institute for Aquaculture No.2. 2 International University, Vietnam Naional University, HCMC. * Email: truonghongviet@yahoo.com
File đính kèm:
 do_an_toan_cua_cao_chiet_kho_sam_croton_tonkinensis_doi_voi.pdf
do_an_toan_cua_cao_chiet_kho_sam_croton_tonkinensis_doi_voi.pdf

