Đánh giá chất lượng cảm quan và một số chủng vi khuẩn gây thối cá ngừ chù nguyên liệu bảo quản bằng Oligochitin kết hợp với nước đá
TÓM TẮT Nghiên cứu đã đánh giá chất lượng cảm quan và một số chủng vi khuẩn: TPC, Shewanella putrefaciens và Pseudomonas spp gây thối điển hình trên mẫu cá ngừ chù nguyên liệu (1000±50 gr/con) đánh bắt tại vùng biển Khánh Hòa, Việt Nam bảo quản bằng oligochitin (1÷3 kDa) nồng độ 1,0% kết hợp với nước đá (2±1ºC) trong thời gian 22 ngày, cụ thể: Chất lượng cảm quan được duy trì trong 21 ngày; TPC bắt đầu vượt giới hạn cho phép từ ngày 16, ứng 9,4x105 cfu/g; Pseudomonas spp trong 21 ngày và Shewanella putrefaciens trong 18 ngày bắt đầu vượt ngưỡng gây ươn hỏng, ứng 1,3x108 cfu/g và 1,5x109 cfu/g. So với mẫu, chỉ sử dụng nước đá để bảo quản thì: Chất lượng cảm quan được duy trì dài hơn 1,9 lần; TPC, Pseudomonas spp và Shewanella putrefaciens thấp hơn tương ứng: 1,67; 1,65 và 1,59 lần

Trang 1

Trang 2
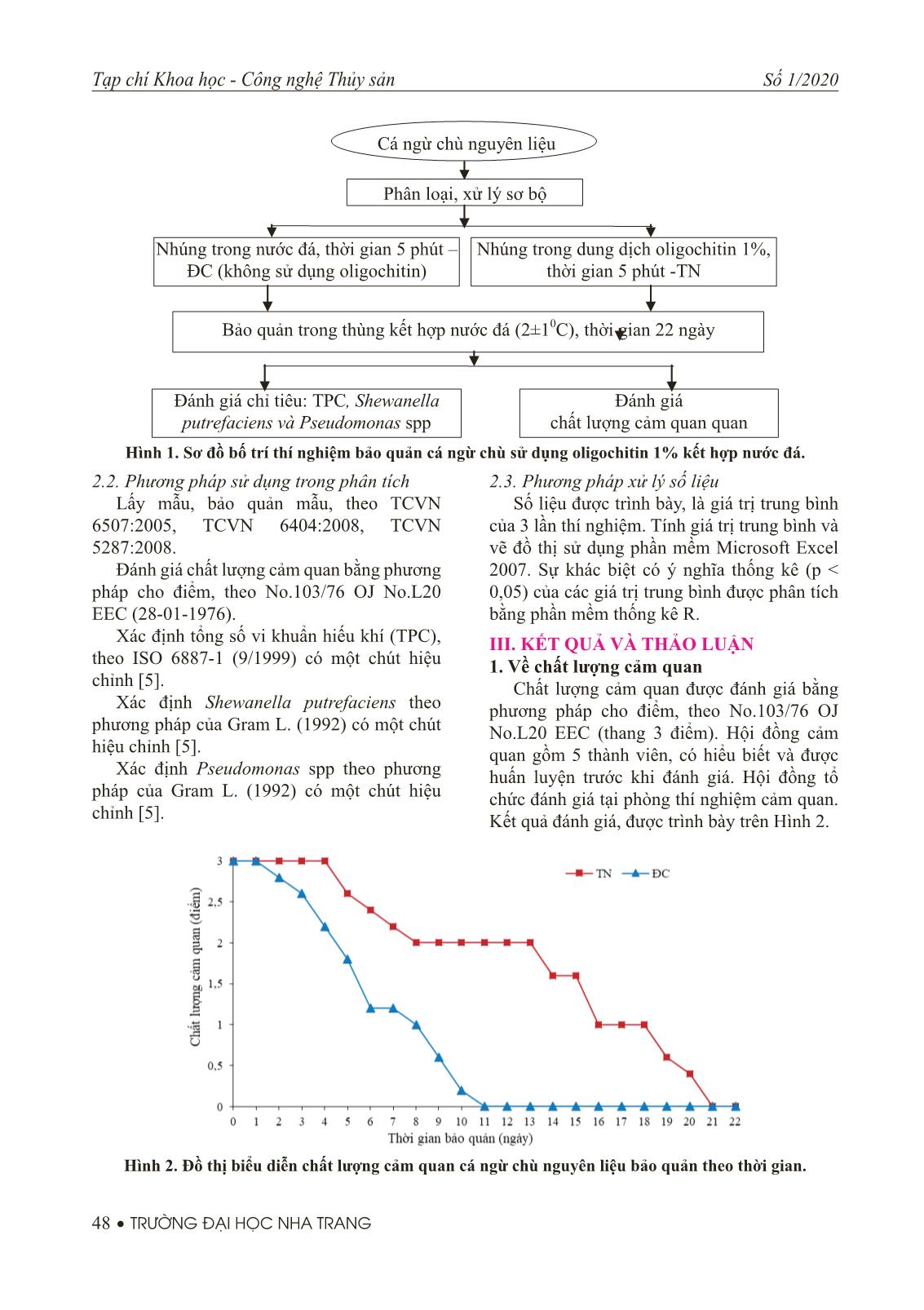
Trang 3
Trang 4
Trang 5
Trang 6

Trang 7

Trang 8
Tóm tắt nội dung tài liệu: Đánh giá chất lượng cảm quan và một số chủng vi khuẩn gây thối cá ngừ chù nguyên liệu bảo quản bằng Oligochitin kết hợp với nước đá

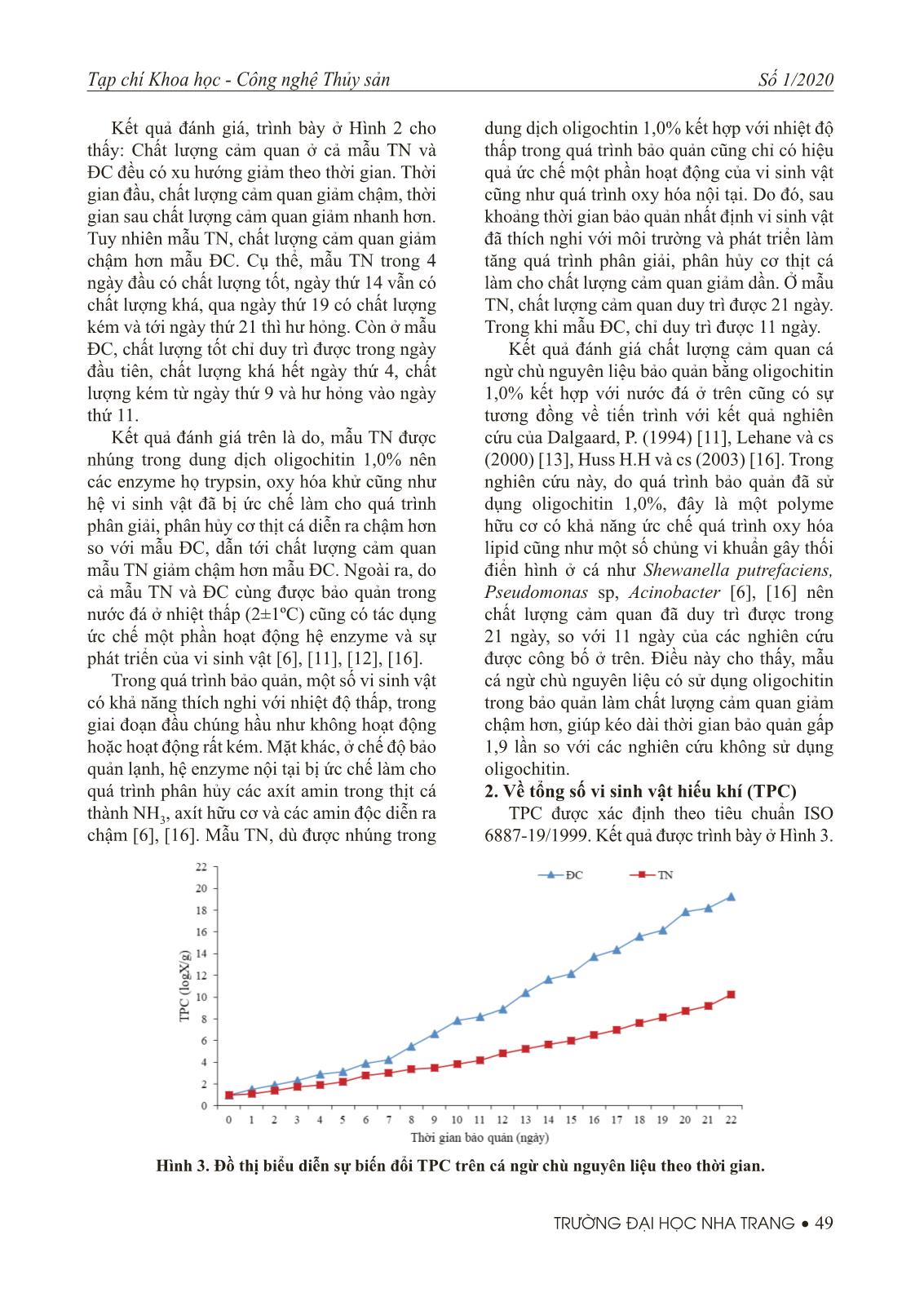
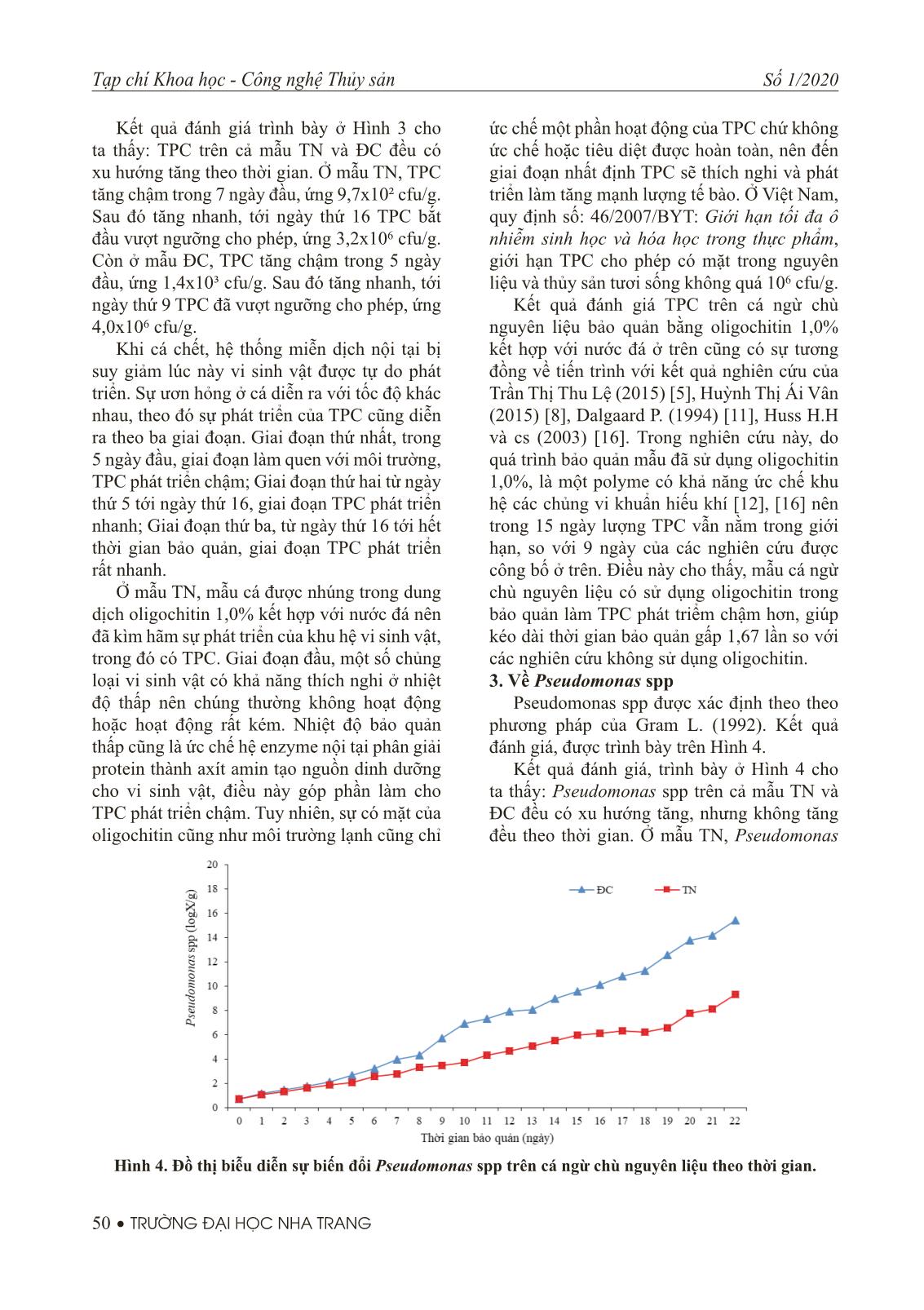
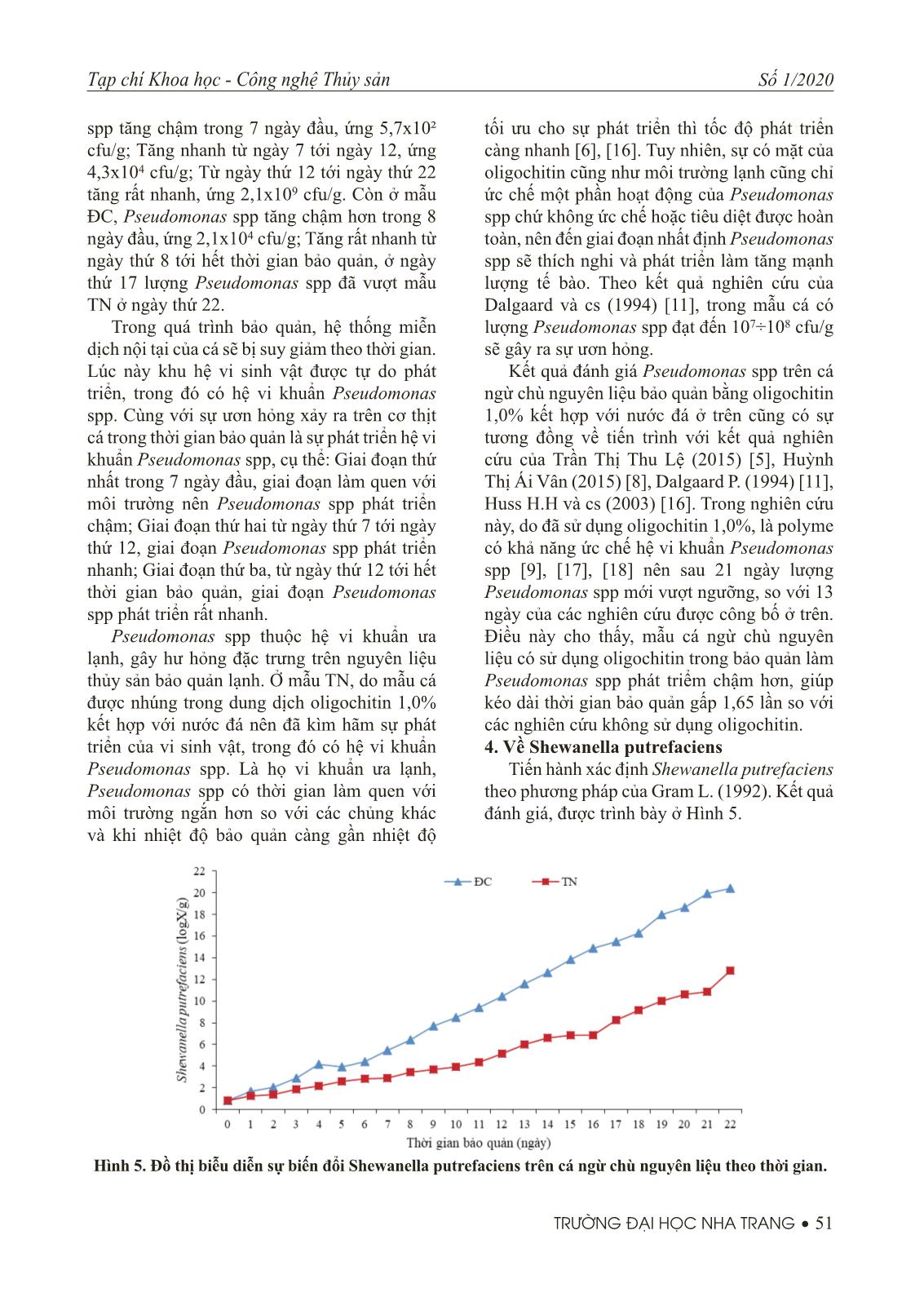
tác dụng ức chế một phần hoạt động hệ enzyme và sự phát triển của vi sinh vật [6], [11], [12], [16]. Trong quá trình bảo quản, một số vi sinh vật có khả năng thích nghi với nhiệt độ thấp, trong giai đoạn đầu chúng hầu như không hoạt động hoặc hoạt động rất kém. Mặt khác, ở chế độ bảo quản lạnh, hệ enzyme nội tại bị ức chế làm cho quá trình phân hủy các axít amin trong thịt cá thành NH3, axít hữu cơ và các amin độc diễn ra chậm [6], [16]. Mẫu TN, dù được nhúng trong dung dịch oligochtin 1,0% kết hợp với nhiệt độ thấp trong quá trình bảo quản cũng chỉ có hiệu quả ức chế một phần hoạt động của vi sinh vật cũng như quá trình oxy hóa nội tại. Do đó, sau khoảng thời gian bảo quản nhất định vi sinh vật đã thích nghi với môi trường và phát triển làm tăng quá trình phân giải, phân hủy cơ thịt cá làm cho chất lượng cảm quan giảm dần. Ở mẫu TN, chất lượng cảm quan duy trì được 21 ngày. Trong khi mẫu ĐC, chỉ duy trì được 11 ngày. Kết quả đánh giá chất lượng cảm quan cá ngừ chù nguyên liệu bảo quản bằng oligochitin 1,0% kết hợp với nước đá ở trên cũng có sự tương đồng về tiến trình với kết quả nghiên cứu của Dalgaard, P. (1994) [11], Lehane và cs (2000) [13], Huss H.H và cs (2003) [16]. Trong nghiên cứu này, do quá trình bảo quản đã sử dụng oligochitin 1,0%, đây là một polyme hữu cơ có khả năng ức chế quá trình oxy hóa lipid cũng như một số chủng vi khuẩn gây thối điển hình ở cá như Shewanella putrefaciens, Pseudomonas sp, Acinobacter [6], [16] nên chất lượng cảm quan đã duy trì được trong 21 ngày, so với 11 ngày của các nghiên cứu được công bố ở trên. Điều này cho thấy, mẫu cá ngừ chù nguyên liệu có sử dụng oligochitin trong bảo quản làm chất lượng cảm quan giảm chậm hơn, giúp kéo dài thời gian bảo quản gấp 1,9 lần so với các nghiên cứu không sử dụng oligochitin. 2. Về tổng số vi sinh vật hiếu khí (TPC) TPC được xác định theo tiêu chuẩn ISO 6887-19/1999. Kết quả được trình bày ở Hình 3. Hình 3. Đồ thị biểu diễn sự biến đổi TPC trên cá ngừ chù nguyên liệu theo thời gian. 50 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 1/2020 Kết quả đánh giá trình bày ở Hình 3 cho ta thấy: TPC trên cả mẫu TN và ĐC đều có xu hướng tăng theo thời gian. Ở mẫu TN, TPC tăng chậm trong 7 ngày đầu, ứng 9,7x10² cfu/g. Sau đó tăng nhanh, tới ngày thứ 16 TPC bắt đầu vượt ngưỡng cho phép, ứng 3,2x106 cfu/g. Còn ở mẫu ĐC, TPC tăng chậm trong 5 ngày đầu, ứng 1,4x10³ cfu/g. Sau đó tăng nhanh, tới ngày thứ 9 TPC đã vượt ngưỡng cho phép, ứng 4,0x106 cfu/g. Khi cá chết, hệ thống miễn dịch nội tại bị suy giảm lúc này vi sinh vật được tự do phát triển. Sự ươn hỏng ở cá diễn ra với tốc độ khác nhau, theo đó sự phát triển của TPC cũng diễn ra theo ba giai đoạn. Giai đoạn thứ nhất, trong 5 ngày đầu, giai đoạn làm quen với môi trường, TPC phát triển chậm; Giai đoạn thứ hai từ ngày thứ 5 tới ngày thứ 16, giai đoạn TPC phát triển nhanh; Giai đoạn thứ ba, từ ngày thứ 16 tới hết thời gian bảo quản, giai đoạn TPC phát triển rất nhanh. Ở mẫu TN, mẫu cá được nhúng trong dung dịch oligochitin 1,0% kết hợp với nước đá nên đã kìm hãm sự phát triển của khu hệ vi sinh vật, trong đó có TPC. Giai đoạn đầu, một số chủng loại vi sinh vật có khả năng thích nghi ở nhiệt độ thấp nên chúng thường không hoạt động hoặc hoạt động rất kém. Nhiệt độ bảo quản thấp cũng là ức chế hệ enzyme nội tại phân giải protein thành axít amin tạo nguồn dinh dưỡng cho vi sinh vật, điều này góp phần làm cho TPC phát triển chậm. Tuy nhiên, sự có mặt của oligochitin cũng như môi trường lạnh cũng chỉ ức chế một phần hoạt động của TPC chứ không ức chế hoặc tiêu diệt được hoàn toàn, nên đến giai đoạn nhất định TPC sẽ thích nghi và phát triển làm tăng mạnh lượng tế bào. Ở Việt Nam, quy định số: 46/2007/BYT: Giới hạn tối đa ô nhiễm sinh học và hóa học trong thực phẩm, giới hạn TPC cho phép có mặt trong nguyên liệu và thủy sản tươi sống không quá 106 cfu/g. Kết quả đánh giá TPC trên cá ngừ chù nguyên liệu bảo quản bằng oligochitin 1,0% kết hợp với nước đá ở trên cũng có sự tương đồng về tiến trình với kết quả nghiên cứu của Trần Thị Thu Lệ (2015) [5], Huỳnh Thị Ái Vân (2015) [8], Dalgaard P. (1994) [11], Huss H.H và cs (2003) [16]. Trong nghiên cứu này, do quá trình bảo quản mẫu đã sử dụng oligochitin 1,0%, là một polyme có khả năng ức chế khu hệ các chủng vi khuẩn hiếu khí [12], [16] nên trong 15 ngày lượng TPC vẫn nằm trong giới hạn, so với 9 ngày của các nghiên cứu được công bố ở trên. Điều này cho thấy, mẫu cá ngừ chù nguyên liệu có sử dụng oligochitin trong bảo quản làm TPC phát triểm chậm hơn, giúp kéo dài thời gian bảo quản gấp 1,67 lần so với các nghiên cứu không sử dụng oligochitin. 3. Về Pseudomonas spp Pseudomonas spp được xác định theo theo phương pháp của Gram L. (1992). Kết quả đánh giá, được trình bày trên Hình 4. Kết quả đánh giá, trình bày ở Hình 4 cho ta thấy: Pseudomonas spp trên cả mẫu TN và ĐC đều có xu hướng tăng, nhưng không tăng đều theo thời gian. Ở mẫu TN, Pseudomonas Hình 4. Đồ thị biễu diễn sự biến đổi Pseudomonas spp trên cá ngừ chù nguyên liệu theo thời gian. Tạp chí Khoa học - Công nghệ Thủy sản Số 1/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 51 spp tăng chậm trong 7 ngày đầu, ứng 5,7x10² cfu/g; Tăng nhanh từ ngày 7 tới ngày 12, ứng 4,3x104 cfu/g; Từ ngày thứ 12 tới ngày thứ 22 tăng rất nhanh, ứng 2,1x109 cfu/g. Còn ở mẫu ĐC, Pseudomonas spp tăng chậm hơn trong 8 ngày đầu, ứng 2,1x104 cfu/g; Tăng rất nhanh từ ngày thứ 8 tới hết thời gian bảo quản, ở ngày thứ 17 lượng Pseudomonas spp đã vượt mẫu TN ở ngày thứ 22. Trong quá trình bảo quản, hệ thống miễn dịch nội tại của cá sẽ bị suy giảm theo thời gian. Lúc này khu hệ vi sinh vật được tự do phát triển, trong đó có hệ vi khuẩn Pseudomonas spp. Cùng với sự ươn hỏng xảy ra trên cơ thịt cá trong thời gian bảo quản là sự phát triển hệ vi khuẩn Pseudomonas spp, cụ thể: Giai đoạn thứ nhất trong 7 ngày đầu, giai đoạn làm quen với môi trường nên Pseudomonas spp phát triển chậm; Giai đoạn thứ hai từ ngày thứ 7 tới ngày thứ 12, giai đoạn Pseudomonas spp phát triển nhanh; Giai đoạn thứ ba, từ ngày thứ 12 tới hết thời gian bảo quản, giai đoạn Pseudomonas spp phát triển rất nhanh. Pseudomonas spp thuộc hệ vi khuẩn ưa lạnh, gây hư hỏng đặc trưng trên nguyên liệu thủy sản bảo quản lạnh. Ở mẫu TN, do mẫu cá được nhúng trong dung dịch oligochitin 1,0% kết hợp với nước đá nên đã kìm hãm sự phát triển của vi sinh vật, trong đó có hệ vi khuẩn Pseudomonas spp. Là họ vi khuẩn ưa lạnh, Pseudomonas spp có thời gian làm quen với môi trường ngắn hơn so với các chủng khác và khi nhiệt độ bảo quản càng gần nhiệt độ tối ưu cho sự phát triển thì tốc độ phát triển càng nhanh [6], [16]. Tuy nhiên, sự có mặt của oligochitin cũng như môi trường lạnh cũng chỉ ức chế một phần hoạt động của Pseudomonas spp chứ không ức chế hoặc tiêu diệt được hoàn toàn, nên đến giai đoạn nhất định Pseudomonas spp sẽ thích nghi và phát triển làm tăng mạnh lượng tế bào. Theo kết quả nghiên cứu của Dalgaard và cs (1994) [11], trong mẫu cá có lượng Pseudomonas spp đạt đến 107÷108 cfu/g sẽ gây ra sự ươn hỏng. Kết quả đánh giá Pseudomonas spp trên cá ngừ chù nguyên liệu bảo quản bằng oligochitin 1,0% kết hợp với nước đá ở trên cũng có sự tương đồng về tiến trình với kết quả nghiên cứu của Trần Thị Thu Lệ (2015) [5], Huỳnh Thị Ái Vân (2015) [8], Dalgaard P. (1994) [11], Huss H.H và cs (2003) [16]. Trong nghiên cứu này, do đã sử dụng oligochitin 1,0%, là polyme có khả năng ức chế hệ vi khuẩn Pseudomonas spp [9], [17], [18] nên sau 21 ngày lượng Pseudomonas spp mới vượt ngưỡng, so với 13 ngày của các nghiên cứu được công bố ở trên. Điều này cho thấy, mẫu cá ngừ chù nguyên liệu có sử dụng oligochitin trong bảo quản làm Pseudomonas spp phát triểm chậm hơn, giúp kéo dài thời gian bảo quản gấp 1,65 lần so với các nghiên cứu không sử dụng oligochitin. 4. Về Shewanella putrefaciens Tiến hành xác định Shewanella putrefaciens theo phương pháp của Gram L. (1992). Kết quả đánh giá, được trình bày ở Hình 5. Hình 5. Đồ thị biễu diễn sự biến đổi Shewanella putrefaciens trên cá ngừ chù nguyên liệu theo thời gian. 52 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 1/2020 Kết quả đánh giá trình bày ở Hình 5 cho ta thấy: Shewanella putrefaciens trên cả mẫu TN và ĐC đều tăng, xu hướng tăng chậm ở những ngày đầu và tăng nhanh ở những ngày sau. Ở mẫu TN, Shewanella putrefaciens tăng chậm trong 12 ngày đầu, ứng 1,5x105 cfu/g; Từ ngày thứ 12 tới ngày thứ 18 tăng nhanh, ứng 1,5x109 cfu/g; Tăng rất nhanh từ ngày 18 tới hết thời gian bảo quản, ứng 6,6x1012 cfu/g. Còn ở mẫu ĐC, Shewanella putrefaciens tăng chậm trong 7 ngày đầu, ứng 2,9x105 cfu/g; Tăng nhanh từ ngày thứ 7 tới hết thời gian bảo quản, ở ngày thứ 16 lượng Shewanella putrefaciens đã vượt mẫu thí nghiệm ở ngày thứ 22. Shewanella putrefaciens thuộc hệ vi khuẩn ưa lạnh, cũng là nhóm gây hư hỏng đặc trưng trên nguyên liệu thủy sản [5], [6], [16] và có khả năng sinh H2S trong quá trình sinh trưởng và phát triển. Ở mẫu TN, do mẫu cá đã sử dụng oligochitin 1,0% kết hợp với nước đá nên đã kìm hãm sự phát triển của vi sinh vật, trong đó có hệ vi khuẩn Shewanella putrefaciens. Do cũng là hệ vi khuẩn ưa lạnh, nên Shewanella putrefaciens cũng có thời gian làm quen ngắn hơn so với các chủng khác và khi nhiệt độ bảo quản càng gần tới nhiệt độ tối ưu cho sự phát triển thì tốc độ phát triển càng nhanh [6], [12], [16]. Tuy nhiên, sự có mặt của oligochtin cũng như môi trường lạnh cũng chỉ ức chế một phần hoạt động của Shewanella putrefaciens chứ không ức chế hoặc tiêu diệt hoàn toàn, nên đến giai đoạn nhất định Shewanella putrefaciens sẽ thích nghi và phát triển làm tăng nhanh lượng tế bào. Theo kết quả nghiên cứu của Dalgaard và cs (1994) [11], trong mẫu cá khi Shewanella putrefaciens đạt đến 108÷109 cfu/g sẽ gây ra sự ươn hỏng. Kết quả đánh giá Shewanella putrefaciens trên cá ngừ chù nguyên liệu bảo quản bằng oligochitin 1,0% kết hợp với nước đá ở trên cũng có sự tương đồng về tiến trình với kết quả nghiên cứu của Trần Thị Thu Lệ (2015) [5], Huỳnh Thị Ái Vân (2015) [8], Dalgaard P. (1994) [11], Huss H.H và cs (2003) [16]. Tuy nhiên, nghiên cứu này đã sử dụng oligochitin 1,0% trong bảo quản, là polymme có khả năng ức chế hệ vi khuẩn Shewanella putrefaciens [2], [9], [17] nên sau 18 ngày lượng Shewanella putrefaciens mới vượt ngưỡng, so với 11 ngày của các nghiên cứu được công bố ở trên. Điều này cho thấy, mẫu cá ngừ chù nguyên liệu có sử dụng oligochitin trong bảo quản làm Shewanella putrefaciens phát triểm chậm hơn, giúp kéo dài thời gian bảo quản gấp 1,59 lần so với các nghiên cứu không sử dụng oligochitin. IV. KẾT LUẬN Nghiên cứu đã đánh giá được sự biến đổi chất lượng cảm quan và một số chủng vi: TPC, Pseudomonas spp và Shewanella putrefaciens khuẩn gây thối điển hình trên mẫu cá ngừ chù nguyên liệu đánh bắt tại vùng biển Khánh Hòa, Việt Nam được bảo quản bằng oligochitin (1÷3kDa) nồng độ 1,0% kết hợp với nước đá (2±1ºC) trong thời gian 22 ngày, cụ thể: Chất lượng cảm quan được duy trì trong 21 ngày, TPC bắt đầu vượt giới hạn cho phép từ ngày thứ 16, còn Pseudomonas spp và Shewanella putrefaciens bắt đầu vượt ngưỡng gây ươn hỏng sau 21 và 18 ngày bảo quản. TÀI LIỆU THAM KHẢO Tiếng Việt 1. Vũ Ngọc Bội (2016), Nghiên cứu công nghệ sản xuất và ứng dụng chế phẩm oligosaccharid (oligochitin và oligochitosan) để bảo quản sau thu hoạch nguyên liệu thủy sản đánh bắt xa bờ, Đề tài KC.07.02/11-15. 2. Nguyễn Anh Dũng (2009), Polysaccharide hoạt tính sinh học và ứng dụng, NXB Giáo dục Việt Nam. 3. Thái Thị Hương (2014), Nghiên cứu những biến đổi về cảm quan và một số thành phần hóa học của cá ngừ Tạp chí Khoa học - Công nghệ Thủy sản Số 1/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 53 Chù nguyên liệu trong quá trình bảo quản bằng nước đá và nước đá kết hợp với oligochitin, Đồ án tốt nghiệp, trường Đại học Nha Trang. 4. Nguyễn Hữu Khánh, Hồ Thị Bích Ngân (2011), “Thực trạng bảo quản về quản lý chất lượng sản phẩm thủy sản sau thu hoạch trên tàu khai thác xa bờ ở một số tỉnh miền trung Việt Nam”, Tạp chí Khoa học và Phát triển, 9(5), tr. 772-779. 5. Trần Thị Thu Lệ (2015), Nghiên cứu ảnh hưởng của nhiệt độ thấp đến sự biến đổi của một số vi sinh vật gây hỏng đặc trưng và gây bệnh hiện diện trên tôm sú (penaeus monodon) nguyên liệu trong quá trình bảo quản, Luận văn tốt nghiệp, trường Đại học Nha Trang. 6. Đỗ Văn Ninh, Ngô Đăng Nghĩa và cs (2004), Cá tươi - chất lượng và các biến đổi về chất lượng, NXB Nông nghiệp (sách dịch). 7. Đinh Mạnh Sơn và cs (2005). Nghiên cứu trữ lượng và khả năng khai thác nguồn lợi cá nổi và hiện trạng cơ cấu nghề nghiệp khu vực biển xa bờ miền Trung và Đông Nam Bộ. Đề tài cấp Bộ (B02.05/03-05). 8. Huỳnh Thị Án Vân (2015), Nghiên cứu ảnh hưởng của nhiệt độ thấp đến sự biến đổi của vi sinh vật gây hỏng đặc trưng (pseudomonas spp) và vi sinh vật gây bệnh (coliform, e.coli) hiện diện trên fi llet cá tra (pangasius hypophthalmus) bảo quản lạnh, Luận văn tốt nghiệp, trường Đại học Nha Trang. 9. Trần Văn Vương, Nguyễn Anh Tuấn, Vũ Ngọc Bội (2018), “Depolymer chitin thu nhận phân đoạn oligochitin bằng axít clohydric, chiếu xạ gamma và chitinase”, Tạp chí Khoa học Công nghệ Thủy sản, 03, Trường Đại học Nha Trang, tr.75-81. Tiếng Anh 10. Ackman, R.G et al. (1992), “Non enzyme oxidation of seafood lipids”, Advances in Seafood Biochemistry, Basel 245-267. 11. Dalgaard, P. (1994), “Quantitative and quantitative characterization of spoilage bacteria from packed fi sh”, Int. J. Food Microbiol. 12. Devaraju and Setty (1985), “Comparative study of fi sh bacteria from tropical and cold/temperate marine waters”, FAO Fish. Rep. (317) Suppl., 97-107. 13. Haaland, H. and L. R. Njaa (1988), “Ammonia (NH3) and total volatile nitrogen (TVB) in preserved an unpreserved stored whole fi sh”, J. Sci. Food Agric. 44, 335-342. 14. Hiroshi Ohkawa, Nobuko Ohishi, And Kunio Yagi (1979), “Assay for Lipid Peroxides in Animal Tissues by Thiobarbituric Acid Reaction”, Analytical Biochemistry 95, 35-L-358. 15. Huss, H.H., Ababouch, L., Gram, L., (2003), “Assessment and Management of Seafood Safety and Quality”, FAO Fisheries Technical Paper 444, Rome, 230 pp. 16. Huss, H.H (1988), “Fresh fi sh. Quality and Quality Changes”, FAO Fisheries Series No.29. 17. Jeon, Y. J., & Kim, S. K. (2000), “Production of oligosaccharides using an ultrafi ltration membrane reactor and their antibacterial activity”, Carbohydrate Polymers, 41, 133–141. 18. Ngo, D.; Lee, S.; Kim, M.; Kim, S. (2009), “Production of chitin oligosaccharides with different molecular weights and their antioxidant effect in RAW 264.7 cells”, J. Funct. Foods, 1, 188–198. 19. stenet.gov.vn/
File đính kèm:
 danh_gia_chat_luong_cam_quan_va_mot_so_chung_vi_khuan_gay_th.pdf
danh_gia_chat_luong_cam_quan_va_mot_so_chung_vi_khuan_gay_th.pdf

