Xác định sự có mặt của các gen độc tố ở các chủng Vibrio gây bệnh hoại tử gan tụy cấp tính trên tôm thẻ chân trắng tại Thừa Thiên Huế
Tóm tắt. Bệnh hoại tử gan tụy cấp tính (Acute Hepatopancreatic Necrosis Disease – AHPND) là một bệnh
do vi khuẩn gây ra. Bệnh này dẫn đến tỷ lệ chết lên đến 100% trong quần thể tôm thẻ chân trắng, tôm
sú và gây những tổn thất kinh tế đáng kể cho ngành nuôi tôm ở nhiều nước châu Á. Các nghiên cứu
trước đây cho thấy không phải chủng Vibrio nào cũng có khả năng gây bệnh do chúng mang các gen độc
tố khác nhau. Chúng tôi đã đánh giá sự có mặt của các gen độc tố trên các chủng Vibrio phân lập tại Thừa
Thiên Huế đồng thời phân tích trình tự các gen này. Kết quả cho thấy trong 14 chủng Vibrio mang gen
pirABvp nghiên cứu, gen tlh xuất hiện ở tất cả các chủng, gen toxR xuất hiện ở 7/14 chủng trong khi đó
các gen trh và tdh không xuất hiện trong các chủng vi khuẩn Vibrio phân lập được. Giải trình tự đoạn chỉ
thị các gen độc tố cho thấy các gen này đều có độ tương đồng khá cao (98–100%) so với các gen đã công
bố trên ngân hàng gen, trong đó 2 gen pirAvp và pirBvp ít sai khác còn các gen tlh và toxR có sự sai khác
nhiều hơn. Đây là cơ sở để thực hiện các nghiên cứu tiếp theo trong việc sản xuất các chế phẩm phòng
và trị bệnh hoại tử gan tụy cấp tính trên tôm.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6

Trang 7

Trang 8

Trang 9
Tóm tắt nội dung tài liệu: Xác định sự có mặt của các gen độc tố ở các chủng Vibrio gây bệnh hoại tử gan tụy cấp tính trên tôm thẻ chân trắng tại Thừa Thiên Huế

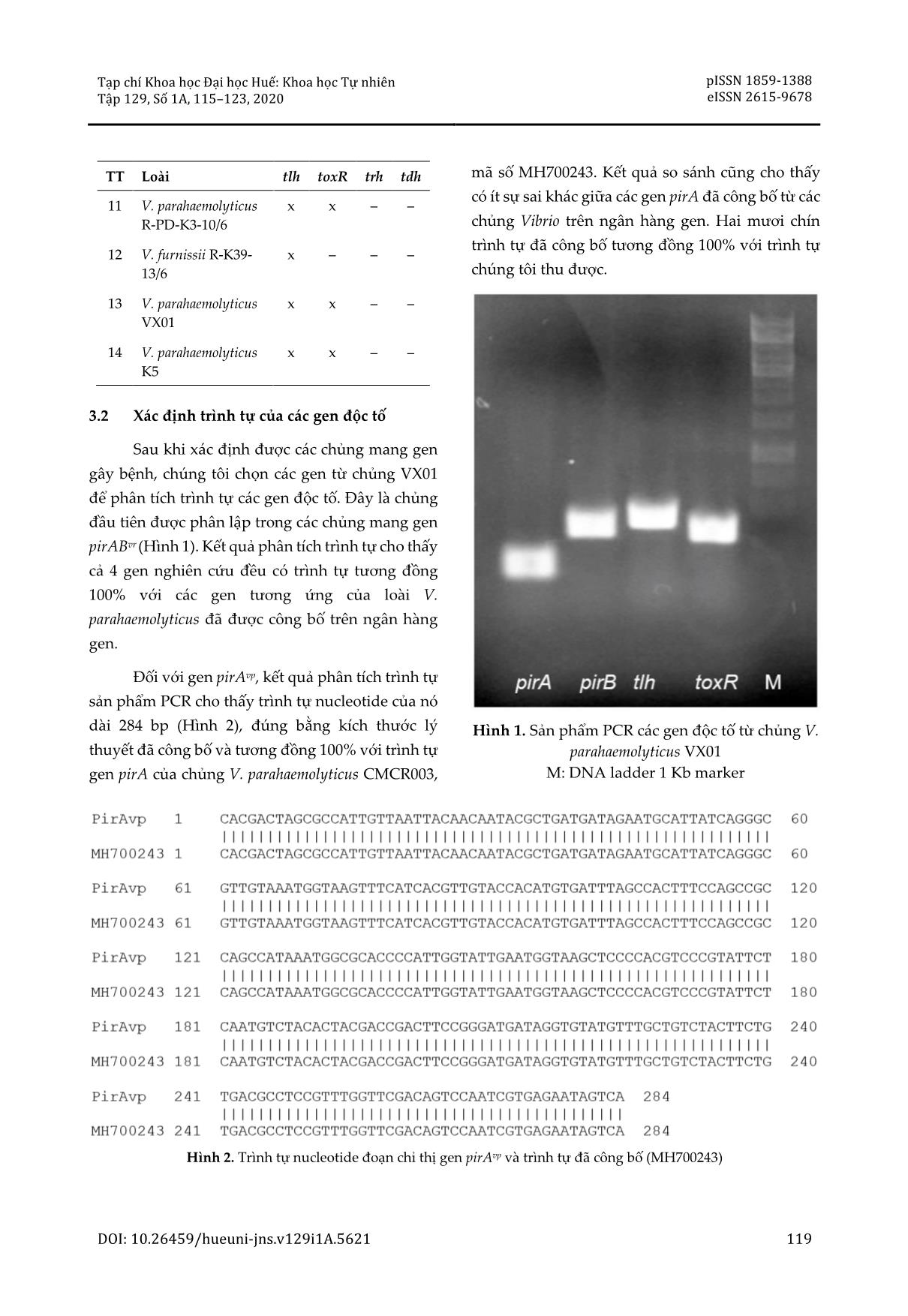
n bền nhiệt và tlh mã hóa hemolysin không bền nhiệt. Cả hai gen tdh và trh đều nằm trên operon độc tố Vp- toxRS, được điều hòa bởi gen toxR có trình tự bảo tồn cao trong loài [8]. Trong bài báo này, chúng tôi trình bày một số kết quả bước đầu về sự có mặt của các gen độc tố trên các loài Vibrio gây bệnh trên tôm được phân lập ở Thừa Thiên Huế. Tạp chí Khoa học Đại học Huế: Khoa học Tự nhiên Tập 129, Số 1A, 115–123, 2020 pISSN 1859-1388 eISSN 2615-9678 DOI: 10.26459/hueuni-jns.v129i1A.5621 117 2 Nguyên liệu và phương pháp 2.1 Nguyên liệu Nguyên liệu nghiên cứu là các loài Vibrio phân lập từ mẫu tôm bị bệnh hoại tử gan tụy cấp tại tỉnh Thừa Thiên Huế do Viện Công nghệ sinh học, Đại học Huế cung cấp. Đây là các chủng đã được định danh và mang các gen độc tố pirAvp và pirBvp. 2.2 Phương pháp Tách chiết DNA tổng số Các chủng vi khuẩn Vibrio được nuôi trong môi trường peptone muối kiềm (ASPW) với 2% peptone và 2% NaCl, pH 8,6, lắc trong 18 giờ ở 30 °C với tốc độ 180 vòng/phút. Dịch nuôi cấy được ly tâm 13.000 vòng/phút trong 1 phút ở 4 °C để thu tế bào. DNA tổng số được tách chiết bằng AquaPure Genomic DNA Isolation Kit (Cat. 732-6340, Bio- rad) theo hướng dẫn của nhà sản xuất và sau đó bảo quản ở 4 °C. Chất lượng DNA tổng số được kiểm tra bằng điện di trên gel agarose 0,8%. Xác định sự có mặt của gen mã hóa độc tố của vi khuẩn Sự có mặt của độc tố của các chủng gây bệnh gan tụy cấp trên tôm được xác định thông qua sự có mặt của các gen mã hóa protein độc tính (pirAvp, pirBvp, toxR và tlh) dựa trên các cặp mồi đặc hiệu cho đoạn chỉ thị của các gen này. Trình tự cụ thể các mồi được trình bày ở Bảng 1. Thành phần PCR bao gồm: 50 ng DNA tổng số, 10 pmol primer mỗi loại, 6 µL 2× GoTaq® Green Master Mix (Promega, Mỹ), bổ sung nước cất vô trùng vừa đủ 12 µL. Quá trình khuếch đại PCR được thực hiện trong máy luân nhiệt MJ Mini™ Thermal Cycler (Biorad, Mỹ) theo chu trình: 95 °C/10 phút; 30 chu kỳ: 95 °C/30 giây, 53 °C/30 giây, và 72 °C/1 phút; cuối cùng 72 °C/10 phút. Sản phẩm PCR được điện di trên gel agarose 0,8% và nhuộm bằng 6× GelRedTM loading buffer with tricolor (ABT, Việt Nam). Hình ảnh điện di được thu nhận trên bàn đọc UV. Sản phẩm PCR được tạo dòng vào vector pGEM T-easy (Promega) theo hướng dẫn của nhà sản xuất, sau đó các vector tái tổ hợp được chuyển vào vi khuẩn E. coli TOP10 bằng phương pháp sốc nhiệt. Thể tái tổ hợp được chọn lọc trên môi trường LB có bổ sung 50 µg/mL ampicillin, X-Gal/IPTG. Khuẩn lạc màu trắng được chọn ngẫu nhiên từ các đĩa và tiến hành PCR với cặp mồi M13F (5’- GTAAACGACGGCCAG-3’) và M13R (5’-CAGGA AACAGCTATG AC-3’). Chu trình nhiệt của phản ứng khuếch đại với mồi M13 được thực hiện giống như phần trên. Sản phẩm PCR được điện di kiểm tra trên gel agarose 0,8% và được gửi đi phân tích trình tự tự bằng phương pháp Sanger. Trình tự nucleotide của các gen được kiểm tra bằng phần mềm BioEdit, sau đó so sánh với các trình tự đã được công bố trên ngân hàng gen thông qua công cụ BLAST (https://blast.ncbi.nlm.nih. gov/). Bảng 1. Trình tự các mồi sử dụng Gen Tên mồi Trình tự nucleotide Kích thước (bp) Tài liệu tham khảo pirAvp VpPirA-284 5’-TGACTATTCTCACGATTGGACTG-3’ 5’-CACGACTAGCGCCATTGTTA-3’ 284 [4] pirBvp VpPirB-392 5’-TGATGAAGTGATGGGTGCTC-3’ 5’-TGTAAGCGCCGTTTAACTCA-3’ 392 [4] tlh tl 5’-AAAGCGGATTATGCAGAAGCACTG-3’ 5’-GCTACTTTCTAGCATTTTCTCTGC-3’ 450 [9] toxR tR 5’-GTCTTCTGACGCAATCGTTG-3’ 367 [10] Hoàng Tấn Quảng và CS. 118 Gen Tên mồi Trình tự nucleotide Kích thước (bp) Tài liệu tham khảo 5’-ATACGAGTGGTTGCTGTCATG-3’ trh L-trh R-trh 5’-TTGGCTTCGATATTTTCAGTATCT-3’ 5’-CATAACAAACATATGCCCATTTCCG-3’ 410 [11] tdh L-tdh R-tdh 5’-GTAAAGGTCTCTGACTTTTGGAC-3’ 5’-TGGAATAGAACCTTCATCTTCACC-3’ 245 [11] 3 Kết quả và thảo luận 3.1 Sự có mặt của các gen độc tố trên các chủng Vibrio gây bệnh Dựa trên các chủng Vibrio được cung cấp, chúng tôi đã nuôi cấy tăng sinh trên môi trường ASPW, tách chiết DNA tổng số sau đó xác định sự có mặt của các gen độc tố. Từ 14 chủng mang gen gây bệnh là pirAvp và pirBvp, chúng tôi tiến hành khảo sát sự có mặt của các gen độc tố khác là tlh, toxR, trh và tdh. Kết quả khảo sát sự có mặt của gen tlh cho thấy 100% chủng mang gen này, đây là tỷ lệ phù hợp với các công bố trước đây. Đối với gen toxR, chúng tôi ghi nhận 7/14 mẫu chứa gen này, trong đó toàn bộ thuộc về loài V. parahaemolyticus (Bảng 2). Theo Han và cs., gen tlh và toxR xuất hiện ở 100% các loài V. parahaemolyticus nghiên cứu [4]; điều này tương đồng với kết quả nghiên cứu của chúng tôi. Trong khi đó, Gutierrez West và cs. nghiên cứu trên các chủng V. parahaemolyticus phân lập từ vùng cửa sông ở Mỹ nhận thấy 79% số chủng mang gen tlh [11]. Ở Việt Nam, sự có mặt của 2 gen tlh và toxR trên các chủng Vibrio gây bệnh cũng đã được công bố. Nguyễn Văn Duy và Nguyễn Thị Cẩm Ly đã phân lập được 5 chủng V. parahaemolyticus trong mẫu hải sản tươi sống ở Nha Trang và cả 5 chủng này đều mang cả 2 gen tlh và toxR [12]. Tương tự, nghiên cứu của Han và cs. cho thấy 9/9 chủng V. parahaemolyticus ở Việt Nam mang cả 2 gen tlh và toxR [13]. Trong nghiên cứu của mình, chúng tôi cũng nhận thấy 2 gen trh và tdh không xuất hiện ở các mẫu nghiên cứu. Kết quả này cũng tương đồng với kết quả của Nguyễn Văn Duy và Nguyễn Thị Cẩm Ly trên loài V. parahaemolyticus trong mẫu hải sản tươi sống ở Nha Trang. Kết quả nghiên cứu của chúng tôi cho thấy có sự tương đồng nhất định giữa các chủng Vibrio gây bệnh ở Việt Nam. Các chủng thu được ở Thừa Thiên Huế có sự có mặt của các gen độc tố tương tự như các chủng thu được tại Nha Trang [12]. Các công bố trước đây cho thấy không phải chủng Vibrio nào cũng mang tất cả các gen độc tố, chẳng hạn, Mahmud và cs. nhận thấy chỉ có 18/6000 chủng V. parahaemolyticus ở Nhật Bản chứa gen tdh [9]. Bảng 2. Sự có mặt của các gen độc tố trong các chủng Vibrio gây bệnh TT Loài tlh toxR trh tdh 1 V. parahaemolyticus TX07-3/3 x x – – 2 V. shilonii TX05-3/3 x – – – 3 V. shilonii TX03-3/3 x – – – 4 V. shilonii TX02-3/3 x – – – 5 V. shilonii TX01-3/3 x – – – 6 V. shilonii TV02-3/3 x – – – 7 V. parahaemolyticus K31-X-13/6/2019 x x – – 8 V. parahaemolyticus K39-X-13/6 x x – – 9 V. communis R-PD- K4-V-13/6 x – – – 10 V. parahaemolyticus R-PD-K3-10/6 x x – – Tạp chí Khoa học Đại học Huế: Khoa học Tự nhiên Tập 129, Số 1A, 115–123, 2020 pISSN 1859-1388 eISSN 2615-9678 DOI: 10.26459/hueuni-jns.v129i1A.5621 119 TT Loài tlh toxR trh tdh 11 V. parahaemolyticus R-PD-K3-10/6 x x – – 12 V. furnissii R-K39- 13/6 x – – – 13 V. parahaemolyticus VX01 x x – – 14 V. parahaemolyticus K5 x x – – 3.2 Xác định trình tự của các gen độc tố Sau khi xác định được các chủng mang gen gây bệnh, chúng tôi chọn các gen từ chủng VX01 để phân tích trình tự các gen độc tố. Đây là chủng đầu tiên được phân lập trong các chủng mang gen pirABvr (Hình 1). Kết quả phân tích trình tự cho thấy cả 4 gen nghiên cứu đều có trình tự tương đồng 100% với các gen tương ứng của loài V. parahaemolyticus đã được công bố trên ngân hàng gen. Đối với gen pirAvp, kết quả phân tích trình tự sản phẩm PCR cho thấy trình tự nucleotide của nó dài 284 bp (Hình 2), đúng bằng kích thước lý thuyết đã công bố và tương đồng 100% với trình tự gen pirA của chủng V. parahaemolyticus CMCR003, mã số MH700243. Kết quả so sánh cũng cho thấy có ít sự sai khác giữa các gen pirA đã công bố từ các chủng Vibrio trên ngân hàng gen. Hai mươi chín trình tự đã công bố tương đồng 100% với trình tự chúng tôi thu được. Hình 1. Sản phẩm PCR các gen độc tố từ chủng V. parahaemolyticus VX01 M: DNA ladder 1 Kb marker Hình 2. Trình tự nucleotide đoạn chỉ thị gen pirAvp và trình tự đã công bố (MH700243) Hoàng Tấn Quảng và CS. 120 Đối với gen pirB, kết quả phân tích trình tự sản phẩm PCR cho thấy trình tự nucleotide của nó dài 392 bp (Hình 3) đúng như lý thuyết đã công bố và tương đồng 100% với trình tự gen pirB của chủng V. parahaemolyticus RECR004, mã số MH714301. Tương tự gen pirAvp, 27 trình tự gen pirB từ các chủng Vibrio đã công bố tương đồng 100% với trình tự của chúng tôi. Đối với gen tlh, kết quả phân tích trình tự sản phẩm PCR cho thấy trình tự nucleotide của nó dài 450 bp (Hình 4) giống như lý thuyết, tương đồng 100% với trình tự gen tlh của chủng V. parahaemolyticus ATCC 33846 (mã số GU971655). Tuy nhiên, khi so sánh trình tự thu được với gen tlh của chủng V. parahaemolyticus TS-9-11-1 (mã số JX262963), mức độ tương đồng là 99,78% (sai khác 1 nucleotide ở vị trí 347). So sánh với gen tlh của chủng V. parahaemolyticus HA2 (mã số CP023709), mức độ tương đồng là 99,56% (sai khác 2 nucleotide ở vị trí 6 và 259). Kết quả so sánh với 100 trình tự tương đồng cao nhất trên NCBI cho thấy mức độ tương đồng của gen tlh với các gen đã công bố thấp hơn so với gen pirAvp và pirBvp, trong đó chỉ có 5 trình tự tương đồng 100%. Điều này chứng tỏ gen tlh là gen có mức độ đột biến cao và không ổn định như gen pirA và pirB. So sánh với gen tlh từ chủng V. parahaemolyticus strain C1 phân lập ở Nha Trang (mã số JQ929914) [12], gen tlh của chúng tôi có mức độ tương đồng 99,56% (sai khác 2 nucleotide ở vị trí 255 và 426). Như vậy, có thể thấy gen tlh ở Việt Nam có sự khác nhau giữa các vùng. Hình 3. Trình tự nucleotide đoạn chỉ thị gen pirBvp và trình tự đã công bố (MH714301) Tạp chí Khoa học Đại học Huế: Khoa học Tự nhiên Tập 129, Số 1A, 115–123, 2020 pISSN 1859-1388 eISSN 2615-9678 DOI: 10.26459/hueuni-jns.v129i1A.5621 121 Hình 4. Trình tự nucleotide đoạn chỉ thị gen tlh và trình tự đã công bố (JQ929914) Đối với gen toxR, kết quả phân tích cho thấy trình tự nucleotide của sản phẩm PCR dài 367 bp (Hình 5) và tương đồng 100% với trình tự gen toxR của chủng V. parahaemolyticus 20130629002S01 (mã số CP020034). So sánh với gen toxR từ chủng V. parahaemolyticus strain C1 phân lập ở Nha Trang (mã số JQ929913), gen toxR của chúng tôi có mức độ tương đồng 100% [12]. Như vậy có thể thấy gen toxR ở Việt Nam không có sự sai khác giữa các vùng. Tuy nhiên, khi so sánh trình tự thu được với gen toxR của chủng V. parahaemolyticus NSTH10 (mã số KF993361), mức độ tương đồng là 99,73% (sai khác 1 nucleotide ở vị trí 76). So sánh với gen toxR của chủng V. parahaemolyticus D3112 (mã số CP034565), mức độ tương đồng là 99,45% (sai khác 2 nucleotide ở vị trí 286 và 301). Khi so sánh trình tự của chúng tôi với 100 gen toxR của các chủng Vibrio khác có mức độ tương đồng cao nhất đã công bố trên ngân hàng gen, chỉ có 7 trình tự có độ tương đồng 100%. Tương tự như gen tlh, gen toxR là một gen có mức độ đột biến cao và không ổn định như gen pirA và pirB. Hoàng Tấn Quảng và CS. 122 Hình 5. Trình tự nucleotide đoạn chỉ thị gen toxR và trình tự đã công bố (CP034565) 4 Kết luận Từ 14 chủng Vibrio mang gen pirABvp nghiên cứu, chúng tôi nhận thấy gen tlh xuất hiện ở tất cả các chủng; gen toxR xuất hiện ở 7/14 chủng trong khi các gen trh và tdh không xuất hiện trong các chủng nghiên cứu. Giải trình tự đoạn chỉ thị các gen độc tố cho thấy các gen này đều có độ tương đồng khá cao (98–100%) so với các gen đã công bố trên ngân hàng gen, trong đó 2 gen pirAvp và pirBvp ít sai khác còn các gen tlh và toxR có sự sai khác nhiều hơn. Thông tin tài trợ: Công trình được thực hiện bằng kinh phí của các đề tài cấp Bộ Giáo dục và Đào tạo năm 2018–2020, mã số CT-2018-DHH-01 và CT-2018-DHH-02. Tài liệu tham khảo 1. de la Pena LD, Cabillon NA, Catedral DD, Amar EC, Usero RC, Monotilla WD, et al. Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannamei and P. monodon cultured in the Philippines. Dis Aquat Organ. 2015;116(3):251-254. 2. Giang NTT, Toàn PV, Hùng PQ. Hội chứng hoại tử gan tụy ở tôm chân trắng (Litopenaeus vannamei) nuôi thương phẩm tại Ninh Thuận. Tạp chí Khoa học – Công nghệ Thủy sản. 2016; 1:32-40. 3. Lụa ĐT, Khuê NV, Vân PT. Non-Vibrio parahaemolyticus gây bệnh hoại tử gan tụy cấp (AHPND) trên tôm nuôi. Tạp chí Khoa học Nông nghiệp Việt Nam. 2016;14(5):690-698. 4. Han JE, Tang KFJ, Tran LH, Lightner DV. Photorhabdus insect-related (Pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp. Diseases of Aquatic Organisms. 2015;113(1):33-40. 5. Lee CT, Chen IT, Yang YT, Ko TP, Huang YT, Huang JY, et al. The opportunistic marine pathogen Vibrio parahaemolyticus becomes virulent by acquiring a plasmid that expresses a deadly toxin. Proceedings of the National Academy of Sciences. 2015;112(34):10798. 6. Sirikharin R, Taengchaiyaphum S, Sanguanrut P, Chi TD, Mavichak R, Proespraiwong P, et al. Characterization and PCR detection of binary, Pir-like toxins from Vibrio parahaemolyticus Isolates that cause Acute Hepatopancreatic Necrosis Disease (AHPND) in shrimp. PLOS ONE. 2015;10(5): e0126987. Tạp chí Khoa học Đại học Huế: Khoa học Tự nhiên Tập 129, Số 1A, 115–123, 2020 pISSN 1859-1388 eISSN 2615-9678 DOI: 10.26459/hueuni-jns.v129i1A.5621 123 7. Yang YT, Chen IT, Lee CT, Chen CY, Lin SS, Hor LI, et al. Draft genome sequences of four strains of Vibrio parahaemolyticus, three of which cause early mortality syndrome/Acute Hepatopancreatic Necrosis Disease in shrimp in China and Thailand. Genome Announc. 2014;2(5):e00816-14. 8. Nishibuchi M, Kaper JB. Thermostable direct hemolysin gene of Vibrio parahaemolyticus: a virulence gene acquired by a marine bacterium. Infect Immun. 1995;63(6):2093-2099. 9. Mahmud HZ, Kassu A, Mohammad A, Yamato M, Bhuiyan NA, Balakrish Nair G, et al. Isolation and molecular characterization of toxigenic Vibrio parahaemolyticus from the Kii Channel, Japan. Microbiological Research. 2006;161(1):25-37. 10. Kim YB, Okuda J, Matsumoto C, Takahashi N, Hashimoto S, Nishibuchi M. Identification of Vibrio parahaemolyticus strains at the species level by PCR targeted to the toxR gene. Journal of Clinical Microbiology. 1999;37(4):1173-1177. 11. Gutierrez West CK, Klein SL, Lovell CR. High frequency of virulence factor genes tdh, trh, and tlh in Vibrio parahaemolyticus strains isolated from a pristine estuary. Applied and Environmental Microbiology. 2013;79(7):2247-2252. 12. Duy NV, Ly NTC. Phân lập và xác định gen độc tố của Vibrio parahaemolyticus trong hải sản tươi sống ở Nha Trang. Tạp chí Khoa học-Công nghệ thủy sản. 2012;2:42-47. 13. Han JE, Mohney LL, Tang KFJ, Pantoja CR, Lightner DV. Plasmid mediated tetracycline resistance of Vibrio parahaemolyticus associated with acute hepatopancreatic necrosis disease (AHPND) in shrimps. Aquaculture Reports. 2015;2:17-21.
File đính kèm:
 xac_dinh_su_co_mat_cua_cac_gen_doc_to_o_cac_chung_vibrio_gay.pdf
xac_dinh_su_co_mat_cua_cac_gen_doc_to_o_cac_chung_vibrio_gay.pdf

