Sinh trưởng, hiệu quả sử dụng thức ăn và thành phần sinh hóa của cá chim (Trachinotus blochii) cho ăn thức ăn có bổ sung protein thủy phân cá ngừ
TÓM TẮT Thí nghiệm được tiến hành nhằm đánh giá ảnh hưởng protein thủy phân cá ngừ (VTH) bổ sung trong thức ăn lên sinh trưởng, hiệu quả sử dụng thức ăn và thành phần sinh hóa của chim giai đoạn giống. Thức ăn thí nghiệm được triển khai với 5 loại thức ăn (protein thô: 46,5%, lipid: 10%) tương ứng bổ sung 0; 3; 6; 9 và 12% nội tạng cá ngừ thủy phân. Cá chim (5,48 g/con) được bố trí ngẫu nhiên vào trong 15 bể composit và cho ăn tới khi thỏa mãn trong 8 tuần. Kết quả nghiên cứu cho thấy, tốc độ tăng trưởng và hiệu quả sử dụng thức ăn của cá chim đạt cao nhất khi cho ăn thức ăn có 6% dịch thủy phân cá ngừ. Không có sai khác về tỷ lệ sống của cá chim ở các nghiệm thức khác nhau. Tăng mức bổ sung VTH từ 0 lên 12% không làm ảnh hưởng đến hàm lượng protein thô, lipid thô và tro của cá chim. Không có sự sai khác ý nghĩa về các chỉ số huyết học trong máu cá chim ở các nghiệm thức khác nhau, ngoại trừ hàm lượng protein trong máu cá chim cho ăn thức ăn có 9% VTH thấp hơn so với nghiệm thức đối chứng. Tóm lại, bổ sung VTH ở mức 6% trong thức ăn là tối ưu cho sinh trưởng của cá chim giai đoạn giống

Trang 1

Trang 2

Trang 3
Trang 4

Trang 5
Trang 6

Trang 7

Trang 8
Tóm tắt nội dung tài liệu: Sinh trưởng, hiệu quả sử dụng thức ăn và thành phần sinh hóa của cá chim (Trachinotus blochii) cho ăn thức ăn có bổ sung protein thủy phân cá ngừ

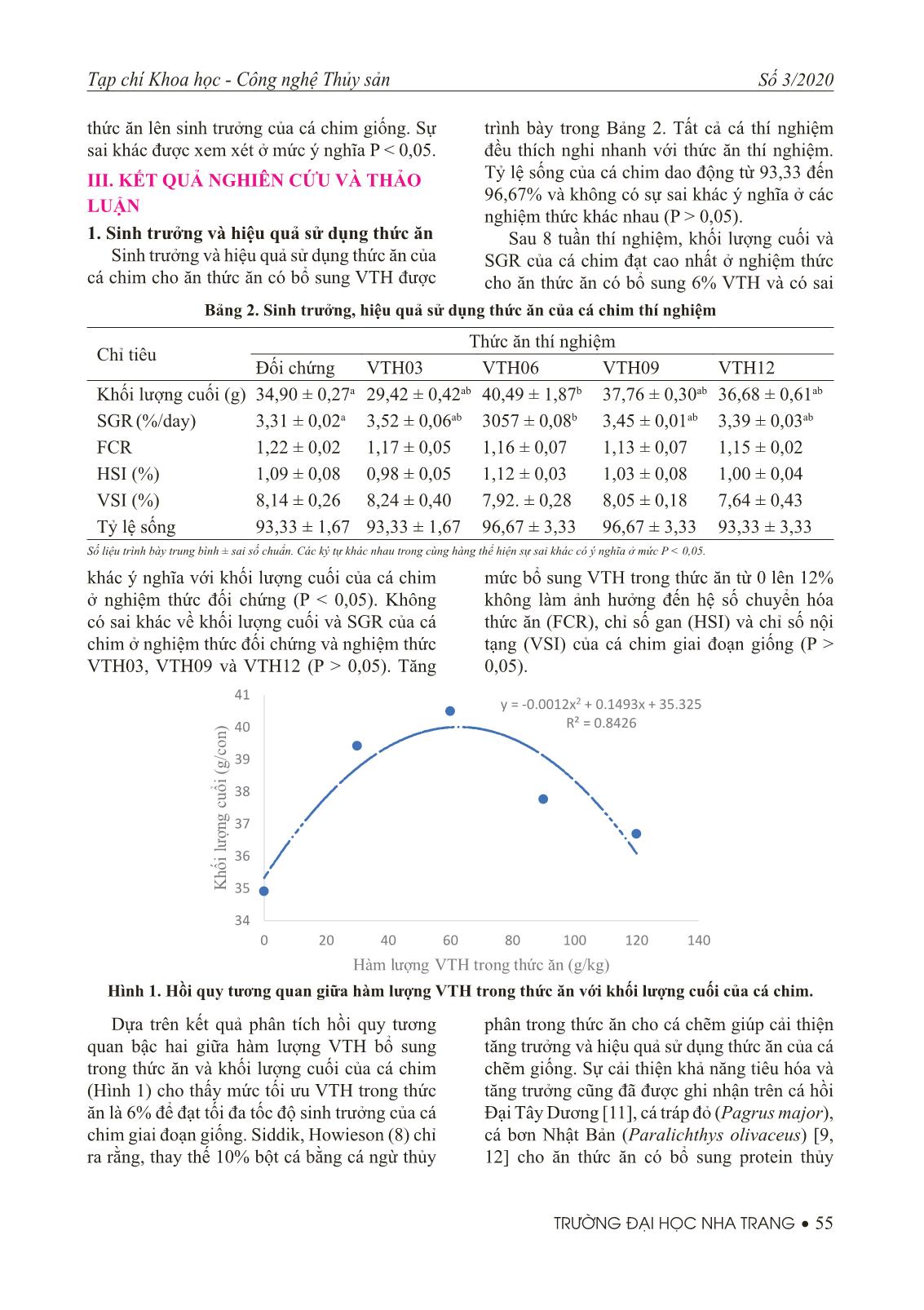
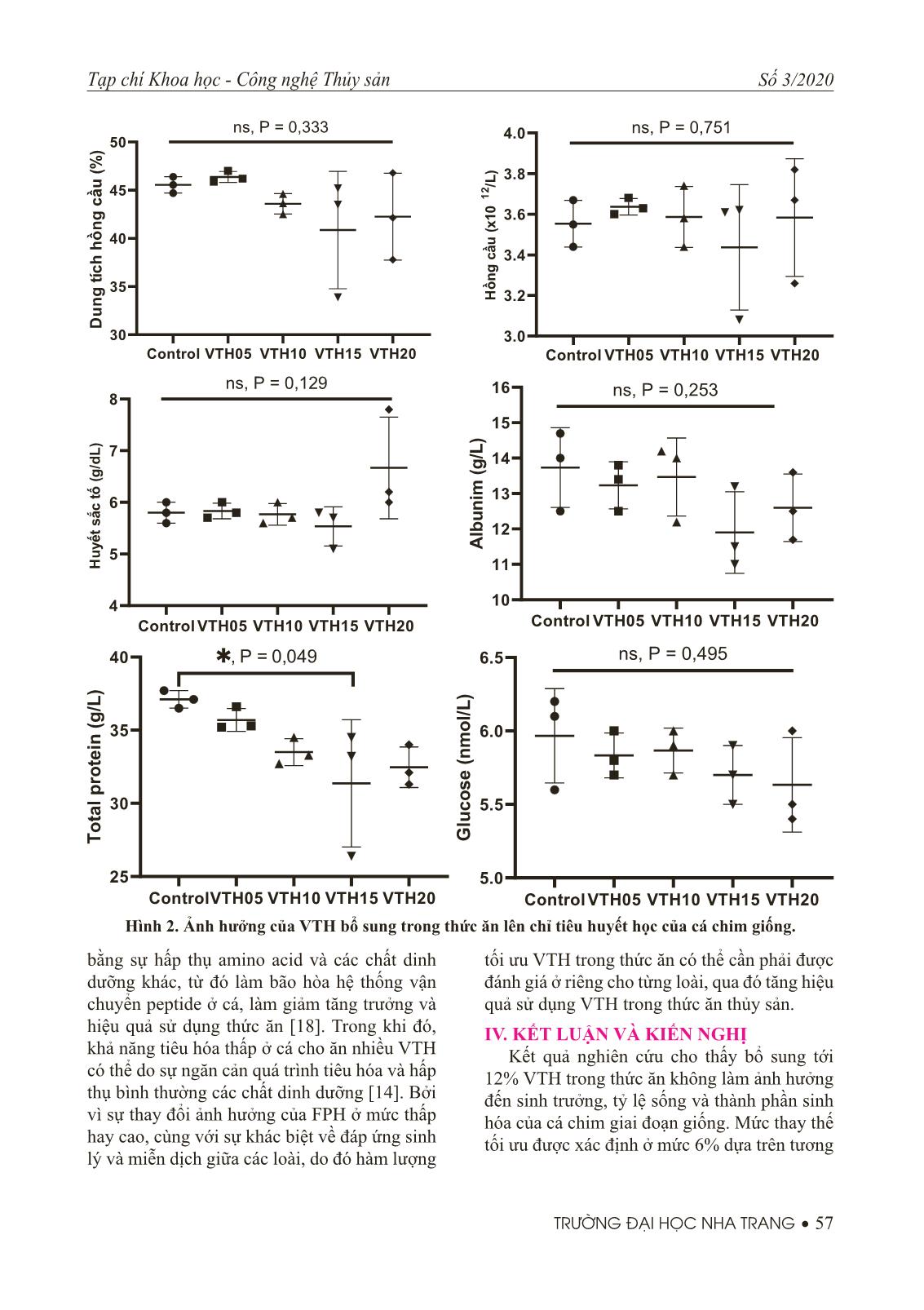
ệm Cá chim giống (trung bình 5,48 g/con) được bố trí ngẫu nhiên vào 15 bể composite (500 L/bể) với mật độ thả 20 con/bể. Mỗi nghiệm thức thức ăn được phân bố ngẫu nhiên vào 3 bể. Tất cả các bể được kết nối với hệ thống cấp nước mặn để duy trì dòng chảy liên tục ở mức 5 L/phút. Cá được cho ăn bằng tay, 2 lần/ngày vào lúc 8h00 và 16h00 cho đến khi thỏa mãn. Thức ăn thừa được siphon sau khi cho ăn 30 phút và bảo quản trong tủ đông để tính toán hiệu quả sử dụng thức ăn. Thời gian thí nghiệm sinh trưởng kéo dài 8 tuần. 3. Thu và phân tích mẫu Sau 8 tuần thí nghiệm, tất cả cá được cân và đo riêng từng con. Số cá thể (3 con) từ mỗi bể được thu để phân tích thành phần sinh hóa. Mẫu máu từ 03 cá thể trong mỗi bể được hút từ tĩnh mạch đuôi bằng kim tiêm và chuyển vào trong các tuýp đựng mẫu có chứa chất chống đông để phân tích công thức máu. Thành phần sinh hóa như protein, lipid, tro, độ ẩm của thức ăn, mẫu cá được phân tích theo phương pháp mô tả bởi AOAC (1990). Protein thô theo phương pháp Kjeldahl, lipid thô theo phương pháp Blind & Dyer, tro được xác định bằng sấy mẫu ở 105ºC đến khối lượng không đổi, tro được xác định bằng nung mẫu ở 550ºC đến khối lượng không đổi. Công thức máu được phân tích tự động bằng máy phân tích huyết học (Sysmex XT-162 1800i, Kobe, Japan). 4. Phương pháp xử lý số liệu Tỷ lệ sống: Trong đó: N t : là số cá tại thời điểm t; N0: Số cá thả ban đầu Tốc độ tăng trưởng đặc trưng (SGR%/ngày) Trong đó: W1, W2 là khối lượng cá lúc bắt đầu và kết thúc thí nghiệm t: là thời gian thí nghiệm (ngày) Hệ số chuyển hoá thức ăn (FCR) Trong đó: Wtasd: là khối lượng thức ăn sử dụng (g, theo khối lượng khô) WG: là khối lượng cá tăng thêm (g, theo khối lượng tươi) Chỉ số gan (HSI) = 100 × khối lượng gan/ khối lượng cá Chỉ số nội tạng (VSI) = 100 × khối lượng nội tạng/khối lượng cá Số liệu trình bày ở dạng trung bình ± sai số chuẩn (SE). Số liệu được phân tích bằng phương pháp phân tích phương sai một nhân tố One-way ANOVA. Sự sai khác (nếu có) giữa các nghiệm thức được xác định bằng phép thử Turkey’s HSD multiple comparison post hoc tests (SPSS version 22, IBM, USA). Tương quan hồi quy sẽ được sử dụng để biểu thị mối liên hệ giữa hàm lượng protein thủy phân trong Nguyên liệu (g/kg) Thức ăn thí nghiệm Đối chứng VTH03 VTH06 VTH09 VTH12 CaCO3 2 2 2 2 2 Dicalcium phosphate 3 3 3 3 3 NaCl 5 5 5 5 5 Proximate compositions Vật chất khô 911.08 913.40 897.10 882.90 904.40 Protein thô 465.60 466.40 468.50 462.40 467.10 Lipid thô 114.20 119.40 113.50 110.70 109.70 Tro 81.00 70.90 64.60 57.20 45.30 Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 55 thức ăn lên sinh trưởng của cá chim giống. Sự sai khác được xem xét ở mức ý nghĩa P < 0,05. III. KẾT QUẢ NGHIÊN CỨU VÀ THẢO LUẬN 1. Sinh trưởng và hiệu quả sử dụng thức ăn Sinh trưởng và hiệu quả sử dụng thức ăn của cá chim cho ăn thức ăn có bổ sung VTH được trình bày trong Bảng 2. Tất cả cá thí nghiệm đều thích nghi nhanh với thức ăn thí nghiệm. Tỷ lệ sống của cá chim dao động từ 93,33 đến 96,67% và không có sự sai khác ý nghĩa ở các nghiệm thức khác nhau (P > 0,05). Sau 8 tuần thí nghiệm, khối lượng cuối và SGR của cá chim đạt cao nhất ở nghiệm thức cho ăn thức ăn có bổ sung 6% VTH và có sai Bảng 2. Sinh trưởng, hiệu quả sử dụng thức ăn của cá chim thí nghiệm Chỉ tiêu Thức ăn thí nghiệm Đối chứng VTH03 VTH06 VTH09 VTH12 Khối lượng cuối (g) 34,90 ± 0,27a 29,42 ± 0,42ab 40,49 ± 1,87b 37,76 ± 0,30ab 36,68 ± 0,61ab SGR (%/day) 3,31 ± 0,02a 3,52 ± 0,06ab 3057 ± 0,08b 3,45 ± 0,01ab 3,39 ± 0,03ab FCR 1,22 ± 0,02 1,17 ± 0,05 1,16 ± 0,07 1,13 ± 0,07 1,15 ± 0,02 HSI (%) 1,09 ± 0,08 0,98 ± 0,05 1,12 ± 0,03 1,03 ± 0,08 1,00 ± 0,04 VSI (%) 8,14 ± 0,26 8,24 ± 0,40 7,92. ± 0,28 8,05 ± 0,18 7,64 ± 0,43 Tỷ lệ sống 93,33 ± 1,67 93,33 ± 1,67 96,67 ± 3,33 96,67 ± 3,33 93,33 ± 3,33 Số liệu trình bày trung bình ± sai số chuẩn. Các ký tự khác nhau trong cùng hàng thể hiện sự sai khác có ý nghĩa ở mức P < 0,05. khác ý nghĩa với khối lượng cuối của cá chim ở nghiệm thức đối chứng (P < 0,05). Không có sai khác về khối lượng cuối và SGR của cá chim ở nghiệm thức đối chứng và nghiệm thức VTH03, VTH09 và VTH12 (P > 0,05). Tăng Hình 1. Hồi quy tương quan giữa hàm lượng VTH trong thức ăn với khối lượng cuối của cá chim. mức bổ sung VTH trong thức ăn từ 0 lên 12% không làm ảnh hưởng đến hệ số chuyển hóa thức ăn (FCR), chỉ số gan (HSI) và chỉ số nội tạng (VSI) của cá chim giai đoạn giống (P > 0,05). Dựa trên kết quả phân tích hồi quy tương quan bậc hai giữa hàm lượng VTH bổ sung trong thức ăn và khối lượng cuối của cá chim (Hình 1) cho thấy mức tối ưu VTH trong thức ăn là 6% để đạt tối đa tốc độ sinh trưởng của cá chim giai đoạn giống. Siddik, Howieson (8) chỉ ra rằng, thay thế 10% bột cá bằng cá ngừ thủy phân trong thức ăn cho cá chẽm giúp cải thiện tăng trưởng và hiệu quả sử dụng thức ăn của cá chẽm giống. Sự cải thiện khả năng tiêu hóa và tăng trưởng cũng đã được ghi nhận trên cá hồi Đại Tây Dương [11], cá tráp đỏ (Pagrus major), cá bơn Nhật Bản (Paralichthys olivaceus) [9, 12] cho ăn thức ăn có bổ sung protein thủy 56 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 phân từ cá biển. Điều này có thể là do sự thích hợp của các amino acid tự do và các peptide được tạo ra trong quá trình thủy phân enzyme [8]. Các peptide nhỏ này dễ tiêu hóa và hấp thụ qua gờ bàn chải của tế bào ruột hơn các protein chưa thủy phân, qua đó cải thiện tiêu hóa ở cá. Những kết quả từ các nghiên cứu này cho thấy sinh trưởng, tiêu hóa, chức năng miễn dịch và khả năng chống lại các tác nhân gây bệnh ở cá có thể được cải thiện thông qua việc bổ sung một lượng FPH thích hợp trong thức ăn. 2. Thành phần sinh hóa Thành phần sinh hóa của cá chim được trình bày trong Bảng 3. Hàm lương protein thô, lipid thô và tro của cá chim không bị ảnh hưởng bởi việc bổ sung VTH trong thức ăn (P > 0,05). Tuy nhiên độ ẩm của cá chim cho ăn thức ăn đối chứng thấp hơn có ý nghĩa so với độ ẩm của cá chim cho ăn thức ăn có bổ sung VTH (P < 0,05). Theo Bui, Khosravi [13], bổ sung các nguồn protein thủy phân từ tôm biển, cá rô phi ở mức 42g/kg thức ăn không làm ảnh hưởng đến thành phần sinh hóa của cá tráp đỏ. Những kết quả tương tự cũng được ghi nhận trên cá chẽm, cá bơn khi cho ăn thức ăn có bổ sung lượng nhỏ protein thủy phân từ cá biển [14]. Dịch thủy phân cá biển thường có hàm lượng protein tương đương với bột cá và chỉ được sử dụng một lượng nhỏ trong thức ăn để kích thích bắt mồi, tăng sức đề kháng của đối tượng nuôi, do đó ít có tác động lên thành phần sinh hóa của đối tượng nuôi. Bảng 3. Thành phần sinh hóa của cá chim thí nghiệm Chỉ tiêu Thức ăn thí nghiệm Đối chứng VTH03 VTH06 VTH09 VTH12 Độ ẩm 66,20 ± 0,43a 68,05 ± 0,28b 66,95 ± 0,80b 68,42 ± 0,17b 66,90 ± 0,34b Protein thô 17,35 ± 0,13 17,16 ± 0,18 17,81 ± 0,40 16,87 ± 0,18 16,91 ± 0,33 Lipid thô 11,22 ± 0,05 10,62 ± 0,32 10,50 ± 0,38 9,86 ± 0,723 11,12 ± 0,18 Tro 4,30 ± 0,08 4,20 ± 0,09 4,29 ± 0,12 4,29 ± 0,03 4,27 ± 0,24 Số liệu trình bày trung bình ± sai số chuẩn. Các ký tự khác nhau trong cùng hàng thể hiện sự sai khác có ý nghĩa ở mức P < 0,05. 3. Công thức máu Thức ăn có bổ sung VTH không làm ảnh hưởng đến công thức máu bao gồm: dung tích hồng cầu, huyết sắc tố, hồng cầu của cá chim giai đoạn giống (P > 0,05). Tương tự, hàm lượng glucose huyết tương và albumin của cá chim cũng không có sự sai khác giữa các nghiệm thức thí nghiệm (P > 0,05). Tuy nhiên, hàm lượng protein huyết tương giảm có ý nghĩa ở cá chim cho ăn thức ăn VTH09 so với cá chim ở nghiệm thức đối chứng (P < 0,05). Theo Siddik, Howieson (15), cá chẽm giống cho ăn thức ăn có bổ sung 12,2% VTH không có sự khác biệt về các chỉ tiêu huyết học và một số chỉ tiêu sinh hóa máu như (protein tổng số, albumin, globumin, glucose huyết tương). Vai trò quan trọng của các peptide có hoạt tính miễn dịch trong protein thủy phân từ cá (FPH) trong việc tăng cường hệ miễn dịch tự nhiên đã được ghi nhận ở một số loài. Những ảnh hưởng tích cực của FPH lên hệ miễn dịch có thể giúp cải thiện cơ chế phòng vệ chống lại các tác nhân gây hại, thúc đẩy hoạt tính của lysosomal enzyme, tăng hoạt hóa bổ thể qua con đường nhánh và cải thiện hoạt tính của các chất chống oxy hóa [8, 16]. Mặc dù những ảnh hưởng tích cực lên sinh trưởng và chức năng miễn dịch đã được ghi nhận ở cá cho ăn thức ăn có bổ sung FPH, tuy nhiên một vài nghiên cứu cũng chỉ ra rằng sử dụng hàm lượng FPH cao trong thức ăn có thể gây ra những ảnh hưởng tiêu cực đến động vật thủy sản. Kim, Jung (17) cho biết sự giảm tăng trưởng và hiệu quả sử dụng thức ăn ở cá bơn giống khi cho ăn thức ăn có trên 30% VTH. Thức ăn có hàm lượng VTH cao cũng làm giảm tăng trưởng, sử dụng thức ăn, tiêu hóa, tăng sự tích lũy lipid và hoại tử mô gan ở cá chẽm giống [14]. Các VTH thường chứa nhiều các peptide mạch ngắn và các amino acid tự do, dẫn đến có thể gây ra sự bão hòa trong cơ chế vận chuyển peptide, đồng thời làm mất cân Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 57 bằng sự hấp thụ amino acid và các chất dinh dưỡng khác, từ đó làm bão hòa hệ thống vận chuyển peptide ở cá, làm giảm tăng trưởng và hiệu quả sử dụng thức ăn [18]. Trong khi đó, khả năng tiêu hóa thấp ở cá cho ăn nhiều VTH có thể do sự ngăn cản quá trình tiêu hóa và hấp thụ bình thường các chất dinh dưỡng [14]. Bởi vì sự thay đổi ảnh hưởng của FPH ở mức thấp hay cao, cùng với sự khác biệt về đáp ứng sinh lý và miễn dịch giữa các loài, do đó hàm lượng tối ưu VTH trong thức ăn có thể cần phải được đánh giá ở riêng cho từng loài, qua đó tăng hiệu quả sử dụng VTH trong thức ăn thủy sản. IV. KẾT LUẬN VÀ KIẾN NGHỊ Kết quả nghiên cứu cho thấy bổ sung tới 12% VTH trong thức ăn không làm ảnh hưởng đến sinh trưởng, tỷ lệ sống và thành phần sinh hóa của cá chim giai đoạn giống. Mức thay thế tối ưu được xác định ở mức 6% dựa trên tương Hình 2. Ảnh hưởng của VTH bổ sung trong thức ăn lên chỉ tiêu huyết học của cá chim giống. 58 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 quan hồi quy bậc hai giữa SGR và mức VTH trong thức ăn. Các nghiên cứu tiếp theo cần xác định ảnh hưởng của việc bổ sung protein thủy phân lên miễn dịch và khả năng kháng bệnh của cá chim. LỜI CẢM ƠN Nghiên cứu này được tài trợ bởi Quỹ Phát triển khoa học và công nghệ Quốc gia (NAFOSTED) trong đề tài mã số 106.05- 2019.46 TÀI LIỆU THAM KHẢO 1. Vo B, V, Bui DP, Nguyen HQ, Fotedar R. Optimized fermented lupin (Lupinus angustifolius) inclusion in juvenile barramundi (Lates calcarifer) diets. Aquaculture. 2015;444:62-9. 2. Gatlin DM, Barrows FT, Brown P, Dabrowski K, Gaylord TG, Hardy RW, et al. Expanding the utilization of sustainable plant products in aquafeeds: a review. Aquaculture Research. 2007;38(6):551-79. 3. Olsen RL, Hasan MR. A limited supply of fi shmeal: Impact on future increases in global aquaculture production. Trends in Food Science & Technology. 2012;27(2):120-8. 4. Hardy RW. Utilization of plant proteins in fi sh diets: effects of global demand and supplies of fi shmeal. Aquaculture Research. 2010;41(5):770-6. 5. Hsu K-C. Purifi cation of antioxidative peptides prepared from enzymatic hydrolysates of tuna dark muscle by-product. Food Chemistry. 2010;122(1):42-8. 6. Chalamaiah M, Dinesh kumar B, Hemalatha R, Jyothirmayi T. Fish protein hydrolysates: Proximate composition, amino acid composition, antioxidant activities and applications: A review. Food Chemistry. 2012;135(4):3020-38. 7. Neklyudov AD, Ivankin AN, Berdutina AV. Properties and uses of protein hydrolysates (Review). Applied Biochemistry and Microbiology. 2000;36(5):452-9. 8. Siddik MA, Howieson J, Partridge GJ, Fotedar R, Gholipourkanani H. Dietary tuna hydrolysate modulates growth performance, immune response, intestinal morphology and resistance to Streptococcus iniae in juvenile barramundi, Lates calcarifer. Scientifi c Reports. 2018;8(1):15942. 9. Khosravi S, Bui HTD, Herault M, Fournier V, Kim K-D, Lee B-J, et al. Supplementation of Protein Hydrolysates to a Low-fi shmeal Diet Improves Growth and Health Status of Juvenile Olive Flounder, Paralichthys olivaceus. Journal of the World Aquaculture Society. 2018;49(5):897-911. 10. Tang H-g, Wu T-x, Zhao Z-y, Pan X-d. Effects of fi sh protein hydrolysate on growth performance and humoral immune response in large yellow croaker (Pseudosciaena crocea R.). Journal of Zhejiang University SCIENCE B. 2008;9(9):684-90. 11. HEVRØY EM, ESPE M, WAAGBØ R, SANDNES K, RUUD M, HEMRE G-I. Nutrient utilization in Atlantic salmon (Salmo salar L.) fed increased levels of fi sh protein hydrolysate during a period of fast growth. Aquaculture Nutrition. 2005;11(4):301-13. 12. Khosravi S, Bui HTD, Rahimnejad S, Herault M, Fournier V, Kim S-S, et al. Dietary supplementation of marine protein hydrolysates in fi sh-meal based diets for red sea bream (Pagrus major) and olive fl ounder (Paralichthys olivaceus). Aquaculture. 2015;435:371-6. Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 59 13. Bui HTD, Khosravi S, Fournier V, Herault M, Lee K-J. Growth performance, feed utilization, innate immunity, digestibility and disease resistance of juvenile red seabream (Pagrus major) fed diets supplemented with protein hydrolysates. Aquaculture. 2014;418-419:11-6. 14. Siddik MAB, Howieson J, Ilham I, Fotedar R. Growth, biochemical response and liver health of juvenile barramundi (Lates calcarifer) fed fermented and non-fermented tuna hydrolysate as fi shmeal protein replacement ingredients. PeerJ. 2018;6:e4870. 15. Siddik MAB, Howieson J, Partridge GJ, Fotedar R, Gholipourkanani H. Dietary tuna hydrolysate modulates growth performance, immune response, intestinal morphology and resistance to Streptococcus iniae in juvenile barramundi, Lates calcarifer. Scientifi c Reports. 2018;8(1):15942. 16. Murray AL, Pascho RJ, Alcorn SW, Fairgrieve WT, Shearer KD, Roley D. Effects of various feed supplements containing fi sh protein hydrolysate or fi sh processing by-products on the innate immune functions of juvenile coho salmon (Oncorhynchus kisutch). Aquaculture. 2003;220(1):643-53. 17. Kim HS, Jung W-G, Myung SH, Cho SH, Kim DS. Substitution effects of fi shmeal with tuna byproduct meal in the diet on growth, body composition, plasma chemistry and amino acid profi les of juvenile olive fl ounder (Paralichthys olivaceus). Aquaculture. 2014;431:92-8. 18. Carvalho AP, Sá R, Oliva-Teles A, Bergot P. Solubility and peptide profi le affect the utilization of dietary protein by common carp (Cyprinus carpio) during early larval stages. Aquaculture. 2004;234(1):319-33.
File đính kèm:
 sinh_truong_hieu_qua_su_dung_thuc_an_va_thanh_phan_sinh_hoa.pdf
sinh_truong_hieu_qua_su_dung_thuc_an_va_thanh_phan_sinh_hoa.pdf

