Sàng lọc các dòng nấm men mang gen VP28 thích hợp để sản xuất tolerine phòng bệnh đốm trắng trên tôm nuôi
TÓM TẮT
Việc sử dụng tế bào nấm men Pichia pastoris làm hệ thống biểu hiện protein tái tổ hợp đã được
nghiên cứu và sản xuất nhiều loại vaccine phòng bệnh cho động vật có xương sống nhưng được vận
dụng hạn chế trong nghiên cứu bệnh thủy sản nói chung và bệnh tôm nói riêng. Nghiên cứu này tiến
hành sàng lọc 150 chủng nấm men Pichia pastoris có mang gen mã hóa protein vỏ VP28 của virus
đốm trắng nhằm tạo nguyên liệu cho sản xuất toreline phòng bệnh đốm trắng cho tôm nuôi. Các
chủng nấm men được chọn lọc dựa trên kiểu hình (Mut+), số lượng bản sao gen mục tiêu, khả năng
biểu hiện protein và tốc độ sinh trưởng. Quá trình sàng lọc đã chọn được 125 chủng mang kiểu hình
Mut+, 82 chủng có mang 14-16 bản sao của gene VP28-His trong genome và 8 chủng có khả năng
biểu hiện protein tốt. Trong 8 chủng chọn lọc, chủng 11 cho tốc độ sinh trưởng nhanh, đạt mật độ
tế bào cao nhất (3,92x109 tế bào/ml) và lượng protein VP28 nhiều nhất sau 84 giờ kích thích biểu
hiện. Chủng này được dùng làm nguyên liệu để điều chế toreline phòng bệnh đốm trắng trong các
nghiên cứu tiếp theo.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5
Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Sàng lọc các dòng nấm men mang gen VP28 thích hợp để sản xuất tolerine phòng bệnh đốm trắng trên tôm nuôi

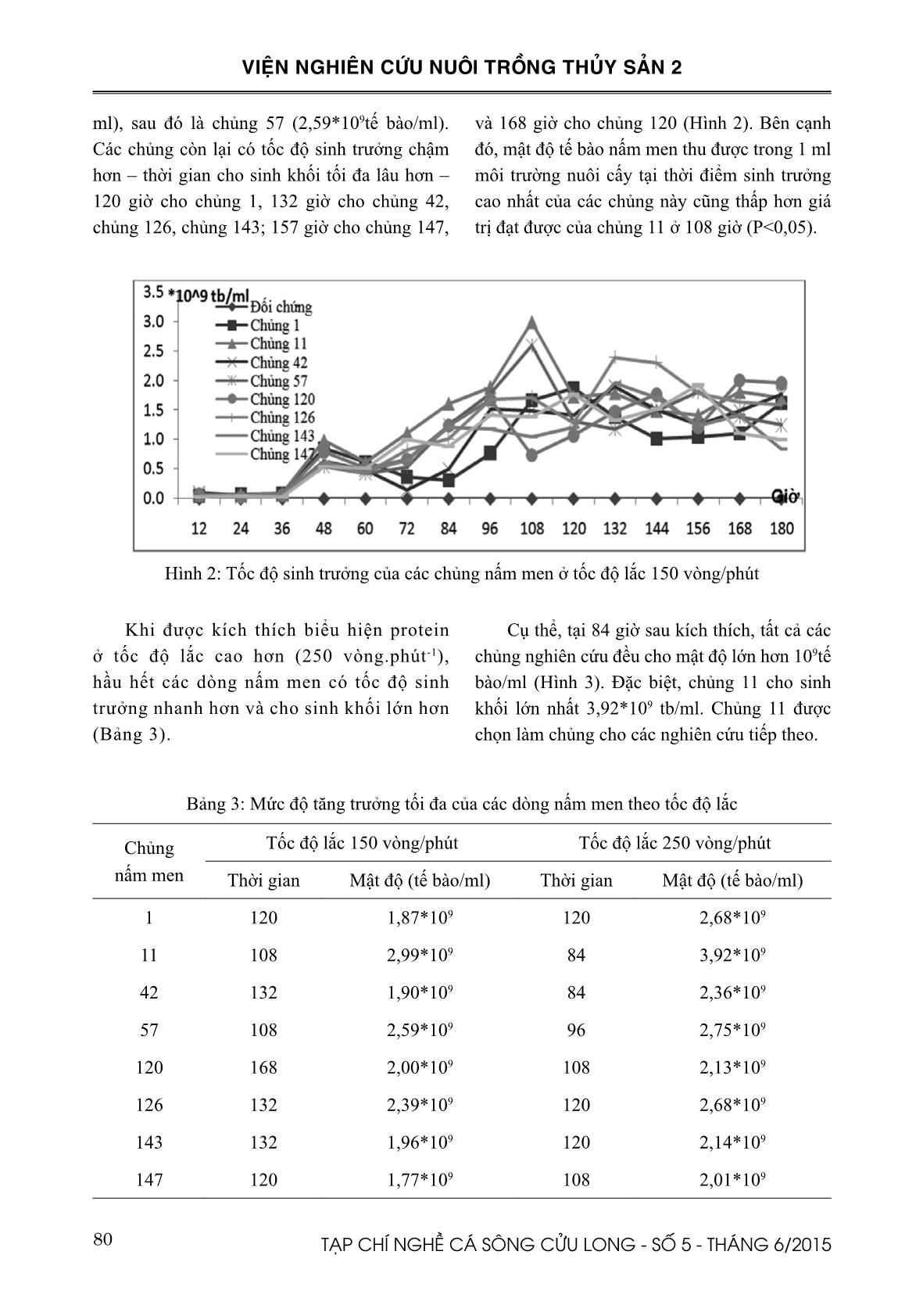
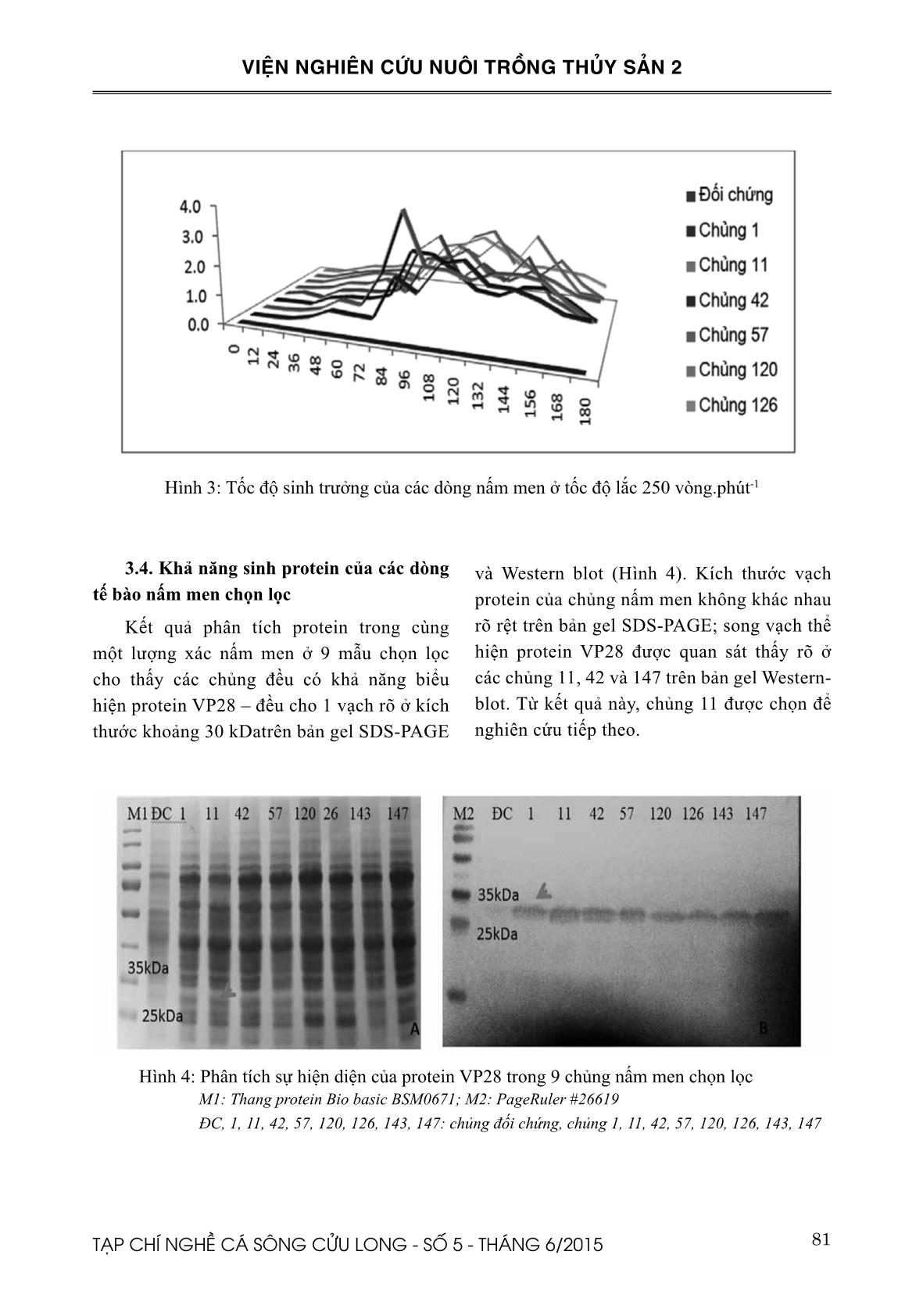
chọn lọc cho thấy các chủng đều có khả năng biểu hiện protein VP28 – đều cho 1 vạch rõ ở kích thước khoảng 30 kDatrên bản gel SDS-PAGE và Western blot (Hình 4). Kích thước vạch protein của chủng nấm men không khác nhau rõ rệt trên bản gel SDS-PAGE; song vạch thể hiện protein VP28 được quan sát thấy rõ ở các chủng 11, 42 và 147 trên bản gel Western- blot. Từ kết quả này, chủng 11 được chọn để nghiên cứu tiếp theo. Hình 4: Phân tích sự hiện diện của protein VP28 trong 9 chủng nấm men chọn lọc M1: Thang protein Bio basic BSM0671; M2: PageRuler #26619 ĐC, 1, 11, 42, 57, 120, 126, 143, 147: chủng đối chứng, chủng 1, 11, 42, 57, 120, 126, 143, 147 25kDa3 82 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 5 - THÁNG 6/2015 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Lượng protein VP28 được chủng 11 biểu hiện theo thời gian được xác định theo thời gian sau kích thích biểu hiện: 0, 12, 24, 36, 48, 60, 72 và 84 giờ. Kết quả cho thấy lượng protein VP28 được tạo ra tăng dần theo thời gian kích thích; lượng protein cao nhất đạt tại 84 giờ (Hình 5). Hình 5: Sự hiện diện của protein VP28 theo thời gian trong xác tế bào nấm men chủng 11 M: Thang PageRuler #26619 ĐC: chủng đối chứng ở 84 giờ 0, 12, 24, 36, 48, 60, 72, 84 chủng 11 ở các giờ 0, 12, 24, 36, 48, 60, 72, 84 sau biểu hiện IV. THẢO LUẬN Việc sử dụng tế bào nấm men để sản xuất vaccine phòng bệnh cho động vật trên cạn đã được nghiên cứu rộng rãi như bệnh Gumboro trên gà (infectious bursal disease), dịch tiêu chảy cấp trên lợn (porcine epidemic diarrhea), bệnh sốt lợn cổ điển (classical swine fever), bệnh do virus viêm gan B trên người,(Eda Celik và Pinar Calik, 2012; Rabert et al., 2013; Shin và Yoo, 2013); tuy nhiên ứng dụng này còn chưa được sử dụng nhiều trong nuôi trồng thủy sản, đặc biệt là trong việc chế tạo vaccine phòng bệnh cho tôm nuôi. Hiện nay, mới chỉ có hai nhóm nghiên cứu sử dụng tế bào nấm men P. pastoris để dòng hóa gen mã hóa protein vỏ: VP19, VP28, VP26 (Jha et al., 2007; Jha et al., 2006a; Wang, 2009), VP37 (Liu et al., 2006), và protein PmRab7 – a shrimp WSSV-binding protein - (Jupatanakul et al., 2010) trong phòng bệnh đốm trắng cho crayfish và tôm nuôi. Trong nghiên cứu này, gen mã hóa protein vỏ VP 28 đã được dòng hóa vào tế bào nấm men và việc sàng lọc 150 chủng nấm men từ 03 đợt dòng hóa khác nhau đã cho 9 chủng có biểu hiện protein VP28 tốt trong tế bào. Chín chủng này đều cho vạch protein đặc hiệu cho VP28 ở khoảng 30 kDa trên bản gel SDS-PAGE và Western-blot. Kết quả này tương tự như kết quả của Wang (2009) khi tác giả đã xác định được vạch khoảng 30 kDa trên bản gel của các dòng nấm men P.pastoris có chứa gen mã hóa protein vỏ VP28. Trong khi đó Jha et al., (2007) lại xác định được vạch ở vị trí 35 kDa trên bản gel phân tách protein của SDS-PAGE và Western- blot. Sự khác biệt về giá trị trọng lượng thực của protein (28 kDa) và giá trị được xác định (30 kDa, hoặc 35 kDa) có thể do việc gắn thêm các nucleotide mã hóa các axit amin của histaq hoặc do quá trình đường hóa (glycosylation) hay phospo hóa (phosphorylation) – những hiện tượng thường gặp khi sử dụng tế bào nấm men làm hệ thống biểu hiện. Kết quả biểu hiện protein của các chủng nấm men chọn lọc đã cho thấy chủng 11 có tốc độ sinh trưởng nhanh nhất, cho mật độ tế bào lớn trong thời gian ngắn. Cụ thể, ở điều kiện 280C, nồng độ methanol bổ sung 2%, tốc độ lắc 250 vòng.phút-1, chủng nấm men 11, nuôi cấy trong erlen 500 ml đạt mật độ tế bào tối đa tại 84 giờ sau kích thích biểu hiện. Trong các trường hợp nuôi cấy trong nồi lên men ở tốc độ khuấy tương tự (250 vòng/phút), tốc độ sinh trưởng của nấm men nhanh hơn, đạt mật độ tế bào tối đa ở 72 giờ (Asada et al., 2011; Cai et al., 2014). Trong phần lớn các nghiên cứu về tốc độ sinh trưởng của nấm men, tốc độ sinh trưởng của nấm men được tính toán dựa trên giá trị OD600 của dung dịch nuôi cấy theo thời gian; trong nghiên cứu này giá trị OD600 của các chủng cũng được xác định (không trình bày trong bài) nhưng không tìm thấy sự sai khác giữa các chủng nghiên cứu, 83TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 5 - THÁNG 6/2015 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 vì vậy tốc độ tăng trưởng được xác định bằng cách đếm trực tiếp khuẩn lạc nấm men thông qua phương pháp trang đĩa dịch nuôi cấy ở các nồng độ pha loãng khác nhau. Hơn thế nữa, phần lớn các tài liệu đều xác định việc tăng trưởng của chủng nấm men sau dòng hóa trong điều kiện sử dụng nồi lên men trong khi nghiên cứu này được tiến hành trên erlen 500 ml nên một số yếu tố môi trường như pH, nồng độ methanol, hàm lượng oxy không được kiểm soát chặt chẽ, do đó có thể làm ảnh hưởng đến mật độ tế bào cũng như làm giảm khả năng biểu hiện protein của dòng nấm men. Đó có thể là các lý do khiến mật độ tế bào nấm men cao nhất mà nghiên cứu này tìm được (3,92x109 tế bào/ml) khác với mật độ nấm men ở các nghiên cứu khác – như 2,4 x 109 tế bào/ml với chủng nấm men chứa gen quy định protein CHRM2 (Asada et al., 2011). Theo các nhà nghiên cứu, ngoài tốc độ lắc, nhiều yếu tố khác nữa có thể ảnh hưởng đến việc biểu hiện protein ở nấm men P. pastoris như pH, nhiệt độ, nồng độ methanol, thành phần trung bình hoặc các chất phụ gia (axit casamino, sorbitol, EDTA), (Peng et al., 2011; Rabert et al., 2013; Shi et al., 2003). Song, trong điều kiện thực tế của phòng thí nghiệm, các nghiên cứu về ảnh hưởng của các yếu tố này đến khả năng lên men của chủng nấm men chọn lọc còn chưa được thực hiện. KẾT LUẬN Chủng nấm men P. pastoris GS115 số 11 có tốc độ sinh trưởng nhanh cho 3,92x109 tế bào/ml sau 84 giờ kích thích biểu hiện ở điều kiện lên men trong bình lắc ở 280C, nồng độ methanol bổ sung 2%, tốc độ lắc 250 vòng/ phút đã được chọn lọc từ 150 chủng nấm men sau dòng hóa. Đây cũng là chủng có khả năng biểu hiện protein VP28 tốt nhất – kết quả chạy điện di phân tách protein trên SDS-PAGE và kết quả phân tích Western-blot bằng kháng thể đặc hiệu của VP28 cho vạch rõ ở khoảng 30 kDa. Chủng này được chọn làm nguyên liệu điều chế vaccine/tolerine phòng bệnh đốm trắng cho tôm nuôi. TÀI LIỆU THAM KHẢO Asada, H., Uemura, T., Yurugi-Kobayashi, T., Shiroishi, M., Shimamura, T., Tsujimoto, H., Ito, K., Sugawara, T., Nakane, T., Nomura, N., Murata, T., Haga, T., Iwata, S., Kobayashi, T., 2011. Evaluation of the Pichia pastoris expression system for the production of GPCRs for structural analysis. Microbial Cell Factories 10. Balamurugan, V., Reddy, G.R., Suryanarayana, V.V.S., 2007. Pichia pastoris: A notable heterologous expression system for the production offoreign proteins—Vaccines Indian J. Biotechnol. 6, 175- 186 Cai, F., Li, T., Xie, Y., He, X., 2014. Expression of functional single-chain variable domain fragment (scFv) antibody against Metolcarb in Pichia pastoris. Annals of Microbiology 64, 589-597. Caipang, C.M.A., Verjan, N., Ooi, E.L., Kondo, H., Hirono, I., Aoki, T., Kiyono, H., Yuki, Y., 2008. Enhanced survival of shrimp, Penaeus (Marsupenaeus) japonicus from white spot syndrome disease after oral administration of recombinant VP28 expressed in Brevibacillus brevis. Fish & Shellfish Immunology 25, 315-320. Eda Celik, Pinar Calik, 2012. Production of recombinant proteins by yeast cells. Biotechnology Advances 30, 1108-1118. Fu, L.L., Wang, Y.B., Wu, Z.C., Li, W.F., 2011. In vivo assessment for oral delivery of Bacillus subtilis harboring a viral protein (VP28) against white spot syndrome virus in Litopenaeus vannamei. Aquaculture 322, 33-38. 84 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 5 - THÁNG 6/2015 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Hansson, M., Nygren, P., Stahl, S., 2000. Design and production of recombinant sub-unit vaccines. Biotechnology and Applied Biochemistry 32, 95- 107. Jha, R.K., Xu, Z.R., Bai, S.J., Sun, J.Y., Li, W.F., Shen, J., 2007. Protection of Procambarus clarkii against white spot syndrome virus using recombinant oral vaccine expressed in Pichia pastoris. Fish & Shellfish Immunology 22, 295-307. Jha, R.K., Xu, Z.R., Pandey, A., 2006a. Protection of Procambarus clarkii against white spot syndrome virus using recombinant subunit injection vaccine expressed in Pichia pastoris. Fisheries Science 72, 1011-1019. Jha, R.K., Xu, Z.R., Shen, J., Bai, S.J., Sun, J.Y., Li, W.F., 2006b. The efficacy of recombinant vaccines against white spot syndrome virus in Procambarus clarkii. Immunology Letters 105, 68-76. Jupatanakul, N., Wannapapho, W., Eurwilaichitr, L., Flegel, T.W., Sritunyalucksana, K., 2010. Cloning and expression of recombinant shrimp PmRab7 (a virus-binding protein) in Pichia pastoris. Protein Expr. Purif. 76, 1-6. Kim, C.S., Kosuke, Z., Nam, Y.K., Kim, S.K., Kim, K.H., 2007. Protection of shrimp (Penaeus chinensis) against white spot syndrome virus (WSSV) challenge by double-stranded RNA. Fish & Shellfish Immunology 23, 242-246. Kumar, S.R., Ahamed, V.P.I., Sarathi, M., Basha, A.N., Hameed, A.S.S., 2008. Immunological responses of Penaeus monodon to DNA vaccine and its efficacy to protect shrimp against white spot syndrome virus (WSSV). Fish & Shellfish Immunology 24, 467-478. Li, P., Anumanthan, A., Gao, X.G., Ilangovan, K., Suzara, V.V., Duzgunes, N., Renugopalakrishnan, V., 2007. Expression of recombinant proteins in Pichia pastoris. Appl Biochem Biotechnol 142, 105-124. Liu, Q.H., Huang, J., Han, W.J., Liang, Y., Lu, C.L., Wang, Q.Y., 2006. Expression, purification and characterization of WSSV-VP37 in Pichia pastoris. Aquaculture 258, 55-62. Mavichak, R., Takano, T., Kondo, H., Hirono, I., Wada, S., Hatai, K., Inagawa, H., Takahashi, Y., Yoshimura, T., Kiyono, H., Yuki, Y., Aoki, T., 2010. The effect of liposome-coated recombinant protein VP28 against white spot syndrome virus in kuruma shrimp, Marsupenaeus japonicus. Journal of Fish Diseases 33, 69-74. Namikoshi, A., Wu, J.L., Yamashita, T., Nishizawa, T., Nishioka, T., Arimoto, M., Muroga, K., 2004. Vaccination trials with Penaeus japonicus to induce resistance to white spot syndrome virus. Aquaculture 229, 25-35. Ning, D., Leng, X., Li, Q., Xu, W., 2011. Surface- displayed VP28 on Bacillus subtilis spores induce protection against white spot syndrome virus in crayfish by oral administration. J. Appl. Microbiol. 111, 1327-1336. Peng, H., Liu, H.P., Chen, B., Hao, H., Wang, K.J., 2011. Optimized production of scygonadin in Pichia pastoris and analysis of its antimicrobial and antiviral activities. Protein Expr. Purif. 82, 37-44. Rabert, C., Weinacker, D., Pessoa Jr, A., FarÃas, J.G., 2013. Recombinants proteins for industrial uses: Utilization of Pichia pastoris expression system. Braz. J. Microbiol. 44, 351-356. Rout, N., Kumar, S., Jaganmohan, S., Murugan, V., 2007. DNA vaccines encoding viral envelope proteins confer protective immunity against WSSV in black tiger shrimp. Vaccine 25, 2778- 2786. Musthaq S Syed, Jimmy Kwang., 2011. Oral Vaccination of Baculovirus-Expressed VP28 Displays Enhanced Protection against White Spot Syndrome Virus in Penaeus monodon. PLoS ONE 6. Sarathi, M., Simon, M.C., Venkatesan, C., Hameed, A.S.S., 2008. Oral administration of bacterially expressed VP28dsRNA to protect Penaeus monodon from white spot syndrome virus. Marine Biotechnology 10, 242-249. Satoh, J., Kim, H.J., Matsui, T., Nishizawa, T., Optimization of WSSV rVP Expression in E. 85TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 5 - THÁNG 6/2015 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 coli Cells and Minimum Dose of rVPs for Oral Vaccination in Kuruma Shrimp. Fish Pathology 45, 169-174. Shi, X., Karkut, T., Chamankhah, M., Alting-Mees, M., Hemmingsen, S.M., Hegedus, D., 2003. Optimal conditions for the expression of a single-chain antibody (scFv) gene in Pichia pastoris. Protein Expr. Purif. 28, 321-330. Shin, M.K., Yoo, H.S., 2013. Animal vaccines based on orally presented yeast recombinants. Vaccine 31, 4287-4292. Singh, I.S.B., Manjusha, M., Pai, S.S., Philip, R., 2005. Fenneropenaeus indicus is protected from white spot disease by oral administration of inactivated white spot syndrome virus. Diseases of Aquatic Organisms 66, 265-270. Wang, L., 2009. Cloning of Envelope Protein Genes vp26 and vp28 of Shrimp White Spot Syndrome Virus (WSSV) and the Expressions in Pichia Pastoris. Master’s thesis, Jimei University. China. Witteveldt, J., Cifuentes, C.C., Vlak, J.M., van Hulten, M.C.W., 2004a. Protection of Penaeus monodon against white spot syndrome virus by oral vaccination. Journal of Virology 78, 2057-2061. Witteveldt, J., Vlak, J.A., Van Hulten, M.C.W., 2004b. Protection of penaeus monodon against white spot syndrome virus using a WSSV subunit vaccine. Fish & Shellfish Immunology 16, 571-579. Witteveldt, J., Vlak, J.M., van Hulten, M.C.W., 2006. Increased tolerance of Litopenaeus vannamei to white spot syndrome virus (WSSV) infection after oral application of the viral envelope protein VP28. Diseases of Aquatic Organisms 70, 167- 170. 86 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 5 - THÁNG 6/2015 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 1 Minh Hai Sub-Institute for Fisheries Research,Research Institute for Aquaculture No 2. * Email: thuyngo8@yahoo.com scReening sUiTable Pichia PasToRis sTRains caRRied VP28 gene To PRodUce ToleRine againsT WhiTe sPoT disease in shRimP Ngo Thi Ngoc Thuy1*, Dang Thi Tra My1 ABSTRACT The use of Pichia pastoris as the expression system to produce recombinant proteins for disease prevention in inverterbrate has been published widely; however, it has been limited used in aqua- culture, especially in preventation of shrimp diseases. This study is aimed to find a suitable strain from 150 strains of P. pastoris carrying pPick9K-VP28 vectors to produce tolerine against white spot disease in shrimp. Those strains were screened based on the phenotype (Mut+), copy number of VP 28 gene, the ability to express VP28 protein and growth rate of yeast strains. The selection process figured 125 strains of phenotype Mut+, in which, 82 strains have got 14-16 copy gene of VP28-His in genome. Further screening showed that recombinant VP28 protein was well expressed in 8 P.pastoris strains; the expressing protein was given a clear specific band of about 30kDa on SDS-PAGE gel and Western-blot cellulose membrane. Finally, one strain – strain 11 – revealed quick growth with the highest cell density of 3.92 x 109cfu/ml at 84 hours post stimulation and ef- fectively expressed rVP28 the protein was selected to produce tolerine against white spot disease in future studies. Keywords: VP28, Pichia pastoris, White spot disease. Người phản biện: TS. Lê Hồng Phước Ngày nhận bài: 29/5/2015 Ngày thông qua phản biện: 10/6/2015 Ngày duyệt đăng: 15/6/2015
File đính kèm:
 sang_loc_cac_dong_nam_men_mang_gen_vp28_thich_hop_de_san_xua.pdf
sang_loc_cac_dong_nam_men_mang_gen_vp28_thich_hop_de_san_xua.pdf

