Nhu cầu lipid và n-3 HUFA của tôm hùm bông giai đoạn puerulus đến cỡ 10g/con
TÓM TẮT Hai thí nghiệm tiếp nối nhau với 11 tuần mỗi thí nghiệm đã được tiến hành nhằm khảo sát các phản ứng tăng trưởng của con giống tôm hùm với thức ăn có các hàm lượng lipid và n-3 HUFA khác nhau. Trong cả 2 thí nghiệm, tôm hùm (khối lượng ban đầu trung bình là 0,29 g) được phân bổ thành các nhóm 30 con vào 16 bể 150 L, được cho ăn 6 lần mỗi ngày đến mức thỏa mãn. Bốn nghiệm thức thức ăn của thí nghiệm thứ nhất có mức protein như nhau là 550 g kg-1 chất khô và bốn mức lipid (đó là 60, 80, 100 và 120 g kg-1 chất khô). Sinh trưởng và hiệu quả sử dụng thức ăn của tôm hùm giống (P2) đạt mức tối đa ở thức ăn có hàm lượng lipid 9%. Trong thí nghiệm thứ hai, bốn nghiệm thức thức ăn có mức protein và lipid như nhau (lần lượt là 550 và 97 g kg-1 chất khô) và chỉ khác nhau về hàm lượng n-3 HUFA (đó là 18, 20, 22 và 24 g kg-1 chất khô). Mức tăng trưởng tối đa của tôm hùm được xác định ở nghiệm thức có hàm lượng n-3 HUFA là 1,9% chất khô. Các kết quả cho thấy hàm lượng lipid và n-3 HUFA tối ưu trong thức ăn cho tôm hùm bông ở giai đoạn giống này lần lượt là 90 và 19 g kg-1 chất khô

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6
Trang 7

Trang 8

Trang 9
Tóm tắt nội dung tài liệu: Nhu cầu lipid và n-3 HUFA của tôm hùm bông giai đoạn puerulus đến cỡ 10g/con

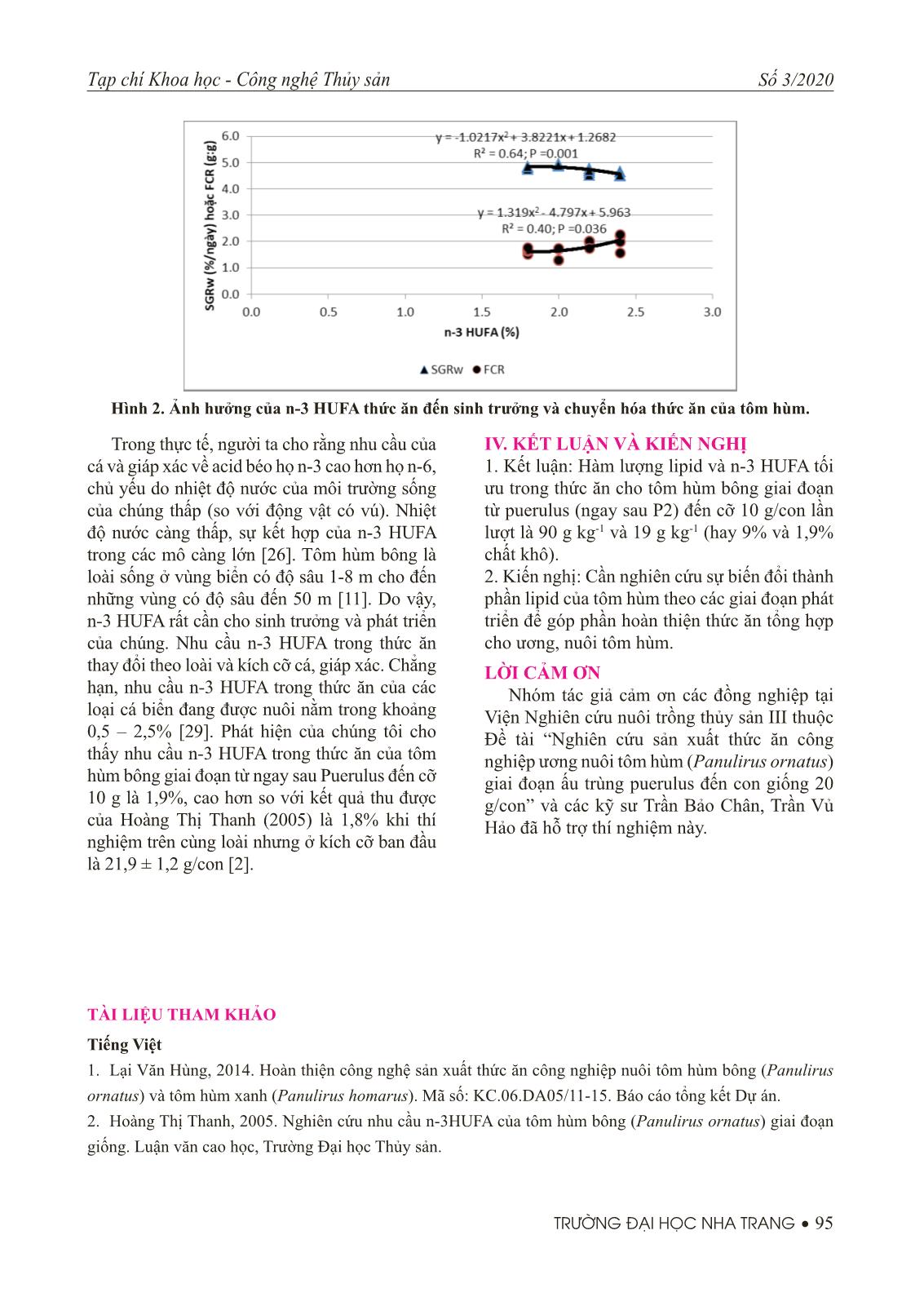
4 g CP/ MJ GE. Giá trị này rất gần với giá trị tối ưu mà Smith (2003) đã rút ra là 29 g CP/MJ GE cho tôm hùm bông [23] và của Cuzon & Guillaume (1997) cho tôm he là 30 g CP/MJ GE [6]. Tuy nhiên, Smith và cộng sự (2003) đã Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 93 nghiên cứu trên tôm hùm giống có kích cỡ ban đầu lớn hơn (1,9 g/con) và tốc độ sinh trưởng của tôm hùm trong nghiên cứu của họ là thấp hơn (1,05%/ngày) [23]. Điều này có thể do nghiên cứu của họ mang tính khai phá nên các công thức thức ăn tại thời điểm đó chưa thật hoàn thiện, đặc biệt là tính dẫn dụ của thức ăn. Ngoài ra, tần suất cho ăn ít hơn của họ (2 lần/ ngày) cũng có thể là một nguyên nhân. Ngoài tự nhiên, khi cư trú tại các vùng sinh Bảng 3. Ảnh hưởng của hàm lượng lipid thức ăn đến sinh trưởng, tỷ lệ sống và hiệu quả sử dụng thức ăn của tôm hùm giai đoạn puerulus đến cỡ 10 g/con. Thông số đánh giá Lipid (%) 6 8 10 12 SEM CL s (mm) 6,43 a 6,50 a 6,25 a 6,68 a 0,122 CL e (mm) 21,25 a 21,33 a 21,45 a 21,25 a 0,003 W s (g) 0,29 a 0,29 a 0,28 a 0,29 a 0,045 W e (g) 9,80 b 10,88 c 12,00 d 8,99 a 0,298 WG (g/con/ngày) 0,12 b 0,13 b 0,14 c 0,11 a 0,003 SGR CL (%/ngày) 1,54 a 1,55 a 1,56 a 1,54 a 0,025 SGRW (%/ngày) 4,53 ab 4,63 b 4,79 c 4,48 a 0,035 FI (g/con/ngày) 0,25 a 0,23 a 0,23 a 0,25 a 0,009 FCR (g:g) 2,06 ab 1,78 ab 1,59 a 2,24 b 0,096 SR (%) 75 a 75 a 80 a 73 a 1,4 Hình 1. Ảnh hưởng của lipid thức ăn đến sinh trưởng và chuyển hóa thức ăn của tôm hùm. a,b,c Trong cùng một hàng, các giá trị trung bình mang ký tự khác nhau thể hiện khác biệt có ý nghĩa (P<0,05). SEM – Sai số chuẩn (n = 16). thái ven bờ, ấu trùng puerulus bắt đầu hình thành các sắc tố (P1 và P2) trong khoảng 13 ngày tiếp theo và chuẩn bị cho lột xác thành con giống instar I (Fisrt Instar Juvenile) [15]. Trong suốt giai đoạn puerulus, ấu trùng hầu như không hoạt động và chưa ăn ngoài [16]. Những sự tích trữ lipid trong giai đoạn ấu trùng phyllosoma, vì thế là cần thiết cho sự sống sót của tôm hùm qua giai đoạn puerulus không ăn [8, 14, 17, 25]. Có một sự thống nhất cao trong các báo cáo khoa học trước đây về ấu trùng tôm hùm thuộc họ tôm hùm gai Palinuridae [20, 21, 31], đó là các lipid phân cực thuộc nhóm lipid phổ biến ở ấu trùng phyllosoma và đã cho là chiếm >90% hàm lượng lipid tổng số trong một nghiên cứu gần đây [4]. Các lipid phân cực rất cần cho các quá trình sinh lý ở ấu trùng cá và giáp xác [8, 28]. Chẳng hạn, phospholipid (PL) là một nguồn năng lượng quan trọng và là nguồn các acid béo thiết yếu trong quá trình phát triển 94 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 ấu trùng ở giai đoạn sớm [10, 22]. Nhóm lipid chiếm ưu thế thứ hai ở ấu trùng phyllosoma là cholesterol [4] và nó cũng được ghi nhận ở các giáp xác mười chân [13, 19, 27], có chức năng như một tiền chất quan trọng cho quá trình lột xác và sự biến thái cuối cùng [24]. Trong khi đó, triacylglycerol (TAG) là nguồn dự trữ năng lượng ngắn hạn chính ở nhiều sinh vật biển [4] và là một thành phần phổ biến trong thức ăn cho giáp xác, đặc biệt có nhiều trong dầu cá (Bảng 2). Giữa TAG và PL dường như có sự chuyển đổi qua lại trong cơ thể tôm hùm như được đề cập trong một số nghiên cứu gần đây [4, 15]. Trong nghiên cứu này, tôm hùm lúc bắt đầu thí nghiệm đang ở giai đoạn cuối Puerulus (P2) và bắt đầu ăn thức ăn ngoài. Do cần có nguồn năng lượng tức thời để đáp ứng nhu cầu phát triển của cơ thể, việc tôm hùm tiếp nhận thức ăn chứa nguồn lipid dạng TAG sẵn có trong dầu cá là điều hợp lý. Tuy nhiên, việc phân tích xa hơn sự biến đổi thành phần lipid của tôm hùm theo các giai đoạn phát triển là rất cần thiết để củng cố thêm hướng suy luận này. 2. Nhu cầu n-3 HUFA của tôm hùm bông giai đoạn puerulus đến cỡ 10g/con Tương tự như ở thí nghiệm 1, trong suốt thời gian thí nghiệm không có sự cố về chất lượng nước. Kết quả từ Bảng 4 cho thấy sinh trưởng và hiệu quả sử dụng thức ăn của tôm hùm giống có xu hướng được cải thiện khi hàm lượng n-3 HUFA trong thức ăn tăng lên từ 1,8% đến 2,0%, còn sau đó thì suy giảm và sự khác biệt các giá trị về SGRw và FCR ở các nghiệm thức có hàm lượng n-3 HUFA 2,0% và 2,4% là có ý nghĩa (P<0,05). Bảng 4. Ảnh hưởng của hàm lượng n-3 HUFA thức ăn đến sinh trưởng, tỷ lệ sống và hiệu quả sử dụng thức ăn của tôm hùm giống giai đoạn tôm trắng (puerulus) đến cỡ 10 g/con. Thông số đánh giá n-3 HUFA (%) 1,8 2,0 2,2 2,4 ±SEM CL s (mm) 6,43 a 6,25 a 6,43 a 6,43 a 0,114 CL e (mm) 21,43 a 21,45 a 21,25 a 21,25 a 0,040 W s (g) 0,29 a 0,28 a 0,29 a 0,29 a 0,002 W e (g) 11,58 b 12,24 c 10,34 a 9,80 a 0,266 WG (g/con/ngày) 0,15 b 0,15 b 0,13 a 0,13 a 0,003 SGR CL (%/ngày) 1,57 a 1,61a 1,56 a 1,56 a 0,023 SGRW (%/ngày) 4,8 b 4,9b 4,6ab 4,5a 0,037 FI (g/con/ngày) 0,243 a 0,235 a 0,253 a 0,248 a 0,0073 FCR (g:g) 1,65 ab 1,51 a 1,94bc 2,01c 0,072 SR (%) 78,4 a 80,0 a 76,7 a 75,0 a 1,34 Để có thể ước tính hàm lượng n-3 HUFA tối ưu cho sinh trưởng của tôm hùm giống dựa trên số liệu có được, sự ảnh hưởng của hàm lượng n-3 HUFA thức ăn đến các thông số sinh trưởng (SGRw) và hiệu quả sử dụng thức ăn (FCR) đã được mô hình hóa. Kết quả nghiên cứu cho thấy có 40-64% sự biến thiên của các thông số này có thể được mô tả bằng các đường hồi quy bậc hai. Qua các đường hồi quy này, hàm lượng n-3 HUFA tối ưu cho tôm hùm giống từ puerulus tới cỡ 10 g được nội suy là 1,9% khối lượng khô (Hình 2). Các kết quả trên cho thấy n-3 HUFA rất cần cho sinh trưởng của tôm hùm giống, tương tự như với các loài cá và giáp xác ở biển khác. Việc thiếu n-3 HUFA trong thức ăn của cá biển đã được ghi nhận là giảm tỷ lệ sống, tốc độ sinh trưởng và dẫn đến sự phát triển bất thường của bóng bơi [18]. Các acid béo họ n-3 được cho là là có một mức chưa bão hòa lớn. Đây là điều cần cho tính nhu động, tính co giãn và tính thấm lớn hơn của màng tế bào và các bào quan ở nhiệt độ thấp. a,b,c Trong cùng một hàng, các giá trị trung bình mang ký tự khác nhau thể hiện khác biệt có ý nghĩa (P<0,05). SEM – Sai số chuẩn (n = 16). Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 95 Trong thực tế, người ta cho rằng nhu cầu của cá và giáp xác về acid béo họ n-3 cao hơn họ n-6, chủ yếu do nhiệt độ nước của môi trường sống của chúng thấp (so với động vật có vú). Nhiệt độ nước càng thấp, sự kết hợp của n-3 HUFA trong các mô càng lớn [26]. Tôm hùm bông là loài sống ở vùng biển có độ sâu 1-8 m cho đến những vùng có độ sâu đến 50 m [11]. Do vậy, n-3 HUFA rất cần cho sinh trưởng và phát triển của chúng. Nhu cầu n-3 HUFA trong thức ăn thay đổi theo loài và kích cỡ cá, giáp xác. Chẳng hạn, nhu cầu n-3 HUFA trong thức ăn của các loại cá biển đang được nuôi nằm trong khoảng 0,5 – 2,5% [29]. Phát hiện của chúng tôi cho thấy nhu cầu n-3 HUFA trong thức ăn của tôm hùm bông giai đoạn từ ngay sau Puerulus đến cỡ 10 g là 1,9%, cao hơn so với kết quả thu được của Hoàng Thị Thanh (2005) là 1,8% khi thí nghiệm trên cùng loài nhưng ở kích cỡ ban đầu là 21,9 ± 1,2 g/con [2]. IV. KẾT LUẬN VÀ KIẾN NGHỊ 1. Kết luận: Hàm lượng lipid và n-3 HUFA tối ưu trong thức ăn cho tôm hùm bông giai đoạn từ puerulus (ngay sau P2) đến cỡ 10 g/con lần lượt là 90 g kg-1 và 19 g kg-1 (hay 9% và 1,9% chất khô). 2. Kiến nghị: Cần nghiên cứu sự biến đổi thành phần lipid của tôm hùm theo các giai đoạn phát triển để góp phần hoàn thiện thức ăn tổng hợp cho ương, nuôi tôm hùm. LỜI CẢM ƠN Nhóm tác giả cảm ơn các đồng nghiệp tại Viện Nghiên cứu nuôi trồng thủy sản III thuộc Đề tài “Nghiên cứu sản xuất thức ăn công nghiệp ương nuôi tôm hùm (Panulirus ornatus) giai đoạn ấu trùng puerulus đến con giống 20 g/con” và các kỹ sư Trần Bảo Chân, Trần Vủ Hảo đã hỗ trợ thí nghiệm này. Hình 2. Ảnh hưởng của n-3 HUFA thức ăn đến sinh trưởng và chuyển hóa thức ăn của tôm hùm. TÀI LIỆU THAM KHẢO Tiếng Việt 1. Lại Văn Hùng, 2014. Hoàn thiện công nghệ sản xuất thức ăn công nghiệp nuôi tôm hùm bông (Panulirus ornatus) và tôm hùm xanh (Panulirus homarus). Mã số: KC.06.DA05/11-15. Báo cáo tổng kết Dự án. 2. Hoàng Thị Thanh, 2005. Nghiên cứu nhu cầu n-3HUFA của tôm hùm bông (Panulirus ornatus) giai đoạn giống. Luận văn cao học, Trường Đại học Thủy sản. 96 • TRƯỜNG ĐẠI HỌC NHA TRANG Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 Tiếng Anh 3. Benson, A., Lee, R.F., 1972. Wax esters: major marine metabolic energy sources. Biochem. J. 128, 10P. 4. Conlan, J. A., Jones, P. L., Turchini, G. M., Hall, M. R., Francis, D. S., 2014. Changes in the nutritional composition of captive early-mid stage Panulirus ornatus phyllosoma over ecdysis and larval development. Aquaculture 434 (2014) 159–170. 5. Cho, C.Y., Slinger, S.J. and Bayley, M.S., 1982. Bioenergertics of salmonid fi shes: energy intake, expenditure and productivity, Com. Biochem. Physiol. 73B, pp 25-41. 6. Cuzon, G. Guillaume, J., 1997. Energy and protein: energy ratio. In: Crustacean Nutrition (D’Abramo, L.R., Conklin, D.E. & Akaiyama, D.M. eds), pp. 51–70. World Aquaculture Society, Louisiana State University, Baton Rouge, LA, USA. 7. De Silva S.S. and Anderson, T.A., 1995. Fish nutrition in aquaculture. Chapman and Hall, 91p. 8. Folch, J., Lees, M., Sloane-Stanley, G.H., 1957. A simple method for the isolation and purifi cation of total lipids from animal tissues, J. Bio. Chem. 226, pp 497-509. 9. Francis, D.S., Salmon, M.L., Kenway, M.J., Hall, M.R., 2014. Palinurid lobster aquaculture: nutritional progress and considerations for successful larval rearing. Rev. Aquac. 10. Gisbert, E., Villeneuve, L., Zambonino-Infante, J.L., Quazuguel, P., Cahu, C.L., 2005. Dietary phospholipids are more effi cient than neutral lipids for long-chain polyunsaturated fatty acid supply in European sea bass Dicentrarchus labrax larval development. Lipids 40, 609–618. 11. Guillaume, J., Kaushik, S., Bergot, P., & Métailler, R., 2001. Nutrition and feeding of fi sh and crustaceans, Praxis Publishing, Chichester, UK. 12. Holthuis, L.B., 1991. FAO species catalogue. Vol. 13 Marine lobsters of the world. An annotated and illustrated catalogue of species of interest to fi sheries known to date. FAO Fisheries Synopsis. No. 125, Vol. 13. Rome, FAO, 292 p. 13. Irvin, S., Williams, K., Barclay, M., Tabrett, S., 2010. Do formulated feeds for juvenile Panulirus ornatus lobsters require dietary cholesterol supplementation? Aquaculture 307, 241–246. 14. Jeffs, A.G., Nichols, P.D., Bruce, M.P., 2001. Lipid reserves used by pueruli of the spiny lobster Jasus edwardsii in crossing the continental shelf of New Zealand. Comp. Biochem. Physiol. A Mol. Integr. Physiol. 129, 305–311. 15. Jeffs, A.G., Peter D. N., 2009. Lipid, fatty acid and protein content of late larval to early juvenile stages of the western rock lobster, Panulirus cygnus. Comparative Biochemistry and Physiology, Part B 152 (2009) 292–298. 16. Jeffs, A.G., Phleger, C.F., Nelson, M.M., Mooney, B.D., Nichols, P.D., 2002. Marked depletion of polar lipid and non-essential fatty acids following settlement by postlarvae of the spiny lobster Jasus verreauxi. Comp. Biochem. Physiol. A 131, 305–311. 17. Jeffs, A.G., Willmott, M.E., Wells, R.M.G., 1999. The use of energy stores in the puerulus of the spiny lobster Jasus edwardsii across the continental shelf of New Zealand. Comp. Biochem. Physiol. A Mol. Integr. Physiol. 123, 351–357. 18. Koven, M.W., Tandler, A., Kissil, G.W., Sklan, D., Frieslander, O. and Harel, M., 1990. The effect of dietary n-3 poly-unsaturated fatty acid on growth, survival and swim bladder development in sparus aurata larvae, Aquaculture 91, pp 131-141. 19. Paibulkichakul, C., Piyatiratitivorakul, S., Kittakoop, P., Viyakarn, V., Fast, A.W., Menasveta, P., 1998. Tạp chí Khoa học - Công nghệ Thủy sản Số 3/2020 TRƯỜNG ĐẠI HỌC NHA TRANG • 97 Optimal dietary levels of lecithin and cholesterol for black tiger prawn Penaeus monodon larvae and postlarvae. Aquaculture 167, 273–281. 20. Phleger, C.F., Nelson, M.M., Mooney, B.D., Nichols, P.D., Ritar, A.J., Smith, G.G., Hart, P.R., Jeffs, A.G., 2001. Lipids and nutrition of the southern rock lobster, Jasus edwardsii, from hatch to puerulus. Mar. Freshw. Res. 52, 1475–1486. 21. Ritar, A.J., Dunstan, G.A., Crear, B.J., Brown, M.R., 2003. Biochemical composition during growth and starvation of early larval stages of cultured spiny lobster (Jasus edwardsii) phyllosoma. Comp. Biochem. Physiol. 136, 353–370. 22. Salze, G., Tocher, D.R., Roy, W.J., Robertson, D.A., 2005. Egg quality determinants in cod (Gadus morhua L.): egg performance and lipids in eggs from farmed and wild broodstock. Aquac. Res. 36, 1488–1499. 23. Smith, D.M., K.C. Williams, S. Irvin, M. Barclay & S. Tabrett, 2003. Development of a pelleted feed for juvenile tropical spiny lobster (Panulirus ornatus): response to dietary protein and lipid. Aquaculture Nutrition 2003 (9); 231-237. 24. Smith, D.M., Tabrett, S.J., Barclay, M.C., 2001. Cholesterol requirement of subadult black tiger shrimp Penaeus monodon (Fabricius). Aquac. Res. 32, 399–405. 25. Smith, G.G., Ritar, A.J., Johnston, D., Dunstan, G.A., 2004. Infl uence of diet on broodstock lipid and fatty acid composition and larval competency in the spiny lobster, Jasus edwardsii. Aquaculture 233, 451–475. 26. Tacon, A.G.J., 1990. Standard methods for the nutrition and feeding of farmed fi sh and shrimp, Argent Laboratories Press, Redmond, Washington U.S.A. 27. Teshima, S., 1997. Phospholipids and sterols. In: D'Abramo, L.R., Conklin, D.E., Akiyama, D.M. (Eds.), Crustacean Nutrition. World Aquaculture Society, Baton Rouge. 28. Tocher, D.R., Bendiksen, E.Å., Campbell, P.J., Bell, J.G., 2008. The role of phospholipids in nutrition and metabolism of teleost fi sh. Aquaculture 280, 21–34. 29. Tuan, L.A., 2015. A review of feeding practices and nutritional requirements of Post-larval spiny lobster. The proceedings of the 7th Regional Aquafeed Forum held in Can Tho, Oct 22-23, 2015. 30. Webster, C.D., Goodgame-Tiu, L.S., Tidwell, J.H., 1995. Total replacement fi sh meal by soybean meal, with various percentages of supplemental L-methionine, in fi sh diets for blue catfi sh, Ictalurus furcatus (Leseur), Aquacult. Res. 26, pp 299-306. 31. Williams, K.C., Smith, D.M., Crear, B., Glencross, B. & Evans, L., 2000. Feed development for rock lobster aquaculture (Project 98/303). In: Final Report to Fisheries Research and Development Corporation (Williams, K.C. ed.), pp. 9–77. Fisheries Research and Development Corporation, Canberra, Australia. 32. Wu, X., Smith, G., Hall, M., 2012. Patterns of larval growth, lipid composition and fatty acid deposition during early to mid stages of development in Panulirus ornatus phyllosoma. Aquaculture 330–333, 63–73.
File đính kèm:
 nhu_cau_lipid_va_n_3_hufa_cua_tom_hum_bong_giai_doan_puerulu.pdf
nhu_cau_lipid_va_n_3_hufa_cua_tom_hum_bong_giai_doan_puerulu.pdf

