Nghiên cứu một số đặc tính sinh hoá của các chủng xạ khuẩn phân lập được từ các ao nuôi tôm thâm canh tại Thừa Thiên Huế
TÓM TẮT
Nghiên cứu này nhằm tìm hiểu đặc tính sinh hoá của các chủng xạ khuẩn phân lập
được từ các ao nuôi tôm tại Thừa Thiên Huế, từ đó tìm ra chủng xạ khuẩn có khả năng kháng
vi khuẩn Vibrio parahaemolyticus gây bệnh cho tôm nuôi. Xạ khuẩn được phân lập theo
phương pháp của Lakshmi (2008) và định danh bằng phương pháp giải trình tự gen 16S
rRNA. Nghiên cứu khả năng sinh enzyme và xác định khả năng gây độc trên máu tôm của
các chủng xạ khuẩn được thực hiện trên các môi trường thạch chuyên biệt. Kết quả đã phân
lập được 5 chủng xạ khuẩn DH A1, DM A1, DM A2, PH A1 và QN A1 có khả năng ức chế sự
phát triển của vi khuẩn V. parahaemolyticus. Cả 5 chủng không làm tan tế bào máu tôm trên
môi trường Rose-Bengal. Các chủng xạ khuẩn phân lập được có trình tự nucleotide tương đồng
từ 94-98% so với chủng Streptomyces sampsonii ATCC 25495. Năm chủng xạ khuẩn phân lập
được đều có khả năng sản sinh ra cellulase, amylase, lipase (trừ chủng PH A1), riêng 2 chủng
PHA1 và QN A1 còn có khả năng tiết ra enzyme gelatinase. Kết quả của nghiên cứu này cho
thấy có thể ứng dụng những chủng này để sản xuất chế phẩm sinh học thay thế cho kháng
sinh trong điều trị bệnh nhiễm khuẩn do Vibrio parahemolyticus gây ra.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5
Trang 6

Trang 7

Trang 8

Trang 9
Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Nghiên cứu một số đặc tính sinh hoá của các chủng xạ khuẩn phân lập được từ các ao nuôi tôm thâm canh tại Thừa Thiên Huế

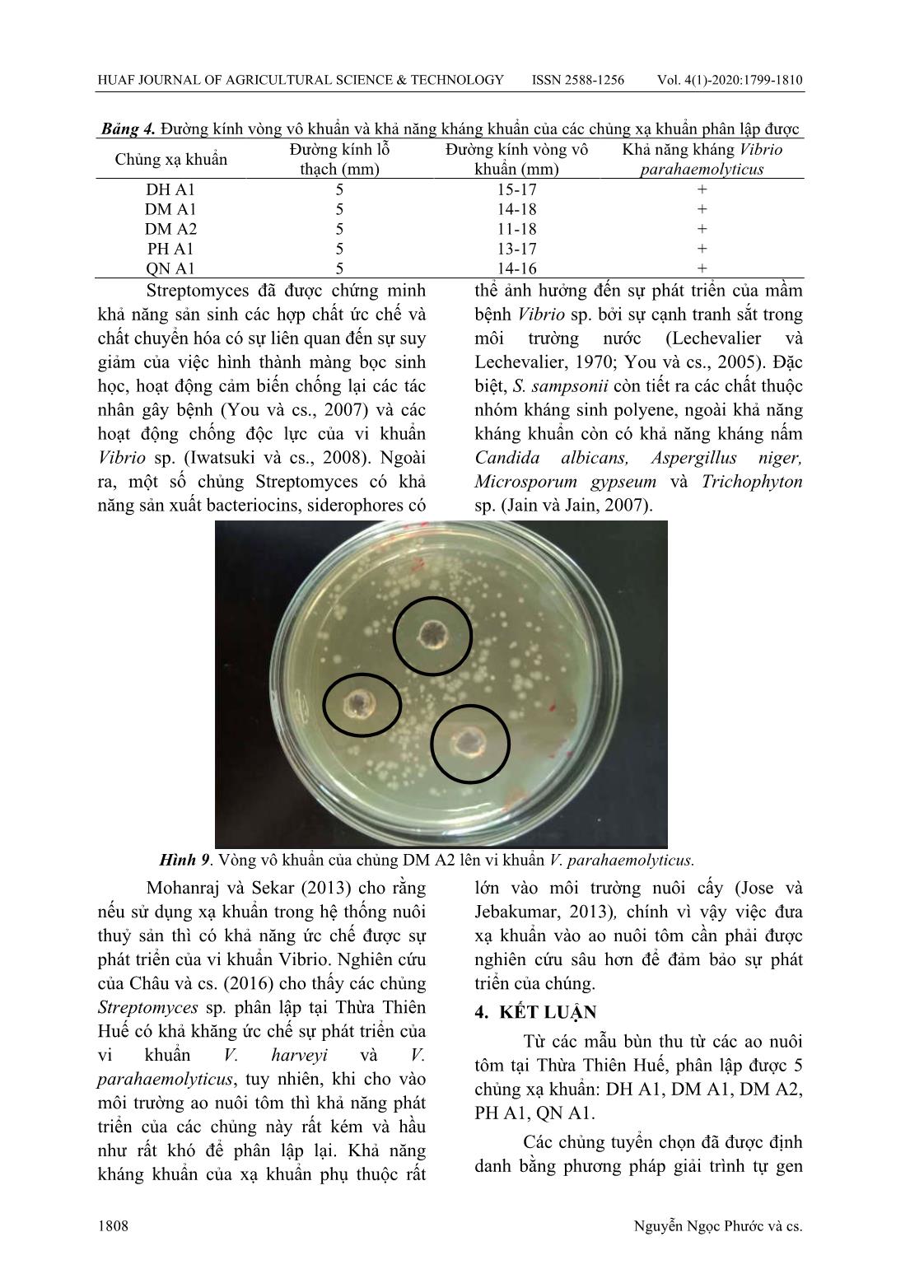
có thể sống trong nhiều môi trường đất khác nhau với hình thái sợi đặc trưng phân nhánh. Streptomyces sp. đã được công nhận rộng rãi là vi sinh vật công nghiệp quan trọng do tiềm năng của nó trong đa dạng sản xuất các chất chuyển hóa thứ cấp (Lee và cs., 2014b; Ser và cs., 2015; Tan và cs., 2015) bao gồm thuốc kháng sinh (Lee và cs., 2014a), thuốc chống ung thư, thuốc chống ký sinh trùng, thuốc ức chế miễn dịch và enzyme HUAF JOURNAL OF AGRICULTURAL SCIENCE & TECHNOLOGY ISSN 2588-1256 Vol. 4(1)-2020:1799-1810 1806 Nguyễn Ngọc Phước và cs. (Manivasagan và cs., 2013). Theo báo cáo của một số nghiên cứu thì xạ khuẩn S. sampsonii có thể phân lập được từ đất nông nghiệp (Jain và cs., 2016) hay từ đất vườn ngập nước (Jain và Jain, 2007). Từ kết quả của nghiên cứu này cho thấy S. sampsonii còn có thể phân lập được từ bùn đáy ao nuôi tôm. Do khả năng sản xuất các hợp chất hóa học phổ rộng của xạ khuẩn thuộc chi Streptomyces và có thể tạo ra các hợp chất kháng khuẩn và kháng sinh tiềm năng, nên các loài xạ khuẩn này có thể có giá trị như probiotic trong nuôi trồng thủy sản. 3.3. Một số đặc điểm sinh hoá của các chủng xạ khuẩn phân lập được 3.3.1. Khảo sát khả năng sản xuất enzyme của xạ khuẩn Kết quả khảo sát khả năng sản xuất enzyme cellulase, amylase, lipase, gelatinase của các chủng xạ khuẩn được thể hiện ở Bảng 2. Bảng 2. Kết quả khảo sát khả năng sản sinh enzyme của các chủng xạ khuẩn Chủng xạ khuẩn/môi trường phân giải Cellulase Amylase Lipase Gelatinase DH A1 + + + - DM A1 + + + - DM A2 + + + - PH A1 + + - + QN A1 + + + + (+) có khả năng phân giải enzyme; (-) không có khả năng phân giải enzyme. Qua Bảng 2 cho thấy các chủng DH A1, DM A1, DM A2, PH A1, QN A1 đều có khả năng sản xuất enzyme cellulase, amylase, lipase (ngoại trừ chủng PH A1 là không có khả năng sản xuất enzyme lipase). Các chủng xạ khuẩn đã phân lập được không có khả năng sản xuất enzyme gelatinase, ngoại trừ hai chủng PH A1 và QN A1. Actinomycetes là vi khuẩn Gram dương dạng sợi, có mặt khắp nơi trong đất, được biết đến như là loại vi sinh vật sản xuất nhiều enzyme ngoại bào với các đặc tính phân hủy polymer, bao gồm chitinase (Gupta và cs., 1995). Tất cả các chủng phân lập được cho thấy khả năng sản xuất các loại enzyme ngoại bào như cellulase, lipase, amylase, gelatinase và chitinase. Bên cạnh đó, chitin là thành phần phổ biến đối với các sinh vật sống trong môi trường nước, là thành phần chính cấu tạo lớp vỏ của động vật không xương sống, vảy cá và thành tế bào của nhiều loại nấm (Souza và cs., 2011). Cellulose cũng là chất khá phổ biến trong sinh vật và được xem như là một polymer sinh học (Arjit và cs., 2012). Xạ khuẩn là một trong những loài vi sinh vật có khả năng sản sinh ra cellulase và đã được áp dụng rộng rãi trên thế giới (Arjit và cs., 2012; Ashutosh, 2008). Khi kiểm tra hoạt tính enzyme của một số chủng xạ khuẩn trên môi trường Starch Casein Agar (SCA), Lechevalier và Lechevalier (1970) đã cho thấy rằng xạ khuẩn có khả năng sản sinh nhiều loại enzyme, có thể là do kết quả của việc chọn lọc sinh học tự nhiên để tồn tại trong môi trường. Shamar và Choudhary (2014) báo cáo rằng các loại vi khuẩn trong môi trường có thể ảnh hưởng đến chức năng sinh học của xạ khuẩn. Khả năng sản xuất enzyme (protease, amylase, lipase), và các axit hữu cơ đã được ghi nhận từ các loại xạ khuẩn trong nuôi trồng thủy sản. You và cs. (2005) ghi nhận một số chủng Streptomyces sinh ra các enzyme làm tăng khả năng hấp thụ chất dinh dưỡng cho tôm nuôi. Jain và cs. (2016) ghi nhận S. sampsonii có khả năng thuỷ phân casein, gelatin, collagen và khi sử dụng S. sampsonii làm chế phẩm sinh học thì nó có khả năng phân giải các chất hữu cơ trong TẠP CHÍ KHOA HỌC & CÔNG NGHỆ NÔNG NGHIỆP ISSN 2588-1256 Tập 4(1)-2020:1799-1810 1807 môi trường nhờ khả năng tiết ra các enzyme này. Ngoài ra, nó còn làm tăng các vi khuẩn nitrate và có khả năng kháng nấm cao. 3.3.2. Kết quả kiểm tra tính dung huyết của các chủng xạ khuẩn phân lập được Khi nuôi cấy các chủng xạ khuẩn trên môi trường Rose-Bengal có bổ sung máu tôm, không thấy xuất hiện các vòng dung huyết (Bảng 3, Hình 8) chứng tỏ các chủng xạ khuẩn không có khả năng dung giải tế bào máu của tôm. Bảng 3. Khả năng dung huyết của các chủng xạ khuẩn phân lập được Chủng xạ khuẩn Khả năng dung huyết máu tôm DH A1 - DM A1 - DM A2 - PH A1 - QN A1 - Theo Kumar và Achuthankutty (2006), các chủng xạ khuẩn phân lập được từ trầm tích biển không gây bệnh cho tôm và không có báo cáo nào về xạ khuẩn có thể là tác nhân gây bệnh cho động vật thuỷ sản. Trong nghiên cứu này, sau 7 ngày nuôi cấy trên môi trường Rose-Bengal có bổ sung máu tôm, các chủng xạ khuẩn đều không làm vỡ tế bào máu tôm chứng tỏ các chủng này không có khả năng gây bệnh cho tôm. Do khả năng của các chủng xạ khuẩn này có thể phát triển trong môi trường nước mặn và không gây bệnh cho tôm, nên có thể ứng dụng các chủng xạ khuẩn này trong ao nuôi tôm như là chế phẩm sinh học. Tuy nhiên, các thử nghiệm sâu hơn cần được nghiên cứu để tìm ra liều dùng và cách dùng phù hợp. Hình 8. Khả năng dung huyết của chủng xạ khuẩn DH A1 (a), PH A1 (b), DM A1 (c) và QN A1 (d) trên môi trường Rose-Bengal có bổ sung máu tôm 3.4. Khả năng kháng khuẩn của các chủng xạ khuẩn phân lập được Khả năng kháng lại vi khuẩn V. parahaemolyticus của các chủng xạ khuẩn được thể hiện ở Bảng 4. Các chủng xạ khuẩn đều có khả năng kháng lại sự phát triển của chủng vi khuẩn V. parahaemolyticus, với khả năng kháng khuẩn của các chủng này tương đối tốt thể hiện qua cácc vòng vô khuẩn trên môi trường (Hình 9). Đường kính vòng tròn vô khuẩn xuất hiện do khả năng khuếch tán của kháng sinh do xạ khuẩn sản sinh vào môi trường nuôi cấy. HUAF JOURNAL OF AGRICULTURAL SCIENCE & TECHNOLOGY ISSN 2588-1256 Vol. 4(1)-2020:1799-1810 1808 Nguyễn Ngọc Phước và cs. Bảng 4. Đường kính vòng vô khuẩn và khả năng kháng khuẩn của các chủng xạ khuẩn phân lập được Chủng xạ khuẩn Đường kính lỗ thạch (mm) Đường kính vòng vô khuẩn (mm) Khả năng kháng Vibrio parahaemolyticus DH A1 5 15-17 + DM A1 5 14-18 + DM A2 5 11-18 + PH A1 5 13-17 + QN A1 5 14-16 + Streptomyces đã được chứng minh khả năng sản sinh các hợp chất ức chế và chất chuyển hóa có sự liên quan đến sự suy giảm của việc hình thành màng bọc sinh học, hoạt động cảm biến chống lại các tác nhân gây bệnh (You và cs., 2007) và các hoạt động chống độc lực của vi khuẩn Vibrio sp. (Iwatsuki và cs., 2008). Ngoài ra, một số chủng Streptomyces có khả năng sản xuất bacteriocins, siderophores có thể ảnh hưởng đến sự phát triển của mầm bệnh Vibrio sp. bởi sự cạnh tranh sắt trong môi trường nước (Lechevalier và Lechevalier, 1970; You và cs., 2005). Đặc biệt, S. sampsonii còn tiết ra các chất thuộc nhóm kháng sinh polyene, ngoài khả năng kháng khuẩn còn có khả năng kháng nấm Candida albicans, Aspergillus niger, Microsporum gypseum và Trichophyton sp. (Jain và Jain, 2007). Hình 9. Vòng vô khuẩn của chủng DM A2 lên vi khuẩn V. parahaemolyticus. Mohanraj và Sekar (2013) cho rằng nếu sử dụng xạ khuẩn trong hệ thống nuôi thuỷ sản thì có khả năng ức chế được sự phát triển của vi khuẩn Vibrio. Nghiên cứu của Châu và cs. (2016) cho thấy các chủng Streptomyces sp. phân lập tại Thừa Thiên Huế có khả khăng ức chế sự phát triển của vi khuẩn V. harveyi và V. parahaemolyticus, tuy nhiên, khi cho vào môi trường ao nuôi tôm thì khả năng phát triển của các chủng này rất kém và hầu như rất khó để phân lập lại. Khả năng kháng khuẩn của xạ khuẩn phụ thuộc rất lớn vào môi trường nuôi cấy (Jose và Jebakumar, 2013), chính vì vậy việc đưa xạ khuẩn vào ao nuôi tôm cần phải được nghiên cứu sâu hơn để đảm bảo sự phát triển của chúng. 4. KẾT LUẬN Từ các mẫu bùn thu từ các ao nuôi tôm tại Thừa Thiên Huế, phân lập được 5 chủng xạ khuẩn: DH A1, DM A1, DM A2, PH A1, QN A1. Các chủng tuyển chọn đã được định danh bằng phương pháp giải trình tự gen TẠP CHÍ KHOA HỌC & CÔNG NGHỆ NÔNG NGHIỆP ISSN 2588-1256 Tập 4(1)-2020:1799-1810 1809 16S rRNA. Kết quả các chủng có trình tự nucleotide giống với chủng Streptomyces sampsonii ATCC 25495 từ 94%-98%. Các chủng xạ khuẩn phân lập được có khả năng sản sinh enzyme amylase, cellulase, lipase (trừ chủng PH A1 không có khả năng sản sinh lipase) và 2 chủng PH A1 và QN A1 có khả năng sản sinh enzyme gelatinase. Các chủng xạ khuẩn phân lập được không có khả năng dung giải tế bào máu tôm nên có thể sử dụng chủng xạ khuẩn này như là chế phẩm sinh học trong phòng và trị bệnh trên tôm. Các chủng xạ khuẩn phân lập được có khả năng kháng lại sự phát triển của chủng vi khuẩn V. parahaemolyticus gây bệnh trên tôm. TÀI LIỆU THAM KHẢO 1. Tài liệu tiếng Việt Chi cục Thuỷ sản Thừa Thiên Huế (2019). Báo cáo tình hình nuôi trồng thuỷ sản tại tỉnh Thừa Thiên Huế năm 2018. Nguyễn Lân Dũng, Phạm Thị Trân Châu, Nguyễn Thanh Hiền, Lê Đình Lương, Đoàn Xuân Mượu, Phạm Văn Ty. (1978). Một số phương pháp nghiên cứu vi sinh vật học, Tập 3. Hà Nội: Nhà xuất bản Khoa học và Kỹ thuật. Nguyễn Lân Dũng, Nguyễn Đình Quyến, Phạm Văn Ty. (1998). Vi sinh vật học. Hà Nội: Nhà xuất bản Giáo dục. Nguyễn Hoàng Minh Huy. (2006). Khảo sát đặc điểm và vai trò của chủng xạ khuẩn Streptomyces dicklowii. Luận văn Thạc sĩ khoa học, trường Đại học Sư phạm thành phố Hồ Chí Minh. 2. Tài liệu tiếng nước ngoài Arjit, D., Mahdi, E.B., Prashanti, K., Sandeep, S. & Sourav, B. (2012). Enzymatic screening and random amplified polymorphic DNA fingerprinting of soil streptomycetes isolated from Wayanad district in Kerala, India. Journal of Biological Sciences, 12, 43-50. Ashutosh, K. (2008). Pharmaceutical Microbiology. New Delhi: New Age International (P) Ltd. Châu, N. T. T., Thanh, L. T. H. & Anh, N. H. T. (2016). Characterization of Actinomycetes antagonistic to Vibrio parahaemolyticus isolated from shrimp pond sediment. Vietnam National University of Journal of Science: Earth and Environmental Sciences, 32, 1-9. Gupta, R., Saxena, R. K., Chaturvedi, P., & Virdi, J. S. (1995). Chitinase production by Streptomyces viridificans: its potential in fungal cell wall lysis. Journal of Applied Bacteriology, 78, 378-383. Iwatsuki, M., Uchida, R., Yoshijima, H., Ui, H., Shiomi, K., Matsumoto, A., Takahashi, Y., Abe, A., Tomoda, H., & Omura, S. (2008). Guadinomines, type III secretion system inhibitors, produced by Streptomyces sp. K01-0509. I: taxonomy, fermentation, isolation and biological properties. Journal of Antibiotics (Tokyo), 61, 230–236. Jain, P. K. & Jain, P. C. (2007). Isolation, characterization and antifungal activity of Streptomyces sampsonii GS 1322. Indian Journal of Experimetal Biology, 45, 203-206. Jain, R., Jain, A., Rawat, N., Nair, M., & Gumashta, R. (2016). Feather hydrolysate from Streptomyces sampsonii GS 1322: A potential low cost soil amendment. Journal of Bioscience and Bioengineering 121(6), 672-677. Jose, P. A., & Jebakumar, S. R. D. (2013). Phylogenetic appraisal of antagonistic, slow growing actinomycetes isolated from hypersaline inland solar salterns at Sambhar salt Lake, India. Frontiers in Microbiology, 4, 190. Kumar, S. S., Philip, R., & Achuthankutty, C. T. (2006). Antiviral property of marine actinomycetes against white spot syndrome virus in penaeid shrimps. Current Science, 91, 807-811. Lakshmi, C. V., Kumar, M. & Khanna, S. (2008). Biotransformation of chlorpyrifos and bioremediation of contaminated soil. International Biodeterioration and Biodegradation, 62, 204-209. Lechevalier, M. P. & Lechevalier, H. (1970). Chemical composition as a criterion in the classification of aerobic actinomycetes. HUAF JOURNAL OF AGRICULTURAL SCIENCE & TECHNOLOGY ISSN 2588-1256 Vol. 4(1)-2020:1799-1810 1810 Nguyễn Ngọc Phước và cs. International Journal of Systematic Bacteriology, 20, 435–443. Lee, L. H., Zainal, N., Azman, A. S., Eng, S. K., Ab Mutalib, N. S., Yin, W. F., & Chan, K. G. (2014a). Streptomyces pluripotens sp. nov., a bacteriocin-producing streptomycete that inhibits meticillin-resistant Staphylococcus aureus. International Journal of Systematic and Evolutionary Microbiology, (64), 3297–3306. Lee, L. H., Zainal, N., Azman, A. S., Eng, S. K., Goh, B. H., Yin, W.F., Ab Mutalib, N. S., & Chan, K. G. (2014b). Diversity and antimicrobial activities of actinobacteria isolated from tropical mangrove sediments in Malaysia. Scientific World Journal, 1-14. Manivasagan, P., Venkatesan, J., Sivakumar, K., & Kim, S. K. (2013). Marine actinobacterial metabolites: current status and future perspectives. Microbiolical Research, (168), 311–332. Mohanraj, G. & Sekar, T. (2013). Isolation and screening of actinomycetes from marine sediments for their potential to produce antimicrobials. International Journal of Life Science Biotechnology and Pharma Research, 2(3), 115-126. Ser, H. L., Palanisamy, U. D., Yin, W. F., Abd Malek, S. N., Chan, K. G., Goh, B. H., & Lee, L. H. (2015). Presence of antioxidative agent, Pyrrolo[1,2-a]pyrazine-1,4-dione, hexahydro- in newly isolated Streptomyces mangrovisoli sp. nov. Frontiers in Microbiology, (6), 854. Sharma, M., Dangi, P., & Choudhary, M. (2014). Actinomycetes: Source, identification, and their applications. International Journal of Current Microbiology and Appiled Sciences, 3(2), 801-83. Souza, C. M., Schwabe, T. M., Pichler, H., Ploier, B., Leitner, E., Guan, X. L., Wenk, M. R., Riezman, I., & Riezman, H. (2011). A stable yeast strain efficiently producing cholesterol instead of ergosterol is functional for tryptophan uptake, but not weak organic acid resistance. Metabolic Engineering, 13(5), 555-69. Tan, L. T.-H., Ser, H.-L., Yin, W.-F., Chan, K.- G., Lee, L.-H., & Goh, B.-H. (2015). Investigation of antioxidative and anticancer potentials of Streptomyces sp. MUM256 isolated from Malaysia mangrove soil. Frontiers in Microbiology, (6), 1316. Weisburg, W.G., Barns S.M., Pelletier D.A., & Lane D.J. (1991). 16S ribosomal DNA amplification for phylogenetic study. Journal of bacteriology, 173(2), 697-703. You, J., Cao, L., Liu, G., Zhou, S., Tan, H., & Lin, Y. (2005). Isolation and characterization of actinomycetes antagonistic to pathogenic Vibrio spp. from nearshore marine sediments. World Journal of Microbiology and Biotechnololy, (21), 679–682. You, J., Xue, X., Cao, L., Lu, X., Wang, J., Zhang, L., & Zhou, S. (2007). Inhibition of Vibrio biofilm formation by a marine actinomycete strain A66. Applied Microbiology and Biotechnology, (76), 1137–1144.
File đính kèm:
 nghien_cuu_mot_so_dac_tinh_sinh_hoa_cua_cac_chung_xa_khuan_p.pdf
nghien_cuu_mot_so_dac_tinh_sinh_hoa_cua_cac_chung_xa_khuan_p.pdf

