Một số đặc tính của tinh trùng và ảnh hưởng các cation lên hoạt lực của tinh trùng cá mú cọp (Epinephelus fuscoguttatus Forsskal, 1775)
TÓM TẮT
Mục đích của nghiên cứu này nhằm xác định một số đặc tính của tinh trùng và ảnh hưởng các cation
lên hoạt lực của tinh trùng cá mú cọp. Kết quả nghiên cứu cho thấy, thành phần chính trong dịch
tương của tinh trùng cá mú cọp là các ion Na+, K+, Ca2+, Mg2+, Cl- với các nồng độ tương ứng là
176,72 ± 2,616 mmol/L Na+; 7,08 ± 1,699 mmol/L K+; 2,93 ± 0,740 mmol/L Ca2+; 15,07 ± 1,586
mmol/L Mg2+; và 122,45 ± 4,815 mmol/L Cl-. Trong nước biển nhân tạo ở tỉ lệ pha loãng 1:100 có
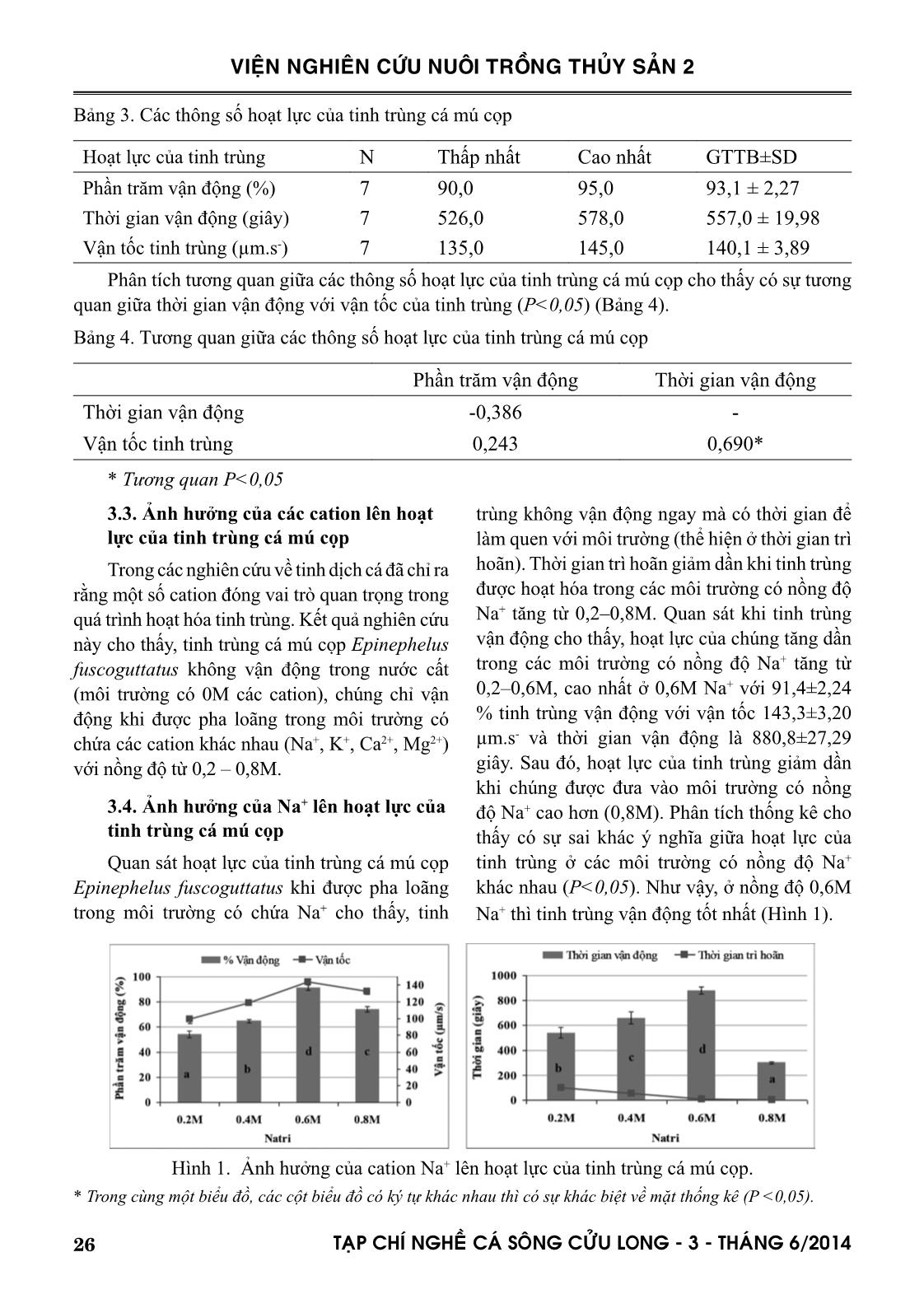
93,1±0,86 % số tinh trùng vận động trong thời gian 557,0±7,55 giây, với vận tốc 140,1±1,47 µm/s.
Tinh trùng cá mú cọp không vận động trong nước cất, chúng chỉ vận động khi ở trong các môi
trường có chứa các cation. Kết quả nghiên cứu cũng chỉ ra rằng tinh trùng cá mú cọp rất nhạy cảm
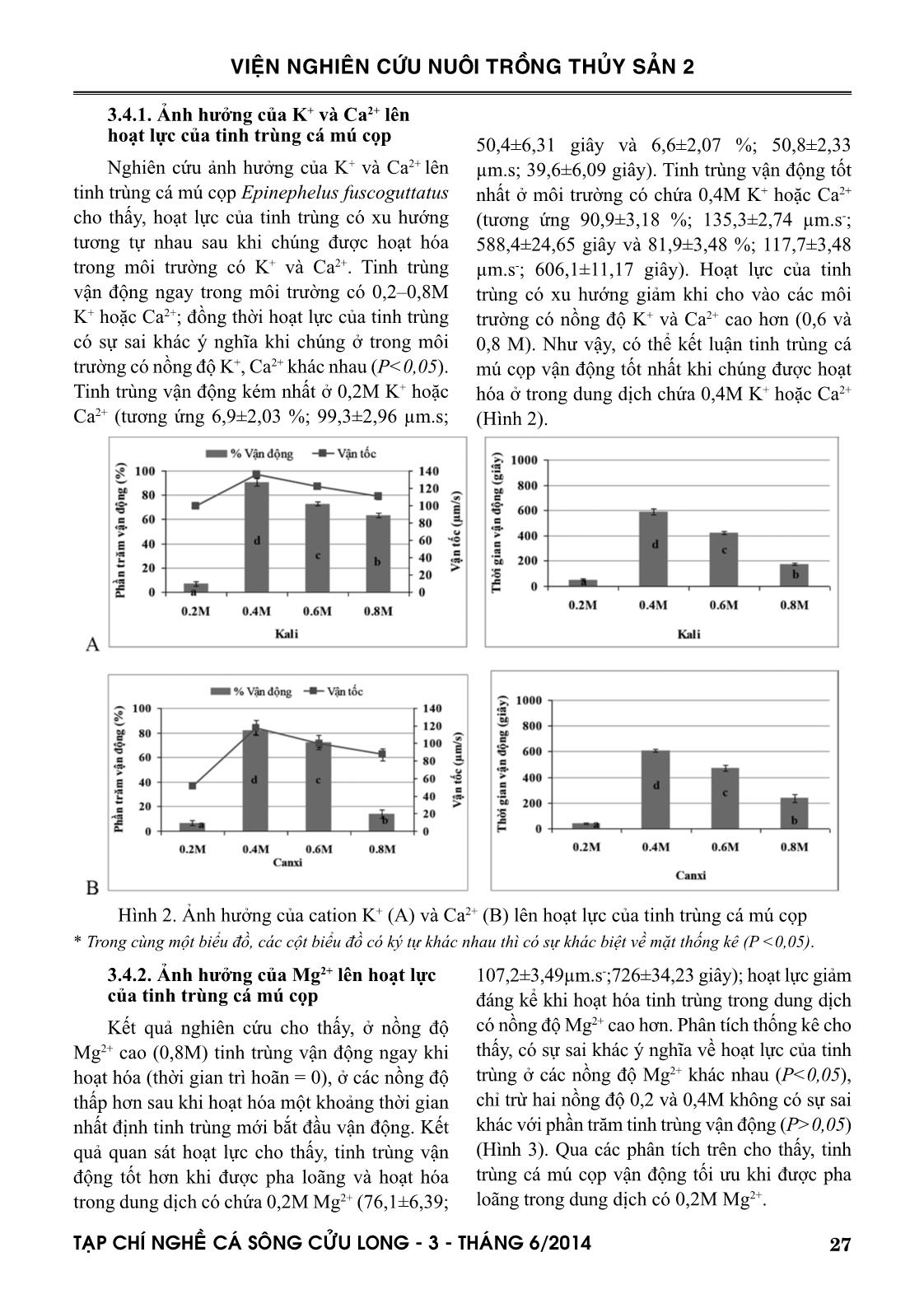
với nồng độ cation trong môi trường nơi chúng tồn tại, các tinh trùng chỉ vận động tốt khi được pha
loãng ở các môi trường chứa 0,6M Na+ hoặc 0,4M K+ hoặc 0,4M Ca2+ hoặc 0,2M Mg2+, ngoài các
nồng độ trên vận động của tinh trùng bị ức chế.

Trang 1

Trang 2

Trang 3
Trang 4
Trang 5
Trang 6

Trang 7

Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Một số đặc tính của tinh trùng và ảnh hưởng các cation lên hoạt lực của tinh trùng cá mú cọp (Epinephelus fuscoguttatus Forsskal, 1775)

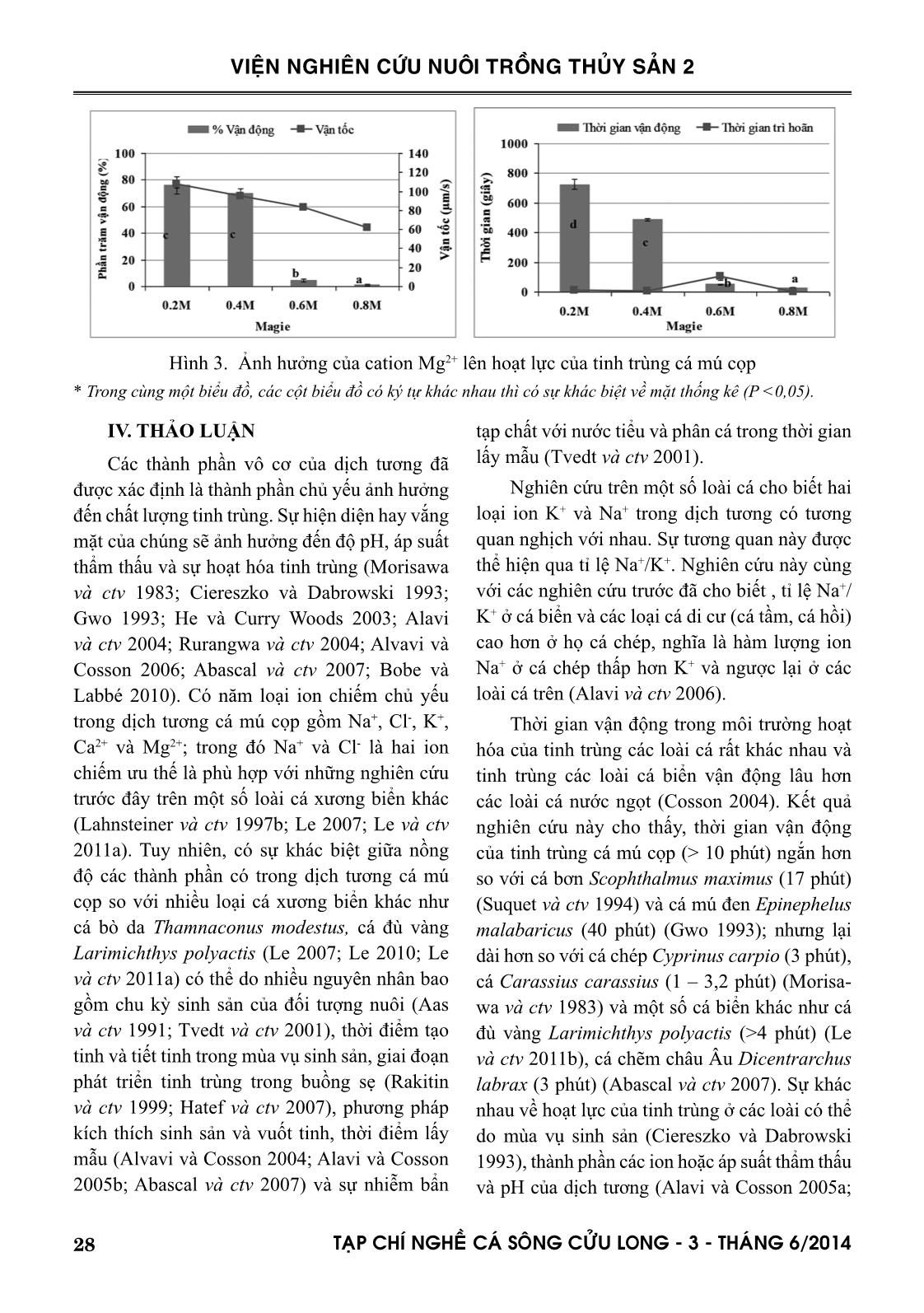
i hoạt hóa tinh trùng trong dung dịch có nồng độ Mg2+ cao hơn. Phân tích thống kê cho thấy, có sự sai khác ý nghĩa về hoạt lực của tinh trùng ở các nồng độ Mg2+ khác nhau (P<0,05), chỉ trừ hai nồng độ 0,2 và 0,4M không có sự sai khác với phần trăm tinh trùng vận động (P>0,05) (Hình 3). Qua các phân tích trên cho thấy, tinh trùng cá mú cọp vận động tối ưu khi được pha loãng trong dung dịch có 0,2M Mg2+. 28 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 IV. THẢO LUẬN Các thành phần vô cơ của dịch tương đã được xác định là thành phần chủ yếu ảnh hưởng đến chất lượng tinh trùng. Sự hiện diện hay vắng mặt của chúng sẽ ảnh hưởng đến độ pH, áp suất thẩm thấu và sự hoạt hóa tinh trùng (Morisawa và ctv 1983; Ciereszko và Dabrowski 1993; Gwo 1993; He và Curry Woods 2003; Alavi và ctv 2004; Rurangwa và ctv 2004; Alvavi và Cosson 2006; Abascal và ctv 2007; Bobe và Labbé 2010). Có năm loại ion chiếm chủ yếu trong dịch tương cá mú cọp gồm Na+, Cl-, K+, Ca2+ và Mg2+; trong đó Na+ và Cl- là hai ion chiếm ưu thế là phù hợp với những nghiên cứu trước đây trên một số loài cá xương biển khác (Lahnsteiner và ctv 1997b; Le 2007; Le và ctv 2011a). Tuy nhiên, có sự khác biệt giữa nồng độ các thành phần có trong dịch tương cá mú cọp so với nhiều loại cá xương biển khác như cá bò da Thamnaconus modestus, cá đù vàng Larimichthys polyactis (Le 2007; Le 2010; Le và ctv 2011a) có thể do nhiều nguyên nhân bao gồm chu kỳ sinh sản của đối tượng nuôi (Aas và ctv 1991; Tvedt và ctv 2001), thời điểm tạo tinh và tiết tinh trong mùa vụ sinh sản, giai đoạn phát triển tinh trùng trong buồng sẹ (Rakitin và ctv 1999; Hatef và ctv 2007), phương pháp kích thích sinh sản và vuốt tinh, thời điểm lấy mẫu (Alvavi và Cosson 2004; Alavi và Cosson 2005b; Abascal và ctv 2007) và sự nhiễm bẩn tạp chất với nước tiểu và phân cá trong thời gian lấy mẫu (Tvedt và ctv 2001). Nghiên cứu trên một số loài cá cho biết hai loại ion K+ và Na+ trong dịch tương có tương quan nghịch với nhau. Sự tương quan này được thể hiện qua tỉ lệ Na+/K+. Nghiên cứu này cùng với các nghiên cứu trước đã cho biết , tỉ lệ Na+/ K+ ở cá biển và các loại cá di cư (cá tầm, cá hồi) cao hơn ở họ cá chép, nghĩa là hàm lượng ion Na+ ở cá chép thấp hơn K+ và ngược lại ở các loài cá trên (Alavi và ctv 2006). Thời gian vận động trong môi trường hoạt hóa của tinh trùng các loài cá rất khác nhau và tinh trùng các loài cá biển vận động lâu hơn các loài cá nước ngọt (Cosson 2004). Kết quả nghiên cứu này cho thấy, thời gian vận động của tinh trùng cá mú cọp (> 10 phút) ngắn hơn so với cá bơn Scophthalmus maximus (17 phút) (Suquet và ctv 1994) và cá mú đen Epinephelus malabaricus (40 phút) (Gwo 1993); nhưng lại dài hơn so với cá chép Cyprinus carpio (3 phút), cá Carassius carassius (1 – 3,2 phút) (Morisa- wa và ctv 1983) và một số cá biển khác như cá đù vàng Larimichthys polyactis (>4 phút) (Le và ctv 2011b), cá chẽm châu Âu Dicentrarchus labrax (3 phút) (Abascal và ctv 2007). Sự khác nhau về hoạt lực của tinh trùng ở các loài có thể do mùa vụ sinh sản (Ciereszko và Dabrowski 1993), thành phần các ion hoặc áp suất thẩm thấu và pH của dịch tương (Alavi và Cosson 2005a; Hình 3. Ảnh hưởng của cation Mg2+ lên hoạt lực của tinh trùng cá mú cọp * Trong cùng một biểu đồ, các cột biểu đồ có ký tự khác nhau thì có sự khác biệt về mặt thống kê (P <0,05). 29TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Alavi và Cosson 2006). Những thông số này có thể được dùng như các chỉ thị cho chất lượng tinh trùng và có thể giúp chọn được tinh trùng tốt cho sinh sản nhân tạo. Tinh trùng cá biển được hoạt hóa trong môi trường có nồng độ cao K+ và Ca2+; trong đó, ion K+ được xem là chìa khóa để hoạt hóa tinh trùng (Alavi và Cosson 2006). Kết quả nghiên cứu này phù hợp với các nghiên cứu trước đây trên cá biển như cá bơn Scophthalmus maximus (Suquet và ctv 1994) và cá đù vàng Larimichthys polyactis (Le và ctv 2011b). Điều này ngược lại với cá nước ngọt, tinh trùng vận động trong môi trường có nồng độ K+ và Ca2+ thấp như ở cá tầm Iran Acipenser persicus (Alavi và Cosson 2005b) và cá rô châu Âu Perca fluviatilis (Alavi và ctv 2007). Ion Na+ là yếu tố ít ảnh hưởng đến hoạt lực của tinh trùng các loài cá, sự ảnh hưởng của chúng lên hoạt lực của tinh trùng cá nước ngọt và nước mặn là khác nhau (Alavi và Cosson 2006; Alavi và ctv 2007). Đối với cá nước ngọt, tinh trùng chỉ vận động trong môi trường có nồng độ ion Na+ thấp như ở cá tầm Iran Acipen- ser persicus tinh trùng vận động tối ưu ở 25mM Na+ (Alavi và Cosson 2005b), 90% tinh trùng cá chép Cyprinus carpio bất hoạt ở môi trường có nồng độ 125mM Na+ (Morisawa và ctv., 1983). Ở cá biển thì ngược lại, tinh trùng vận động tối ưu trong môi trường có nồng độ ion Na+ cao như trên cá đù vàng Larimichthys polyactis là 0,4M Na+ (Le và ctv., 2011b) và trên cá mú cọp Epinephelus fuscogustatus là 0,6M Na+ (nghiên cứu này). Thông tin nghiên cứu về ảnh hưởng của Mg2+ lên hoạt lực của tinh trùng cá còn rất hạn chế. Một vài nghiên cứu cho rằng ion này ít ảnh hưởng đến hoạt lực của tinh trùng cá (Linhart và ctv 2003; Alavi và ctv 2007; Le 2010; Le và ctv 2011b). Các nghiên cứu khác cho biết Mg2+ đóng vai trò trong sự vận động ban đầu của tinh trùng cá sau khi hoạt hóa (Alavi và Cosson 2006; Alavi và ctv 2007). Đây là nghiên cứu đầu tiên khẳng định Mg2+ ảnh hưởng mạnh đến hoạt lực của tinh trùng với nồng độ thích hợp là 0,2 M. V. KẾT LUẬN VÀ ĐỀ XUẤT 5.1. Kết luận Thành phần chính trong dịch tương của tinh trùng cá mú cọp bao gồm các ion: Na+ (176,72 mmol/L), K+ (7,08 mmol/L), Cl- (122,45 mmol/L), Mg2+ (15,07 mmol/L), Ca2+ (2,93 mmol/L); trong đó các ion Na+ và K+; Mg2+ và Cl- thể hiện sự tương quan. Hoạt lực của tinh trùng cá mú cọp trung bình là 93,1% số tinh trùng vận động với vận tốc 140,1 µm/s trong thời gian 557,0 giây khi pha loãng tinh trùng với nước biển nhân tạo ở tỉ lệ 1:100. Tinh trùng cá mú cọp không vận động trong nước cất. Chúng vận động tốt sau khi pha loãng với tỷ lệ 1:100 trong môi trường nước biển nhân tạo lần lượt có chứa 0,6M Na+ hoặc 0,4M K+ hoặc 0,4M Ca2+ hoặc 0,2M Mg2+. 5.2. Đề xuất Cần nghiên cứu về sự thay đổi thành phần hóa học của tinh trùng cá mú cọp ở các thời điểm khác nhau trong mùa sinh sản để đánh giá được chất lượng tinh trùng ở từng thời điểm. Cần nghiên cứu ảnh hưởng của thời gian bảo quản lên chất lượng tinh trùng trong điều kiện nhân tạo thông qua các chỉ số như tỷ lệ thụ tinh, tỷ lệ nở của trứng và sức sống của ấu trùng. LỜI CẢM ƠN Đây là một phần kết quả trong dự án nghiên cứu của quỹ khoa học trẻ Thụy Điển (IFS): “Nghiên cứu một số đặc tính lý hóa và bảo quản tinh trùng cá mú cọp Epinephelus fuscoguttatus (Forsskal, 1775) tại Việt Nam” với mã số A/5165-1 do TS. Lê Minh Hoàng làm chủ nhiệm dự án. 30 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Đoàn Khắc Bộ, 2008. Kỹ thuật nuôi cá mú. Nhà xuất bản Đà Nẵng, 71 trang. Lê Anh Tuấn, 2004. Tình hình nuôi cá mú ở Việt Nam: hiện trạng và các trở ngại về mặt kỹ thuật. Tạp chí Khoa học – Công nghệ Thủy sản, Trường ĐH Thủy sản, số đặc biệt, 174 - 179. Tài liệu tiếng Anh Aas, G.H., Refstie, T., and Gjerde, B., 1991. Evaluation of milt quality of Atlantic salmon. Aquaculture 95, 125-132. Abascal, F.J., Cosson, J., and Fauvel, C., 2007. Characterization of sperm motility in sea bass: the effect of heavy metals and physicochemical variables on sperm motility. Journal Fish Biology 70, 509-522. Alavi, S.M.H., Cosson, J., Karami, M., Abdolhay, H., and Amiri, B.M., 2004. Chemical composition and osmolality of seminal fluid of Acipenser persicus; their physiological relationship with sperm motility. Aquaculture Research 35, 1238- 1243. Alavi, S.M.H., and Cosson, J., 2005a. Sperm motility in fishes: (I) effects of temperature and pH. Cell Biology International 29, 101-110. Alavi, S.M.H., and Cosson, J., 2005b. Spermatozoa motility in the Persian sturgeon, Acipenser persicus: effects of pH, dilution rate, ions and osmolality. Aquaculture Research 36, 841-850. Alavi, S.M.H., and Cosson, J., 2006. Sperm motility in fishes: (II) Effects of ions and osmolality. Cell Biology International 30, 1-14. Alavi, S.M.H., Rodina, M., Policar, T., Kozak, P., Psenicka, M. and Linhart, O., 2007. Semen of Perca fluviatilis L.: Sperm volume and density, seminal plasma indices and effects of dilution ratio, ions and osmolality on sperm motility. Theriogenology 68, 276-283. Bobe, J., and Labbé, C., 2010. Egg and sperm quality in fish. General and Comparative Endocrinology 165, 535-548. Chang, Y.J., Choi, Y.H., Lim, H.K. and Kho, K.H., 1999. Milt property and sperm motility of grey mullet Mugil cephalus. J Kor Fish Soc. 32, 238- 241. Charles, D. and Peter, T., 1998. Role of Ions and Ion Channels in the Regulation of Atlantic Croaker Sperm Motility. The Journal of Experimental Zoology 281, 139–148. Ciereszko, A., and Dabrowski, K., 1993. Estimation of sperm concentration of rainbow trout, whitefish and yellow perch using a spectrophotometric technique. Aquaculture 109, 367-373. Cosson, J., 2004. The ionic and osmotic factors controlling motility of fish spermatozoa. Aquaculture International 12, 69-85. Gwo, J.C., 1993. Cryopreservation of black grouper Epinephelus malabaricus spermatozoa. Theriogenology 39, 1331-1342. Hatef, A., Niksirat, H., Amiri, B.M., Alavi, S.M.H. and Karami, M., 2007. Sperm desity, seminal plasma composition and their physiological relationship in the endangered Caspian brown trout Salmo trutta caspius. Aquaculture Research 38, 1175- 1181. He, S.Y. and Curry Woods, L., 2003. The Effects of Osmolality, Cryoprotectant and Equilibration Time on Striped Bass Morone saxatilis Sperm Motility. Journal of The World Aquaculture Society 34(3), 255-265. Lahnsteiner, F., Berger, B., Weismann, T. and Patzner, R.A., 1996. Physiological and biochemical determination of rainbow trout Oncorhynchus mykiss semen quality for cryopreservation. J Appl Aquacult 6, 47-73. Lahnsteiner, F., Berger, B., Weismann, T. and Patzner, R.A., 1997a. Sperm motility and seminal fluid composition in the burbot Lota lota. J Appl Ichthyol 13, 113-119. Lahnsteiner, F., Berger, B., Weismann, T. and Patzner, R.A., 1997b. Sperm structure and motility of the freshwater teleost Cottus gobio. Journal of Fish Biology 50, 564–574. 31TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Le, M.H., Lim, H.K., Min, B.H., Kim, S.Y. and Chang, Y.J., 2007. Milt properties and spermatozoa structure of filefish Thamnaconus modestus, Dev Reprod. 11, 227-233. Le, M.H., 2010. Reproductive cycle and semen preservation of yellow croaker Larimichthys polyactis. Ph.D thesis, Pukyong National University, Korea, p. 168. Le, M.H., Lim, H.K., Min, B.H., Lee, J.U. and Chang, Y.J., 2011a. Semen properties and spermatozoan structure of yellow croaker Larimichthys polyactis. Israeli Journal of Aquaculture 63, p. 8. Le, M.H., Lim, H.K., Min, B.H., Park, M.S., Son, M.H., Lee, J.U. and Chang, Y.J., 2011b. Effects of varying dilutions, pH, temperature and cations on sperm motility in fish Larimichthys polyactis. Journal of Environmental Biology 32, 271-276. Linhart, O., Cosson, J., Mims, S.D., Rodina, M., Gela, D. and Shelton, W.L., 2003. Effects of ions on the motility of fresh and demembranate spermatozoa of common carp Cyprinus carpio and paddlefish Polyodon spathula. Fish Physiol Biochemical 28, 203-205. Morisawa, M., Suzuki, K., Shimizu, H., Morisawa, S. and Yasuda, K., 1983. Effects of osmolality and potassium on motility of spermatozoa from freshwater Cyprinid fishes. J.exp.Biol. 107, 95-103. Rakitin, A., Ferguson, M.M. and Trippel, E.A., 1999. Spermatocrit and spermatozoa density in Atlantic cod Gadus morhua: correlation and variation during the spawning season. Aquaculture. 170, pp. 349-358. Rurangwa, E., Kime, D.E., Ollevier, F. and Nash, J.P., 2004. The measurement of sperm motility and factors affecting sperm quality in cultured fish. Aquaculture 234, 1-28. Suquet, M., Billard, R., Cosson, J., Dorange, G., Chauvaud, L., Mugnier, C. and Fauvel, C., 1994. Sperm features in turbot Scophthalmus maximus: a comparison with other freshwater and marine fish species. Aquat Liv Resour. 7, 283-294. Tan-Fermin, J.D., Miura, T., Adachi, S. and Yamauchi, K., 1999. Seminal plasma composition, sperm motility and milt dilution in the Asian catfish Clarias macrocephalus. Aquaculture 171, 323- 338. Tvedt, H.B., Benfey, T.J., Martin-Robichaud, D.J. and Power, J., 2001. The relationship between sperm density, spermatocrit, sperm motility and fertilization success in Atlantic halibut Hippoglossus hippoglossus. Aquaculture 194, pp. 191-200. 32 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 SOME SEMEN PROPERTIES AND EFFECTS OF CATIONS ON SPERM MOTILITY FROM TIGER GROUPER (Epinephelus fuscoguttatus Forsskal, 1775) Hoang Thi Hien1, Le Minh Hoang2 ABSTRACT The aims of this study were to determine the properties of semen and to study the effects of cations on motility of spermatozoa from tiger grouper Epinephelus fuscoguttatus. The major composition of seminal plasma of tiger grouper contained 176.72 ± 2.616 mmol/L Na+; 7.08 ± 1.699 mmol/L K+; 122.45 ± 4.815 mmol/L Cl-; 15.07 ± 1.586 mmol/L Mg2+; 2.93 ± 0.740 mmol/L Ca2+. The percent- age of motile sperm (%), sperm longevity (second) and sperm velocity (µm/s) in artificial seawater (at a diluted ratio of 1:100, spermatozoa:seawater) were 93.1±0.86 %; 557.0±7.55s and 140.1±1.47 µm/s, respectively. The spermatozoa of tiger grouper were immotile in distilled water, they was only activated in a solution containing various cations. The results also showed that spermatozoa of tiger grouper were extremely sensitive to cation concentration in surrounding environment. The motility of these spermatozoa when they were activated in each solution containing 0.6M NaCl; 0.4M KCl; 0.4M CaCl 2 and 0.2M MgCl 2 was better than that when they were activated in any other concentrations. Keywords: Cations, motility, properties, sperm, tiger grouper. Người phản biện: TS. Trịnh Quốc Trọng Ngày nhận bài: 10/02/2014 Ngày thông qua phản biện: 28/02/2014 Ngày duyệt đăng: 30/3/2014 1 Minh Hai Sub-Institute for Fisheries Research, Research Institute for Aquaculture No 2. Email: hoanghien153@yahoo.com.vn 2 Nha Trang University.
File đính kèm:
 mot_so_dac_tinh_cua_tinh_trung_va_anh_huong_cac_cation_len_h.pdf
mot_so_dac_tinh_cua_tinh_trung_va_anh_huong_cac_cation_len_h.pdf

