Khả năng kiểm soát sinh học Vibrio parahaemolyticus NT7 phân lập từ tôm thẻ bệnh hoại tử gan tụy (AHPND) của chủng Bacillus polyfermenticus F27 phân lập từ giun quế
TÓM TẮT
Bệnh hoại tử gan tụy ở tôm được phát hiện đầu tiên ở Trung Quốc năm 2009 và gây hại cho
nghề nuôi tôm ở nhiều nước kể cả Việt Nam. Trong nghiên cứu này, chúng tôi sàng lọc khả năng
kháng Vibrio parahaemolyticus gây bệnh hoại tử gan tụy của một số chủng Bacillus. Chủng V.
parahaemolyticus NT7 sử dụng trong nghiên cứu này được phân lập từ mẫu tôm thẻ chân trắng
bệnh hoại tử gan tụy tại Ninh Thuận và đã được định danh bằng phương pháp sinh hóa. Bằng
phương pháp vạch vuông góc và giếng khuếch tán, chúng tôi sàng lọc được chủng Bacillus
polyfermenticus F27 đối kháng V. parahaemolyticus NT7 với đường kính lớn nhất là 18,50 mm. B.
polyfermenticus F27 có khả năng ức chế V. parahaemolyticus NT7 khi tiến hành đồng nuôi cấy,
không gây tiêu huyết và an toàn đối với tôm thẻ giống với tỷ lệ sống 100% của nghiệm thức thử
nghiệm. Kết quả khảo sát LD50 khi gây nhiễm V. parahaemolyticus NT7 lên tôm thẻ giống là 1,12.
105 CFU/ml. Tiến hành thử nghiệm đánh giá khả năng bảo vệ vật chủ của chủng B. polyfermenticus
F27, chúng tôi nhận thấy chủng có khả năng bảo vệ tôm thẻ giống từ chủng V. parahaemolyticus
NT7 gây bệnh. Những kết quả trên cho thấy rằng chủng Bacillus polyfermenticus F27 có tiềm năng
để sản xuất chế phẩm sinh học kiểm soát và phòng bệnh EMS/AHPNS trên tôm.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5
Trang 6

Trang 7

Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Khả năng kiểm soát sinh học Vibrio parahaemolyticus NT7 phân lập từ tôm thẻ bệnh hoại tử gan tụy (AHPND) của chủng Bacillus polyfermenticus F27 phân lập từ giun quế

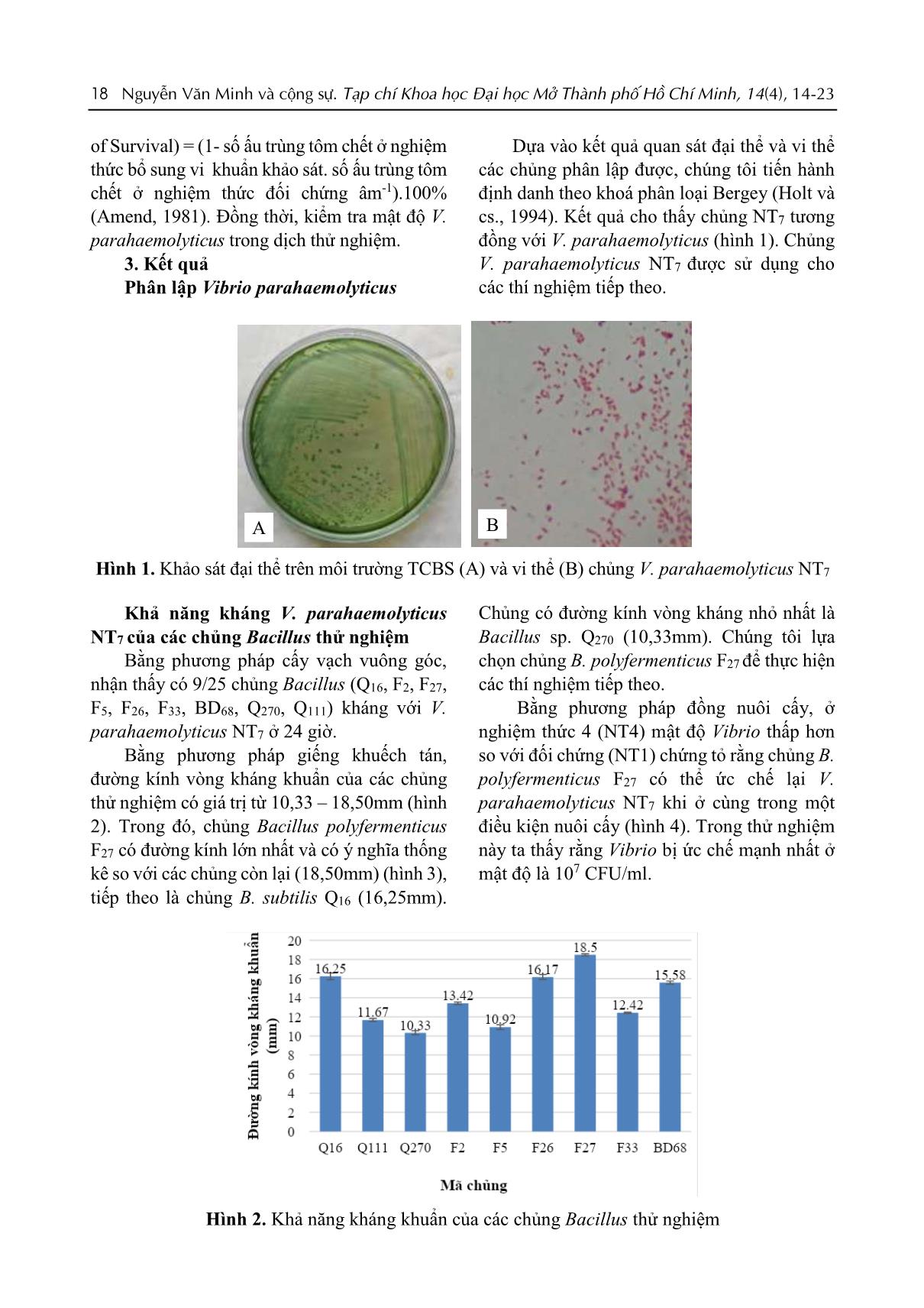
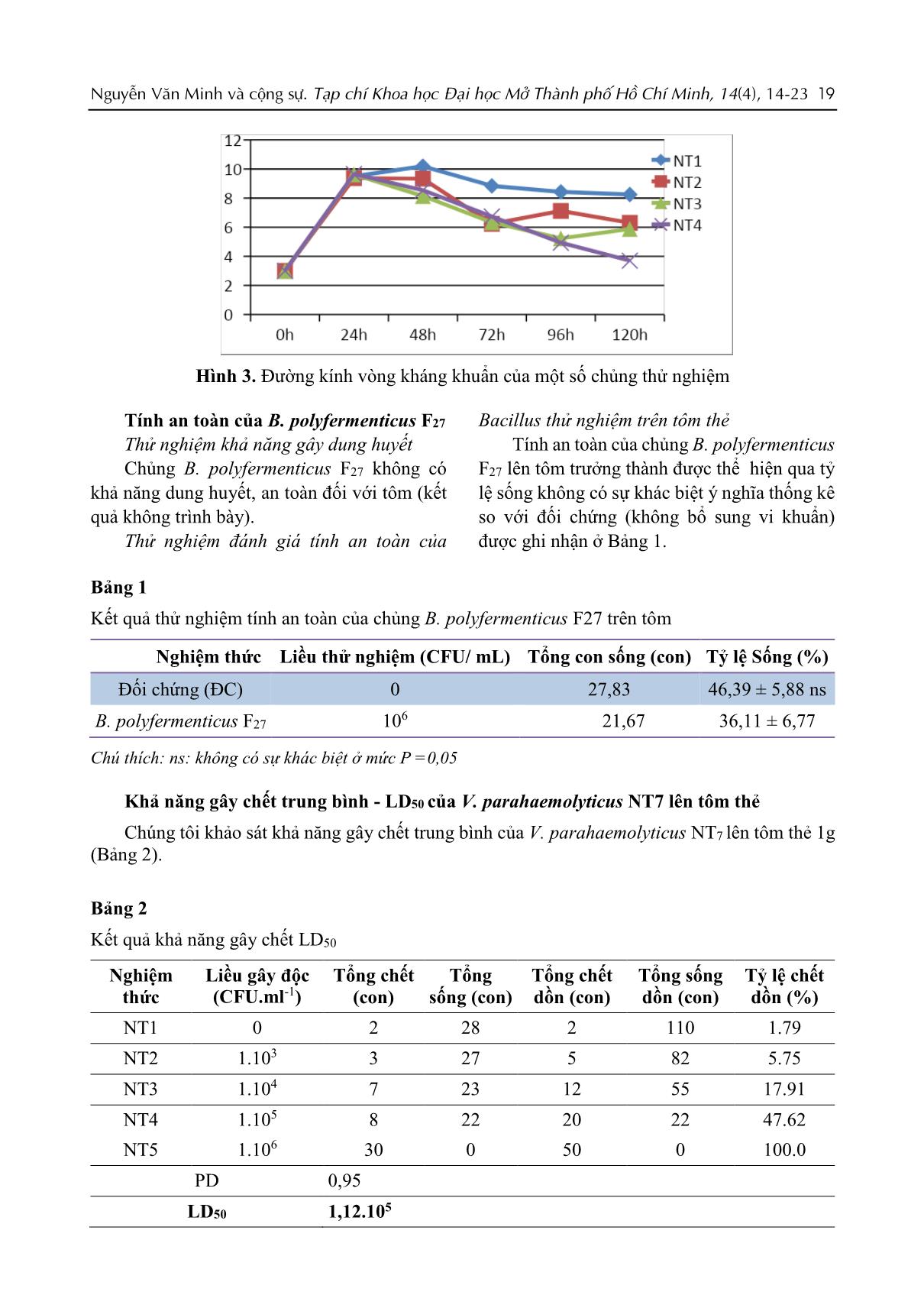
24 giờ. Bằng phương pháp giếng khuếch tán, đường kính vòng kháng khuẩn của các chủng thử nghiệm có giá trị từ 10,33 – 18,50mm (hình 2). Trong đó, chủng Bacillus polyfermenticus F27 có đường kính lớn nhất và có ý nghĩa thống kê so với các chủng còn lại (18,50mm) (hình 3), tiếp theo là chủng B. subtilis Q16 (16,25mm). Chủng có đường kính vòng kháng nhỏ nhất là Bacillus sp. Q270 (10,33mm). Chúng tôi lựa chọn chủng B. polyfermenticus F27 để thực hiện các thí nghiệm tiếp theo. Bằng phương pháp đồng nuôi cấy, ở nghiệm thức 4 (NT4) mật độ Vibrio thấp hơn so với đối chứng (NT1) chứng tỏ rằng chủng B. polyfermenticus F27 có thể ức chế lại V. parahaemolyticus NT7 khi ở cùng trong một điều kiện nuôi cấy (hình 4). Trong thử nghiệm này ta thấy rằng Vibrio bị ức chế mạnh nhất ở mật độ là 107 CFU/ml. Hình 2. Khả năng kháng khuẩn của các chủng Bacillus thử nghiệm A B Nguyễn Văn Minh và cộng sự. Tạp chí Khoa học Đại học Mở Thành phố Hồ Chí Minh, 14(4), 14-23 19 Hình 3. Đường kính vòng kháng khuẩn của một số chủng thử nghiệm Tính an toàn của B. polyfermenticus F27 Thử nghiệm khả năng gây dung huyết Chủng B. polyfermenticus F27 không có khả năng dung huyết, an toàn đối với tôm (kết quả không trình bày). Thử nghiệm đánh giá tính an toàn của Bacillus thử nghiệm trên tôm thẻ Tính an toàn của chủng B. polyfermenticus F27 lên tôm trưởng thành được thể hiện qua tỷ lệ sống không có sự khác biệt ý nghĩa thống kê so với đối chứng (không bổ sung vi khuẩn) được ghi nhận ở Bảng 1. Bảng 1 Kết quả thử nghiệm tính an toàn của chủng B. polyfermenticus F27 trên tôm Nghiệm thức Liều thử nghiệm (CFU/ mL) Tổng con sống (con) Tỷ lệ Sống (%) Đối chứng (ĐC) 0 27,83 46,39 ± 5,88 ns B. polyfermenticus F27 10 6 21,67 36,11 ± 6,77 Chú thích: ns: không có sự khác biệt ở mức P =0,05 Khả năng gây chết trung bình - LD50 của V. parahaemolyticus NT7 lên tôm thẻ Chúng tôi khảo sát khả năng gây chết trung bình của V. parahaemolyticus NT7 lên tôm thẻ 1g (Bảng 2). Bảng 2 Kết quả khả năng gây chết LD50 Nghiệm thức Liều gây độc (CFU.ml-1) Tổng chết (con) Tổng sống (con) Tổng chết dồn (con) Tổng sống dồn (con) Tỷ lệ chết dồn (%) NT1 0 2 28 2 110 1.79 NT2 1.103 3 27 5 82 5.75 NT3 1.104 7 23 12 55 17.91 NT4 1.105 8 22 20 22 47.62 NT5 1.106 30 0 50 0 100.0 PD 0,95 LD50 1,12.105 20 Nguyễn Văn Minh và cộng sự. Tạp chí Khoa học Đại học Mở Thành phố Hồ Chí Minh, 14(4), 14-23 Kết quả Bảng 2 cho thấy nghiệm thức NT1 (đối chứng âm) không thấy biểu hiện tôm chết. Điều này chứng tỏ rằng tôm chết là do độc lực từ vi khuẩn gây ra. Dựa vào công thức tính LD50, nhận thấy rằng tỷ lệ chết 50% của tôm sau khi cảm nhiễm V. parahaemolyticus NT7 là 1,12.105 CFU/ml. Khả năng bảo vệ tôm thẻ trong điều kiện cảm nhiễm V. parahaemolyticus NT7 Với kết quả xác định liều gây độc (LD50) là 1,12.105, chúng tôi thử nghiệm đánh giá hiệu quả kiểm soát sinh học của chủng B. polyfermenticus F27. Kết quả bảng 3 cho thấy nghiệm thức NT3, NT4 được bổ sung chủng B. polyfermenticus F27 với các mật độ 106 và 107 CFU/mL trong điều kiện gây nhiễm vi khuẩn gây bệnh V. parahaemolyticus NT7 thì có tỷ lệ tôm sống cao hẳn hơn so với nghiệm thức NT1 chỉ bổ sung V. parahaemolyticus NT7 và có sự khác biệt có ý nghĩa (P < 0,05). RPS (%) của các nghiệm thức NT3, NT4 lần lượt là 66,7% và 76,19% cho thấy chủng vi khuẩn khảo sát có khả năng bảo vệ tôm gây nhiễm với V. parahaemolyticus NT7 khá cao ở mật độ 106 và 107 CFU/ mL. Từ kết quả trên, chủng B. polyfermenticus F27 đạt mật độ 106 CFU/ml đã có khả năng bảo vệ tôm chống lại V. parahaemolyticus NT7 và đạt hiệu quả tốt hơn ở mật độ 107 CFU/ml.. Bảng 3 Kết quả tỷ lệ sống (%) và RPS (%) khi gây nhiễm V. parahaemolyticus NT7 Nghiệm thức Tỉ lệ sống (%) RPS (%) NT1 30,00 NT2 93,33 NT3 73,33 66,7 NT4 83,33 76,19 Trong cùng một cột, các trị số có cùng mẫu tự không có sự khác biệt ớ mức ý nghĩa P=0,05 qua phép thử Duncan. Đồng thời, trong thời gian thử nghiệm, chúng tôi kiểm tra mật độ V. parahaemolyticus ở các nghiệm thức. Nghiệm thức NT1 mật độ Vibrio luôn cao hơn so với NT3 và NT4. Điều này cho thấy chủng B. polyfermenticus F27 có khả năng ức chế vi khuẩn V. parahaemolyticus trên quy mô thực nghiệm (hình 4), giúp khẳng định lại khả năng ức chế của chủng B. polyfermenticus F27 ở mật độ 106 CFU/ml và ức chế cao ở mật độ 107 CFU/ml. Hình 4. Kết quả kiểm tra mật độ V. parahaemolyticus ở các nghiệm thức Nguyễn Văn Minh và cộng sự. Tạp chí Khoa học Đại học Mở Thành phố Hồ Chí Minh, 14(4), 14-23 21 4. Thảo luận Nhiều nghiên cứu về vi khuẩn Bacillus spp. đã cho thấy rằng chúng có thể làm giảm mật độ vi khuẩn gây bệnh trong nuôi trồng thủy sản. Như báo cáo của Vaseeharan, Ramasamy (2003) đã sử dụng Bacillus subtilis BT23 để kiểm soát V. harveyi. Nghiên cứu của Balcazar và Tyrone (2007) cũng cho thấy Bacillus subtilis UTM 126 có khả năng kiểm soát sinh học chủng V. parahaemolyticus (Balcazar và Tyrone, 2007). Nguyễn Văn Minh và cộng sự (2011) đã sử dụng 3 chủng vi khuẩn Bacillus spp. (F11, F33, F10) có khả năng kiểm soát sự tăng trưởng của 3 chủng vi khuẩn gây bệnh là V. parahaemolyticus, V. alginolyticus, V. harveyi ở mật độ Bacillus spp. tốt nhất là 109 CFU/ml (Nguyễn Văn Minh và cs., 2011). Ở nghiên cứu này, chúng tôi chọn lọc được chủng B. polyfermenticus F27 có khả năng kháng V. parahaemolyticus NT7 cao nhất (18,50 mm). Ở thử nghiệm tính an toàn của chủng B. polyfermenticus F27 được đánh giá dựa trên 2 thử nghiệm là khả năng huyết giải và tính an toàn đối với tôm. Thử nghiệm khả năng dung huyết là bước sàng lọc tính gây bệnh của các chủng để đảm bảo an toàn đối với động vật thủy sản và cho động vật có vú nói chung nhằm đảm bảo tính an toàn khi thực phẩm thủy sản bị nhiễm cho con người qua chuỗi thức ăn (Shafiqur, 2009). Trong nghiên cứu của Shafiqur (2009) về Bacillus spp. phân lập được từ ao tôm tỉ lệ dương tính hemolysin là 48,64%. Chủng B. polyfermenticus F27 được đánh giá an toàn đối với tôm nên được lựa chọn để tiến hành thử nghiệm tiếp theo. Nguyễn Văn Minh và cộng sự (2011) đã phân lập được 2 chủng Bacillus sp. F10 và F11 từ giun quế có khả năng bảo vệ ấu trùng tôm sú chống lại V. parahaemolyticus (Nguyễn Văn Minh và cs., 2011). “Kết quả của nghiên cứu thí nghiệm khả năng bảo vệ tôm giống trong điều kiện cảm nhiễm V. parahaemolyticus NT7 cho thấy B. polyfermenticus F27 có khả năng bảo vệ tôm giống”. 5. Kết luận Hiện nay, tình trạng lạm dụng kháng sinh và hóa chất trong nuôi trồng thủy sản ngày càng gia tăng, làm tiêu diệt các vi khuẩn gây bệnh lẫn các vi khuẩn có lợi, gây ra tình trạng kháng thuốc và dư lượng kháng sinh và hóa chất còn gây ảnh hưởng đến chất lượng sản phẩm và sức khỏe người sử dụng. Do đó kết quả của nghiên cứu này giúp mở ra một hướng phát triển mới cho ngành chế phẩm thủy sản - chế phẩm an toàn cho con người và không ảnh hưởng đến môi trường sinh thái. Chúng tôi đã phân lập được chủng V. parahaemolyticus NT7 từ mẫu tôm thẻ bệnh hoại tử gan tụy. Thử nghiệm khả năng đối kháng bằng phương pháp cấy vạch vuông góc cho thấy có 9 trong số 25 chủng Bacillus kháng V. parahaemolyticus NT7. Trong đó, chủng B. polyfermenticus F27 phân lập từ giun quế có đường kính lớn nhất là 18,50 mm, khác biệt thống kê so với các chủng còn lại, có khả năng ức chế V. parahaemolyticus NT7 khi tiến hành đồng nuôi cấy, an toàn đối với tôm giống được lựa chọn cho những thử nghiệm tiếp theo. Đồng thời chứng minh được chủng B. polyfermenticus F27 có khả năng bảo vệ tôm thẻ chống lại V. parahaemolyticus gây bệnh trên mô hình gây nhiễm nhân tạo. Sau thời gian thử nghiệm, 93,33% tôm ở nghiệm thức đối chứng không bổ sung vi khuẩn (NT2) vẫn sống và hoạt động bình thường chứng tỏ các yếu tố môi trường không ảnh hưởng đến tôm. Bên cạnh đó, tôm chết ở các nghiệm thức đều có dấu hiệu của bệnh hoại tử gan tụy và phân lập được V. parahaemolyticus từ những mẫu này. Điều này chứng tỏ tôm ở các nghiệm thức chết là do V. parahaemolyticus. Số lượng tôm sống ở các nghiệm thức có sự khác biệt có ý nghĩa (P < 0,05). Trong đó, các nghiệm thức NT3, NT4 bổ sung B. polyfermenticus F27 với mật độ 106 và 107 CFU/ml có tỷ lệ sống cao hơn gấp 2,44 và 2,78 lần so với nghiệm thức đối chứng NT1. RPS (%) của các nghiệm thức NT3, NT4 đều lớn hơn 50% cho thấy khả năng bảo vệ tôm khá cao của chủng khảo sát. Kết quả của nghiên cứu này cho thấy chủng Bacillus polyfermenticus F27 có tiềm năng ứng dụng sản xuất chế phẩm sinh học kiểm soát và phòng bệnh EMS/AHPNS trên tôm. 22 Nguyễn Văn Minh và cộng sự. Tạp chí Khoa học Đại học Mở Thành phố Hồ Chí Minh, 14(4), 14-23 Tài liệu tham khảo Balcazar, J. L. & Rojas-Luna, T. (2007). Inhibitory activity of probiotic Bacillus subtilis UTM 126 against Vibrio species confers protection against vibriosis in juvenile shrimp (Litopenaeus vannamei). Curr Microbiol, 55(5), 409-412. Chythanya, R., Karunasagar, I. & Karunasagar, I. (2002). Inhibition of shrimp pathogenic vibrios by a marine Pseudomonas I-2 strain. Aquaculture, 208, 1-10. Domorongpokkaphan, V. & Wanchaitanawong, P. (2006). In vitro Antimicrobial Activity of Bacillus spp. Against Pathogenic Vibrio spp. in Black Tiger Shrimp (Penaeus monodon). Kasetsart J., 40, 949-957. FAO (2013). Report of the FAO/MARD technical workshop on early mortality syndrome (EMS) or acute hepatopancreatic necrosis syndrome (AHPNS) of cultured shrimp (under TCP/VIE/3304) Hanoi, Vietnam, on 25–27 June 2013. FAO Fisheries and Aquaculture Report No. 1053. Flegel, T.W. (2012). Historic emergence, impact and current status of shrimp pathogens in Asia. Journal of Invertebrate Pathology, 110, 166-173. Gatesoupe, F. J. (1999). The use of probiotics in aquaculture. Aquaculture 180, 147-165. Smibert, R.M. and Krieg, N.R. (1981) General Characterization. In: Gerdhardt, P., Murray, R.G.E., Costilow, R.N., Nester, E.W., Wood, W.A., Krieg, N.R. and Phillips, G.B., Eds., Manual of Methods for General Bacteriology, American Society for Microbiology, Washington, DC, 409-443. Han, J. E. et al. (2015). Plasmid mediated tetracycline resistance of Vibrio parahaemolyticus associated with acute hepatopancreatic necrosis disease (AHPND) in shrimps. Aquaculture, 2, 17-21. Holt, J. G. et al. (1994). Bergey's Manual of Determinative Bacteriology 9th edition, Chapper V, 816 pages. Kondo, H. et al. (2014). Draft genome sequences of six strains of Vibrio parahaemolyticus Isolated from Early Mortality Syndrome/Acute Hepato- pancreatic Necrosis Disease shrimp in Thailand. Genome Announc, 2(2), (e00221-14). Lightner, D.V. et al. (2013). Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Diseases of Aquatic Organisms, 105, 45-55. Lightner, D.V. et al. (2012). Early mortality syndrome affects shrimp in Asia. Global Aquaculture Advocate, January/February, 40. MacFaddin, J.F. (2000). Biochemical Tests for Identification of Medical Bacteria. 3rd Edition, Lippincott Williams & Wilkins, Philadelphia. Mooney, A. (2012). An emerging shrimp disease in Vietnam, microsporidiosis or liver disease? Available at: (accessed 24 Feb 2012). Moriarty, D. J. W. (1997). The role of microorganisms in aquaculture ponds. Aquaculture, 151, 333-349. NACA-FAO (Network of Aquaculture Centers in Asia-Pacific-Food and Agriculture Organization of the United Nations) (2011). Quarterly Aquatic Animal Disease Report (Asia and Pacific Nguyễn Văn Minh và cộng sự. Tạp chí Khoa học Đại học Mở Thành phố Hồ Chí Minh, 14(4), 14-23 23 Region), 2011/2, April–June 2011. NACA, Bangkok. Nguyễn Văn Minh, Nguyễn Hoàng Tuấn Duy, Đỗ Phương Quỳnh, Võ Ngọc Yến Nhi, Dương Nhật Linh, Nguyễn Thị Ngọc Tĩnh, Lê Hồng Phước (2013). Khả năng kiểm soát sinh học Edwardsiella ictaluri gây bệnh của một số chủng Bacillus spp. phân lập từ ao nuôi cá tra. Tạp chí Khoa học và Công nghệ, 51(5C), 508-512. Nguyễn Văn Minh, Dương Nhật Linh, Đan Duy Pháp, Lai Phong Mỹ Lệ, Lại Thị Minh Lê, Nguyễn Thị Hồng Phương, , Phạm Hùng Vân (2010). Phân lập và sàng lọc một số vi khuẩn tiềm năng làm probiotic trong nuôi trồng thủy sản từ trùn quế (Perionyx excavatus). Hội nghị CNSH thủy sản toàn quốc, Bộ Nông Nghiệp và Phát Triển Nông Thôn. Nguyễn Văn Minh, Dương Nhật Linh, Đỗ Bảo Ngọc, Trần Thị Khánh Linh, Hà Thị Bảo Yến, Nguyễn Văn Hòa, Nguyễn Thị Ngọc Tĩnh (2011). Nghiên cứu khả năng kiểm soát Vibrio spp. gây bệnh trên tôm sú của một số chủng Bacillus spp. phân lập từ trùn quế. Tạp chí NN & PTNN, 137 -143. Purivirojkul, W. & Areechon, N. (2007). Application of Bacillus spp. isolated from the intestine of blacktiger shrimp (Penaeus monodon Fabricius) from natural habitat for control pathogenic bacteria in aquaculture. Kasetsart J. (Nat. Sci.) 41, 125-132. Shafiqur, R.et al. (2009) Application of probiotic bacteria: A novel approach towards ensuring food safety in shrimp aquaculture. Journal of Bangladesh Academy of Sciences, 33(1), 139-144. Schryver, P., Defoirdt, T. & Sorgeloos, P. (2014). Early Mortality Syndrome Outbreaks: A Microbial Management Issue in Shrimp Farming?. Pathogens magazines, Ghent University, Gent, Belgium. Ravi, A .V. et al. (2007). Screening and evaluation of probiotics as a biocontrol agent against pathogenic Vibrios in marine aquaculture. Lett Appl Microbiol, 45(2), 219-223. Reed, J. L. & Muench, H. (1938). A simple method of estimating fifty percent Endpoints. The American journal of hygiene, 27, 493-497. Tran, L. et al. (2013). Determination of the infectious nature of the agent of acute hepato-pancreatic necrosis syndrome affecting penaeid shrimp. Diseases of Aquatic Organisms, 105, 45–55. Tổng cục Thủy sản (2014a). Hội thảo Khoa học bệnh Đốm trắng và bệnh Hoại tử gan tụy cấp trên tôm nuôi nước lợ, benh/tinh-hinh-dich-benh-111om-trang-va-benh-hoai-tu-gan-tuy-cap-tren-tom-nuoi-nuoc-lo/. Tổng cục thủy sản (2014b). Tình hình sản xuất thủy sản năm 2014, thong-tin-huu-ich/thong-tin-thong-ke/thong-ke-1/tinh-hinh-san-xuat-thuy-san-nam-2014/. Trần Linh Thước (2010). Phương pháp phân tích vi sinh vật trong nước, thực phẩm và mỹ phẩm. NXB Giáo Dục Việt Nam, 70 trang. Vaseeharan, B., Lin, J. & Ramsamy, P. (2003). Control of pathogenic Vibrio spp. by Bacillus subtilis BT23, a Possible Probiotic Treatment for Black Tiger Shrimp (Penaeus monodon). Lett Appl Microbiol, 36(2), 83-87. Verschuere, L., Rombaut, P. & Verstraete, W. (2000). Probiotic bacteria as biological control agents in aquaculture. Microbiology Molecular Biology Reviews, 64(4), 655-671. Zorriehzahra, M.J. & Banaederakhshan, R. (2015). Early mortality syndrome (EMS) as new emerging threat in shrimp industry. Adv. Anim. Vet. Sci., 3, 64-72.
File đính kèm:
 kha_nang_kiem_soat_sinh_hoc_vibrio_parahaemolyticus_nt7_phan.pdf
kha_nang_kiem_soat_sinh_hoc_vibrio_parahaemolyticus_nt7_phan.pdf

