Hiệu quả các dịch chiết khổ sâm (Croton tonkinensis ) và đơn châu chấu (Aralia armata ) trong phòng trị bệnh hoại tử gan tụy cấp trên tôm thẻ chân trắng (Penaeus vannamei) ở điều kiện phòng thí nghiệm
TÓM TẮT
Bệnh hoại tử gan tụy cấp tính (AHPND) xuất hiện đầu tiên ở Trung Quốc năm 2009, sau đó phát
tán đến Việt Nam năm 2010. Nó gây ảnh hưởng tiêu cực cho ngành công nghiệp tôm ở Việt Nam
với thiệt hại kinh tế khoảng 7,2 triệu Đô la Mỹ trong năm 2012. Mục tiêu của nghiên cứu này là thử
nghiệm tính hiệu quả của hai dịch chiết Khổ sâm (Croton tonkinensis) và Đơn châu chấu (Aralia
armata) về khả năng phòng AHPND được gây ra bởi Vibrio parahaemolyticus ở tôm thẻ chân trắng
(Penaeus vannamei) bằng gây cảm nhiễm thực nghiệm. Có hai thí nghiệm được thực hiện: (1)
Phòng bệnh bằng hai loại dịch chiết Khổ sâm hoặc Đơn châu chấu được trộn vào thức ăn với hai
nồng độ gồm 2% (20 g dịch chiết/kg thức ăn) và 4% (40 g dịch chiết/kg thức ăn), tôm được cho ăn
liên tục suốt 7 ngày trước và sau khi gây nhiễm bệnh bằng phương pháp ngâm trực tiếp dịch nuôi
cấy vi khuẩn vào bể tôm. (2) Phòng bệnh bằng hai loại dịch chiết Khổ sâm hoặc Đơn châu chấu
được cho trực tiếp vào nước nuôi tôm với hai nồng độ gồm 15 ppm (0,45 g dịch chiết/bể/30 lít
nước) và 20 ppm (0,6 g dịch chiết/bể/30 lít nước). Tôm được ngâm dịch chiết 1 giờ trước khi gây
nhiễm bệnh bằng phương pháp ngâm trực tiếp dịch nuôi cấy vi khuẩn vào bể tôm, và thêm 1 lần
cùng nồng độ dịch chiết đó ở 24 giờ sau gây nhiễm bệnh. Kết quả thí nghiệm 1 cho thấy tỷ lệ sống
trung bình khi kết thúc thí nghiệm phòng bệnh (7 ngày) với hai dịch chiết trên ở các nồng độ 2% và
4% đều lớn hơn 60%, và tỷ lệ này có sự khác biệt ý nghĩa thống kê (p<0,05) so="" với="" đối="" chứng.="">
với thí nghiệm 2, tỷ lệ sống trung bình sau khi kết thúc thí nghiệm phòng bệnh (9 ngày) của nhóm
ngâm dịch chiết với nồng độ 20 ppm là lớn hơn 60%, và tỷ lệ này có sự khác biệt ý nghĩa thống kê
(p<0,05) so="" với="" đối="" chứng.="" từ="" các="" kết="" quả="" trên,="" chúng="" tôi="" đề="" xuất="" hai="" dịch="" chiết="" này="" có="" khả="">
phòng AHPND ở tôm thẻ chân trắng với liều 2% trộn vào thức ăn hoặc ngâm vào nước nuôi với
nồng độ 20 ppm trong điều kiện phòng thí nghiệm.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7
Trang 8
Trang 9
Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Hiệu quả các dịch chiết khổ sâm (Croton tonkinensis ) và đơn châu chấu (Aralia armata ) trong phòng trị bệnh hoại tử gan tụy cấp trên tôm thẻ chân trắng (Penaeus vannamei) ở điều kiện phòng thí nghiệm

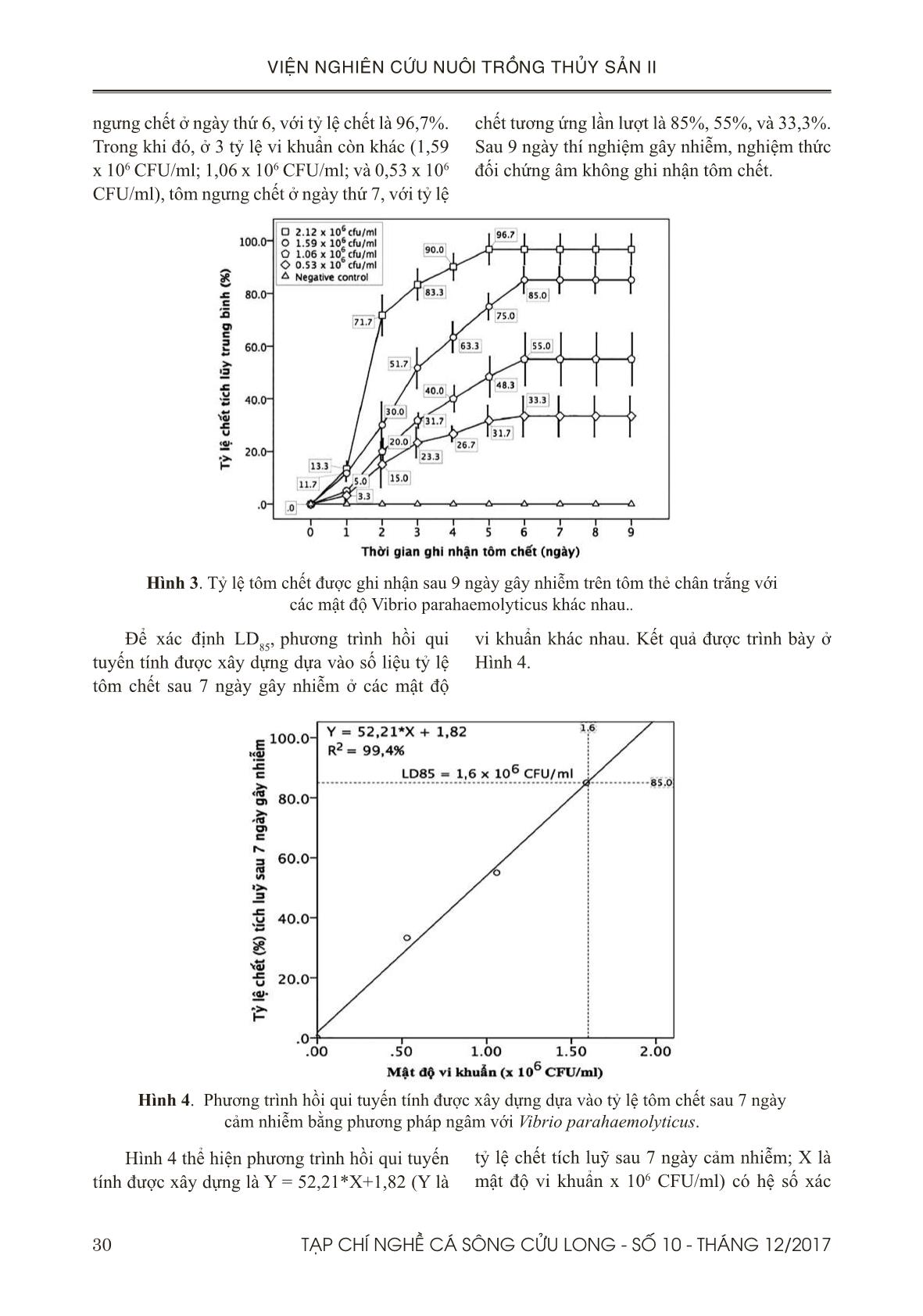
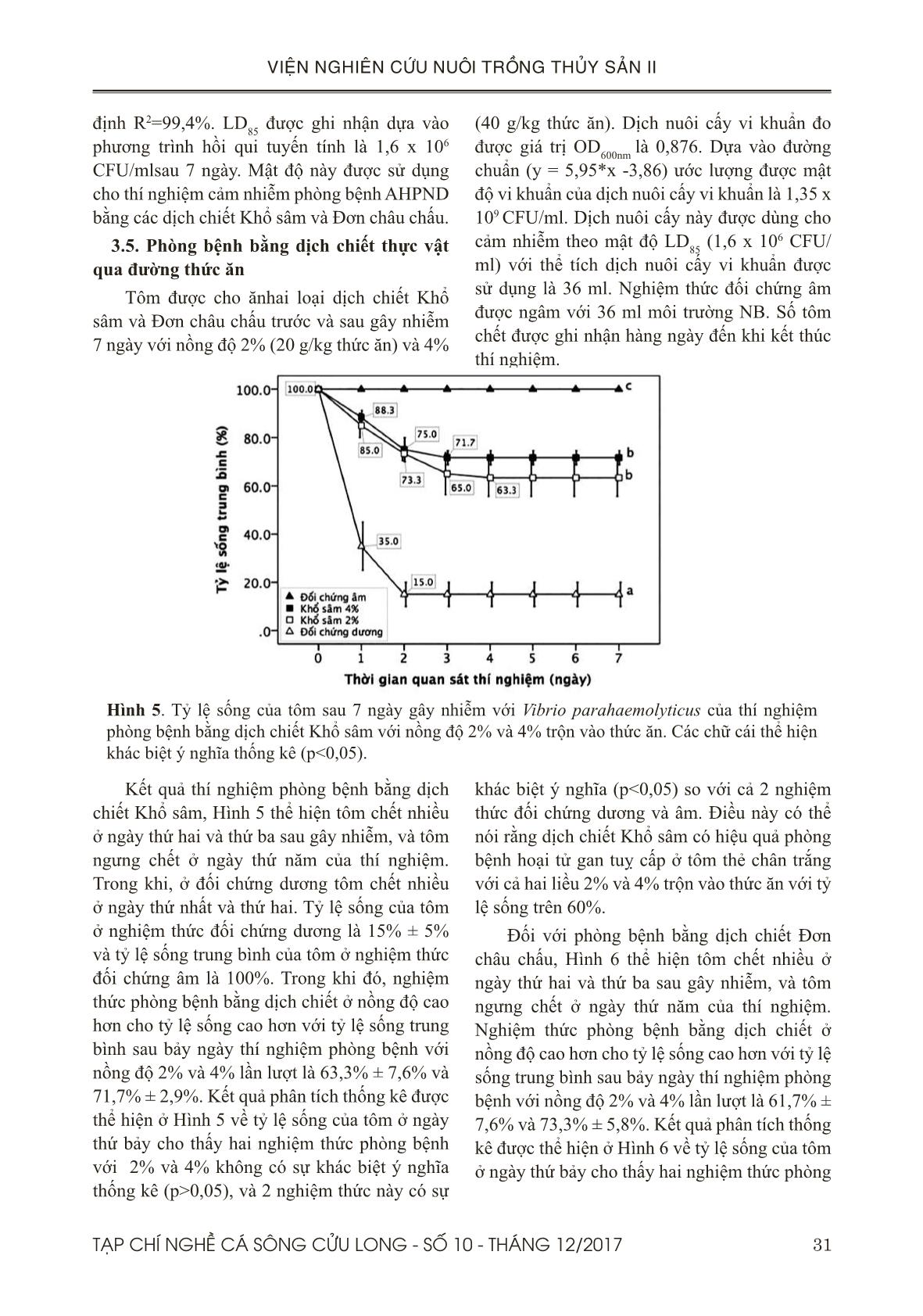
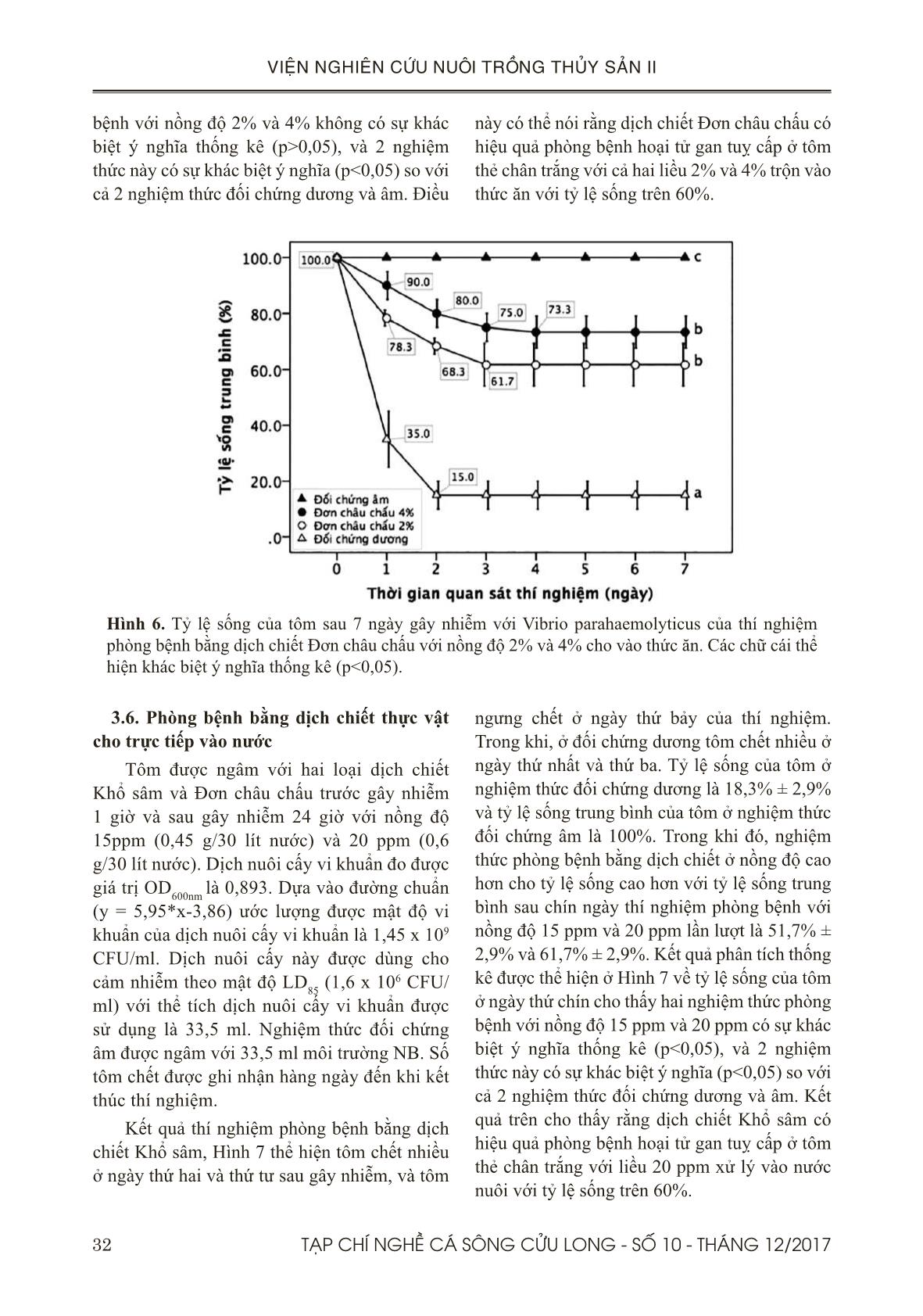
học ở thí nghiệm gây nhiễm với Vibrio parahaemolyticus chủng ST8T và phòng bệnh bằng dịch chiết trộn vào thức ăn cho thấy gan tuỵ của tôm ở đối chứng dương có biểu hiện bong tróc các tế bào biểu mô phù hợp với đặc tính của bệnh AHPND (Tran & ctv., 2013; Joshi & ctv., 2014; Thitamadee & ctv., 2016). Trong khi gan tuỵ của tôm được cho ăn thức ăn có trộn dịch chiết Khổ sâm hoặc Đơn châu chấu với liều 4% xuất hiện nhiều tế bào B. Kết quả này phù hợp với kết quả mô học của nghiên cứu phòng AHPND bằng dịch chiết Protein thô từ tảo đỏ với kết quả tế bào B xuất hiện nhiều ở gan tôm của các nghiệm thức được cho ăn dịch chiết (Boonsri & ctv., 2016). V. KẾT LUẬN VÀ ĐỀ XUẤT 5.1. Kết luận Dựa vào các kết quả trên, hai dịch chiết này đã được chứng minh là có hiệu quả phòng bệnh qua đường thức ăn với liều 2% (20 g dịch chiết/kg thức ăn) và hiệu quả phòng bệnh qua đường nước nuôi với nồng độ 20 ppm. Vì vậy, hai loại dịch chiết này có thể được dùng như là biện pháp thay thế kháng sinh cho phòng AHPND gây ra bởi V. parahaemolyticus trên 38 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II tôm thẻ chân trắng Penaeus vannamei trong điều kiện phòng thí nghiệm. 5.2. Đề xuất Mặc dù kết quả cho thấy hai dịch chiết Khổ sâm và Đơn châu chấu có hiệu quả tốt trong phòng AHPND qua đường ăn và nước nuôi, chúng tôi đề nghị cần thử nghiệm hiệu quả của nó ở qui mô nông hộ. LỜI CẢM ƠN Đề tài này được thực hiện từ kinh phí của hợp đồng đề tài nhánh số 02/HĐ-TS với Viện Hoá học và các Hợp chất thiên nhiên. TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Hà Ký, 1995. Phòng và trị bệnh cho tôm cá. Bệnh học thủy sản, NXB Nông Nghiệp, Hà Nội. Đỗ Tất Lợi, 2004. Những Cây thuốc và Vị thuốc Việt Nam. Nhà xuất bản Y học. Nguyễn Ngọc Phước, Phạm Thị Phương Lan, Nguyễn Quang Linh, Kishio Hatai, 2007. Nghiên cứu khả năng kháng nấm của dịch chiết lá Trầu (Piper betle. L). Tạp chí Thủy Sản số 4/2007. Bùi Quang Tề & Lê Xuân Thành, 2006. Kết quả nghiên cứu chế phẩm (VTS1-C) (VTS1 - T) tách chiết từ thảo dược phòng trị bệnh cho tôm sú và cá tra. Tổng cục Thuỷ sản, 2015. https://tongcucthuysan. gov.vn/vi-vn/nuôi-trồng-thủy-sản/-phòng- chống-dịch-bệnh/doc-tin/001048/2017-01-22/ hoi-nghi-tong-ket-cong-tac-phong-chong-dich- benh-gia-suc-gia-cam-va-thuy-san-nam-2014. Thời gian truy cập 22/1/2015. Tổng Cục Thuỷ sản, 2017. https://tongcucthuysan. gov.vn/vi-vn/nuôi-trồng-thủy-sản/-phòng- chống-dịch-bệnh/doc-tin/007053/2017-02-22/ tang-cuong-kiem-soat-dich-benh-tren-nuoi- tom-nuoc-lo. Thời gian truy cập (22/2/2017). Tổng Cục Thuỷ sản, 2017. https://tongcucthuysan. gov.vn/vi-vn/nuôi-trồng-thủy-sản/-phòng- chống-dịch-bệnh/doc-tin/007095/2017-02-28/ tinh-hinh-dich-benh-tren-tom-tai-mot-so-tinh- dong-bang-song-cuu-long-va-bien-phap-ngan- chan. Thời gian truy cập 28/02/2017. Tổng Cục Thuỷ sản, 2017. https://tongcucthuysan. gov.vn/vi-vn/nuôi-trồng-thủy-sản/-phòng- chống-dịch-bệnh/doc-tin/008389/2017-07-11/ chu-dong-phong-tri-dich-benh-tren-tom-nuoi. Thời gian truy cập 11/7/2017. Trương Hồng Việt, Ajaree Nilawongse, Kallaya Sritunyalucksana, Timothy W. Flegel, Siripong Thitamadee, 2017. Nghiên cứu vi khuẩn không thuộc nhóm Vibrio có khả năng kết hợp với Vibrio parahaemolyticus gây bệnh hoại tử gan tụy cấp trên tôm thẻ chân trắng ở Thái Lan. ISSN 1859-1159. Tạp chí Nghề cá Sông cửu long. Số 9-Tháng 2/2017. 26-42. Tài liệu tiếng Anh Al-Mohanna, S.Y., Nott, J.A., (1986). B-cells and digestion in the hepatopancreas of Penaeussemisulcatus (Crustacea, Decapoda). J. Mar. Biol. Assoc. U. K, 66, 403–414. Bautista, M.N., Lavilla-Pitogo, C., Subosa, P.F., Begino, E.T. (1994). Aflatoxin B1 contamination of shrimp feeds and its effect on growth and hepatopancreas of preadult Penaeus monodon. J. Sci. Food Agricult. 65, 5–11. Bell, T.A., Lightner, D.V. (1988). A Handbook of Normal Penaeid Shrimp Histology. World Aquaculture Society, Baton Rouge, LA. Bhavan, P.S., Geraldine, P. (2000). Histopathology of the hepatopancreas and gills of the prawn Macrobrachium malcolmsonii exposed to endosulfan. Aquat. Toxicol. 50, 331–339. Boonsri N., Rudtanatip T., Withyachumnarnkul B., & Wongprasert K. (2016). Protein extract from red seaweed Gracilaria fisheri prevents acute hepatopancreatic necrosis disease (AHPND) infection in shrimp.J Appl Phycol. DOI 10.1007/ s10811-016-0969-2. Caceci, T., Neck, K.F., Lewis, D.H., Sis, R.F. (1988). Ultrastructure of the hepatopancreas of the Pacific white. shrimp, Penaeus vannamei (Crustacea: Decapoda). J. Mar. Biol. Assoc. U. K. 68, 323–327. Citarasu, T. (2010). Herbal biomedicines: a new opportunity for aquaculture industry. Aquaculture International, 18, 403-414. Chaweepack, T., Muenthaisong, B., Chaweepack, S.,and Kamei, K. (2015a). The Potential of Galangal (Alpinia galanga Linn) Extract against the Pathogens that Cause White Feces Syndrome and Acute Hepatopancreatic Necrosis Disease (AHPND) in Pacific White Shrimp (Litopenaeus vannamei). International Journal of Biology; Vol. 7, No. 3. 39TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II Chaweepack, T., Chaweepack, S., Muenthaisong, B., Ruangpan, L., Nagata, K., & Kamei, K. (2015b). Effect of galangal (Alpinia galanga Linn) extract on the expression of immune- related genes and Vibrio harveyi resistance in Pacific white shrimp (Litopenaeus vannamei). Aquacult Int., 23(1), 385-399. De La Peña L.D., Cabillon N.A., Catedral D.D., Amar E.C., Usero R.C., Mono Tilla W.D., Calpe A.T., Fernandez D.D. & Saloma C.P. (2015). Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannameiand P. monodon cultured in the Philippines. Dis. Aquat. Org., 116, 251–254. De Pooter, H. L., Omar, M. N., Coolaset, B. A., & Schamp, N. M. (1985). The essential oil of greater galanga (Alpinia galanga) from Malaysia. Phytochemistry., 24, 93-96. http:// dx.doi.org/10.1016/S0031-9422 (00)80814-6. De Schryver, P., Defoirdt, T., Sorgeloos, P. (2014). Early mortality syndrome outbreaks: a microbial management issue in shrimp farming? PLoS Pathog. 10: e1003919. Despres J. P., Prudhomme D., Pouliot M. C., Tremblay A., Bouchard C. (1991). Estimation of deep abdominal fat in men. Am J Clin Nutr; 54-471-7. Printed in USA. © 1991 American Society for Clinical Nutrition. Flegel, T. W. (2012). Historic emergence, impact and current status of shrimp pathogens in Asia. Journal of Invertebrate Pathology, 110(2), 166–73. Gibson, R., and P. L. Barker. (1979). The decapod hepatopancreas. Oceanography and Marine Biology 17: 285-346. Han, J.E., Tang, K.F.J., Tran, L.H., Lightner, D.V. (2015). Photorhabdus insect-related (pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp. Dis Aquat Org 113:33−40 Hong, X. P., Xu, D., Zhuo, Y., Liu, H. Q. and Lu, L. Q. (2016). Identification and pathogenicity of Vibrio parahaemolyticus isolates and immune responses of Penaeus (Litopenaeus) vannamei (Boone). Journal of fish Diseases. doi:10.1111/ jfd.12441. Jintasatapor O., Chumkam S., and Songsiritanaphat P. (2017). Effect of Progen-S in Fishmeal Reduction Diet on White Shrimp, Litopeanaeus vannamei, Growth performance, Immunity and Disease Challenge Against Vibrio parahaemolyticus. Aquafeed Nutrient and Better Feeding Management in Aquaculture. 9th Regional Aquafeed Forum. 39-40. Joshi, J., Srisala, J., Truong, V. H., Chen, I.- T., Nuangsaeng, B., Suthienkul, O., Thitamadee, S. (2014). Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture, 428-429, 297–302. Li E., Chen L., Zeng C., Yu N., Xiong Z., Chen X., G. Qin J.G. (2008). Comparison of digestive and antioxidant enzymes activities, haemolymph oxyhemocyanin contents and hepatopancreas histology of white shrimp, Litopenaeusvannamei, at various salinities. Aquaculture 274 (2008) 80–86. Lightner, D. V., Redman, R. M., Pantoja, C. R., Tang, K. F. J., Noble, B. L., Schofield, P., Mohney L. L., Nunan L. M., Navarro, S. A. (2012). Historic emergence, impact and current status of shrimp pathogens in the Americas. Journal of Invertebrate Pathology, 110(2), 174–83. Lightner, D.V., Hasson, K.W., White, B.L., Redman, R.M. (1996). Chronic toxicityand histopathological studies with Benlate, a commercial grade of benomyl, in Penaeusvannamei (Crustacea: Decapoda). Aquat. Toxicol. 34, 105–118. Loizzi, R. F. (1971). Interpretation of crayfish hepatopancreatic function based on fine structural analysis of epithelial cell lines and muscle network. Zeitschrift fuer Zellforschung und mikroscopische Anatomic 113: 420-440. Mooney, A. (2012). An emerging shrimp disease in Vietnam, microsporidiosis or liver disease? Available at: http:// aquatichealth.net/ issues/38607 (accessed 24 Feb 2012). NACA (2012). Final Report Asia Pacific Emergency regional Consultation on the Emerging Shrimp Disease: Early Mortality Syndrome (EMS)/ Acute Hepatopancreatic Necrosis syndrome (AHPNS). Network of Aquaculture Centres in Asia-Pacific. Nunan L., Lightner D., Pantoja C. & Gomez- Jimenez S. (2014). Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico. Dis. Aquat. Org., 111, 81–86. Oonmetta-aree, J., Suzuki, T., Gasaluck, P., 40 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II & Eumkeb., G. (2006). Antimicrobial and action of galangal (Alpinia galanga Linn.) on Staphylococus aureus. Food Science and Technology., 39, 959-965. Pandey, G., Sharma, M., and Mandloi, A. K. (2012). Medicinal plants useful in fish diseases. Plant Archives, 2(1), 1-4. Stephen C. E. (1977). ‘‘Methods for Calculating an LC50’’ Aquatic Toxicology and Hazard Evaluation, ASTM STP 634, American Society of Testing and Materials, Philadelphia, pp 65– 84. Sun H., Fang WS., Wang W.Z., and Hu C. (2006). Structure activity relationships of oleanane and ursane type triterpenoids. Botanical Studies 47: 339-368. Syahidah, A. (2014). Status and potential of herbal applications in aquaculture. Iranian Journal of Fisheries Sciences, 14, 27-44. Thitamadee S, Prachumwat A, Srisala J, Jaroenlak P, Salachan PV, Sritunyalucksana K. (2016). Review of current disease threats for cultivated Penaeid shrimp in Asia. Aquaculture.; 452: 69– 87. doi: 10.1016/j.aquaculture.2015.10.028. Tran, L., Nunan, L., Redman, R.M., Mohney, L.L., Pantoja, C.R., Fitzsimmons, K., Lightner, D.V. (2013). Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting Penaeid shrimp. Dis Aquat Org 105:45−55 Vogt G. (1993). Differentiation of B-cells in the hepatopancreas of the prawn Penaeusmonodon. Acta Zool 74: 51-60. Vuddhakul, V., Bhoopong, P., Hayeebilan, F., & Subhadhirasakul, S. (2007). Inhibitory activity of Thai condiments on pandemic strain of Vibrio parahaemolyticus. Food Microbiology., 24, 413-418. fm.2006.04.010 Wu J.P.,Chen H.H., Huang D.J. (2008). Histopathological and biochemical evidence of hepatopancreatic toxicity caused by cadmium and zinc in the white shrimp, Litopenaeusvannamei. Chemosphere 73. 1019– 1026. Yang Y. T., Chen I. T., Lee C. T., et al. (2014). Draft genome sequences of four strains of Vibrio parahaemolyticus, three of which cause early mortality syndrome/acute hepatopancreatic necrosis disease in shrimp in China and Thailand. Genome Announc; 2:e00816–14. Yin, G., L. Ardo, Z. Jeney, P. Xu and G. Jeney. (2008). Chineseherbs (Lonicera japonica and Ganoderma lucidum) enhance nonspecific immune response of tilapia, Oreochromisniloticus and protection against Aeromonashydrophila. In: Diseases in Asian Aquaculture VI, FishHealth Section (Bondad-Reantaso, M.G., Mohan, C.V.,CrumLish, M. and Subasinghe, R. P. eds.). Asian FisheriesSociety, Manila, Philippines, 269-282. 41TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II THE EFFECTS OF Croton tonkinensis AND Aralia armata EXTRACTS ON PREVENTION AND TREATMENT OF ACUTE HEPATOPANCREATIC NECROSIS DISEASE IN WHITE-LEG SHRIMP Penaeus vannamei UNDER LABORATORY CONDITIONS Truong Hong Viet1*, Do Thi Cam Hong1, Vu Thien An1, Tran Bao Ngoc2, Nguyen Tran Gia Bao2, Tran Minh Trung1 ABSTRACT Acute hepatopancreatic necrosis disease (AHPND) was first emerged in China in 2009, and was spread to Vietnam in 2010. It has caused a negative impact on the aquaculture industry in Vietnam with an economic loss estimated at 7.2 million USD in 2012. The aim of this study is to evaluate the effects of Crotonton kinensis and Aralia armata extracts on prevention and treatment of AHPND disease caused by Vibrio parahaemolyticus (VP AHPND ) in white-leg shrimp (Penaeus vannamei) by experimental challenge test. Two experiments were conducted: (1) The two extracts were individually mixed with shrimp diet at two concentrations including 2% (20g extracts/kg diet) and 4% (40g extracts/kg diet); shrimp were fed during 7 days before and after challenge test with VP AHPND . (2) The two extracts were separately soaked into culture water at two concentrations including 15 ppm (0.45g extracts/tank/30 litres of water) and 20 ppm (0.6g extracts/tank/30 litres of water); shrimps were immersed in these extracts in 1 hour before challenge test with VP AHPND , and were immersed one more time after 24 hours. The results of experiment 1 showed that shrimp survival rates on the last day (day 7) in all extract treated groups were greater than 60%, and it was significantly different (P<0.05) in compared with control groups. In the experiment 2, shrimp survival rates on the last day (day 9) in two extract treated groups with 20 ppm concentration were greater than 60%, and it was significantly different (P<0.05) in compared with control groups. Based on these results, we suggest that these two extracts are capable of prevention and treatment of AHPND disease in white-leg shrimp either via diet at 2% dose or immersion treatment in the culture water at 20 ppm concentration under laboratory conditions. Keywords: Crotontonkinensis, Aralia armata, Vibrio parahaemolyticus, AHPND, white-leg shrimp. Người phản biện: TS. Lý Thị Thanh Loan Ngày nhận bài: 26/10/2017 Ngày thông qua phản biện: 03/11/2017 Ngày duyệt đăng: 12/12/2017 1 Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No.2. 2 International Univerisity, Ho Chi Minh National Univerisity. *Email: truonghongviet@yahoo.com
File đính kèm:
 hieu_qua_cac_dich_chiet_kho_sam_croton_tonkinensis_va_don_ch.pdf
hieu_qua_cac_dich_chiet_kho_sam_croton_tonkinensis_va_don_ch.pdf

