Dòng hóa và biểu hiện gen mã hóa protein vỏ VP28 của virus gây bệnh đốm trắng trong tế bào nấm men Pichchia pastoris
TÓM TẮT Virus gây bệnh đốm trắng là loại virus phổ biến và là một trong những nguyên nhân gây thiệt hại lớn cho nghề nuôi tôm he trên thế giới cũng như ở Việt Nam. Nghiên cứu này có mục tiêu là tạo tái tổ hợp ADN của gen VP28 ở virus trong tế bào nấm men nhằm thu được chủng nấm men có khả năng biểu hiện protein VP28 ngoại bào làm nguyên liệu cho việc điều chế vắc xin/tolerine phòng bệnh đốm trắng cho tôm nuôi. Đoạn gen VP28 đã được khuếch đại bằng kỹ thuật Polymerase chain reaction; sản phẩm khuếch đại sau đó được dòng hóa vào vector pPIC9K để tạo tái tổ hợp pPIC9K-VP28 rồi pPIC9K-VP28 được biến nạp vào tế bào nấm men Pichia pastoris GS115 để biểu hiện protein mục tiêu và cảm ứng biểu hiện bằng methanol. Quá trình sàng lọc 200 chủng nấm men sau biến nạp đã được thực hiện. Kết quả thu được 5 chủng nấm men có mang pPICK9KVP28 có khả năng cảm ứng biểu hiện protein VP28 ngoại bào. Áp dụng phương pháp Bradford để đo nồng độ protein ngoại bào của 5 chủng nghiên cứu theo thời gian lên men P. pastoris và lượng protein tổng số cao nhất sau 72 giờ nuôi cấy là 106,9 μg/ml

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5
Trang 6

Trang 7

Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Dòng hóa và biểu hiện gen mã hóa protein vỏ VP28 của virus gây bệnh đốm trắng trong tế bào nấm men Pichchia pastoris

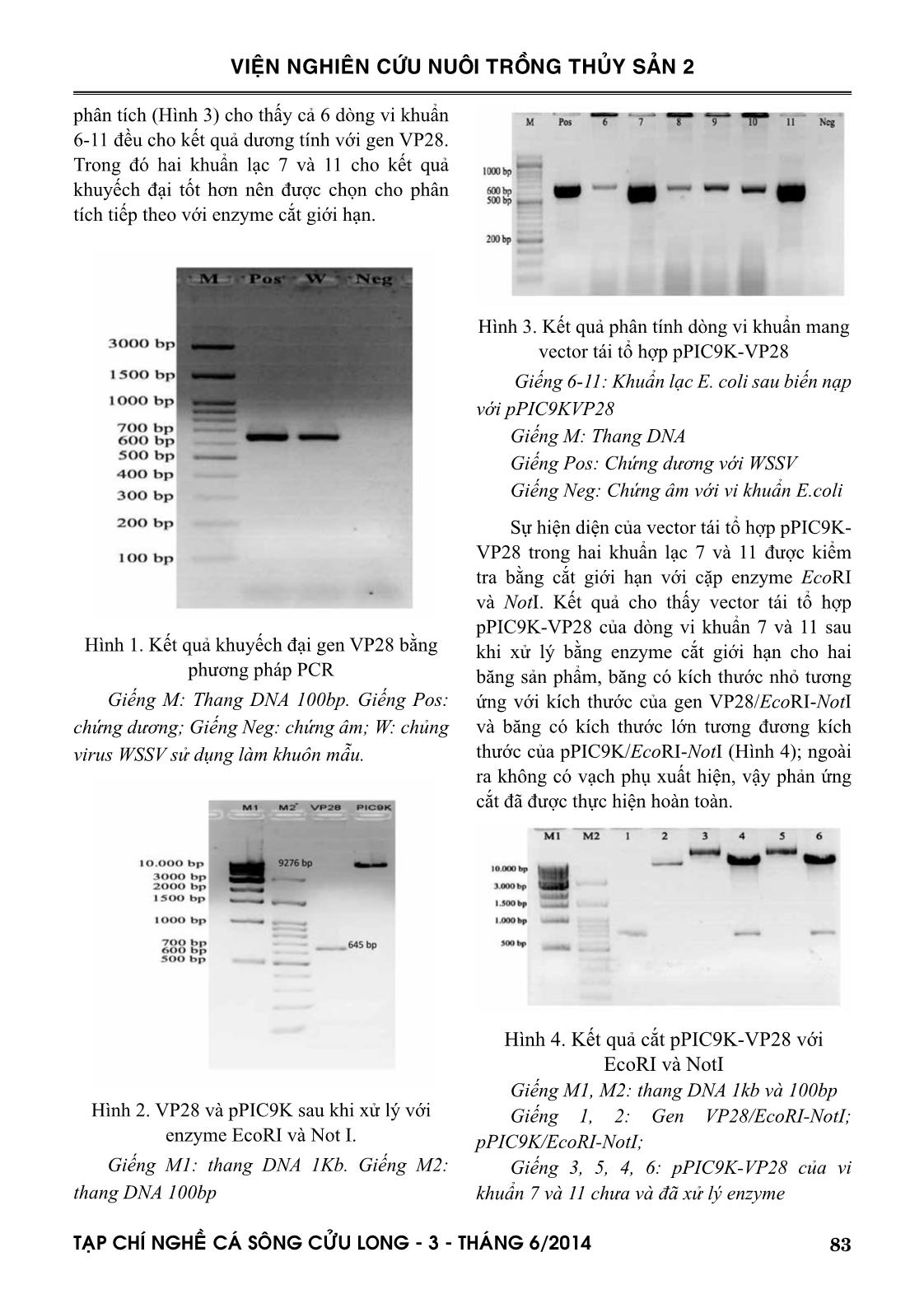
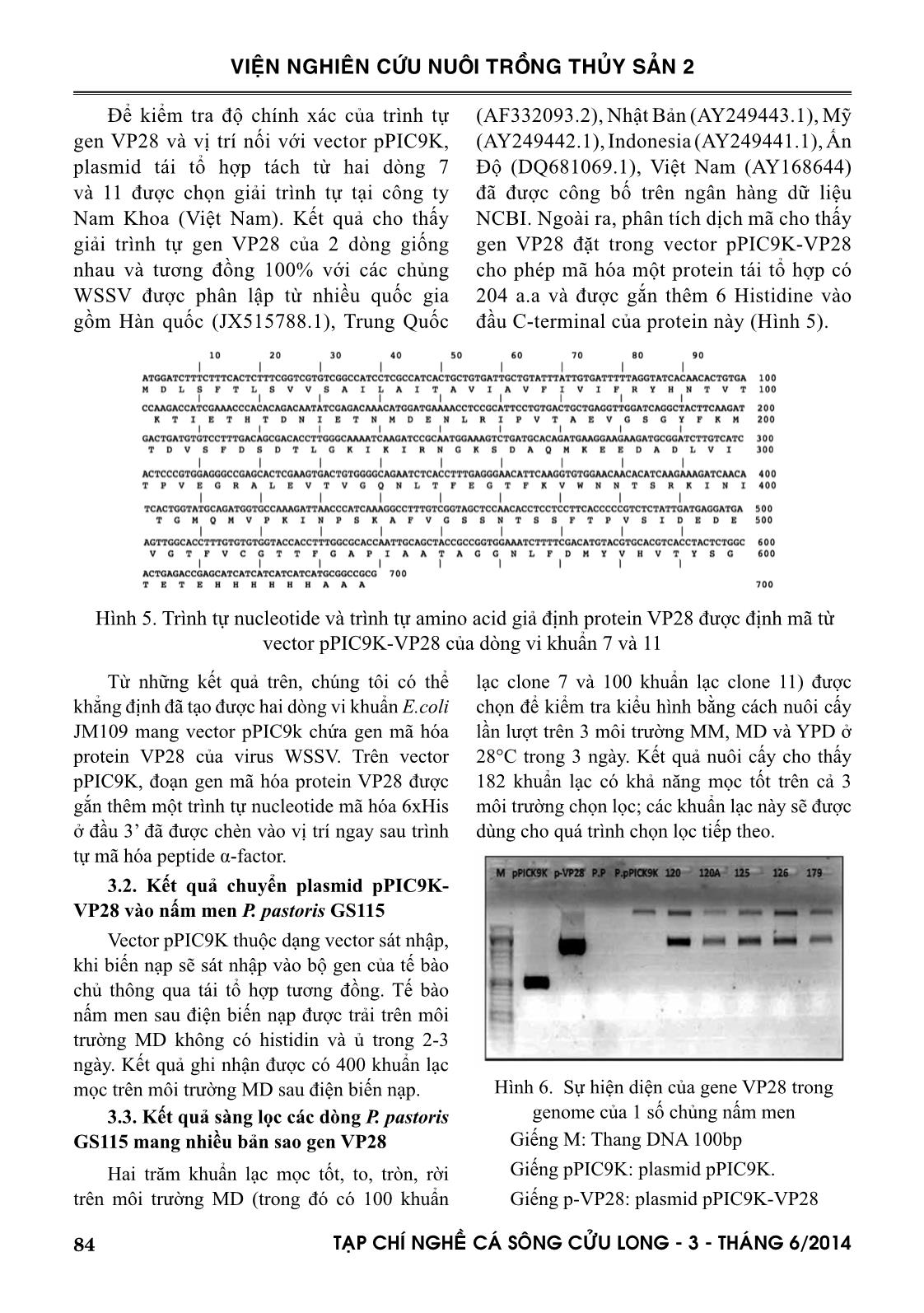
i hạn với cặp enzyme EcoRI và NotI. Kết quả cho thấy vector tái tổ hợp pPIC9K-VP28 của dòng vi khuẩn 7 và 11 sau khi xử lý bằng enzyme cắt giới hạn cho hai băng sản phẩm, băng có kích thước nhỏ tương ứng với kích thước của gen VP28/EcoRI-NotI và băng có kích thước lớn tương đương kích thước của pPIC9K/EcoRI-NotI (Hình 4); ngoài ra không có vạch phụ xuất hiện, vậy phản ứng cắt đã được thực hiện hoàn toàn. Hình 4. Kết quả cắt pPIC9K-VP28 với EcoRI và NotI Giếng M1, M2: thang DNA 1kb và 100bp Giếng 1, 2: Gen VP28/EcoRI-NotI; pPIC9K/EcoRI-NotI; Giếng 3, 5, 4, 6: pPIC9K-VP28 của vi khuẩn 7 và 11 chưa và đã xử lý enzyme 84 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Để kiểm tra độ chính xác của trình tự gen VP28 và vị trí nối với vector pPIC9K, plasmid tái tổ hợp tách từ hai dòng 7 và 11 được chọn giải trình tự tại công ty Nam Khoa (Việt Nam). Kết quả cho thấy giải trình tự gen VP28 của 2 dòng giống nhau và tương đồng 100% với các chủng WSSV được phân lập từ nhiều quốc gia gồm Hàn quốc (JX515788.1), Trung Quốc (AF332093.2), Nhật Bản (AY249443.1), Mỹ (AY249442.1), Indonesia (AY249441.1), Ấn Độ (DQ681069.1), Việt Nam (AY168644) đã được công bố trên ngân hàng dữ liệu NCBI. Ngoài ra, phân tích dịch mã cho thấy gen VP28 đặt trong vector pPIC9K-VP28 cho phép mã hóa một protein tái tổ hợp có 204 a.a và được gắn thêm 6 Histidine vào đầu C-terminal của protein này (Hình 5). Hình 5. Trình tự nucleotide và trình tự amino acid giả định protein VP28 được định mã từ vector pPIC9K-VP28 của dòng vi khuẩn 7 và 11 Từ những kết quả trên, chúng tôi có thể khẳng định đã tạo được hai dòng vi khuẩn E.coli JM109 mang vector pPIC9k chứa gen mã hóa protein VP28 của virus WSSV. Trên vector pPIC9K, đoạn gen mã hóa protein VP28 được gắn thêm một trình tự nucleotide mã hóa 6xHis ở đầu 3’ đã được chèn vào vị trí ngay sau trình tự mã hóa peptide α-factor. 3.2. Kết quả chuyển plasmid pPIC9K- VP28 vào nấm men P. pastoris GS115 Vector pPIC9K thuộc dạng vector sát nhập, khi biến nạp sẽ sát nhập vào bộ gen của tế bào chủ thông qua tái tổ hợp tương đồng. Tế bào nấm men sau điện biến nạp được trải trên môi trường MD không có histidin và ủ trong 2-3 ngày. Kết quả ghi nhận được có 400 khuẩn lạc mọc trên môi trường MD sau điện biến nạp. 3.3. Kết quả sàng lọc các dòng P. pastoris GS115 mang nhiều bản sao gen VP28 Hai trăm khuẩn lạc mọc tốt, to, tròn, rời trên môi trường MD (trong đó có 100 khuẩn lạc clone 7 và 100 khuẩn lạc clone 11) được chọn để kiểm tra kiểu hình bằng cách nuôi cấy lần lượt trên 3 môi trường MM, MD và YPD ở 28°C trong 3 ngày. Kết quả nuôi cấy cho thấy 182 khuẩn lạc có khả năng mọc tốt trên cả 3 môi trường chọn lọc; các khuẩn lạc này sẽ được dùng cho quá trình chọn lọc tiếp theo. Hình 6. Sự hiện diện của gene VP28 trong genome của 1 số chủng nấm men Giếng M: Thang DNA 100bp Giếng pPIC9K: plasmid pPIC9K. Giếng p-VP28: plasmid pPIC9K-VP28 85TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Giếng P.P: Pichia pastoris Giếng P.pPIC9K: P.pastoris –pPIC9K. Giếng 120, 120A, 125, 126, 179: chủng số 120, 120A, 125, 126, 179 Sự hiện diện của gen VP28 trong 182 khuẩn lạc nấm men chọn lọc được kiểm tra bằng phương pháp PCR với cặp mồi AOX1-F và AOX1-R dựa trên khuôn mẫu là DNA tổng số của tế bào nấm men. Kết quả cho thấy các chủng nghiên cứu đều cho 2 vạch: khoảng 1.117 bp (kích thước của gen VP28 thêm 492bp - kích thước từ vị trí bắt cặp của mồi trên hệ gen P. pastoris đến vị trí gắn chèn) và khoảng 2,2 kb - kích thước của gen AOX1 (Hình 6). Như vậy, tất cả các chủng nấm men kiểm tra đều có chứa pPICK9K-VP28 trong genome; nói cách khác, gen VP28 đã được biến nạp thành công vào bộ gen của nấm men P. pastoris với kiểu hình Mut+. Sau khi tạo dòng thành công, quá trình sàng lọc dòng P.pastoris có khả năng biểu hiện pro- tein VP28 cao nhất được thực hiện bằng cách cấy chuyển 182 khuẩn lạc sang môi trường YDP có bổ sung G418 ở các nồng độ 4mg/l và 6mg/l. Kết quả sàng lọc đã xác định được 123/182 khuẩn lạc có khả năng kháng Geneticin 418 ở nồng độ 4mg/l và 62 khuẩn lạc kháng G418 ở nồng độ 6mg/l (Hình 7). Theo lý thuyết, 62 khuẩn lạc này có chứa 14-18 copy gene VP28 trong genome và chúng được sử dụng để kiểm tra khả năng biểu hiện protein VP28. Hình 7. Kết quả chọn lọc dòng P. pastoris mang tái tổ hợp pPIC9K-VP28 kháng 6ppm Geneticin 3.4. Kết quả sàng lọc các dòng P. pastoris GS115 có khả năng tiết protein VP28 ngoại bào Sáu mươi hai chủng nấm men mang pPIC9K-VP28 đã qua sàng lọc và 1 chủng nấm men mang pPICK9K (đối chứng âm) được cảm ứng biểu hiện protein trên môi trường nuôi cấy sinh khối BMGY và kích thích methanol 2% trên môi trường BMMY trong 72 giờ. Sự hiện diện của protein VP28 trong dịch nuôi cấy được phân tích bằng kỹ thuật Western blot với kháng thể đặc hiệu của VP28. Kết quả biểu hiện protein đã xác định được 25 chủng có sự hiện diện của protein VP28 trong dịch nuôi cấy. Tuy nhiên, chỉ 5 chủng: 120, 120A, 125, 126, 179 cho vạch rõ ràng ở kích thước khoảng 28 kDa trên bản gel chạy Western blot với kháng thể kháng VP28 được dùng để nghiên cứu tiếp theo. Hình 8. Protein VP28 trong dịch nuôi cấy nấm men M: Thang protein; 120, 120A, 125, 126, 179: các chủng nấm men Ctrl(-): Chứng âm-nấm men có pPICK9K rỗng 3.5. Kết quả biểu hiện protein Năm chủng nấm men có chứa pPICK9k- VP28 trong genome có khả năng tiết protein ngoại bào được cảm ứng biểu hiện và lượng protein tiết ra trong dịch nuôi cấy được xác định theo thời gian: 24, 48 và 72 giờ. Kết quả đo hàm lượng protein theo thời gian trong quá trình nuôi cấy cho thấy cả 5 chủng nghiên cứu đều có khả năng tiết protein ngoại bào và lượng protein tiết ra tăng dần theo thời gian lên men từ 24 đến 72 86 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 giờ (Đồ thị 1); Trong đó, chủng 126 có khả năng tiết ra lượng protein cao nhất (106,9μg/ml) sau 72 giờ nuôi cấy. Đồ thị 1. Nồng độ protein tổng số của các chủng nghiên cứu ở các thời điểm khác nhau trong quá trình lên men IV. THẢO LUẬN Trên thế giới, nhiều tác giả đã dòng hóa và biểu hiện protein VP28 trong tế bào vi khuẩn khả biến E.coli để làm nguyên liệu để chế tạo vắc xin/tolerine (Witteveldt và ctv., 2004; 2006; Satoh và ctv., 2008). Ngoài E. coli, một số nhà nghiên cứu còn sử dụng các vi khuẩn khả biến khác như: vi khuẩn gram dương Brevibacillus brevis (Caipang et al., 2008), hoặc tế bào côn trùng (Du et al., 2006) để dòng hóa các gen vỏ của virus gây bệnh đốm trắng trên tôm nuôi. Ở Việt Nam, Nguyễn Quỳnh Anh (2006), Bùi Thị Bích Hằng (2012) cũng đã thành công trong việc dòng hóa gen VP28 của virus đốm trắng vào tế bào khả biến E.coli để tạo kháng thể ứng dụng trong việc chẩn đoán nhanh bệnh. Việc dùng tế bào nấm men để dòng hóa và biểu hiện protein chỉ được 1 nhóm nhỏ các nhà nghiên cứu quan tâm nhưng hiệu quả bảo vệ của loại vắc xin/tolerine - sản phẩm của quá trình dòng hóa này - mang lại cao hơn và cho thời gian bảo hộ dài hơn các loại vắc xin/tolerine khác. Cụ thể, Jha và ctv (2006, 2007) đã xác định dùng rVP28 biểu hiệu qua tế bào nấm men bằng phương pháp tiêm hoặc cho ăn đều đem lại hiệu quả bảo vệ cho crayfish trước bệnh đốm trắng sau 3 ngày và kéo dài tới 21 ngày sau khi dùng rVP28. Trong khi đó, thời gian bảo hộ của rVP28 biểu hiện bằng vi khuẩn gram âm E.coli hoặc vi khuẩn gram dương Brevibacillus choshinensis và B. brevis trên tôm lần lượt là 10 ngày, 7 ngày và 14 ngày (Caipang et al., 2008; Mavichak et al., 2009; Witteveldt et al., 2006). Chính vì vậy, việc tạo ra nguyên liệu là dòng nấm men có mang pPICK9K-VP28 có khả năng tiết protein ngoại bào là bước khởi đầu cho những nghiên cứu về vắc xin/tolerine phòng bệnh đốm trắng cho tôm nuôi ở Việt Nam. V. KẾT LUẬN Đoạn gen VP28 của virus gây bệnh đốm trắng trên tôm đã được nhân bản, gắn với plasmid pPICK9K và dòng hóa thành công vào vi khuẩn khả nạp E. coli JM109 và tế bào nấm men P. pastoris GS 115. Năm chủng nấm men Pichia patoris có chứa pPICK9K-VP28 trong bộ gen có khả năng biểu hiện được protein mục tiêu VP28 dạng ngoại bào trong điều kiện cảm ứng bằng methanol với nồng độ 2% và lượng protein tổng số tiết ra cao nhất sau 72 giờ nuôi cấy là 106,9 μg/ml. TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Nguyễn Quỳnh Anh, 2006. Báo cáo đề tài: “Dòng hoá và biểu hiện Gen mã hoá Protein vỏ VP28 và VP281 của Virus gây hội chứng đốm trắng ( WSSV ) trong E.coli”. Bùi Thị Bích Hằng, 2012. Tạo tái tổ hợp DNA VP28 của virus gây bệnh đốm trắng (WSSV) trên tôm sú. Tạp chí khoa học 2012:22a 1-7. Trường Đại Học Cần Thơ. Cục Thúy Y- Bộ nông nghiệp và phát triển nông thôn, 2012. Báo cáo Hội nghị tổng kết nuôi tôm nước lợ. Tình hình dịch bệnh trên tôm nuôi năm 2012 và triển khai kế hoạch năm 2013. Cục Thú Y - Bộ nông nghiệp và phát triển nông thôn, 2013. Báo cáo Tình hình dịch bệnh, dịch tễ 87TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 bệnh đốm trắng (WSD) và hoại tử gan tụy cấp (AHPND) ở tôm nuôi 7 tháng đầu năm 2013 và một số đề xuất quản lý rủi ro đối với AHPND. Tài liệu phục vụ Hội nghị tại Bạc Liêu – 6/8/2013. Tài liệu tiếng Anh Caipang, C.M.A., Verjan, N., Ooi, E.L., Kondo, H., Hirono, I., Aoki, T., Kiyono, H., Yuki, Y., 2008. Enhanced survival of shrimp, Penaeus (Marsupenaeus) japonicus from white spot syndrome disease after oral administration of recombinant VP28 expressed in Brevibacillus brevis. Fish & Shellfish Immunology 25, 315-320. Chou, H.Y., Huang, C.Y., Wang, C.H., Chiang, H.C. and Lo, C.F, 1995. Pathogenicity of a baculovirus infection causing white spot syndrome in cultured penaeid shrimp in Taiwan. Diseases of Aquatic Organisms. 23(3):p. 165-173.Du, H.H., Xu, Z. R., Wu, X. F., Li, W. F., Dai, W., 2006. Increased resistance to white spot syndrome virus in Procambarus clarkii by injection of envelope protein VP28 expressed using recombinant baculovirus. Aquaculture, 2006 260(1-4), p. 39-43. Huang, J., Song, X.L., Yu, J., Yang, C.H., 1994. Baculoviral hypodermal and haematopoietic necrosis-pathology of the shrimp explosive epidermic disease. Yellow Sea Fishery Research Institute, Qingdae, P.R. China.Jha, R.K., Xu, Z. R., Bai, S. J., Sun, J. Y., Li, W. F., Shen, J., 2007. Protection of Procambarus clarkii against white spot syndrome virus using recombinant oral vac- cine expressed in Pichia pastoris. Fish & Shellfish Immunology, 2007. 22(4), p. 295-307. Jha, R.K., Xu, Z.R., Pandey, A., 2006. The efficacy of recombinant vaccines against white spot syn- drome virus in Procambarus clarkii. Immunology Letters, 2006. 105(1), p. 68-76. Mavichak, R. K., Hirino, H., Aoki, I., Kiyono, T., Yuki, Y., 2009. Protection of pacific white shrimp, Liptopenaeus vannamei against white spot virus following administration of N-terminus truncated recombinant VP28 protein expressed in Gram positive bacteria, Brevibacillus choshinensis. Aquaculture Science 57:83-90. Satoh, J., T. Nishizawa, Yoshimizu, M., 2008. “Protection against white spot syndrome virus (WSSV) infection in kuruma shrimp orally vaccinated with WSSV rVP26 and rVP28.” Diseases of Aquatic Organisms 82(2), 89-96. Takahashi Y., Itami T., Kondo M., Maeda M., Fujii R., Tomonaga S., Supamattaya K., Boonyaratpalin S., 1994. Electron microscopy evidence of bacilliform virus infection in Kuruma shrimp (Penaeus Japonicus). Fish Pathol 29:121-125.Venegas, C. A., L. Nonaka, Mushiake, K., Nishizawa, T., Muroga, K., 2000. “Quasi-immune response of Penaeus japonicus to penaeid rod-shaped DNA virus (PRDV).” Diseases of Aquatic Organisms 42(2), 83-89. Van Hulten M.C., Westenberg M., Goodall S.D., Vlak J.M., 2000. Identification of two major virion protein genes of white spot syndrome virus of shrimp. Virology 266, 227-36. Wang, C., Lo, C., Leu, J., Chou, C., Yeh, P., Chou, H., Tung, M., Chang, C., Su, M. and Kou, G., 1995. Purification and genomic analysis of baculovirus associated with white spot syndrome (WSBV) of Penaeus monodon. Diseases of Aquatic Organisms, 1995. 23, 239-242. Witteveldt, J., J. M. Vlak, van Hulten, M. C. W., 2004. “Protection of Penaeus monodon against white spot syndrome virus using a WSSV subunit vác xin.” Fish & Shellfish Immunology 16(5), 571-579 Witteveldt, J., J. M. Vlak, van Hulten, M. C. W., 2006. “Increased tolerance of Litopenaeus vannamei to white spot syndrome virus (WSSV) infection after oral application of the viral envelope protein VP28.” Diseases of Aquatic Organisms 70(1-2), 167-170. Wongteerasupaya C., Vicker J.E., Sriurairatana S., Nash G.L., Akarajarmorn A., Boonsaeng V., Panyim S., Tassanakajon A., Withyachumnarnkul B., Flegel T.W., 1995. A nonoccluded, systemic baculovirus that occurs in cells of ectodermal and mesodermal origin and causes high mortality in the black tiger prawn Penaeus monodon. Disease of Aquatic Organism 21, 69–77 88 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 3 - THAÙNG 6/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 DEVELOP DNA RECOMBINANT VP28 OF WHITE SPOT SYNDROME VIRUS IN YEAST PICHIA PASTORIS Ngo Thi Ngoc Thuy1, Nguyen Viet Dung2, Dang Thi Tra My1 ABSTRACT White spot syndrome virus (WWSSV) is a popular and devastating virus to Penaeus shrimp-culture industry worldwide. The aim of this study is to develope DNA recombinant VP28 of the virus in yeast P. pastoris for expressing protein VP28 extracellularly in order to make materials for recombinant protein vaccine/tolerine against WSSV in shrimp. DNA fragment content of VP28 was amplified from WSSV and its product was di- gested by restriction enzyme EcoRI and NotI; then cloned into plasmid pPICK9K to make recombinant vector pPICK9K-VP28. This vector, after that was transformed into Pichia pastoris GS115 to express protein VP28. The screening of 200 yeast clones after transformation was conducted and 5 yeast clones which expressed protein VP28 extracellular were selected for Bradford assay. The results indicated that the total extracellular protein containing VP28 increased with fermentation periods of 24, 48 and 72 hours and the highest concen- tration of total protein reached to 106.9 μg.ml-1. Keywords: Pichia pastoris, protein, VP28 , WSSV Người phản biện: ThS. Nguyễn Thị Hiền Ngày nhận bài: 10/02/2014 Ngày thông qua phản biện: 28/02/2014 Ngày duyệt đăng: 30/3/2014 1 Minh Hai Sub-Institute for Fisheries Research, Research Institute for Aquaculture No 2. Email: thuyngo8@yahoo.com 2 Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No 2.
File đính kèm:
 dong_hoa_va_bieu_hien_gen_ma_hoa_protein_vo_vp28_cua_virus_g.pdf
dong_hoa_va_bieu_hien_gen_ma_hoa_protein_vo_vp28_cua_virus_g.pdf

