Bệnh vi khuẩn mới nổi nguy hiểm ở cá hồi vân và nghiên cứu ứng dụng liệu pháp thực khuẩn thể trong phòng trị bệnh
TÓM TẮT
Nghiên cứu này đã được tiến hành để phân lập và xác định tác nhân gây bệnh, tìm kiếm và thử
nghiệm liệu pháp thực khuẩn thể để thay thế kháng sinh trong phòng trị bệnh cho cá hồi vân (rainbow
trout). 36 chủng vi khuẩn đã được phân lập từ cá hồi vân bị bệnh trên cơ sở chẩn đoán khẳng định
bằng phản ứng sinh hóa, 16S rRNA và PCR. Thực khuẩn thể Pwr-1 lần đầu tiên đã được sàng lọc
và phân lập thành công trong nghiên cứu này. Chủng thực khuẩn thể thuộc họ virus Siphoviridae, có
đường kính đầu khoảng 65 nm và đuôi dài 170-180 nm. Thực khuẩn thể xâm nhập và nhân lên trong
tế bào vi khuẩn gây bệnh trong thời gian 25 phút và giải phóng 16 thực khuẩn thể mới sau khi tiêu
diệt một tế bào vi khuẩn. Chủng thực khuẩn thể tồn tại tốt ở khoảng pH rộng và nhiệt độ tương đối
cao. Liệu pháp thực khuẩn thể đã được sử dụng để điều trị bệnh trong điều kiện in vitro cho thấy thực
khuẩn thể có thể diệt 100% (36/36) chủng vi khuẩn gây bệnh, với tốc độ rất nhanh và mạnh. Kết quả
nghiên cứu mở ra hướng điều trị mới thay thế kháng sinh nhằm giảm thiểu tình trạng kháng kháng
sinh, nâng cao chất lượng và an toàn sinh học cho loài cá nuôi có giá trị kinh tế cao này.

Trang 1

Trang 2
Trang 3

Trang 4

Trang 5
Trang 6

Trang 7

Trang 8
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Bệnh vi khuẩn mới nổi nguy hiểm ở cá hồi vân và nghiên cứu ứng dụng liệu pháp thực khuẩn thể trong phòng trị bệnh

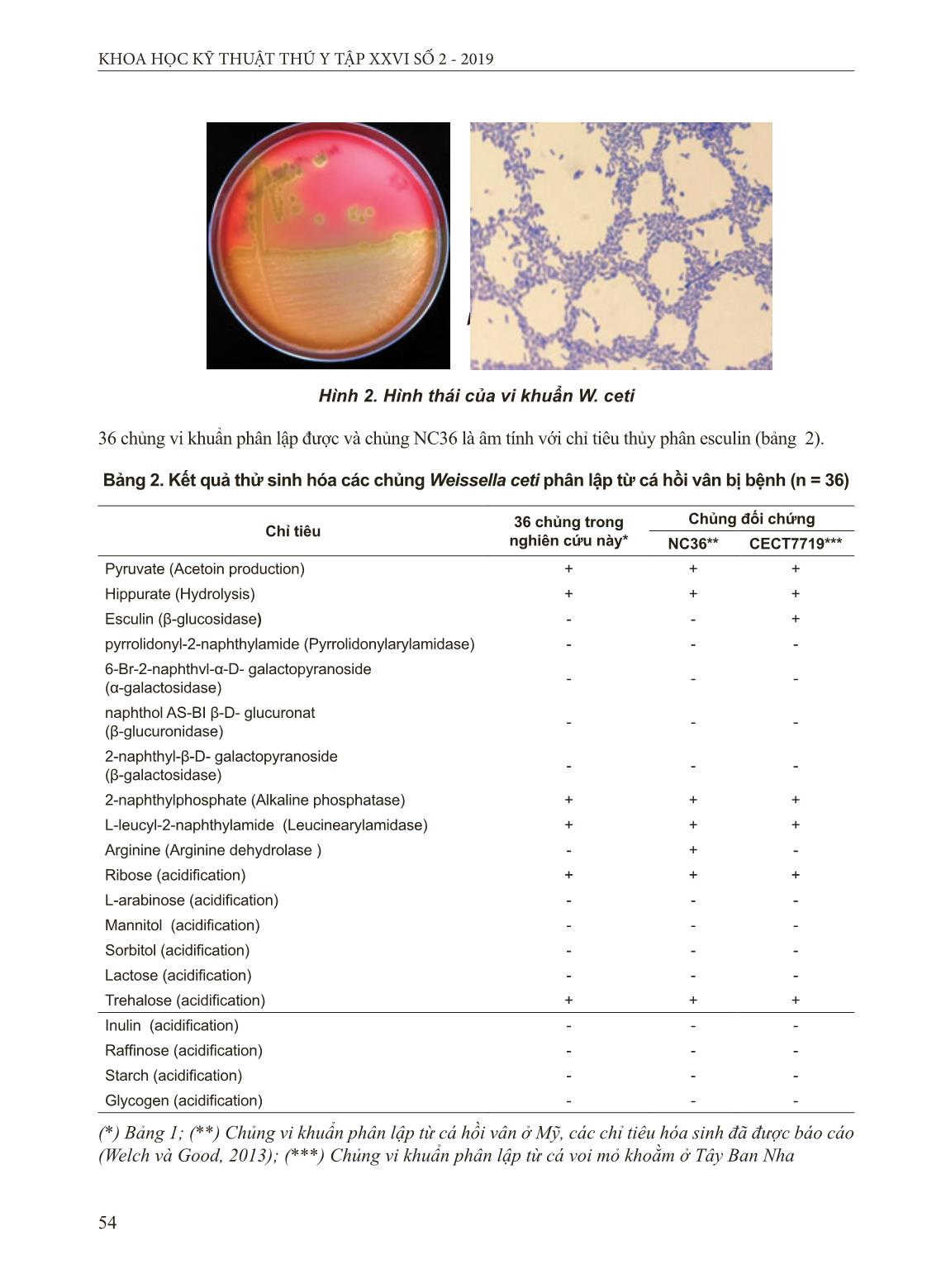
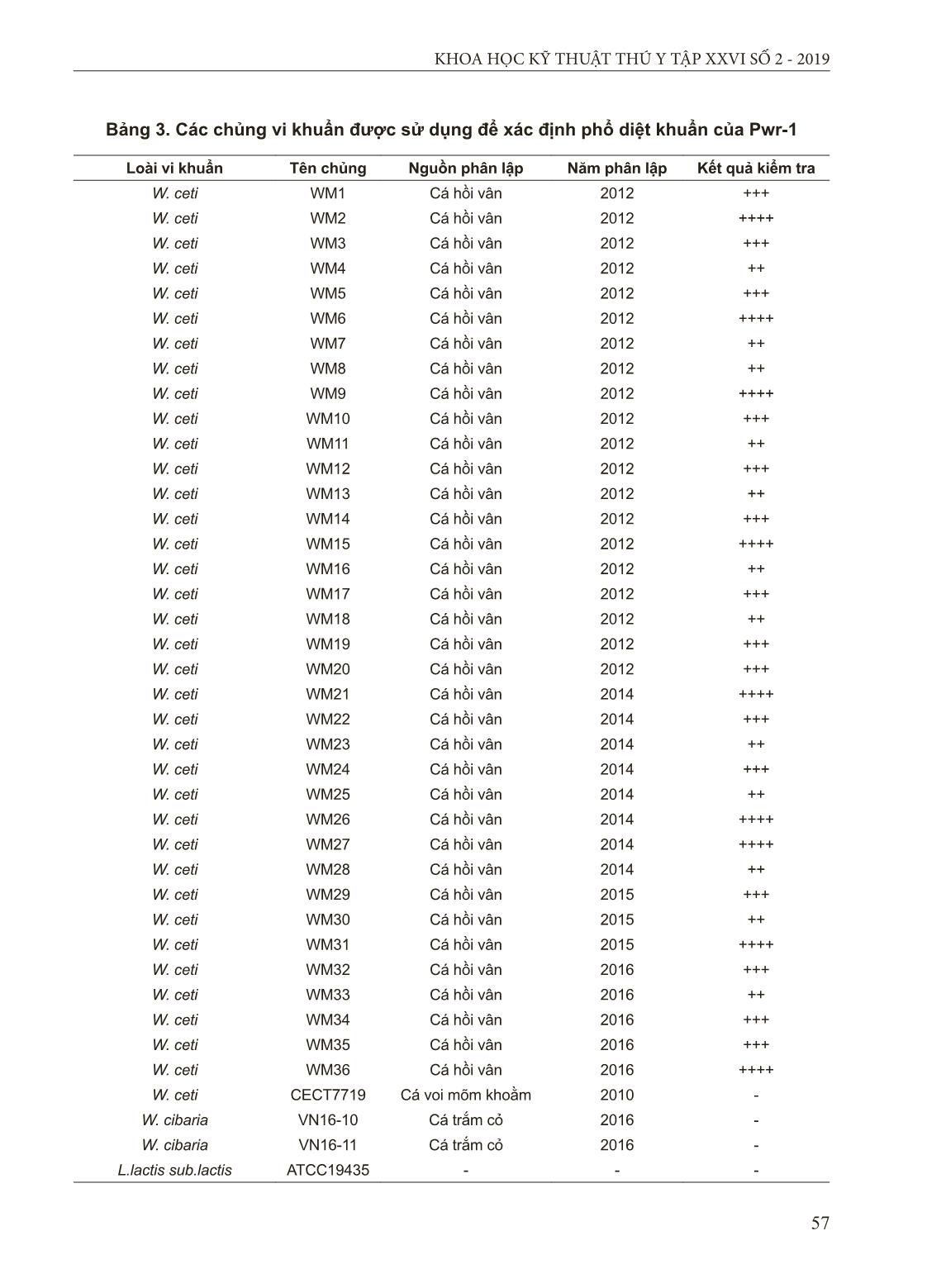
. Kết quả thử nghiệm sinh hóa cho thấy 36 chủng vi khuẩn này là đồng nhất về mặt sinh hóa và chúng có sự tương đồng cao với cả hai chủng W. ceti đối chứng (NC36 và CECT7719) về 19 trong số 20 chỉ tiêu sinh hóa được kiểm tra bằng bộ test API 20 STREP. 36 chủng vi khuẩn phân lập được và chủng CECT7719 là âm tính với chỉ tiêu arginine dihydrolase, ngược lại chủng NC36 dương tính với chỉ tiêu này. Trong khi đó chủng CECT7719 dương tính với chỉ tiêu thủy phân esculin, trong khi 54 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 2 - 2019 36 chủng vi khuẩn phân lập được và chủng NC36 là âm tính với chỉ tiêu thủy phân esculin (bảng 2). a b Hình 2. Hình thái của vi khuẩn W. ceti Bảng 2. Kết quả thử sinh hóa các chủng Weissella ceti phân lập từ cá hồi vân bị bệnh (n = 36) Chỉ tiêu 36 chủng trong nghiên cứu này* Chủng đối chứng NC36** CECT7719*** Pyruvate (Acetoin production) + + + Hippurate (Hydrolysis) + + + Esculin (β-glucosidase) - - + pyrrolidonyl-2-naphthylamide (Pyrrolidonylarylamidase) - - - 6-Br-2-naphthvl-α-D- galactopyranoside (α-galactosidase) - - - naphthol AS-BI β-D- glucuronat (β-glucuronidase) - - - 2-naphthyl-β-D- galactopyranoside (β-galactosidase) - - - 2-naphthylphosphate (Alkaline phosphatase) + + + L-leucyl-2-naphthylamide (Leucinearylamidase) + + + Arginine (Arginine dehydrolase ) - + - Ribose (acidification) + + + L-arabinose (acidification) - - - Mannitol (acidification) - - - Sorbitol (acidification) - - - Lactose (acidification) - - - Trehalose (acidification) + + + Inulin (acidification) - - - Raffinose (acidification) - - - Starch (acidification) - - - Glycogen (acidification) - - - (*) Bảng 1; (**) Chủng vi khuẩn phân lập từ cá hồi vân ở Mỹ, các chỉ tiêu hóa sinh đã được báo cáo (Welch và Good, 2013); (***) Chủng vi khuẩn phân lập từ cá voi mỏ khoằm ở Tây Ban Nha 55 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 2 - 2019 Kết quả phân tích trình tự gen 16S rRNA của 36 chủng cho thấy chúng có trình tự đoạn gen 16S rRNA có độ tương đồng rất cao (100%) với độ dài là 1.481 bp. Phân tích BLAST đoạn gen 16S rRNA cho thấy trình tự này tương đồng cao (tỷ lệ tương đồng 96% đến 99%) với các thành viên của loài Weissella. Kết quả phân tích đoạn gen 16R rRNA và cây phả hệ cho thấy các chủng vi khuẩn phân lập được có sự tương đồng cao nhất với Weissella sp. gây bệnh ở Trung Quốc, Brazil và Mỹ ((Liu, Li et al., 2009; Figueiredo, Costa et al., 2012; Welch và Good, 2013) (hình 3). Hình 3. Cây phả hệ được xây dựng dựa trên trình tự gen 16S rRNA của các chủng Weissella sp. chủng Leuconostoc gasicomitatum LMG 18811 là đối chứng nhóm ngoài Kết quả của xét nghiệm PCR cho thấy tất cả các chủng phân lập từ cá hồi vân gây bệnh Weissellosis trong nghiên cứu này đều có cả hai sản phẩm khuếch đại của đoạn gen 16S rRNA đặc trưng 725 bp và sản phẩm khuếch đại 500 bp là các đoạn gen đặc trưng và liên quan đến các yếu tố độc lực bao gồm collagen- like và platelet-associated adhesive proteins (hình 4). Vị trí gen đặc trưng có chiều dài 500 bp có trong bộ gen của chủng vi khuẩn W. ceti NC36 được phân lập từ cá hồi vân ở Hoa Kỳ (Welch et al., 2013) nhưng không được phát hiện trong bộ gen của các loài vi khuẩn Weissella khác và bộ gen của chủng W. ceti CECT7719 phân lập từ cá voi mõm khoằm nên đã được sử dụng để xác nhận sự hiện diện của W. ceti trong sự bùng phát bệnh Weissellosis trên cá hồi vân (Snyder et al., 2015). Những kết quả này chỉ ra rằng vi khuẩn gây bệnh Weissellosis trên cá hồi vân trong nghiên cứu này là W. ceti. Điều này cũng củng cố tính đặc hiệu của đoạn mồi sử dụng trong chẩn đoán W. ceti gây bệnh Weissellosis trên cá hồi vân bằng phương pháp PCR kép đã được công bố ở báo cáo trước đây (Snyder et al., 2015). W. ceti NC36 (WCNC r01255) Weiaaella sp. JZ-1L (EU869290) Weissella sp. (KC461925) W. ceti (KY697255) Weissella sp. WS-08 (GU112514) W. ceti 1119-1A-09 (FN813251) W. halotolerans (AB022926) W. viridescens (AB023236) W. minor (AB022920) W. thailandensis (AB023838) W. paramesenteroides (AB023238) W. hellenica (S67831) W. cibaria (AJ295989) W. confusa (AB023241) W. kandleri (AB022922) W. koreensis (AY035891) W. soli (AY028260) W. beninensis (EU439435) W. ghanensis (AM882997) W. fabaria (FM179678) Leuconostoc gasicomitatum (AF231131) 100 100 86 100 100 31 55 90 93 100 94 83 53 63 20 32 69 28 0.01 56 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 2 - 2019 Hình 4. Kết quả kiểm tra PCR kép để xác định sự hiện diện của W. ceti Giếng M: DNA tiêu chuẩn; Giếng 1-36: Lần lượt các chủng vi khuẩn W. ceti trong nghiên cứu này (bảng 1). Giếng 37: W. ceti CECT7719 được phân lập từ cá voi mỏ khoằm 3.2. Phân lập và định danh thực khuẩn thể Pwr-1 Đốm thực khuẩn thể Pwr-1 (vòng vô khuẩn do Pwr-1 tạo ra) có hình tròn, rõ ràng, trong suốt và không có sự hiện diện của vi khuẩn W. ceti với đường kính từ 0,7 - 2 mm (hình 5A). Hình ảnh chụp bằng kính hiển vi điện tử cho thấy Pwr-1 có đường kính đầu khoảng 60 - 65 nm và đuôi hình trụ và linh hoạt với chiều dài khoảng 170 - 180 nm, chiều rộng 9 - 10 nm (hình 5B). Theo các đặc điểm hình thái và dựa trên sự phân loại của Ackermann (Ackermann, 2001), Pwr-1 thuộc về họ Siphoviridae. Hình 5. Đốm thực khuẩn thể và hình thái học của thực khuẩn thể Pwr-1. thước: 100nm a b 3.3. Thời gian lây nhiễm và khả năng diệt khuẩn của Pwr-1 Kết quả trong hình 6 cho thấy thời gian tiềm tàng của Pwr-1 được xác định là khoảng 25 phút và số lượng thực khuẩn thể được giải phóng là 16 thực khuẩn thể/tế bào bị nhiễm. Kết quả của thử nghiệm kiểm tra phổ diệt khuẩn cho thấy rằng Pwr-1 có phổ diệt khuẩn rộng và có thể lây nhiễm trên tất cả các chủng W. ceti được phân lập (n = 36) từ cá hồi vân bị nhiễm bệnh trong nghiên cứu này. Pwr-1 không thể diệt chủng vi khuẩn W. ceti CECT7719 (phân lập từ cá voi mõm khoằm), chủng W. cibaria (VN16-10 và VN16-11 phân lập từ cá trắm cỏ) và Lactococcus lactis subsp. lactis ATCC19435 (bảng 3). A B 57 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 2 - 2019 Bảng 3. Các chủng vi khuẩn được sử dụng để xác định phổ diệt khuẩn của Pwr-1 Loài vi khuẩn Tên chủng Nguồn phân lập Năm phân lập Kết quả kiểm tra W. ceti WM1 Cá hồi vân 2012 +++ W. ceti WM2 Cá hồi vân 2012 ++++ W. ceti WM3 Cá hồi vân 2012 +++ W. ceti WM4 Cá hồi vân 2012 ++ W. ceti WM5 Cá hồi vân 2012 +++ W. ceti WM6 Cá hồi vân 2012 ++++ W. ceti WM7 Cá hồi vân 2012 ++ W. ceti WM8 Cá hồi vân 2012 ++ W. ceti WM9 Cá hồi vân 2012 ++++ W. ceti WM10 Cá hồi vân 2012 +++ W. ceti WM11 Cá hồi vân 2012 ++ W. ceti WM12 Cá hồi vân 2012 +++ W. ceti WM13 Cá hồi vân 2012 ++ W. ceti WM14 Cá hồi vân 2012 +++ W. ceti WM15 Cá hồi vân 2012 ++++ W. ceti WM16 Cá hồi vân 2012 ++ W. ceti WM17 Cá hồi vân 2012 +++ W. ceti WM18 Cá hồi vân 2012 ++ W. ceti WM19 Cá hồi vân 2012 +++ W. ceti WM20 Cá hồi vân 2012 +++ W. ceti WM21 Cá hồi vân 2014 ++++ W. ceti WM22 Cá hồi vân 2014 +++ W. ceti WM23 Cá hồi vân 2014 ++ W. ceti WM24 Cá hồi vân 2014 +++ W. ceti WM25 Cá hồi vân 2014 ++ W. ceti WM26 Cá hồi vân 2014 ++++ W. ceti WM27 Cá hồi vân 2014 ++++ W. ceti WM28 Cá hồi vân 2014 ++ W. ceti WM29 Cá hồi vân 2015 +++ W. ceti WM30 Cá hồi vân 2015 ++ W. ceti WM31 Cá hồi vân 2015 ++++ W. ceti WM32 Cá hồi vân 2016 +++ W. ceti WM33 Cá hồi vân 2016 ++ W. ceti WM34 Cá hồi vân 2016 +++ W. ceti WM35 Cá hồi vân 2016 +++ W. ceti WM36 Cá hồi vân 2016 ++++ W. ceti CECT7719 Cá voi mõm khoằm 2010 - W. cibaria VN16-10 Cá trắm cỏ 2016 - W. cibaria VN16-11 Cá trắm cỏ 2016 - L.lactis sub.lactis ATCC19435 - - - 58 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 2 - 2019 3.4. Khả năng tồn tại của Pwr-1 trong điều kiện bất lợi Kết quả thử nghiệm khả năng tồn tại của Pwr-1 ở các giá trị pH khác nhau cho thấy Pwr-1 có khả năng chịu đựng tốt với khoảng pH rộng. Cụ thể, Pwr-1 phát triển tốt nhất ở khoảng pH 7,0 và tồn tại ở một loạt các giá trị pH khác với hơn 60% Pwr-1 có thể hoạt động ở pH 4 - 10 và hơn 40% ở pH 3,0. Đặc biệt, một vài thực khuẩn thể Pwr-1 vẫn có thể tồn tại ở pH 2,0. Tuy nhiên, các thực khuẩn thể hoàn toàn bị mất khả năng lây nhiễm ở pH 1,0 (hình 7). Kết quả kiểm tra khả năng chịu nhiệt (hình 8) cho thấy Pwr-1 chịu đựng khá tốt với khoảng nhiệt độ từ 40 đến 60°C, với hơn 90% sống ở khoảng nhiệt độ 40 - 50°C và 63,3% sống ở nhiệt độ 60°C sau 1 giờ. Mật độ thực khuẩn thể giảm nhanh chóng ở nhiệt độ 70°C (giảm 90% sau 15 phút) và không phát hiện thấy Pwr-1 tồn tại sau 30 phút ở nhiệt độ này. Ở nhiệt độ 80°C và 90°C, không phát hiện thấy Pwr-1 còn tồn tại sau 15 phút. Việc Pwr-1 có phổ diệt khuẩn khá rộng, khả năng hoạt động trong khoảng pH rộng và tồn tại ở khoảng nhiệt độ lên tới 60°C mở ra khả năng sử dụng Pwr-1 trong điều trị bệnh do vi khuẩn W. ceti trên cá hồi vân. Hình 6. Khả năng tăng trưởng của Pwr-1. Thời gian tiềm tàng và số lượng thực khuẩn thể Pwr-1 được giải phóng. L: pha tiềm tàng; R: pha sinh trưởng và P: pha đỉnh Hình 7. Khả năng chống chịu của Pwr-1 ở môi trường có độ pH khác nhau 59 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 2 - 2019 IV. KẾT LUẬN VÀ ĐỀ NGHỊ 4.1. Kết luận Trong nghiên cứu đã phân lập được 36 chủng vi khuẩn W. ceti trên cá hồi vân bị nhiễm bệnh Weissellosis có triệu chứng bệnh được mô tả và tác nhân vi khuẩn gây bệnh có sự tương đồng cao về mặt di truyền với các chủng W. ceti gây bệnh trên cá hồi vân đã phân lập được ở các nước khác nhau trên thế giới. Lần đầu tiên, thực khuẩn thể (Pwr-1) được phân lập thành công có khả năng tiêu diệt mầm bệnh W. ceti. Pwr-1 có thời gian tiềm tàng ngắn, số lượng thực khuẩn thể được giải phóng tương đối cao, khả năng chịu đựng với khoảng pH rộng, nhiệt độ cao, có phổ diệt khuẩn rộng và khả năng diệt khuẩn rất mạnh. Những kết quả này cho thấy Pwr-1 có nhiều tính năng thuận lợi và có triển vọng cao để sử dụng trong điều trị bệnh Weissellosis trên cá hồi vân. 4.2. Đề nghị Nghiên cứu thử nghiệm phương pháp sử dụng thực khuẩn thể cho kết quả điều trị cao nhất ở quy mô phòng thí nghiệm và áp dụng ở thực tế tại các trại nuôi cá hồi vân. TÀI LIỆU THAM KHẢO 1. Ackermann, H.-W. (2001). “Frequency of morphological phage descriptions in the year 2000.” Archives of virology 146(5): 843-857. 2. Adams, M. H. (1959). “Bacteriophages.” Interscience, New York. 3. Figueiredo, H., F. Costa, C. Leal, G. Carvalho-Castro and R. Leite (2012). “Weissella sp. outbreaks in commercial rainbow trout (Oncorhynchus mykiss) farms in Brazil.” Veterinary Microbiology 156(3- 4): 359-366. 4. Figueiredo, H. C., S. C. Soares, F. L. Pereira, F. A. Dorella, A. F. Carvalho, J. P. Teixeira, V. A. Azevedo and C. A. Leal (2015). “Comparative genome analysis of Weissella ceti, an emerging pathogen of farm-raised rainbow trout.” BMC genomics 16(1): 1095. 5. Kot, W., H. Neve, K. J. Heller and F. K. Vogensen (2014). “Bacteriophages of leuconostoc, oenococcus, and weissella.” Frontiers in microbiology 5: 186. 6. Ladner, J. T., T. J. Welch, C. A. Whitehouse and G. F. Palacios (2013). “Genome sequence of Weissella ceti NC36, an emerging pathogen of farmed rainbow trout in the United States.” Genome announcements 1(1): e00187-00112. 7. Lane, D. (1991). “16S/23S rRNA Hình 8. Khả năng chịu nhiệt của Pwr-1 60 KHOA HỌC KỸ THUẬT THÚ Y TẬP XXVI SỐ 2 - 2019 sequencing.” Nucleic acid techniques in bacterial systematics: 115-175. 8. Liu, J. Y., A. H. Li, C. Ji and W. M. Yang (2009). “First description of a novel Weissella species as an opportunistic pathogen for rainbow trout Oncorhynchus mykiss (Walbaum) in China.” Veterinary microbiology 136(3-4): 314-320. 9. Lu, Z., I. M. Perez-Diaz, J. S. Hayes and F. Breidt (2012). “Bacteriophage ecology in a commercial cucumber fermentation.” Applied and environmental microbiology: AEM. 01914-01912. 10. Marancik, D. P., T. J. Welch, T. D. Leeds and G. D. Wiens (2013). “Acute mortality, bacterial load, and pathology of select lines of adult rainbow trout challenged with Weissella sp. NC36.” Journal of aquatic animal health 25(4): 230-236. 11. Mitomi, K., T. Hoai, I. Nishiki and T. Yoshida (2018). “First isolation of Weissella ceti responsible for outbreaks of weissellosis in farmed rainbow trout in Japan.” Journal of fish diseases 41(5): 847-850. 12. Oliveira, J., F. Castilho, A. Cunha and M. Pereira (2012). “Bacteriophage therapy as a bacterial control strategy in aquaculture.” Aquaculture International 20(5): 879-910. 13. Pringsulaka, O., N. Patarasinpaiboon, N. Suwannasai, W. Atthakor and A. Rangsiruji (2011). “Isolation and characterisation of a novel Podoviridae-phage infecting Weissella cibaria N 22 from Nham, a Thai fermented pork sausage.” Food microbiology 28(3): 518-525. 14. Saitou, N. and M. Nei (1987). “The neighbor-joining method: a new method for reconstructing phylogenetic trees.” Molecular biology and evolution 4(4): 406-425. 15. Schleifer, K., J. Kraus, C. Dvorak, R. Kilpper- Bälz, M. Collins and W. Fischer (1985). “Transfer of Streptococcus lactis and related streptococci to the genus Lactococcus gen. nov.” Systematic and Applied Microbiology 6(2): 183-195. 16. Snyder, A., J. Hinshaw and T. Welch (2015). “Diagnostic tools for rapid detection and quantification of Weissella ceti NC 36 infections in rainbow trout.” Letters in applied microbiology 60(2): 103-110. 17. Tamura, K., G. Stecher, D. Peterson, A. Filipski and S. Kumar (2013). “MEGA6: molecular evolutionary genetics analysis version 6.0.” Molecular biology and evolution 30(12): 2725-2729. 18. Thompson, J. D., D. G. Higgins and T. J. Gibson (1994). “CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice.” Nucleic acids research 22(22): 4673-4680. 19. Vela, A. I., A. Fernández, Y. B. de Quirós, P. Herráez, L. Domínguez and J. F. Fernández- Garayzábal (2011). “Weissella ceti sp. nov., isolated from beaked whales (Mesoplodon bidens).” International journal of systematic and evolutionary microbiology 61(11): 2758-2762. 20. Welch, T. J. and C. M. Good (2013). “Mortality associated with Weissellosis (Weissella sp.) in USA farmed rainbow trout: potential for control by vaccination.” Aquaculture 388: 122-127. 21. Woo, P. T. and R. C. Cipriano (2017). Fish Viruses and Bacteria: Pathobiology and Protection, CABI. Ngày nhận 19-8-2018 Ngày phản biện 26-11-2018 Ngày đăng 1-3-2019
File đính kèm:
 benh_vi_khuan_moi_noi_nguy_hiem_o_ca_hoi_van_va_nghien_cuu_u.pdf
benh_vi_khuan_moi_noi_nguy_hiem_o_ca_hoi_van_va_nghien_cuu_u.pdf

