Bài giảng Kỹ thuật nhiệt - Chương 2: Năng lượng - Phần C: Tính chất của vật chất (Properties of Substances)
Thuộc tính (property)
Để mô tả một hệ thống và dự đoán ứng xử của nó, cần kiến thức về các
thuộc tính của nó và mối quan hệ giữa chúng
Thuộc tính của một hệ thống là các đặc tính vĩ mô của nó.
Một số thuộc tính phổ biến là: áp suất (pressure-P), nhiệt độ (temperatureT), thể tích (volume-V) và khối lượng (G) hoặc (mass-m).
Các thuộc tính mô tả trạng thái của một hệ thống chỉ khi hệ thống ở trạng
thái ổn định (cân bằng-equilibrium state).
Không phải tất cả các thuộc tính là độc lập. Mật độ hay khối lượng riêng
(density-ρ) là thuộc tính độc lập với áp suất và nhiệt độ. Mật độ và thể tích
riêng (specific volume-v) nghịch đảo nhau

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7

Trang 8

Trang 9
Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài giảng Kỹ thuật nhiệt - Chương 2: Năng lượng - Phần C: Tính chất của vật chất (Properties of Substances)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Kỹ thuật nhiệt - Chương 2: Năng lượng - Phần C: Tính chất của vật chất (Properties of Substances)

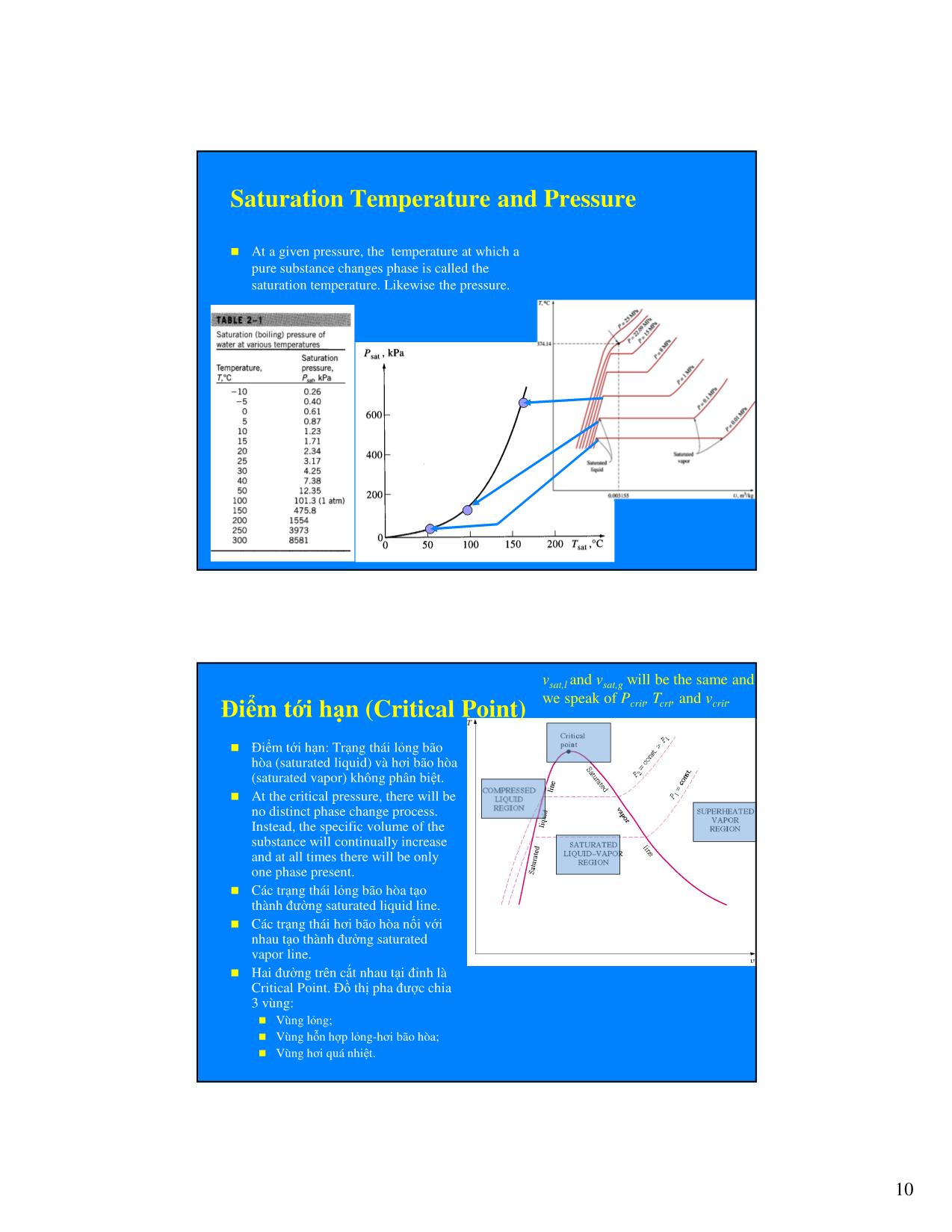
pha. Ví d ụ khi n ướ c đang sôi. Đị nh lu ật pha: Môi ch ất đơ n nh ất, không bi ến đổ i pha: c ần 2 thông s ố; Môi ch ất có bi ến đổ i pha: c ần 1 thông s ố. Các d ạng n ăng l ượ ng (Forms of Energy) Trong h ệ ổn đị nh (không t ồn t ại ảnh h ưở ng c ủa điện, t ừ, ), n ăng l ượ ng toàn ph ần (E) c ủa h ệ bao g ồm: Độ ng n ăng (kinetic-KE ), th ế n ăng (potential-PE ) và n ội n ăng (internal-U) E = U + KE + PE (kJ), mv 2 me = mu + + mgz (kJ), 2 Ho ặc vi ết cho m ột đơ n v ị kh ối l ượ ng: v2 e = u + ke + pe = u + + gz (kJ / kg ) 2 Năng l ượ ng v ĩ mô c ủa h ệ là n ăng l ượ ng toàn ph ần so v ới xung quanh, bao g ồm độ ng n ăng và th ế n ăng. Năng l ượ ng vi mô c ủa h ệ liên quan đế n c ấu trúc phân t ử c ủa h ệ th ống và độ c l ập với bên ngoài. Đó là n ội n ăng. Sự thay đổ i c ủa n ăng l ượ ng toàn ph ần ∆E của m ột h ệ t ĩnh t ại (closed system) chính bằng s ự thay đổ i n ội n ăng ∆U. Ví d ụ: khi đun nóng v ật ch ất trong m ột bình kín. 4 Enthalpy – Một thông s ố tr ạng thái k ết h ợp Khi nghiên c ứu m ột s ố quá trình liên quan đế n n ăng l ượ ng và làm l ạnh, th ườ ng g ặp s ự k ết h ợp gi ữa internal energy U, và tích pressure-volume PV. Ng ườ i ta g ọi nó là ENTHALPY. Là đơ n v ị n ăng l ượ ng: Vi ết cho h ệ b ấy k ỳ: � = � + �� Vi ết cho h ệ g ồm 1kg môi ch ất: ℎ = � +�� Tr ướ c 1930, h th ườ ng đượ c g ọi là heat content or total heat. Sau 1930, đượ c g ọi là enthalpy (theo ti ếng Hy L ạp, enthalpien ngh ĩa là heat) Sự chuy ển pha, đồ th ị pha, tính ch ất c ủa ch ất tinh khi ết 5 Ch ất tinh khi ết Hóa h ọc đị nh ngh ĩa đơ n ch ất và h ợp ch ất. Air Nhi ệt độ ng h ọc coi ch ất tinh khi ết (pure substance) là ch ất có thành ph ần hóa h ọc đồ ng N2 nh ất. Ví d ụ Water, nitrogen, helium, and carbon dioxide, for example, are all pure substances. Water vapor A mixture of water liquid and water vapor, for example, is a pure substance because both phases have the same chemical composition. Water liquid �������������� Các pha c ủa ch ất tinh khi ết (n ướ c) Vật ch ất có th ể bi ến đổ i gi ữa các pha (r ắn, l ỏng, khí). Các pha khác nhau có s ắp x ếp phân t ử khác nhau. Các pha phân tách v ới nhau b ởi các b ề m ặt phân cách. ����� ������ ����� 6 Cấu trúc phân t ử các pha Đặ c điểm chuy ển độ ng phân t ử? - Solid; - Liquid; - Vapor (Gas). Bi ến đổ i pha N ướ c-Hơi Điều gì x ảy ra khi c ấp nhi ệt cho môi ch ất ở th ể l ỏng (n ướ c) v ới áp su ất không đổ i? Piston cylinder device – Liquid Water maintains constant pressure 7 T Quá trình hóa hơi (chuy ển 5 pha) trên đồ th ị T-v 2 3 4 1 v Phase Change Processes on a T-v diagram Consider a piston-cylinder device with water inside at 20 oC and 1 atm pressure . At this P and T, water is called compressed (or subcooled) liquid state. Compressed liquid means that it is not about to vaporize. The system is heated and the piston is allowed A liquid that is about to float and thus the pressure will be constant. to vaporize is called Saturated Liquid. T and v will increase until the system reaches 100 C at which any addition of heat will cause some of the liquid to vaporize The temperature at which a pure substance changes phase is called the saturation temperature, T sat . At T sat , Liquid and vapor phases are in equilibrium. 8 A substance between saturated liquid (state 2) and Adding more heat will cause saturated vapor (state 4) is boiling to start. Liquid gradually called saturated liquid-vapor mixture . evaporates (state 3) but temperature will remain constant, Why? The only change is the increase in the specific volume (v) until it A vapor that is about to reaches state 4 (saturated vapor). condense is called Heating the system further, will Saturated vapor. increase both the temperature and specific volume (state 5). This single-phase state is called “Superheated vapor” Repeat this experiment for higher pressures. Similar curves will be obtained but at higher sat. temperature. Note that the sat. liquid specific volume (v sat,l ) will increase while the sat. vapor specific volume (v sat,g ) will decrease Nhi ệt độ và áp su ất bão hòa (Saturation Temperature and Pressure) Water at a pressure of 101.325 kPa, T sat is 100 oC. Conversely, at a temperature of o 100 C, P sat is 101.325 kPa. Nhi ệt ẩn (Latent heat): ng ưng t ụ, hóa h ơi (fusion and vaporization). The magnitude of the latent heats depend on the temperature or pressure at which the phase change occur. 9 Saturation Temperature and Pressure At a given pressure, the temperature at which a pure substance changes phase is called the saturation temperature. Likewise the pressure. vsat,l and vsat,g will be the same and Điểm t ới h ạn (Critical Point) we speak of Pcrit , T crt , and vcrit . Điểm t ới h ạn: Tr ạng thái l ỏng bão hòa (saturated liquid) và h ơi bão hòa (saturated vapor) không phân bi ệt. At the critical pressure, there will be no distinct phase change process. Instead, the specific volume of the substance will continually increase and at all times there will be only one phase present. Các tr ạng thái l ỏng bão hòa t ạo thành đườ ng saturated liquid line. Các tr ạng thái h ơi bão hòa n ối v ới nhau t ạo thành đườ ng saturated vapor line. Hai đườ ng trên c ắt nhau t ại đỉ nh là Critical Point. Đồ th ị pha đượ c chia 3 vùng: Vùng l ỏng; Vùng h ỗn h ợp l ỏng-hơi bão hòa; Vùng h ơi quá nhi ệt. 10 Độ khô – Tr ạng thái c ủa môi ch ất trên đồ th ị pha Vùng n ằm gi ữa đườ ng l ỏng bão hòa và đườ ng h ơi bão hòa luôn t ồn t ại m ột ph ần môi ch ất ở tr ạng thái l ỏng bão hòa và m ột ph ần h ơi bão hòa. Tỷ l ệ gi ữa ph ần h ơi trên t ổng l ượ ng môi ch ất đượ c g ọi là ĐỘ KHÔ (x=0÷1): � � = ��� ���� ��� Đườ ng saturated liquid có x=0 (còn g ọi là đườ ng gi ới h ạn d ướ i); Phân bi ệt các vùng tr ạng thái: Đườ ng saturated vapor có x=1 (còn g ọi -Lỏng; là đườ ng gi ới h ạn trên). -Lỏng bão hòa; -Hơi bão hòa ẩm (h ỗn h ợp); -Hơi bão hòa khô; -Hơi quá nhi ệt. Bi ến đổ i pha trên P-v diagram Decrease P gradually but keep T constant. Water boils at P sat The pressure at which a pure substance changes phase is called the 1 saturation pressure P sat . At P sat , Liquid and vapor phases are in equilibrium. From State 2 to 4, no 2 3 4 weights are removed (P=constant) and T is kept constant but heating 5 causes liquid to vaporize. 11 P-v diagrams with Solid Phase Đồ th ị P – v v ới v ật ch ất co l ại khi đông đặ c P – v v ới v ật ch ất giãn khi đông đặ c (n ướ c) Điểm ba th ể - Triple point Under some conditions all three phases of substance coexist in equilibrium at states along the triple line. The states on the triple line of substance have the same pressure and temperature but different v. The triple line appears as a point on the P-T diagram. The triple point of water occurs at T= 0.01 C and P=0.6113 Kpa 12 Property Diagrams P-T diagram (or Phase diagram) The P-T diagram is often called phase diagram since all three phases are separated by three lines, namely the sublimation line (between solid and vapor regions), the vaporization line (between liquid and vapor regions), and the melting line (between solid and liquid). T P-v-T surfaces Top view v P P v T 13 Nh ận xét Một s ố môi ch ất, khi th ực hi ện các quá trình nhi ệt độ ng trong các thi ết b ị, xảy ra bi ến đổ i pha, ch ủ y ếu gi ữa hai pha LIQUID và VAPOR. Ví d ụ tiêu bi ểu là N ƯỚ I và H ƠI N ƯỚ C trong các chu trình nhà máy nhi ệt điện; môi ch ất l ạnh (REFRIGERANT) trong các h ệ th ống làm l ạnh, điều hòa không khí Quá trình đặ c tr ưng cho vi ệc bi ến đổ i pha là BAY H ƠI và NG ƯNG T Ụ. BAY H ƠI, NG ƯNG T Ụ th ườ ng x ảy ra ở áp su ất nh ất đị nh và là quá trình vừa đẳ ng áp v ừa đẳ ng nhi ệt. Vi ệc nghiên c ứu các môi ch ất bi ến đổ i pha có th ể s ử d ụng các đồ th ị nh ư ở trên. Ng ườ i ta c ũng l ập ra các b ảng tra c ứu các thông s ố c ủa môi ch ất ở các tr ạng thái đặ c tr ưng nh ư ph ần sau đây. Bảng nhi ệt độ ng - Thermodynamics Tables Quan h ệ gi ữa các thông s ố c ủa môi ch ất có bi ến đổ i pha khá ph ức t ạp nên không thu ận l ợi khi s ử d ụng các công th ức. Ng ườ i ta xây d ựng các b ảng tra cứu. Trong vùng đơ n pha (vùng lỏng, vùng h ơi quá nhi ệt), c ần 2 thông s ố b ất k ỳ để xác đị nh tr ạng thái. Trong vùng h ỗn h ợp, P và T ph ụ thu ộc l ẫn nhau, nên c ần 2 thông s ố độ c l ập b ất k ỳ để xác đị nh tr ạng thái. Các b ảng tra c ứu xem tài li ệu: Appendix Tables 14 Bảng n ướ c và h ơi n ướ c bão hòa- Saturated Liquid and Saturated Vapor States Table A-4 Saturated liquid-vapor mixture n ằm d ướ i đườ ng gi ới hạn trên các đồ th ị P-v (or T- v). Tra c ứu thông s ố t ừ các b ảng: Water Tables A-4 and A-5 (theo T và theo P – vì trong vùng bão hòa 2 thông s ố này ph ụ thu ộc nhau) t. s n o c = P Saturated Liquid and Saturated Vapor States Table A-5 Bảng Table A-5: N ướ c và h ơi nướ c bão hòa theo áp su ất. Enthalpy c ủa quá trình bay h ơi – Nhi ệt ẩn (latent heat): là lượ ng nhi ệt c ần cung c ấp để làm m ột đơ n v ị ch ất ở tr ạng thái l ỏng bão hòa bi ến h ết thành h ơi ở áp su ất nào đó. 15 Example 2-1: Saturated Liquid and Saturated Vapor Một két ch ứa 50 kg of n ướ c bão hòa ở 90 oC. Hãy xác đị nh áp su ất c ủa nướ c trong két và th ể tích c ủa két. (Table A-4) Example 2-2: Saturated Liquid and Saturated Vapor Một két ch ứa 2m3 hơi bão hòa ở áp su ất 2bar. Hãy xác đị nh nhi ệt độ c ủa hơi và kh ối l ượ ng h ơi trong két. (Table A-5) Example 2-3: Saturated Liquid and Saturated Vapor 200 g n ướ c ở tr ạng thái bão hòa đượ c c ấp nhi ệt để hóa h ơi hoàn toàn ở áp su ất không đổ i là 100kPa. Hãy xác đị nh s ự thay đổ i th ể tích c ủa h ệ th ống và l ượ ng nhi ệt c ần thi ết cung c ấp. Tr ạng thái c ủa môi ch ất vùng h ỗn h ợp Vùng h ỗn h ợp (saturated liquid-vapor) luôn t ồn t ại môi ch ất ở hai pha ( đang sôi). Quan h ệ gi ữa các thông s ố tr ạng thái nh ư th ể tích riêng (v), n ội n ăng (u), enthalpy (h) theo quan h ệ sau: � = 1 − � �� + �. �� Trong đó: - y là m ột trong các thông s ố v, u, h ; - x là độ khô; - yl , yh là các thông s ố c ủa ph ần l ỏng và ph ần h ơi. 16 Hỗn h ợp l ỏng-hơi bão hòa (vùng đang sôi) Độ khô m m x ≡ g = g m + m m Derivation: f g total ���� � � V = V f +Vg ����� � ������ mv = m f v f + mg vg �� �� = (m − mg )v f + mg vg ∴ v = 1( − x)v f + xv g v = v f + x(vg − v f ) v = v f + xv fg υ υ <υ <υ υ where v fg = vg − v f f f g g υ Average Properties Trong vùng bão hòa, thông s ố c ủa h ỗn h ợp đượ c xác đị nh nh ư sau: y= yf+ x() y g− y f =yf + x y fg Trong đó: f (ho ặc l) là ký hi ệu ph ần l ỏng, g (ho ặc h) là ph ần h ơi; ��� = �� − �� 17 X = 0 X = 1 Example 2- 4: Saturated Liquid-vapor mixture (continued) Một bình kín ch ứa 10kg n ướ c ở 90 oC. N ếu 8 kg ở th ể l ỏng và ph ần còn l ại ở th ể h ơi: (a) xác đị nh áp su ất trong bình; (b) xác đị nh th ể tích bình. (Answers: 70.14 kPa, 4.73 m 3) 18 Example 2-5: Saturated Liquid-vapor mixture (continued) An 80-L vessel contains 4 kg of refrigerant 134a at a pressure of 160 kPa. Determine a) the temperature of the refrigerant, b) the quality, c) the enthalpy of the refrigerant, and d) the volume occupied by the vapor phase. (Answers: -15.62 oC, 0.158, 62.7 kJ/kg, 0.0777 m3) Hơi quá nhi ệt: Table A-6 Trong vùng phía bên ph ải đồ th ị pha, môi ch ất là h ơi quá nhi ệt (single phase). P T= co ns t. vg v v 19 Superheated Vapor t. s n o c = P P Psat T= co ns P t. vg v v Lỏng ch ưa sôi (Compressed liquid): Table A-7 Vùng phía bên ph ải môi ch ất t ổn t ại ở th ể l ỏng. 20 Compressed Liquid t. s n o c = P Gi ả thi ết g ần đúng Trong vùng l ỏng, th ể tích riêng c ủa môi ch ất coi nh ư không đổ i ở các áp su ất khác nhau (ch ất l ỏng không ch ịu nén – incompressible substance). Acceptable T . a p M 5 = P 264 80 v vf v Approximate value Precise value y ≅ y f @T Khi thay đổ i nhi ệt độ thì th ể tích riêng c ủa môi ch ất l ỏng thay đổ i. 21 Phép n ội suy (s ử d ụng khi tra b ảng) AB 100 5 130 y 200 10 130 −100 y − 5 = 200 −100 10 − 5 Linear Interpolation (Continued) Now T P sat yy− xx − X1= 140 y1= 0.3615 1= 1 X = 143 y = ? y− y x − x X2= 145 y2= 0.4154 2 1 2 1 x − x1 y = y1 + ×(y2 − y1) x2 − x1 143− 140 Psat := 0.3615 + ⋅ ()0.4154− 0.3615 145− 140 Psat = 0.394 kPa 22 Example 2-7 Superheated Vapor Determine the temperature of water at a state of P = 0.5 MPa and h = 2890 kJ/kg. (Answers: 216.4 oC) Example on Compressed Liquid Example 2-8: Determine the internal energy of compressed liquid water at 80 oC and 5 MPa using (a) data from the compressed liquid table and (b) saturated liquid data. What is the 263 .99 error involved in the second case? 80 (Answers: 333.72 kJ/kg, 334.86 kJ/kg, 0.34%) 80 23 Tra b ảng n ướ c-hơi n ướ c Example 2-9: Determine the missing properties and the phase descriptions in the following table for water. Tr ạng thái tham kh ảo – Thông s ố tham kh ảo Reference State and Reference Values Các đạ i l ượ ng u, h, s không đo đượ c mà ph ải tính toán t ự các thông s ố đo đượ c theo các quan h ệ nhi ệt độ ng h ọc. Khi đó, h ầu nh ư ch ỉ xác đị nh đượ c sự thay đổ i c ủa các th ống s ố trên. Để thu ận l ợi, ng ườ i ta quy ướ c l ấy tr ạng thái n ướ c bão hòa (n ướ c sôi) ở nhi ệt độ 0.01 oC làm tr ạng thái tham kh ảo. Ở tr ạng thái này, n ội n ăng (u) và entropy c ủa n ướ c có giá tr ị b ằng 0. Với refrigerant 134a, tr ạng thái l ỏng bão hòa ở -40 oC là tr ạng thái tham kh ảo. Khi nghiên c ứu, chúng ta ch ỉ quan tâm đế n s ự thay đổ i c ủa các thông s ố. Vì vậy, vi ệc ch ọn tr ạng thái tham kh ảo (m ốc) không ảnh h ưở ng đế n k ết qu ả nghiên c ứu. 24 Ghi nh ớ Hi ểu đượ c s ự thay đổ i pha c ủa ch ất thu ần khi ết (n ướ c) và b ản ch ất c ủa môi ch ất (n ướ c l ỏng, l ỏng bão hòa, h ơi ẩm, h ơi bão hòa khô, h ơi quá nhi ệt) trên đồ th ị pha; Bi ết cách tra các đồ th ị c ủa n ướ c, h ơi n ướ c (t ươ ng t ự đố i v ới các môi ch ất có bi ến đổ i pha khác (môi ch ất l ạnh nh ư R22, R134a, ). Áp d ụng để làm các bài t ập. X = 0 X = 1 25
File đính kèm:
 bai_giang_ky_thuat_nhiet_chuong_2_nang_luong_phan_c_tinh_cha.pdf
bai_giang_ky_thuat_nhiet_chuong_2_nang_luong_phan_c_tinh_cha.pdf

