Ảnh hưởng của tỉ lệ N:P hỗn hợp nước thải đến tốc độ sinh trưởng tảo xoắn Spirulina và hiệu quả loại bỏ N, P sau nuôi tảo
Tóm tắt Tảo Spirulina (tảo xoắn) được biết đến do sinh khối giàu protein và phát triển tốt ở qui mô lớn. Sinh khối tảo có thể được dùng để làm thực phẩm bổ sung cho bữa ăn của người, thức ăn gia súc và nhiều ứng dụng khác. Nuôi trồng Spirulina trong nước thải nhằm tận dụng nguồn dinh dưỡng N, P để tổng hợp sinh khối tảo Spirulina có giá trị cao, đồng thời góp phần loại bỏ các chất ô nhiễm trong nước thải đang rất được quan tâm. Nghiên cứu này được tiến hành nhằm mục đích xác định tỉ lệ N:P phù hợp nhất để nuôi trồng tảo Spirulina bằng hỗn hợp nước thải bã rượu gạo và chăn nuôi, thu sinh khối tảo giàu protein và giúp làm giảm chất ô nhiễm từ nước thải. Kết quả khảo sát đã xác định được N:P từ 16:1 – 20:1, bổ sung 3 g/L bicacbonat là điệu kiện tốt nhất cho tảo Spirulina sp. HH phát triển. Năng suất sinh khối thu được cao nhất là 0,147 g.L- 1 .ngày-1 , ứng với hàm lượng protein của sinh khối đạt được là 59,8 %. Hiệu suất xử lý NH4+, NO3- và PO43- cao nhất đạt được, tương ứng là 97,5 %, 98,1 % và 86,6 %. Nghiên cứu này cho thấy lợi ích của tái sử dụng nước thải để tận dụng các chất dinh dưỡng, tạo ra sản phẩm có giá trị gia tăng

Trang 1

Trang 2

Trang 3
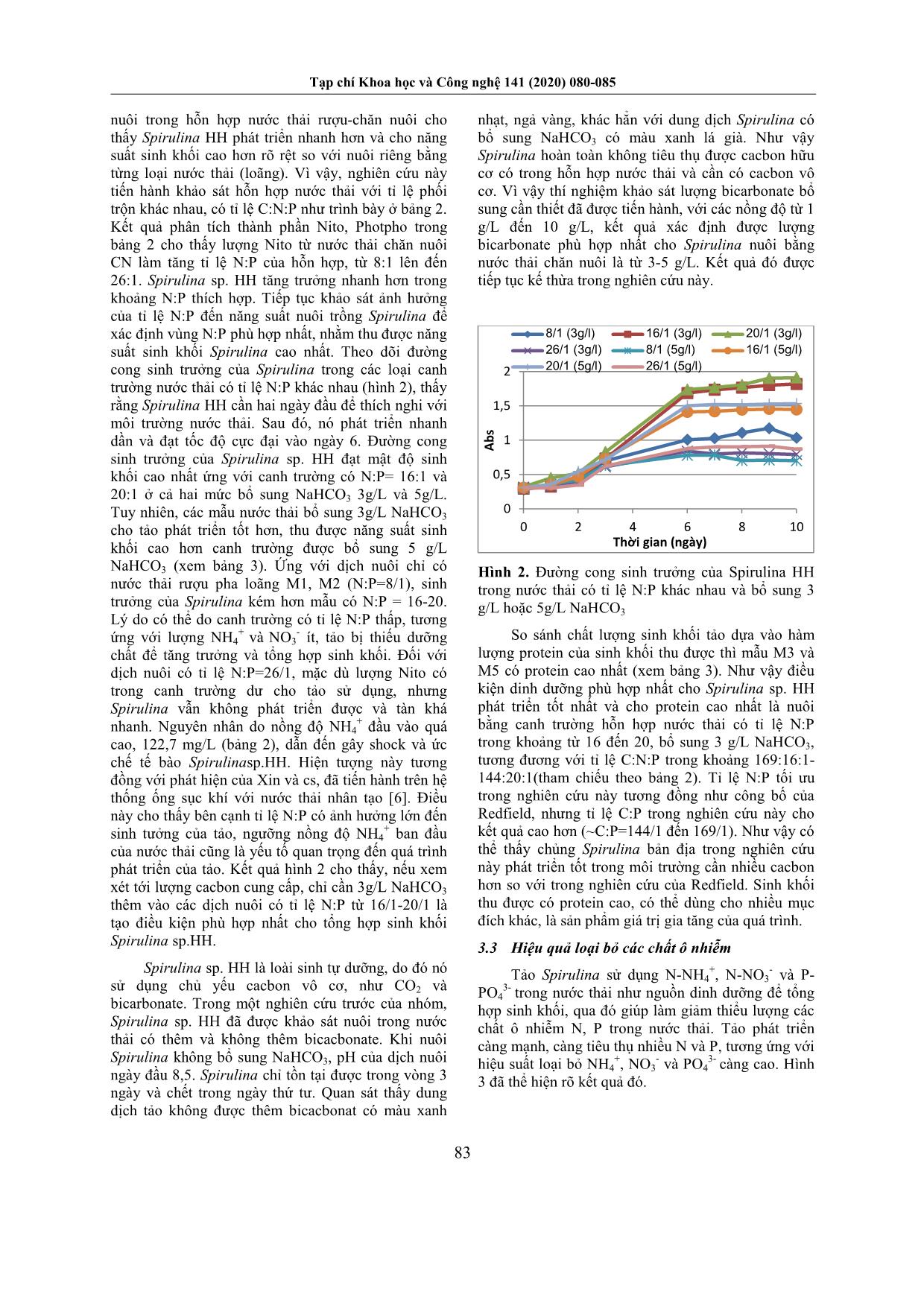
Trang 4

Trang 5

Trang 6
Tóm tắt nội dung tài liệu: Ảnh hưởng của tỉ lệ N:P hỗn hợp nước thải đến tốc độ sinh trưởng tảo xoắn Spirulina và hiệu quả loại bỏ N, P sau nuôi tảo

ha loãng (tỉ lệ pha 10 ml/L, mẫu M1, M2) và hỗn hợp nước thải bã rượu (loãng) trộn với nước thải chăn nuôi (sau biogas), theo các tỉ lệ thể tích 1:1, 2:1 , 4:1 (mẫu M3-M8). Các dịch nuôi này được bổ sung NaHCO3 theo hai mức là 3 g/L và 5 g/L. Các mẫu nước thải riêng biệt và hỗn hợp được phân tích nồng độ NH4 +, NO3 - và PO4 3- trước khi nuôi tảo. Các thí nghiệm được tiến hành trong các chai nhựa trong 1,5 lít, với dung tích làm việc 1 lít, sục khí liên tục, ở nhiệt độ 27oC và chiếu sáng 24/24 giờ bằng đèn huỳnh quang, cường độ chiếu sáng 2000 lux. Tất cả các thí nghiệm đều được tiến hành lặp 3mẫu/nghiệm thức. 2.4. Phương pháp phân tích, đo đạc Theo dõi tốc độ sinh trưởng của Spirulina sp. HH thông qua đo mật độ quang hàng ngày, bằng máy spectrophotometer UV/VIS Lambda EZ210 (PerkinElmer, USA), bước sóng 680nm. Bên cạnh đó, sinh khối tảo ngày đầu (md0) và ngày 10 (md10) được lọc, sấy khô ở 90 oC và cân để xác định năng suất sinh khối theo công thức: P(g.L-1.ngày-1)=(md10- md0)/10. NH4 + được xác định bằng phương pháp TCVN 6179-1:1996(E) – Chất lượng nước – Xác định amoni - Phương pháp trắc phổ thao tác bằng tay; NO3 -: TCVN 6180:1996 Chất lượng nước - Xác định nitrat - Phương pháp trắc phổ dùng axit sunfosalixylic và PO4 3-: TCVN 6202:2008-Phương pháp quang phổ dùng Amoni molipdat. Protein tổng của sinh khối Spirulina được xác định theo phương pháp Nito Kjedahl theo TCVN 6498:1999, sau đó nhân với 6,25. 3. Kết quả và thảo luận 3.1. Đặc tính nước thải rượu (R) và chăn nuôi (CN) Trong nước thải R, lượng COD rất cao so với nước thải CN (Bảng 1). Điều đó cho thấy nước thải CN đã Tạp chí Khoa học và Công nghệ 141 (2020) 080-085 82 được loại bỏ hiệu quả chất ô nhiễm hữu cơ thông qua xử lý yếm khí trong hầm biogas, nhưng nước ra vẫn cao hơn tiêu chuẩn được phép xả thải. Bên cạnh COD cao, cả hai loại nước thải còn chứa rất nhiều các hợp chất nito và phốtpho chưa được xử lý. Lượng các chất ô nhiễm này cao hơn qui chuẩn quốc gia về nước thải công nghiệp QCVN 40: 2011/BTNMT nên cần phải được xử lý tiếp trước khi ra nguồn tiếp nhận. Thành phần NH4 + và PO4 3- trong nước thải có thể được tảo tiêu thụ như là nguồn dinh dưỡng. Giải pháp tận dụng nước thải để nuôi tảo là một giải pháp bền vững, vừa thu được sinh khối Spirulina vừa loại được các chất ô nhiễm. Bảng 1. Đặc tính của nước thải chăn nuôi (CN) và nước thải bã rượu (R) Thông số Đơn vị Nước thải bã rượu gạo từ viện Công nghiệp thực phẩm (R) Nước thải chăn nuôi từ trại lợn Thanh Hưng (CN) COD mg/L 70.000÷100.000 200 - 400 N-NH4 + mg/L 300÷500 70 - 300 N-NO3 - mg/L 0,00÷0,11 0,2- 1,1 PO4 3- mg/L 300÷400 50 - 100 pH - 4÷5,5 4÷5,5 Bảng 2. Thành phần dinh dưỡng đầu vào và tỉ lệ C:N:P của các mẫu nước thải dùng trong nuôi tảo M1 M2 M3 M4 M5 M6 M7 M8 NH4 + (mg/L) 11,6 11,6 60,7 60,7 87.8 87,8 122,7 122,7 NO3 - (mg/L) 6,6 6,6 7,0 7,5 6,8 7,4 7,0 6,5 PO4 3- (mg/L) 9,2 9,2 20,1 20,1 23,5 23,5 25,1 25,1 NaHCO3 (g/L) 3 5 3 5 3 5 3 5 N:P 8:1 8:1 16:1 16:1 20:1 20:1 26:1 26:1 C:N:P 369/8/1 615/8/1 169/16/1 281/16/1 144/20/1 240/20/1 135:26:1 225:26:1 Hình 1. Sơ đồ bố trí thí nghiệm và ký hiệu các nghiệm thức. 3.2. Ảnh hưởng của tỉ lệ các chất dinh dưỡng (N, P) đến khả năng phát triển sinh khối Spirulina Hỗn hợp bã sau chưng cất rượu gạo là một loại chất thải khá phổ biến ở các vùng nông thôn Việt Nam, phát sinh từ các cơ sở nấu rượu truyền thống. Nước thải từ bã rượu không chứa các chất độc tồn lưu nên việc dùng nó để nuôi tảo Spirulina, thu sinh khối làm thức ăn chăn nuôi hoặc phân bón hữu cơ là một phương án có lợi cả về môi trường và kinh tế. Tuy nhiên, nếu dùng trực tiếp nước thải này để nuôi tảo thì không khả thi do tảo không sống được trong dịch thải có tải lượng ô nhiễm hữu cơ rất cao như vậy. Thử nghiệm nuôi Spirulina với nước thải bã rượu được pha loãng các mức khác nhau thì thấy tảo có thể phát triển tốt nhất ở mức 10ml/L. Tiếp tục so sánh với Tạp chí Khoa học và Công nghệ 141 (2020) 080-085 83 nuôi trong hỗn hợp nước thải rượu-chăn nuôi cho thấy Spirulina HH phát triển nhanh hơn và cho năng suất sinh khối cao hơn rõ rệt so với nuôi riêng bằng từng loại nước thải (loãng). Vì vậy, nghiên cứu này tiến hành khảo sát hỗn hợp nước thải với tỉ lệ phối trộn khác nhau, có tỉ lệ C:N:P như trình bày ở bảng 2. Kết quả phân tích thành phần Nito, Photpho trong bảng 2 cho thấy lượng Nito từ nước thải chăn nuôi CN làm tăng tỉ lệ N:P của hỗn hợp, từ 8:1 lên đến 26:1. Spirulina sp. HH tăng trưởng nhanh hơn trong khoảng N:P thích hợp. Tiếp tục khảo sát ảnh hưởng của tỉ lệ N:P đến năng suất nuôi trồng Spirulina để xác định vùng N:P phù hợp nhất, nhằm thu được năng suất sinh khối Spirulina cao nhất. Theo dõi đường cong sinh trưởng của Spirulina trong các loại canh trường nước thải có tỉ lệ N:P khác nhau (hình 2), thấy rằng Spirulina HH cần hai ngày đầu để thích nghi với môi trường nước thải. Sau đó, nó phát triển nhanh dần và đạt tốc độ cực đại vào ngày 6. Đường cong sinh trưởng của Spirulina sp. HH đạt mật độ sinh khối cao nhất ứng với canh trường có N:P= 16:1 và 20:1 ở cả hai mức bổ sung NaHCO3 3g/L và 5g/L. Tuy nhiên, các mẫu nước thải bổ sung 3g/L NaHCO3 cho tảo phát triển tốt hơn, thu được năng suất sinh khối cao hơn canh trường được bổ sung 5 g/L NaHCO3 (xem bảng 3). Ứng với dịch nuôi chỉ có nước thải rượu pha loãng M1, M2 (N:P=8/1), sinh trưởng của Spirulina kém hơn mẫu có N:P = 16-20. Lý do có thể do canh trường có tỉ lệ N:P thấp, tương ứng với lượng NH4 + và NO3 - ít, tảo bị thiếu dưỡng chất để tăng trưởng và tổng hợp sinh khối. Đối với dịch nuôi có tỉ lệ N:P=26/1, mặc dù lượng Nito có trong canh trường dư cho tảo sử dụng, nhưng Spirulina vẫn không phát triển được và tàn khá nhanh. Nguyên nhân do nồng độ NH4 + đầu vào quá cao, 122,7 mg/L (bảng 2), dẫn đến gây shock và ức chế tế bào Spirulinasp.HH. Hiện tượng này tương đồng với phát hiện của Xin và cs, đã tiến hành trên hệ thống ống sục khí với nước thải nhân tạo [6]. Điều này cho thấy bên cạnh tỉ lệ N:P có ảnh hưởng lớn đến sinh tưởng của tảo, ngưỡng nồng độ NH4 + ban đầu của nước thải cũng là yếu tố quan trọng đến quá trình phát triển của tảo. Kết quả hình 2 cho thấy, nếu xem xét tới lượng cacbon cung cấp, chỉ cần 3g/L NaHCO3 thêm vào các dịch nuôi có tỉ lệ N:P từ 16/1-20/1 là tạo điều kiện phù hợp nhất cho tổng hợp sinh khối Spirulina sp.HH. Spirulina sp. HH là loài sinh tự dưỡng, do đó nó sử dụng chủ yếu cacbon vô cơ, như CO2 và bicarbonate. Trong một nghiên cứu trước của nhóm, Spirulina sp. HH đã được khảo sát nuôi trong nước thải có thêm và không thêm bicacbonate. Khi nuôi Spirulina không bổ sung NaHCO3, pH của dịch nuôi ngày đầu 8,5. Spirulina chỉ tồn tại được trong vòng 3 ngày và chết trong ngày thứ tư. Quan sát thấy dung dịch tảo không được thêm bicacbonat có màu xanh nhạt, ngả vàng, khác hẳn với dung dịch Spirulina có bổ sung NaHCO3 có màu xanh lá già. Như vậy Spirulina hoàn toàn không tiêu thụ được cacbon hữu cơ có trong hỗn hợp nước thải và cần có cacbon vô cơ. Vì vậy thí nghiệm khảo sát lượng bicarbonate bổ sung cần thiết đã được tiến hành, với các nồng độ từ 1 g/L đến 10 g/L, kết quả xác định được lượng bicarbonate phù hợp nhất cho Spirulina nuôi bằng nước thải chăn nuôi là từ 3-5 g/L. Kết quả đó được tiếp tục kế thừa trong nghiên cứu này. Hình 2. Đường cong sinh trưởng của Spirulina HH trong nước thải có tỉ lệ N:P khác nhau và bổ sung 3 g/L hoặc 5g/L NaHCO3 So sánh chất lượng sinh khối tảo dựa vào hàm lượng protein của sinh khối thu được thì mẫu M3 và M5 có protein cao nhất (xem bảng 3). Như vậy điều kiện dinh dưỡng phù hợp nhất cho Spirulina sp. HH phát triển tốt nhất và cho protein cao nhất là nuôi bằng canh trường hỗn hợp nước thải có tỉ lệ N:P trong khoảng từ 16 đến 20, bổ sung 3 g/L NaHCO3, tương đương với tỉ lệ C:N:P trong khoảng 169:16:1- 144:20:1(tham chiếu theo bảng 2). Tỉ lệ N:P tối ưu trong nghiên cứu này tương đồng như công bố của Redfield, nhưng tỉ lệ C:P trong nghiên cứu này cho kết quả cao hơn (~C:P=144/1 đến 169/1). Như vậy có thể thấy chủng Spirulina bản địa trong nghiên cứu này phát triển tốt trong môi trường cần nhiều cacbon hơn so với trong nghiên cứu của Redfield. Sinh khối thu được có protein cao, có thể dùng cho nhiều mục đích khác, là sản phẩm giá trị gia tăng của quá trình. 3.3 Hiệu quả loại bỏ các chất ô nhiễm Tảo Spirulina sử dụng N-NH4 +, N-NO3 - và P- PO4 3- trong nước thải như nguồn dinh dưỡng để tổng hợp sinh khối, qua đó giúp làm giảm thiểu lượng các chất ô nhiễm N, P trong nước thải. Tảo phát triển càng mạnh, càng tiêu thụ nhiều N và P, tương ứng với hiệu suất loại bỏ NH4 +, NO3 - và PO4 3- càng cao. Hình 3 đã thể hiện rõ kết quả đó. 0 0,5 1 1,5 2 0 2 4 6 8 10 A b s Thời gian (ngày) 8/1 (3g/l) 16/1 (3g/l) 20/1 (3g/l) 26/1 (3g/l) 8/1 (5g/l) 16/1 (5g/l) 20/1 (5g/l) 26/1 (5g/l) Tạp chí Khoa học và Công nghệ 141 (2020) 080-085 84 Bảng 3. Năng suất sinh khối và lượng protein của sinh khối tảo nuôi trong nước thải N:P khác nhau. L o ại n ư ớ c th ải K ý h iệ u T ỉ lệ N :P N aH C O 3 b ổ s un g N ăn g s u ất si nh k hố i (g .l -1 . ng ày -1 ) P ro te in (% ) R M1 8/1 3 0,068±0,010 43,0±1,5 M2 5 0,034±0,005 23,8±1,4 R- CN M3 16/1 3 0,139±0,008 55,6±1,7 M5 20/1 0,147±0,013 59,8±1,8 M7 26/1 0,043±0,004 25,9±1,3 M4 16/1 5 0,103±0,008 44,9±0,7 M6 20/1 0,112±0,010 52,9±1,4 M8 26/1 0,052±0,006 34,6±1,0 Trong hỗn hợp nước thải dùng cho nuôi tảo, Nito tồn tại ngày đầu chủ yếu ở dạng ammonium, số mol nitrat gần như không đáng kể. Rất nhiều nghiên cứu đã cho thấy tảo Spirulina có khả năng đồng hóa N-NH4 + để tổng hợp sinh khối [4,5,6]. Quá trình đồng hóa ammonium trong nuôi trồng tảo đã giúp loại bỏ lượng lớn N-NH4 + trong nước thải. Hình 3.a. cho thấy sau 10 ngày nuôi tảo, lượng NH4 + giảm gần như hoàn toàn, đạt hiệu suất từ 94-97,5%, tương ứng với hai loại canh trường có tỉ lệ N:P= 16/1 (M3, M4) và 20/1 (mẫu M5, M6), cho Spirulina sp. HH phát triển tốt nhất. Hiệu suất cao nhất là 97,5% ứng với canh trường nước thải có tỉ lệ C:N:P = 144/20/1 (mẫu M5). So sánh với tiêu chuẩn xả thải QCVN 40:2011/BTNMT, các mẫu đều có lượng NH4 + còn trong nước thải sau 10 ngày nuôi tảo thấp hơn tiêu chuẩn, ngoại trừ hai mẫu M7 và M8 (là mẫu có tỉ lệ N:P= 26/1). Như vậy, với tỉ lệ N:P phù hợp, từ 16:1 đến 20:1, Spirulina sp. HH tăng trưởng mạnh nhất đồng thời tạo hiệu quả cao nhất trong xử lý N, P của hỗn hợp nước thải. Kết quả này khá tương đồng so với các nghiên cứu cùng loại, ví dụ như so với nghiên cứu của Choi và Lee trên tảo Chlorella vulgaris, tỉ lệ N:P của nghiên cứu này nằm ở khoảng giữa [4]. Mặc dù nitrat tồn tại ngày đầu với lượng không đáng kể, nhưng tăng dần theo thời gian, do sục khí giúp cho quá trình nitrat hóa diễn ra. Nitrat là thành phần dinh dưỡng ưu thích cho tảo tiêu thụ, vì thế lượng nitrat hình thành trong canh trường sẽ được tiêu thụ nhanh, giúp cho nước thải sau nuôi tảo loại bỏ được tối đa N-NO3 -. Hiệu quả loại bỏ nitrat cao ở các nghiệm thức từ M3 đến M6. Trong đó, hiệu suất đạt cao nhất ở nghiệm thức M5, 98,1 %, ứng với hỗn hợp nước thải có tỉ lệ N:P là 20:1, bổ sung 3 g/L NaHCO3 (hình 3.b). Hình 3. Nồng độ NH4 +(a), NO3 - (b) và PO4 3-(c) trước/sau 10 ngày nuôi tảo và hiệu suất xử lý, ứng với các dịch nuôi có tỉ lệ N:P đầu vào khác nhau. Hiệu quả xử lý PO4 3- trong mẫu từ M3-M6, ứng với hỗn hợp nước thải có tỉ lệ N:P = 16/1 và 20/1 là cao nhất đạt 83,1-86,8% (Hình 3.c). Hiệu suất loại bỏ PO4 3- thấp nhất, 55,4% và 58,2%, khi Spirulina sp. HH phát triển kém nhất, tương ứng với mẫu tỉ lệ C:N:P = 135/26/1 và 225/26/1 (M7 và M8). Kết quả này phù hợp với kết luận của Choi và Lee, khi tỉ lệ N:P quá cao thì photpho thiếu hụt, trở thành yếu tố giới hạn đối với quá trình phát triển của tảo [4]. 4. Kết luận Hỗn hợp nước thải bã rượu gạo và nước thải chăn nuôi sau biogas có hàm lượng Nito, Photpho cao 94.8% 88.8% 96% 94.1% 97.5% 95.7% 44.2% 43.4% 0 50 100 8/1(3g/l) 8/1 (5g/l) 16/1 (3g/l) 16/1 (5g/l) 20/1 (3g/l) 20/1 (5g/l) 26/1 (3g/l) 26/1 (5g/l) NH4 + (mg/L) T ỉ lệ m ol N :P QCVN 40:2011 ngày 10 ngày 0 87,9% 90,3% 96,9% 94% 98,1% 94,6% 75,8% 76,9% 0 2 4 6 8 8/1 (3g/l) 8/1(5g/l) 16/1(3g/l) 16/1 (5g/l) 20/1(3g/l) 20/1(5g/l) 26/1(3g/l) 26/1(5g/l) NO3 - (mg/L) T ỉ lệ m o l N :P ngày 10 ngày 0 80,4% 77,2% 83,1% 85% 86,8% 85,5% 58,2% 55,4% 0 10 20 8/1 (3g/l) 8/1 (5g/l) 16/1 (3g/l) 16/1 (5g/l) 20/1 (3g/l) 20/1 (5g/l) 26/1 (3g/l) 26/1 (5g/l) PO4 3- (mg/L) T ỉ lệ m o l N :P ngày 10 ngày 0 a b c Tạp chí Khoa học và Công nghệ 141 (2020) 080-085 85 phù hợp cho nuôi trồng tảo Spirulina. Kết quả nghiên cứu đã xác định được tỉ lệ dinh dưỡng N:P từ 16/1 – 20/1, bổ sung 3g/L bicacbonat là điều kiện phù hợp nhất cho tảo Spirulina sp. HH phát triển. Bên cạnh tạo sinh khối có hàm lượng protein cao (55,6-59,8 %), điều kiện canh trường này cũng cho phép tảo hấp thụ N, P mạnh nhất, cho hiệu quả loại bỏ chất ô nhiễm trong nước thải cao nhất. Hiệu suất xử lý cao nhất NH4 +, NO3 - và PO4 3- tương ứng là 97,5 %, 98,1 % và 86,6%. Nghiên cứu cho thấy tính khả thi của việc tận dụng các nguồn nước thải rất sẵn có ở nông thôn Việt Nam để nuôi trồng tảo Spirulina, thu sinh khối giàu protein, có thể dùng cho nhiều mục đích khác. Lời cảm ơn Các tác giả chân thành cám ơn sự hỗ trợ tài chính cho nghiên cứu từ trường Đại học Bách khoa Hà Nội (mã số đề tài T2017-PC-014). Tài liệu tham khảo [1] Avigad Vonshak, Spirulina platensis (Arthrospira): Physiology, Cell- Biology and Biotechnology, (1997), Taylor & Francis Press, USA. [2] Amha Belay (2007), Chapter 1: Spirulina (Arthrospira): Production and Quality Assurance, edited by M. E. Gershwin Amha Belay, Spirulina in Human nutrition and Health, Taylor & Francis Group, pp 1-26. [3] Redfield, A. C. Ketchum, B. H, Richards, F.A. The influence of organisms on the composition of seawater. The sea, In: Hill, M.N (Ed.), (1963), Vol.II, page 26-77. [4] Richard Geider & Julie La Roche (2002), Redfield revisited: Variability of C:N:P in marine microalgae and its biochemical basis, European Journal of Phycology, 37:1 (2002), 1-17. [5] Hee Jeong Choi & Seung Mok Lee. Effect of the N:P ratio on productivity and nutrient municipal wastewater. Bioprocess and Biosystems Engineering, 38:4 (2015), 761-766. [6] Xin Yuan, Amit Kumar, Ashish K. Sahu, Sarina J. Ergas. Impact of ammonia concentration on Spirulina platensis growth in an airlift photobioreactort. Bioresource Technology, 102 (2011), 3234–3239.
File đính kèm:
 anh_huong_cua_ti_le_np_hon_hop_nuoc_thai_den_toc_do_sinh_tru.pdf
anh_huong_cua_ti_le_np_hon_hop_nuoc_thai_den_toc_do_sinh_tru.pdf

