Quy trình công nghệ sản xuất Alkyl glycerol từ sinh vật biển dùng và tạo thực phẩm chức năng Akumarin
TÓM TẮT
Alkyl glycerol (AG) có tác dụng kích thích hệ miễn dịch của con người một cách tự nhiên, giảm
lượng cholesterol, chống viêm. Tác động sinh lý của các chất này rất đa dạng, rõ rệt nhất là để điều
trị và phục hồi cho bệnh nhân ung thư (ức chế sự phát triển khối u, giảm di căn, giảm tăng trưởng
mạch máu trong khối u, giảm đau), trị liệu sau xạ trị và xử lý trạng thái suy giảm miễn nhiễm.
Được sử dụng như dạng thuốc hỗ trợ, điều trị đối HIV/AIDS để tăng cấp độ của hệ thống miễn
dịch của chúng và các tế bào máu. Tác dụng điều tiết miễn nhiễm dựa vào kích sinh bạch cầu, tiểu
cầu và cytokine diệt virus. Nó cũng giúp ngăn ngừa và giảm bệnh tiểu đường, cao huyết áp. Bài
viết này trình bày phương pháp sản xuất alkyl glycerol từ sinh vật biển tạo thực phẩm chức năng
akumarin phục vụ cho cuộc sống. Chi tiết các bước trong quy trình như thủy phân mỡ, axít hóa,
rửa nước, kết tinh từng phần hai bước trong aceton, lọc và sấy khô tạo sản phẩm cuối cùng trong
điều kiện phù hợp được trình bày trong bài báo. Với hàm lượng AG thu được là ≥90% và được
bào chế thực phẩm chức năng Akumarin chứa 50% hàm lượng AG.

Trang 1
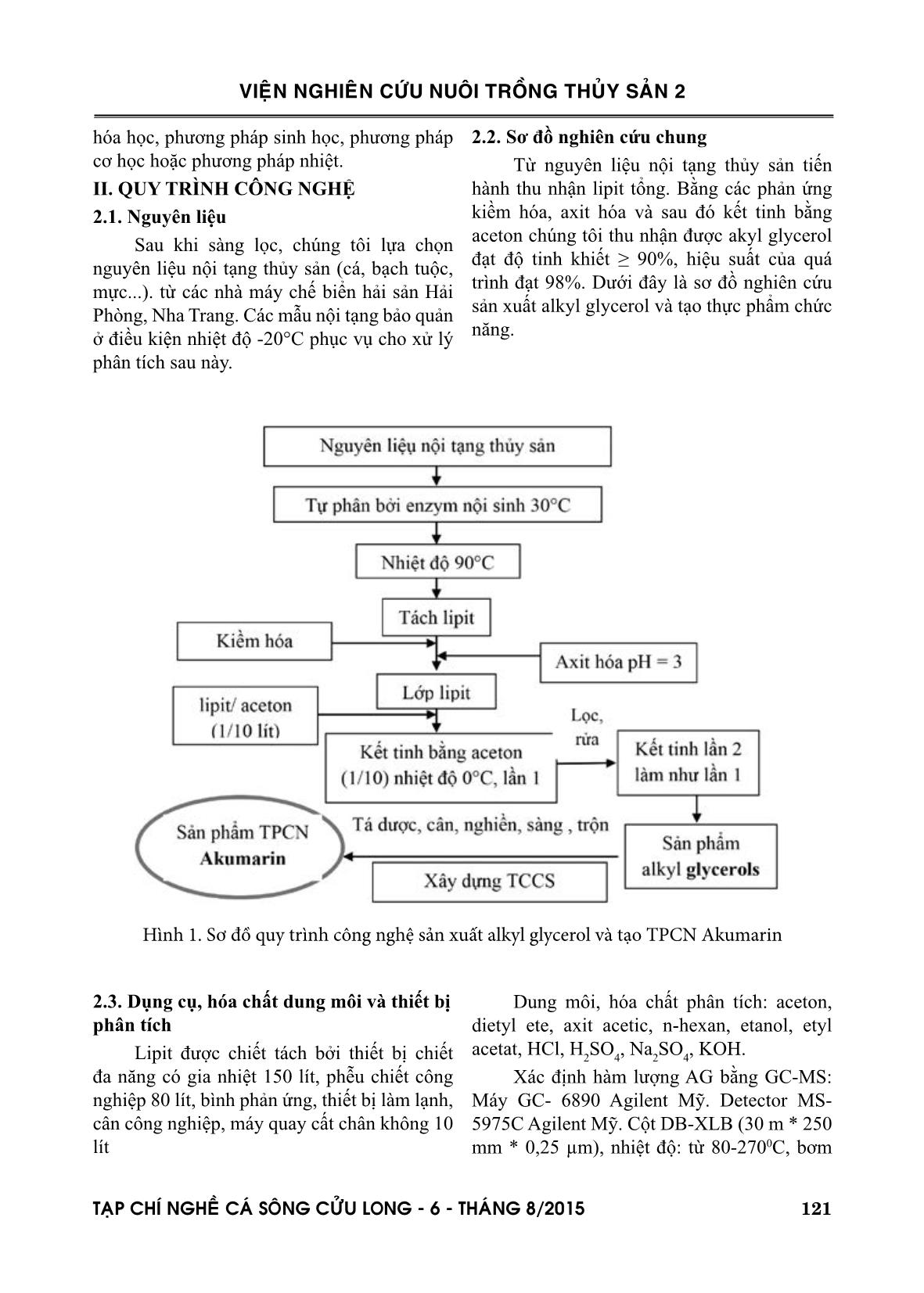
Trang 2

Trang 3
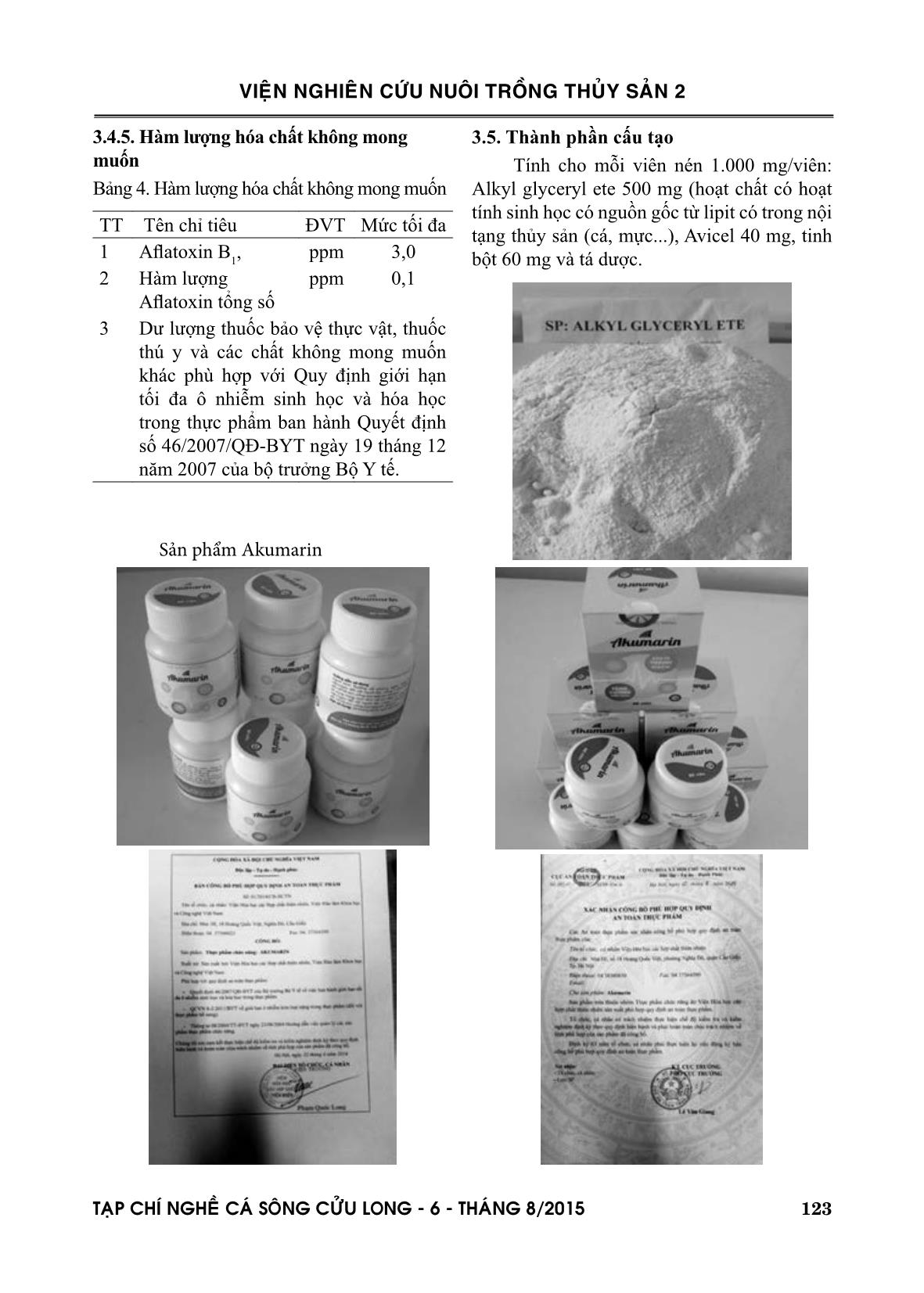
Trang 4

Trang 5

Trang 6

Trang 7

Trang 8
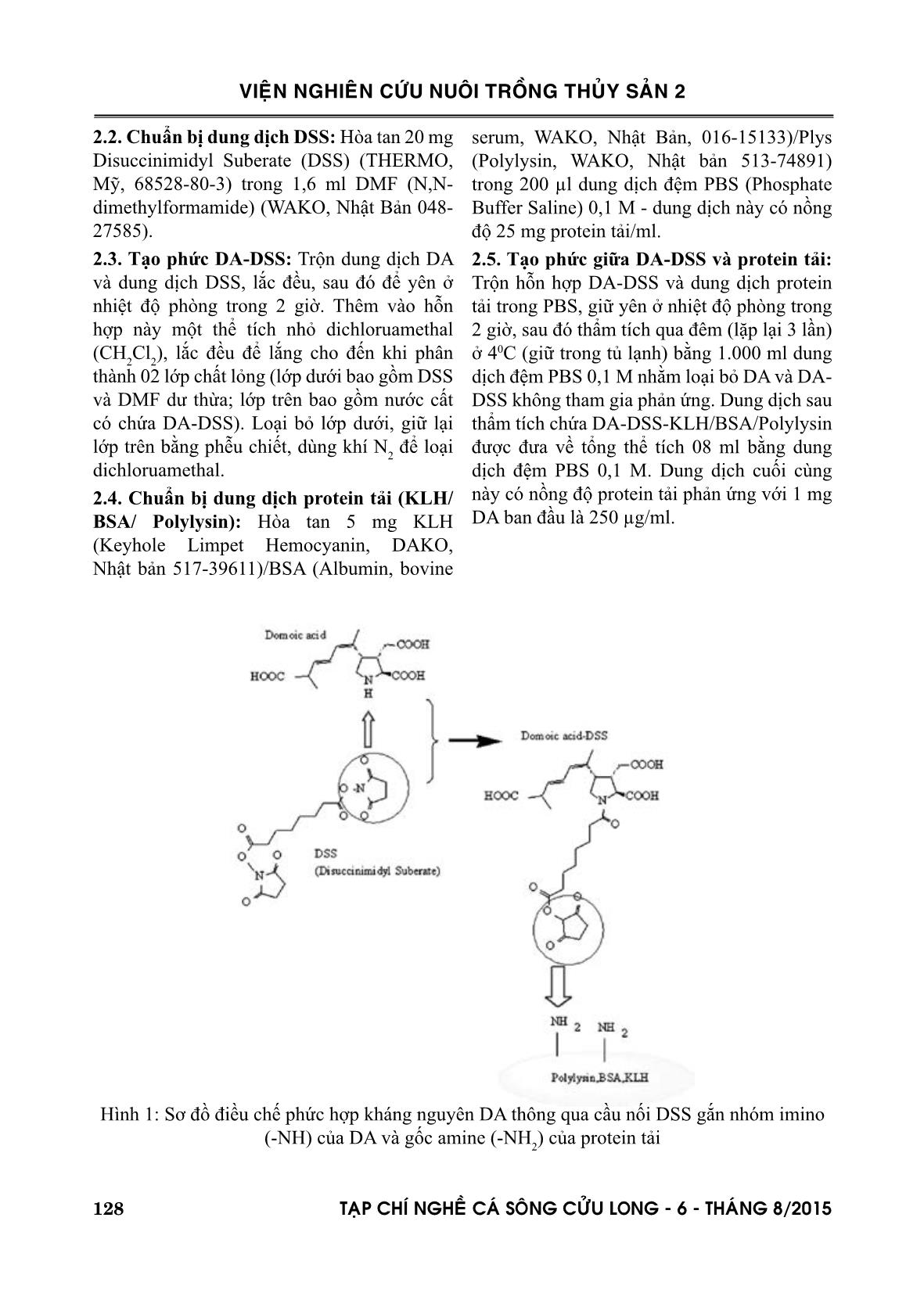
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Quy trình công nghệ sản xuất Alkyl glycerol từ sinh vật biển dùng và tạo thực phẩm chức năng Akumarin

Thủy sản của Bộ Nông nghiệp và Phát triển Nông thôn đến 2020. II. PHƯƠNG PHÁP NGHIÊN CỨU 2.1. Chuẩn bị dung dịch DA: Hòa tan 2 mg domoic acid (DA) chuẩn (TOCRIS, Anh 14277-97-5) trong 1 thể tích nhỏ nước cất (<1 ml); hiệu chỉnh pH 6-7 bằng dung dịch Natri Cacbonate (Na 2 CO 3 ) 1M. ngẫu nhiên với phân tử protein tải nên kháng thể sản sinh sẽ ở dạng hỗn hợp 03 kháng thể tương ứng với 03 điểm tiếp nhận khác nhau của phân tử DA. Mặt khác, hàm lượng kháng thể tạo ra từ kháng nguyên được điều chế bằng phương pháp này cũng rất ít và lẫn nhiều tạp chất không mong muốn. Nhằm cải thiện chất lượng kháng thể (có tính đặc hiệu hơn), Garthwaite và ctv., (1998) đã phát triển phương pháp tạo kháng nguyên bằng cách gắn gốc amine của DA với gốc cacboxyl của protein tải. Ở phương pháp này, với 01 gốc amine tự do duy nhất của DA, kháng nguyên hoàn toàn tương đồng về điểm tiếp nhận của DA do đó sẽ giảm thiểu được tạp chất không mong muốn trong sản phẩm miễn dịch. Mặc dù vậy, do các protein mang thường có rất nhiều nhóm cacboxyl trên bề mặt phân tử, chất lượng kháng thể còn phụ thuộc vào tỉ lệ gắn kết thành công giữa số lượng phân tử DA nhất định với một phân tử protein tải. Bằng phương pháp này, kháng thể sản sinh ra có sản lượng và tính đặc hiệu cao hơn hẳn so với Smith và Kitts (1994). Tuy nhiên, do DA chỉ có nhóm amine thứ cấp (-NH) nên cần phải chuyển đổi sang dạng amine sơ cấp (-NH 2 ) trước khi tạo phức kháng nguyên có thể làm hao hụt đi phần nào kháng nguyên sau điều chế nên quy trình thực hiện này lại quá phức tạp và tốn kém. Một phương pháp khác có thể sử dụng để điều chế phức hợp kháng nguyên là gắn kết gốc amine sơ cấp của phân tử DA với chính gốc amine sơ cấp của phân tử protein tải. Để thực hiện được phản ứng gắn kết này, cần có sự tham gia của hợp chất mang tính cầu nối giữa 02 phân tử. Disuccinimidyl Suberate (DSS, C 16 H 20 N 2 O 8 ) là một hợp chất có khả năng liên kết giữa nhóm amine sơ cấp của DA và nhóm nitrate (-NO 3 ) của phân tử DSS, sau đó phức này được kết hợp với nhóm amine sơ cấp của phân tử protein thông qua nhóm cacboxyl của phân tử DSS tạo thành phức hợp kháng nguyên DA-DSS-protein. Phương pháp này đơn giản VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 128 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 serum, WAKO, Nhật Bản, 016-15133)/Plys (Polylysin, WAKO, Nhật bản 513-74891) trong 200 µl dung dịch đệm PBS (Phosphate Buffer Saline) 0,1 M - dung dịch này có nồng độ 25 mg protein tải/ml. 2.5. Tạo phức giữa DA-DSS và protein tải: Trộn hỗn hợp DA-DSS và dung dịch protein tải trong PBS, giữ yên ở nhiệt độ phòng trong 2 giờ, sau đó thẩm tích qua đêm (lặp lại 3 lần) ở 40C (giữ trong tủ lạnh) bằng 1.000 ml dung dịch đệm PBS 0,1 M nhằm loại bỏ DA và DA- DSS không tham gia phản ứng. Dung dịch sau thẩm tích chứa DA-DSS-KLH/BSA/Polylysin được đưa về tổng thể tích 08 ml bằng dung dịch đệm PBS 0,1 M. Dung dịch cuối cùng này có nồng độ protein tải phản ứng với 1 mg DA ban đầu là 250 µg/ml. 2.2. Chuẩn bị dung dịch DSS: Hòa tan 20 mg Disuccinimidyl Suberate (DSS) (THERMO, Mỹ, 68528-80-3) trong 1,6 ml DMF (N,N- dimethylformamide) (WAKO, Nhật Bản 048- 27585). 2.3. Tạo phức DA-DSS: Trộn dung dịch DA và dung dịch DSS, lắc đều, sau đó để yên ở nhiệt độ phòng trong 2 giờ. Thêm vào hỗn hợp này một thể tích nhỏ dichloruamethal (CH 2 Cl 2 ), lắc đều để lắng cho đến khi phân thành 02 lớp chất lỏng (lớp dưới bao gồm DSS và DMF dư thừa; lớp trên bao gồm nước cất có chứa DA-DSS). Loại bỏ lớp dưới, giữ lại lớp trên bằng phễu chiết, dùng khí N 2 để loại dichloruamethal. 2.4. Chuẩn bị dung dịch protein tải (KLH/ BSA/ Polylysin): Hòa tan 5 mg KLH (Keyhole Limpet Hemocyanin, DAKO, Nhật bản 517-39611)/BSA (Albumin, bovine Hình 1: Sơ đồ điều chế phức hợp kháng nguyên DA thông qua cầu nối DSS gắn nhóm imino (-NH) của DA và gốc amine (-NH 2 ) của protein tải VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 129 hợp kháng nguyên sau cộng hợp với cùng 01 lượng DA (2 mg) thông qua cầu nối DSS được trình bày trong Bảng 2. - Tính toán hàm lượng protein tải (KLH/ BSA/Polylysin) trên cơ sở so sánh với dung dịch protein chuẩn 1 mg/ml trong đệm PBS 0,1 M. III. KẾT QUẢ 3.1. Hiệu suất của phản ứng giữa DA và DSS Hàm lượng DA tham gia phản ứng tạo phức DA-DSS được trình bày ở Bảng 1. Hiệu suất phản ứng có khoảng dao động từ 65% đến 68% so với lượng DA sử dụng ban đầu, và không có sự sai khác thống kê giữa 03 lần thí nghiệm. Như vậy, hiệu suất phản ứng của quy trình gắn kết giữa DA và DSS là khá ổn định giữa 03 lần thí nghiệm. 2.6. Xác định hiệu suất tạo phức của phức DA-DSS: Xác định hàm lượng DA dư thừa sau phản ứng DS-DSS trong hỗn hợp bằng phương pháp HPLC cho phân tích độc tố DA theo Kodama và Kotaki (2005). 2.7. Xác định hiệu suất tạo phức của phức DA-DSS-KLH/BSA/Polylysin - Đo cường độ màu của DA có mặt trong phức hợp DA-DSS-protein thu nhận sau thẩm tích ở bước sóng 242 nm với mẫu trắng là đệm PBS 0,1 M. - Tính toán hàm lượng DA trong phức hợp trên cơ sở so sánh với dung dịch DA chuẩn 250 µg/ml trong đệm PBS 0,1 M. - Đo cường độ màu của protein tải có mặt trong phức hợp DA-DSS-protein (sau thẩm tích) ở bước sóng 280 nm; Thí nghiệm Hàm lượng DA (mg) ban đầu Hàm lượng DA (mg) tham gia phản ứng Hiệu suất phản ứng 1 2,0 1,30 65% 2 2,0 1,36 68% 3 2,0 1,30 65% Bảng 1. Hàm lượng DA trong phức hợp DA-DSS và hiệu suất phản ứng 3.2. Hiệu suất phản ứng cộng hợp giữa DA- DSS và protein tải Kết quả xác định hàm lượng 03 protein tải bao gồm KLH, BSA và Plys trong phức STT Phức hợp kháng nguyên Hàm lượng protein (mg) sử dụng cộng hợp Hàm lượng protein (mg) trong phức hợp kháng nguyên Hiệu suất phản ứng (%) 1 Plys-DSS-DA1 5,0 0,710 14,2 2 BSA-DSS-DA2 5,0 1,025 20,5 3 KLH-DSS-DA3 5,0 0,088 7,15 Bảng 2. Hàm lượng protein trong phức hợp kháng nguyên DA-DSS-protein và hiệu suất phản ứng Ghi chú: Plys: Polylysin, BSA: Bovine Serum Albumin, KLH: Keyhole Limpet Hemocyanin DA 1, DA 2, DA 3: DA của từng thí nghiệm kết hợp DA-DSS (Bảng1) VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 130 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 Từ kết quả tính toán hàm lượng DA trước và sau phản ứng, số phân tử DA tham gia phản ứng tạo phức với 01 phân tử protein tải được trình bày trong Bảng 3. Theo kết quả bảng này, 59 trong tổng số 79 gốc lysine của Plys, 22 trong tổng 39 gốc lysine của BSA đã gắn kết với DA, trong khi ở Plys, chỉ có 14 trong tổng số 735 gốc lysine kết hợp thành công. với DA do chúng cũng bị che khuất khi hòa tan trong môi trường đệm (giống như trường hợp của KLH). Khác với 02 protein trên, BSA có khối lượng phân tử nhỏ hơn hẳn (khoảng 65.000 đ.v.c), nhưng lại có tính tan tốt trong đệm PBS. Trong thực nghiệm, 22 gốc lysine của BSA đã kết hợp thành công với DA trong phức hợp kháng nguyên DA-DSS-BSA. Kết quả này hoàn toàn phù hợp với nghiên cứu của Huang và ctv., (2004) chứng minh rằng một phân tử BSA có chứa 35 gốc lysine tự do nhưng chỉ có khoảng 22-24 gốc có thể gắn kết đặc hiệu với phân tử DA. Như vậy, có thể đánh giá rằng trong 03 protein thử nghiệm, BSA có hiệu suất gắn kết tốt nhất với DA. Ngoài ra, nguồn gốc của protein tải đóng vai trò quan trọng trong cơ chế gây miễn dịch đối với sinh vật thử nghiệm. Thông thường, hệ miễn dịch sẽ nhạy cảm hơn đối với kháng nguyên có đặc tính lạ, do đó các protein có nguồn gốc xa với động vật gây miễn dịch thường cho hiệu giá kháng thể cao hơn. KLH có nguồn gốc từ loài ốc đá (Giant Keyhole Limpet Megathura crenulata) phân bố giới Kết quả cho thấy, hiệu suất thực nghiệm tính theo hàm lượng protein tham gia phản ứng dao động từ 14,2-20,5% tùy theo protein khác nhau. Hiệu suất cao nhất được ghi nhận ở BSA (20,5%), tiếp theo là Plys (14,2%), trong khi KLH lại có hiệu suất thấp nhất (7,15%). 3.3. Hệ số kết hợp của DA với 01 phân tử protein STT Phức hợp Số gốc lysine tự do trong 1 phân tử protein Số phân tử DA kết hợp với 1 phân tử protein 1 Plys-DSS-DA 79 (*) 59 2 BSA-DSS-DA 35 (**) 22 3 KLH-DSS-DA 735 (***) 14 Bảng 3. Số phân tử DA trong các phức hợp kháng nguyên cộng hợp với KLH, BSA và Plys Ghi chú: Plys: Polylysin; BSA: Bovine Serum Albumin; KLH: Keyhole Limpet Hemocyanin (*): theo Brian và ctv., 1996; (**): theo Huang và ctv., 2004; (***): theo Dolaski và ctv., 2005 IV. THẢO LUẬN Xét về mặt khối lượng phân tử, KLH là một protein glycosyl hóa rất lớn với khối lượng phân tử 4.500.000-13.000.000 đ.v.c. Thông thường, protein có khối lượng phân tử càng lớn sẽ có càng nhiều gốc lysine tự do đóng vai trò là epitope (điểm tiếp nhận) trong phản ứng tạo phức với DA-DSS nên sẽ tăng khả năng cao hơn tạo ra các kháng thể. Dolaski và ctv., (2005) xác định có 739 gốc lysine tự do trong phân tử KLH. Tuy nhiên, các phân tử KLH lại có xu hướng tập hợp lại và kết tủa khi hòa tan trong môi trường đệm PBS. Do đó, các nhóm lysine tự do có nguy cơ bị che khuất, dẫn đến hạn chế khả năng liên kết với phân tử DA. Đây chính là nguyên nhân dẫn đến hiệu suất và hệ số kết hợp giữa các gốc lysine tự do của KLH với DA không cao trong thí nghiệm. Plys có khối lượng phân tử 150.000-300.000 đ.v.c, với 79 gốc lysine tự do trong cấu trúc phân tử. Kết quả thí nghiệm cho thấy protein này có tỉ lệ gắn kết giữa gốc lysine và phân tử DA cao nhất trong 03 protein thử nghiệm. 20 gốc lysine trong Plys không gắn kết được VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 131 Hemocyanin. World Journal of Agricultural Sciences 1 (2): 129-136. Garthwaite, I., Ross, K.M., Miles, C.O., Hansen, R.P., Foster, D., Wilkins, A.L., and Towers, N.R., 1998. Polyclonal Antibodies to Domoic Acid, and Their Use in Immunoassays for Domoic Acid in Sea Water and Shellfish. Natural Toxins 6: 93-104. Huang, B.X., Kim, H-Y., and Dass, C., 2004. Probing Three-Dimensional Structure of Bovine Serum Albumin by Chemical Cross- Linking and Mass Spectrometry. J Am Soc Mass Spectrom. 15: 1237–1247. Kania, M., and Hock, B., 2002. Development of monoclonal antibodies to domoic acid for the detection of domoic acid in blue mussel (Mytilus edulis) tissue by ELISA. Analytical Letters: Chemical and Bio-sensors 35(5): 855-868. Kania, M., Kreuzer, M., Moore, E., Pravda, M., Hock, B., and Guilbault, G., 2003. Development of Polyclonal Antibodies against domoic acid for their use in electrochemical biosensors. Analytical Letters 36(9): 1851-1863. Kawatsu, K., Hamano, Y., Noguchi,T., 1999. Production and characterization of a monoclonal antibody against domoic acid and its application to enzyme immunoassay. Toxicon 37: 1579-1589. Newsome, H., Truelove, J., Hierlihy, L., and Collins, P., 1991. Determination of Domoic Acid in Serum and Urine by Immunochemical Analysis. Bull. Environ. Contam. Toxicol. 47: 329-334. Osada, L., Marks, J., Stewart, J.E., 1995. Determination of Domoic Acid by Two Different Versions of a Competitive Enzyme- Linked Immunosorbent Assay (ELISA). Bull. Environ. Contam. Toxicol. 54: 797-804. Smith, D.S., and Kitts, D.D., 1994. A competitite Enzyme-linked Immunoassay for domoic acid determination in human fluid. Fd. Chem. Toxic. 32 (12): 1147-1154. Smith, D.S., and Kitts, D.D., 1995. Enzyme immunoassay for the determination of domoic acid in mussel extracts. J. Agric. Food. Chem.43: 367-371. hạn ở một số vùng thuộc ven biển Thái Bình Dương, BSA là protein nguồn gốc từ động vật móng guốc (bò), và Plys có nguồn gốc từ tế bào cơ thể người. Như vậy, khi gây miễn dịch ở đối tượng thỏ trắng New Zealand, KLH có tính sinh miễn dịch tốt nhất so với 02 protein còn lại. Tuy nhiên, tính theo hệ số gắn kết giữa DA và protein, số phân tử DA kết hợp với KLH lại quá nhỏ. Kháng thể tạo ra bằng liệu pháp miễn dịch khi sử dụng phức hợp kháng nguyên này sẽ không đạt được tính đặc hiệu cao với DA, do đó, không đáp ứng yêu cầu sử dụng cho tạo kít ELISA. V. KẾT LUẬN Kết hợp giữa kết quả thực nghiệm và nguyên lý miễn dịch, BSA được chọn lựa làm protein tải để điều chế phức hợp kháng nguyên từ bán kháng nguyên DA để sử dụng gây miễn dịch ở thỏ trắng New Zealand nhằm thu nhận kháng thể đặc hiệu kháng DA. LỜI CẢM ƠN Công trình này thuộc nội dung khoa học của đề tài KHCN cấp Nhà nước 2013-2015 "Nghiên cứu phát triển bộ KIT phát hiện nhanh một số độc tố vi tảo trong sản phẩm thủy sản" trong chương trình Công nghệ Sinh học Thủy sản của Bộ Nông nghiệp và Phát triển Nông thôn đến 2020. TÀI LIỆU THAM KHẢO Branna, P., Naar, J., Chinain, M., Pauillac, S., 1999. Preparation and characterization of domoic acid - protein conjugates using a small amount of toxin in a reversed micellar medium: Application in Competitive Enzyme linked Immunosorbant Assay. Bioconjugate. Chem. 10: 1137-1142. Brian, L. F., and Corn, R.M.,1996. Covalent Attachment and Derivatization of Poly (L-lysine) Monolayers on Gold Surfaces As Characterized by Polarization-Modulation FT- IR Spectroscopy. Anal. Chem. 68: 3187-3193. Dolashki, A., Schütz, J., Hristova, R., Voelter, W., and Dolashka, P., 2005. Spectroscopic Properties of Non-glycosilated Functional Unit KLH2-c of Keyhole Limpet VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 132 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 MAKING ANTIGEN FROM A HAP TEN DOMOIC ACID Dao Viet Ha1* and Pham Xuan Ky1 ABSTRACT With the aim to select the appropriate carrier protein for DA-antigen, a hap ten DA was coupled with 03 different carrier proteins e.g. Keyhole Limpet Hemocyanin (KLH), Bovine Serum Albumin (BSA) and Polylysin (Plys) via chemical substrate of Disuccinimidyl Suberate (DSS). Productivity of a reaction between DA and DSS (pH 6-7, room temperature) was stable (65-68%). In contrast, there was the difference in productivity among 03 carrier proteins reacted with DA-DSS: BSA showed highest productivity (20.5%), following were KLH (7.15%) and Plys (14.2%). In the antigen compound, a coupling ratio between DA and each protein was also different (Plys:59, BSA: 22, KLH: 14). Based on the information about free lysin number in protein structure, BSA is considered more advantage in both productivity and coupling ratio, therefore, it is selected to be as a carrier protein for DA antigen in order to produce specific DA-antibody in New Zealand rabbit in Vietnam. Keywords: domoic acid, productivity, antigen, carier protein. Người phản biện: TS. Lê Hồng Phước Ngày nhận bài: 29/5/2015 Ngày thông qua phản biện: 03/8/2015 Ngày duyệt đăng: 07/8/2015 1Institute of Oceanography, Vietnam Academy of Science and Technology *Email: daovietha69@gmail.com
File đính kèm:
 quy_trinh_cong_nghe_san_xuat_alkyl_glycerol_tu_sinh_vat_bien.pdf
quy_trinh_cong_nghe_san_xuat_alkyl_glycerol_tu_sinh_vat_bien.pdf

