Nuôi cấy mô rong sụn (Kappaphycus alvarezii, Doty): Kết quả bước đầu về tạo mô sẹo trong phòng thí nghiệm
TÓM TẮT
Mô sẹo (callus) là nguyên liệu quan trọng để nhân nhanh số lượng cây mầm trong công nghệ nuôi
cấy mô rong biển. Bài viết này trình bày kết quả bước đầu về nghiên cứu tạo mô sẹo rong sụn trong
phòng thí nghiệm sử dụng môi trường nuôi cấy PES ở độ mặn 28‰, khử trùng bằng hỗn hợp
kháng sinh và cảm ứng tạo mô sẹo trong điều kiện nhiệt độ 250C (±1°C), ánh sáng huỳnh quang
5 μmol photons m-2.s-1, chu kỳ chiếu sáng là 12: 12. Kết quả cho thấy với 100% mẫu cấy không bị
nhiễm khuẩn và nấm, tỷ lệ hình thành mô sẹo có thể đạt tới 45,16% và mô sẹo hình thành sớm
nhất được quan sát sau 5 ngày nuôi cấy. Kết quả bước đầu xác định việc hình thành mô sẹo bị ảnh
hưởng bởi các yếu tố kích thước mẫu cấy, nồng độ agar làm môi trường nhưng không ảnh hưởng
vào việc bổ sung chất điều tiết sinh trưởng.

Trang 1

Trang 2

Trang 3
Trang 4

Trang 5
Trang 6

Trang 7

Trang 8

Trang 9
Tóm tắt nội dung tài liệu: Nuôi cấy mô rong sụn (Kappaphycus alvarezii, Doty): Kết quả bước đầu về tạo mô sẹo trong phòng thí nghiệm

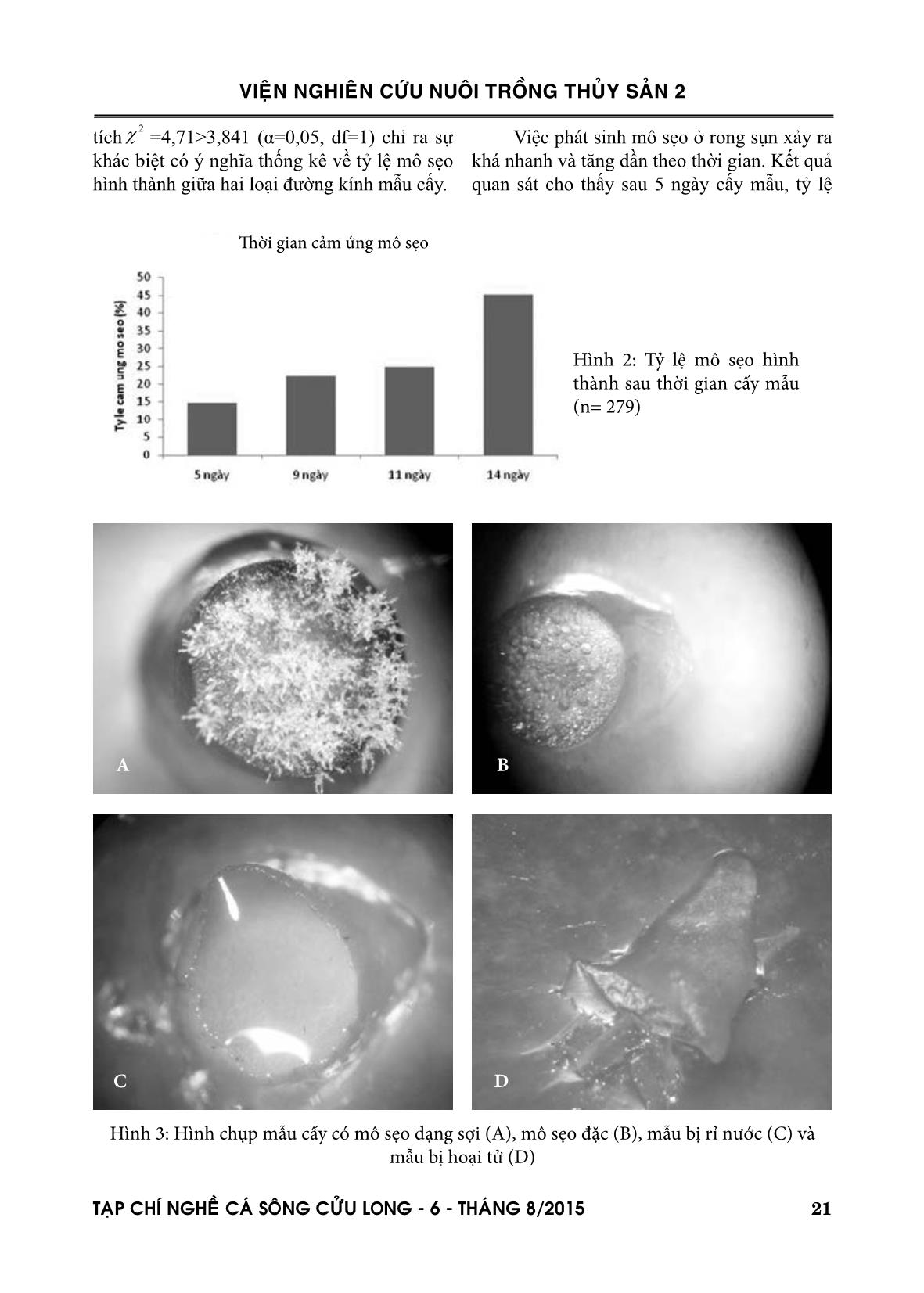
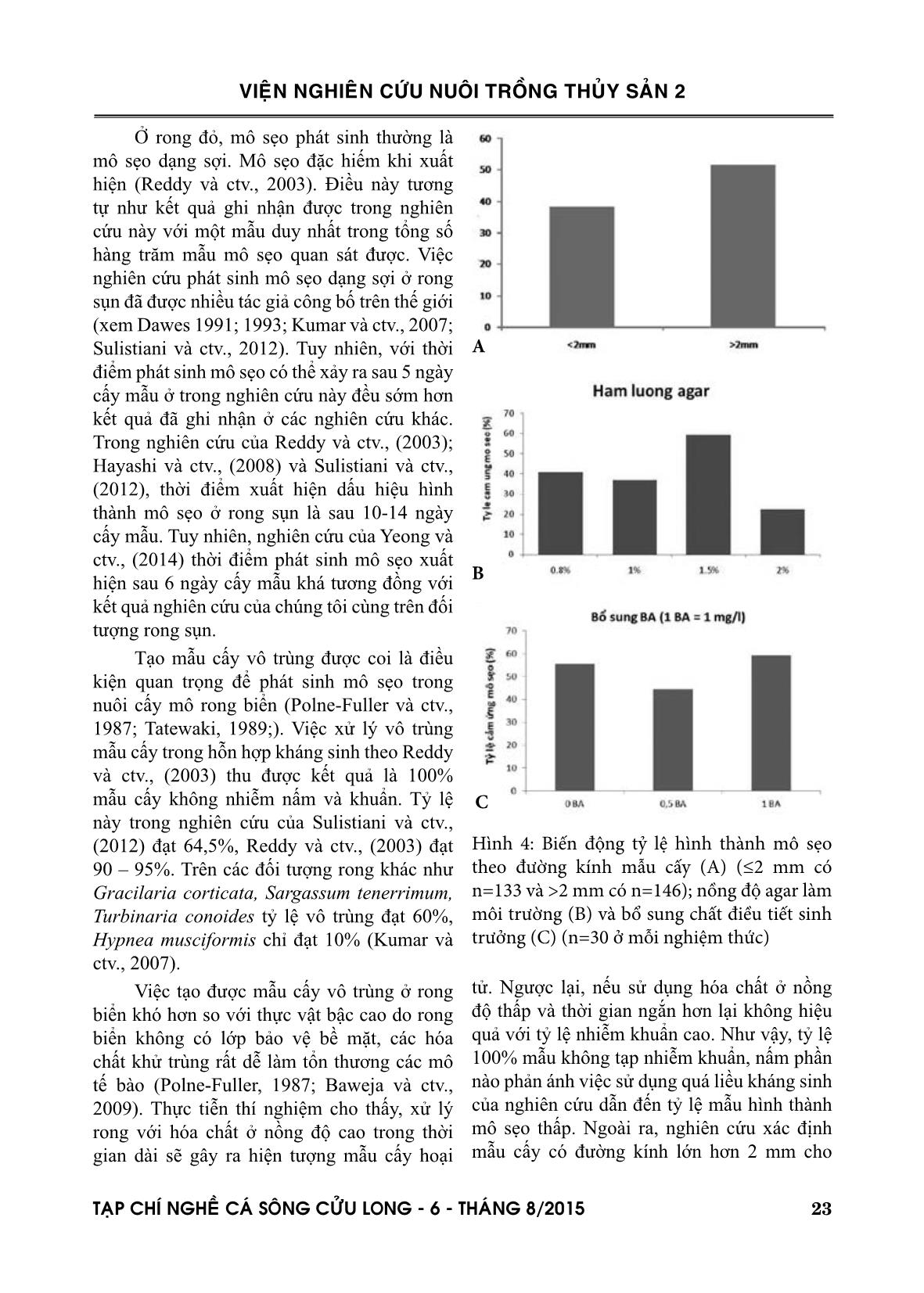
i sự phát triển mô sẹo hàng ngày dưới kính giải phẫu với độ phóng đại tối đa 4,5 lần. Các đĩa petri đựng mẫu cấy được đặt ngẫu nhiên trong cùng một vị trí thí nghiệm để đảm bảo đồng 2χ VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 21 Việc phát sinh mô sẹo ở rong sụn xảy ra khá nhanh và tăng dần theo thời gian. Kết quả quan sát cho thấy sau 5 ngày cấy mẫu, tỷ lệ tích =4,71>3,841 (α=0,05, df=1) chỉ ra sự khác biệt có ý nghĩa thống kê về tỷ lệ mô sẹo hình thành giữa hai loại đường kính mẫu cấy. A B C D Hình 3: Hình chụp mẫu cấy có mô sẹo dạng sợi (A), mô sẹo đặc (B), mẫu bị rỉ nước (C) và mẫu bị hoại tử (D) Hình 2: Tỷ lệ mô sẹo hình thành sau thời gian cấy mẫu (n= 279) 2χ Thời gian cảm ứng mô sẹo VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 22 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 Việc bổ sung thêm chất điều tiết sinh trưởng BA không kích thích sự hình thành và phát triển của mô sẹo. Kết quả nghiên cứu cho thấy lô đối chứng (không bổ sung BA) cho tỷ lệ hình thành mô sẹo đạt 55%, cao hơn so với lô bổ sung 0,5 mg/l BA (đạt 45%) và tương đương với lô bổ sung 1 mg/l BA (đạt 57%) (Hình 4C). Kết quả phân tích (α=0,05, df=1) cho thấy giá trị dao động từ 0,05 đến 1,00 <3,84 chứng tỏ sự khác biệt về tỷ lệ mô sẹo giữa các lô thí nghiệm bổ sung chất kích thích sinh trưởng BA không có ý nghĩa thống kê. hình thành mô sẹo dạng sợi đạt 14,17%, sau 9 ngày tỷ lệ này tăng lên 22,22%, sau 11 ngày đạt 24,73% và sau 14 ngày là 45,16% (Hình 2). Sau 14 ngày, không có mô sẹo được phát hiện thêm. Các mẫu cấy không hình thành mô sẹo sẽ có hiện tượng rỉ nước trên bề mặt vết cấy, mất màu tự nhiên và hoại tử hoàn toàn sau 25-30 ngày (Hình 2). Quan sát quá trình hình thành mô sẹo ghi nhận được có hai dạng mô sẹo xuất hiện là mô sẹo dạng sợi và mô sẹo đặc (Hình 3). Tuy nhiên, trong tổng số 126 mẫu mô sẹo chỉ có 1 mẫu có dạng mô sẹo đặc, còn lại 125 mẫu là mô sẹo dạng sợi ( =122>>>3,841 (α=0,05, df=1)). 3.2. Ảnh hưởng của nồng độ agar và chất điều tiết sinh trưởng Kết quả nghiên cứu cũng phản ánh sự khác biệt về tỷ lệ mô sẹo hình thành giữa các nồng độ agar thí nghiệm. Nồng độ agar 1,5% cho tỷ lệ hình thành mô sẹo đạt 60% cao nhất trong ba nồng độ thử nghiệm. Nồng độ agar 2% cho tỷ lệ hình thành mô sẹo thấp nhất (20%) (Hình 4B). Ở nồng độ agar 0,8% và 1% cho tỷ lệ hình thành mô sẹo tương đương nhau (40%). Kết quả phân tích (α=0,05, df=1) chỉ ra sự sai khác có ý nghĩa thống kê về tỷ lệ hình thành mô sẹo giữa nồng độ agar 1,5% với các nồng độ agar thử nghiệm (Bảng 1). Lô thí nghiệm Đối chứng (không bổ sung) Bổ sung 0,5%BA Bổ sung 0,50%BA 0,58 Bổ sung 1%BA 0,057 1,00 IV. THẢO LUẬN Nuôi cấy mô rong sụn là lĩnh vực nghiên cứu trên đối tượng thực vật bậc thấp yêu cầu quy trình và kỹ thuật hoàn toàn khác so với thực vật bậc cao. Kết quả nghiên cứu của chúng tôi đã tạo ra được mô sẹo trong phòng thí nghiệm mặc dù mô sẹo hình thành chưa phát triển mạnh, chưa có khả năng tái sinh thành cây mới. Với tỷ lệ hình thành mô sẹo đạt tới 45-60% không cao bằng các nghiên cứu đã công bố trên thế giới ví dụ như Reddy và ctv., (2003) ghi nhận hơn 80% mẫu cấy hình thành mô sẹo, Yeong và ctv., (2014) ghi nhận tỷ lệ hình thành mô sẹo đạt 68,57%. Nguyên nhân dẫn đến tỷ lệ hình thành mô sẹo thấp như nghiên cứu này có thể do hóa chất nghiên cứu sử dụng có nguồn gốc từ Trung Quốc nên chất lượng và độ tinh khiết không cao bằng hóa chất nguồn gốc ở các nước tư bản phát triển. Nhận định này đã được chúng tôi kiểm chứng gần đây nhưng chưa công bố. 2χ 2χ Nồng độ agar 2% 1,5% 1% 1,5% 12,00* 1% 2,94 3,38 0,8% 4,00* 2,40 0,09 Bảng 1: Kết quả phân tích giá trị đánh giá sai khác về tỷ lệ mô sẹo giữa các nồng độ agar thí nghiệm * Khác biệt có ý nghĩa thống kê 2χ 2χ 2χ Bảng 2: Kết quả phân tích đánh giá sai khác về tỷ lệ mô sẹo giữa các nồng độ BA thí nghiệm 2χ VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 23 tử. Ngược lại, nếu sử dụng hóa chất ở nồng độ thấp và thời gian ngắn hơn lại không hiệu quả với tỷ lệ nhiễm khuẩn cao. Như vậy, tỷ lệ 100% mẫu không tạp nhiễm khuẩn, nấm phần nào phản ánh việc sử dụng quá liều kháng sinh của nghiên cứu dẫn đến tỷ lệ mẫu hình thành mô sẹo thấp. Ngoài ra, nghiên cứu xác định mẫu cấy có đường kính lớn hơn 2 mm cho Ở rong đỏ, mô sẹo phát sinh thường là mô sẹo dạng sợi. Mô sẹo đặc hiếm khi xuất hiện (Reddy và ctv., 2003). Điều này tương tự như kết quả ghi nhận được trong nghiên cứu này với một mẫu duy nhất trong tổng số hàng trăm mẫu mô sẹo quan sát được. Việc nghiên cứu phát sinh mô sẹo dạng sợi ở rong sụn đã được nhiều tác giả công bố trên thế giới (xem Dawes 1991; 1993; Kumar và ctv., 2007; Sulistiani và ctv., 2012). Tuy nhiên, với thời điểm phát sinh mô sẹo có thể xảy ra sau 5 ngày cấy mẫu ở trong nghiên cứu này đều sớm hơn kết quả đã ghi nhận ở các nghiên cứu khác. Trong nghiên cứu của Reddy và ctv., (2003); Hayashi và ctv., (2008) và Sulistiani và ctv., (2012), thời điểm xuất hiện dấu hiệu hình thành mô sẹo ở rong sụn là sau 10-14 ngày cấy mẫu. Tuy nhiên, nghiên cứu của Yeong và ctv., (2014) thời điểm phát sinh mô sẹo xuất hiện sau 6 ngày cấy mẫu khá tương đồng với kết quả nghiên cứu của chúng tôi cùng trên đối tượng rong sụn. Tạo mẫu cấy vô trùng được coi là điều kiện quan trọng để phát sinh mô sẹo trong nuôi cấy mô rong biển (Polne-Fuller và ctv., 1987; Tatewaki, 1989;). Việc xử lý vô trùng mẫu cấy trong hỗn hợp kháng sinh theo Reddy và ctv., (2003) thu được kết quả là 100% mẫu cấy không nhiễm nấm và khuẩn. Tỷ lệ này trong nghiên cứu của Sulistiani và ctv., (2012) đạt 64,5%, Reddy và ctv., (2003) đạt 90 – 95%. Trên các đối tượng rong khác như Gracilaria corticata, Sargassum tenerrimum, Turbinaria conoides tỷ lệ vô trùng đạt 60%, Hypnea musciformis chỉ đạt 10% (Kumar và ctv., 2007). Việc tạo được mẫu cấy vô trùng ở rong biển khó hơn so với thực vật bậc cao do rong biển không có lớp bảo vệ bề mặt, các hóa chất khử trùng rất dễ làm tổn thương các mô tế bào (Polne-Fuller, 1987; Baweja và ctv., 2009). Thực tiễn thí nghiệm cho thấy, xử lý rong với hóa chất ở nồng độ cao trong thời gian dài sẽ gây ra hiện tượng mẫu cấy hoại Hình 4: Biến động tỷ lệ hình thành mô sẹo theo đường kính mẫu cấy (A) (≤2 mm có n=133 và >2 mm có n=146); nồng độ agar làm môi trường (B) và bổ sung chất điều tiết sinh trưởng (C) (n=30 ở mỗi nghiệm thức) A B C VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 24 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 thí nghiệm quan trọng hơn việc bổ sung chất kích thích sinh trưởng bởi vì khi rong sụn đã thích nghi với môi trường thí nghiệm thì đã tự tổng hợp đủ chất kích thích sinh trưởng cần thiết để phát sinh mô sẹo một cách tự nhiên. Việc bổ sung thêm chất điều tiết sinh trưởng có thể làm mất cân bằng auxins và cytokinins hoặc bị thừa, không cần thiết. V. KẾT LUẬN VÀ ĐỀ XUẤT Kết luận Việc nghiên cứu phát sinh mô sẹo ở rong sụn làm nguyên liệu tái sinh thành cây giống ở rong sụn đã bước đầu được thử nghiệm thành công với tỷ lệ mô sẹo đạt được lên tới 45,16% sau 14 ngày cảm ứng. Việc hình thành mô sẹo có thể được bắt đầu từ sau 5 ngày cấy và chỉ kéo dài được khoảng 10 ngày. Kết quả nghiên cứu cũng chỉ ra quá trình phát sinh mô sẹo phụ thuộc vào nhiều yếu tố như kích thước mẫu cấy, nồng độ agar sử dụng làm môi trường. Bước đầu xác định việc hàm lượng agar làm mô trường cấy mẫu thích hợp là 1,5%; mẫu cấy có đường kính > 2 mm sẽ cho hiệu quả phát sinh mô sẹo cao. Ngoài ra, nuôi thích nghi rong trong phòng thí nghiệm trước khi tạo mô sẹo là điều kiện bắt buộc thực hiện. Đề xuất Mặc dù đã tạo được mô sẹo trong phòng thí nghiệm, tuy nhiên đây chỉ là kết quả bước đầu. Cần phải làm thêm nhiều lần thí nghiệm để khẳng định được quy trình ổn định và hiệu quả. Ngoài ra, tốc độ phát triển của mô sẹo còn thấp và hiện tượng chết trắng vẫn xảy ra trên nhiều mẫu cấy. Cần phải nghiên cứu xác định được nguyên nhân và phương án khắc phục. Việc xử lý vô trùng mẫu cấy bằng hỗn hợp kháng sinh bước đầu cho hiệu quả cao nhưng mất nhiều thời gian và chi phí cao. Cần nghiên cứu thử nghiệm một số phương pháp tỷ lệ hình thành mô sẹo cao hơn so với mẫu có đường kính nhỏ hơn. Có thể mẫu có kích thước nhỏ thường là nhánh mới sinh trong quá trình thích nghi ở phòng thí nghiệm nên các tế bào còn non, lớp vỏ mẫu cấy mỏng dẫn đến khả năng ngấm chất kháng sinh nhiều gây ức chế sinh trưởng. Điều này đã được Reddy và ctv., (2003) và Sulistiani và ctv., (2012) làm sáng tỏ trong nghiên cứu của mình. Như vậy, kích thước mẫu cấy của mẫu cấy có ảnh hưởng đến tỷ lệ cảm ứng mô sẹo trong nuôi cấy mô. Kết quả thử nghiệm chỉ ra rằng agar 1,5% cho hiệu quả cảm ứng tạo mô sẹo cao nhất với 59,26% số mẫu cấy hình thành mô sẹo dạng sợi sau 14 ngày nuôi cấy. Các nồng độ agar còn lại cho tỷ lệ cảm ứng mô sẹo từ 22-40%. Kết quả này tương tự nghiên cứu của Reddy và ctv., (2003), với nồng độ agar 1,5% cho 82% mẫu cấy hình thành mô sẹo sau 2 tuần, trong khi nồng độ 0,8% tỷ lệ này thấp hơn nhiều (Reddy và ctv., 2003). Ở nồng độ agar 2%, tỷ lệ hình thành mô sẹo thấp hơn hẳn có thể do môi trường có độ cứng cao, giữ lại dinh dưỡng và mẫu rong không đủ khả năng thẩm thấu dinh dưỡng từ thạch. Điều này chứng tỏ rằng, tính chất vật lý của môi trường mà cụ thể là độ cứng của thạch có ảnh hưởng đến việc hình thành mô sẹo. Kết quả nghiên cứu cũng chỉ ra, bổ sung chất điều tiết sinh trưởng BA (6 - benzyl aminopurine) không làm tăng tỷ lệ hình thành mô sẹo ở rong sụn. Điều này tương tự nhận định của Reddy và ctv., (2003) nhưng trái với nhận định của các tác giả khác, rằng việc bổ sung chất điều tiết sinh trưởng làm tăng tỷ lệ cảm ứng mô sẹo và sự phát triển của mô sẹo rong biển (Dawes và Koch, 1991; Huang và Fujita, 1997; Yokoya và Handro, 2004; Yokoya và ctv., 2004; Munoz và ctv., 2006; Sulistiani và ctv., 2012). Theo Reddy và ctv., (2003), việc thích nghi rong sụn trong phòng VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 25 Polne-Fuller, M., Gibor, A., 1987. Calluses and callus-like growth in seaweeds: induction and culture. Hydrobiologia, 151/152:131– 138. Reddy, C.R.K., Kumar, G.R.K., Siddhanta, A.K., Tewari, A., Eswaran, K., 2003. In vitro somatic embryogensis and regeneration of somatic embryos from pigmented callues of Kappaphycus alvarezii (Doty) Doty (Rhodophyta, Gigartinales). Journal of Phycology, 39(3): 610-616. Reddy, C., Jha, B., Fujita, Y., Ohno, M., 2008. Seaweed micropropagation techniques and their potentials: an overview. Journal of Applied Phycology, 20(5): 609-617. Reddy, C.R.K., Gupta, V., Jha, B., 2010. Developments in biotechnology of red algae. In Red algae in the genomic age. J. Seckbach & D.J. Chapman (Eds.), Springer Netherlands. 13: 307-341. Sulistiani, E., Soelistyowati, D.T., Alimuddin & Yani, S.A., 2012. Callus induction and filaments regeneration from callus of cottonii seaweed (Doty) collected from Natuna Islands, Riau Islands Province. Biotropia, 19 (2): 103 -114. Tatewaki, M., 1989. The simple method of seaweed axenic culture. The Korean Journal of Phycology, 4(2): 183-189. Yeong, H.Y., Phang, S.M., Reddy, C.R.K., Khalid, N., 2014. Production of clonal planting materials from Gracilaria changii and Kappaphycus alvarezii through tissue culture and culture of G. changii explants in airlift photobioreactor. Journal of Applied Phycology, 26: 729-746. Yokoya, N.S., West, J.A., Luchi, A.E., 2004. Effect of plant growth regulator on callus formation, growth and regeneration in axenic tissue culture of Gracilaria tenuistipitata and Gracilaria perplexa (Gracilariales, Rhodophyta). Phycological Research, 52: 244-54. vô trùng khác như các loại hóa chất khử trùng nhanh như cồn, formol nồng độ thấp TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Đào Duy Thu, Nguyễn Văn Nguyên và Trần Mai Đức, 2014. Hiện trạng nghề trồng rong sụn (Kappaphycus alvarezii, Doty) ở Việt Nam. Tạp chí Nông nghiệp và Phát triển Nông thôn, tháng 9/2014:221-228. Tài liệu tiếng Anh Baweja, B., Sahoo, D., García-Jiménez, P., Robaina, R.R., 2009. Seaweed tissue culture as applied to biotechnology: Problems, achievements and prospects. Phycological Research, 57: 45 - 58. Dawes, C.J., Koch, E.W., 1991. Branch, microprapagule and tissue culture of the red alga Eucheuma denticulatum and Kappaphycus alvarezii farmed in the Philippines. Journal of Applied Phycology, 3: 247–257 Dawes, C.J., Trono, G.C., Lluisma, A.O., 1993. Clonal propagation of Eucheuma denticulatum and Kappaphycus alvarezii for Philippines seaweed farms. Hydrobiologia, 260/261: 379–83 Huang, W., Fujita, Y., 1997. Callus induction and thallus regeneration in some species of red algae. Phycological Research. 45:105–11. Kumar, G.R., Reddy, C.R.K., Jha, B., 2007. Callus induction and thallus regeneration from callus of phycocolloid yielding seaweeds from the Indian coast. Journal of Applied Phycology, 19:15–25 Muñoz, J., Cahue-López, A.C., Patiño, R., Robledo, D., 2006. Use of plant growth regulators in micropropagation of Kappaphycus alvarezii (Doty) in airlift bioreactors. Journal of Applied Phycology, 18:209 – 218. VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 26 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 TISSUE CULTURE OF COTTONI SEAWEED (Kappaphycus alvarezii, Doty): PRELIMINARY RESULTS OF IN VITRO CALLUS INDUCTION Dao Duy Thu1*, Pham Thi Mat1, Vu Thi Hoai1, Nguyen Van Nguyen1 ABSTRACT The callus is an essential material to produce propagules in seaweed tissue culture technology. The study presents preliminary results of experimental callus induction in Kappaphycus alvarezii using culture medium PES at salinity of 28‰; aseptic culture condition with a mixture of antibiotics; and callus induction in temperature of 25°C (±1°C), cool white fluorescent irradiance of 5 μmol photons m−2 s−1 and light regime with light:dark equals 12:12. The results showed that all experimental explants were not contaminated. The primary result showed that callus induction rate was 45.16% and earliest callus could appear after 5 day cultivation. The callus induction depended strongly on size of explants, agar concentration in medium and not depend on the plant growth regulator addition. Keywords: Cottoni seaweed, Kappaphycus alvarezii, callus induction, Vietnam Người phản biện: ThS. Võ Minh Sơn Ngày nhận bài: 29/5/2015 Ngày thông qua phản biện: 03/8/2015 Ngày duyệt đăng: 07/8/2015 1Research Institute for Marine Fisheries * Email: ddthu@rimf.org.vn
File đính kèm:
 nuoi_cay_mo_rong_sun_kappaphycus_alvarezii_doty_ket_qua_buoc.pdf
nuoi_cay_mo_rong_sun_kappaphycus_alvarezii_doty_ket_qua_buoc.pdf

