Khảo sát ảnh hưởng của một số yếu tố môi trường đến sự phát triển của vi tảo biển (Thalassiosira sp.) trong điều kiện phòng thí nghiệm
TÓM TẮT
Nghiên cứu thực hiện nhằm xác định ảnh hưởng của môi trường dinh dưỡng, độ mặn, nhiệt độ và
việc có hoặc không bổ sung CO2 lên sự phát triển của vi tảo Thalassiosira sp. trong điều kiện phòng
thí nghiệm để cải tiến và hoàn thiện quy trình nuôi sinh khối vi tảo Thalassiosira sp. quy mô lớn.
Nghiên cứu đã thu được các kết quả: Vi tảo Thalassiosira sp. phát triển tốt nhất ở môi trường dinh
dưỡng F/2 đạt mật độ cao nhất là 105,83 ± 1,69 x 104 tế bào/ml vào ngày thứ 5 của chu kỳ nuôi với
nhiệt độ 310C, độ mặn 20‰ và không có bổ sung CO2.

Trang 1

Trang 2

Trang 3
Trang 4
Trang 5
Trang 6

Trang 7

Trang 8

Trang 9
Bạn đang xem tài liệu "Khảo sát ảnh hưởng của một số yếu tố môi trường đến sự phát triển của vi tảo biển (Thalassiosira sp.) trong điều kiện phòng thí nghiệm", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Khảo sát ảnh hưởng của một số yếu tố môi trường đến sự phát triển của vi tảo biển (Thalassiosira sp.) trong điều kiện phòng thí nghiệm

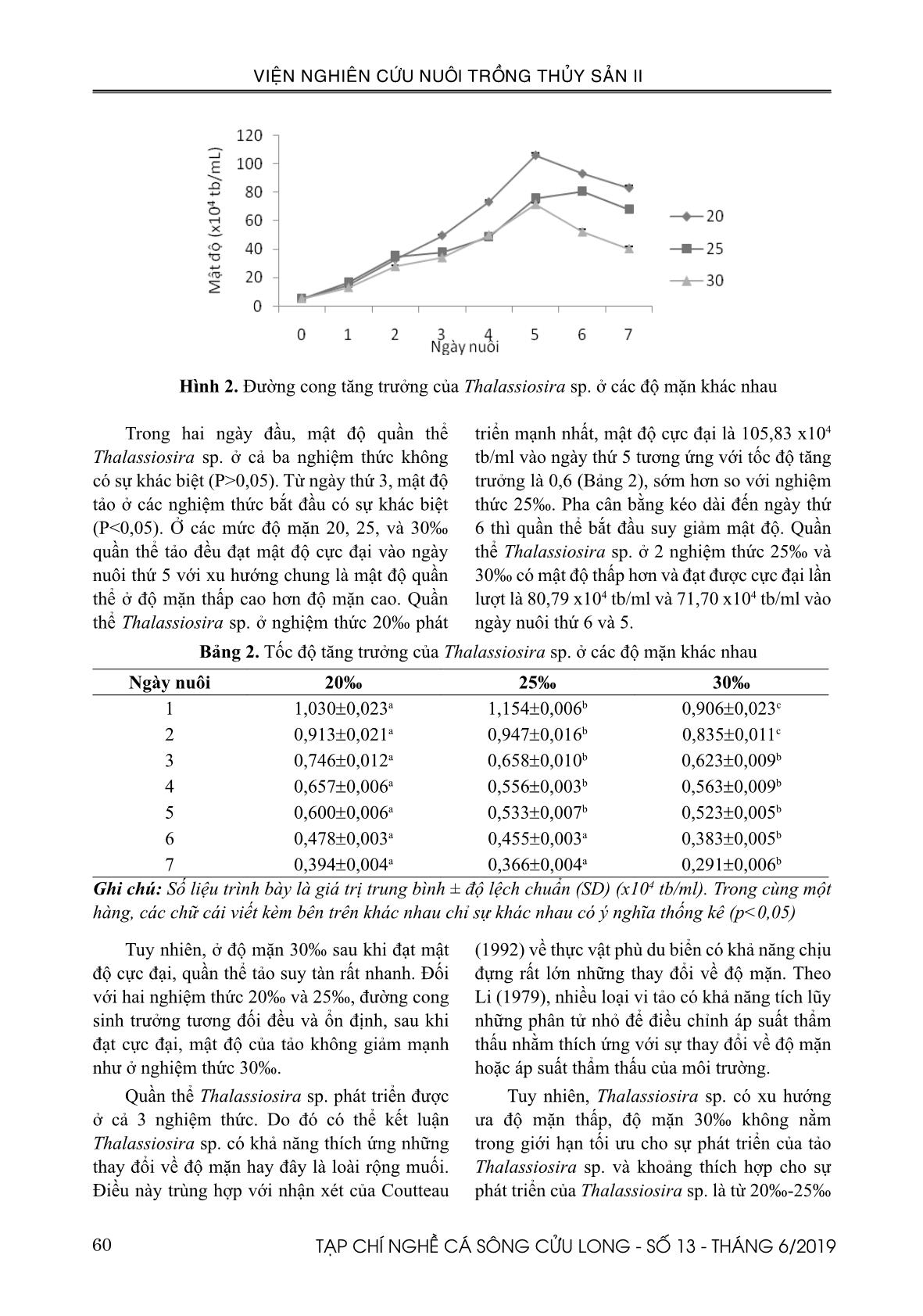
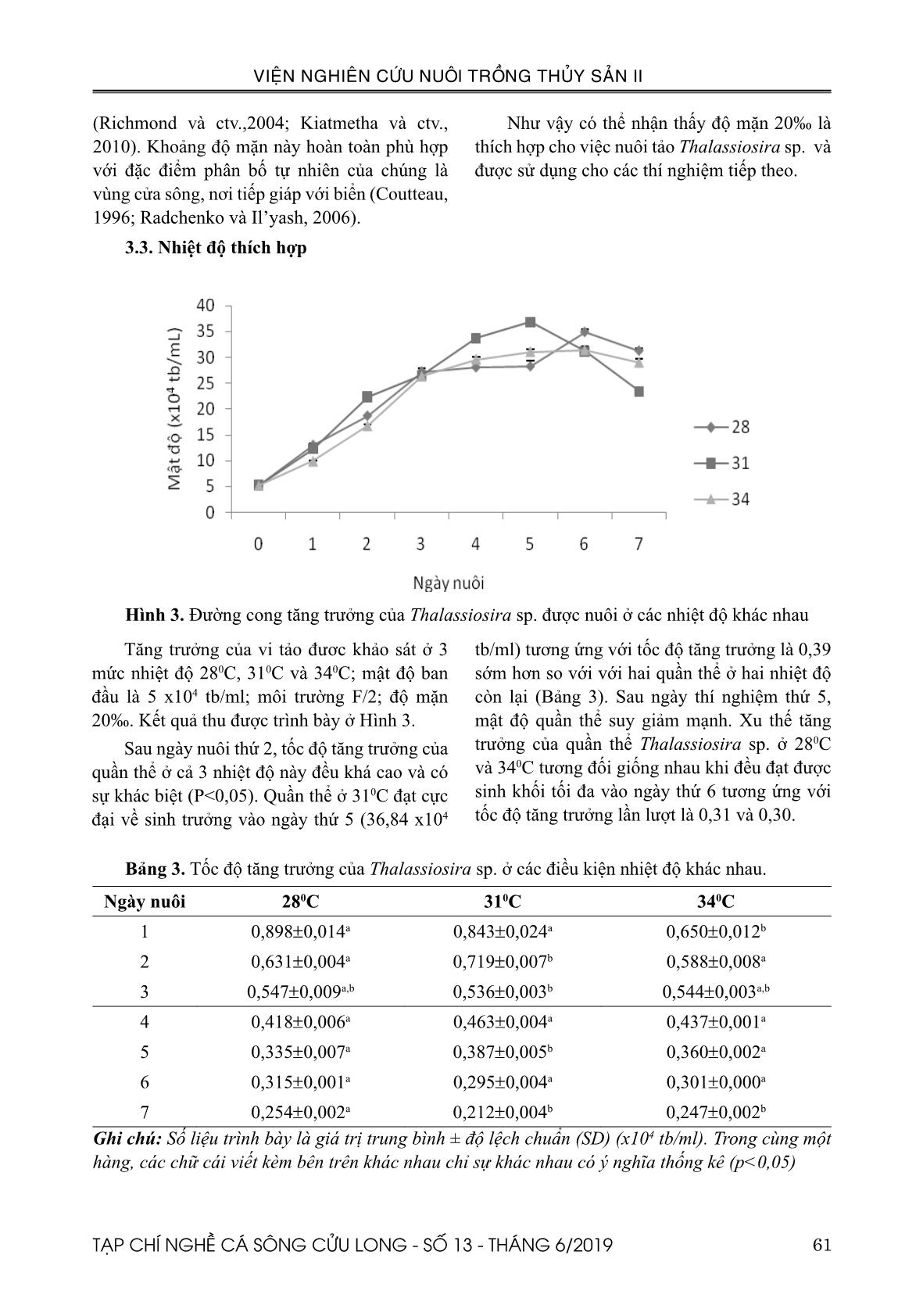
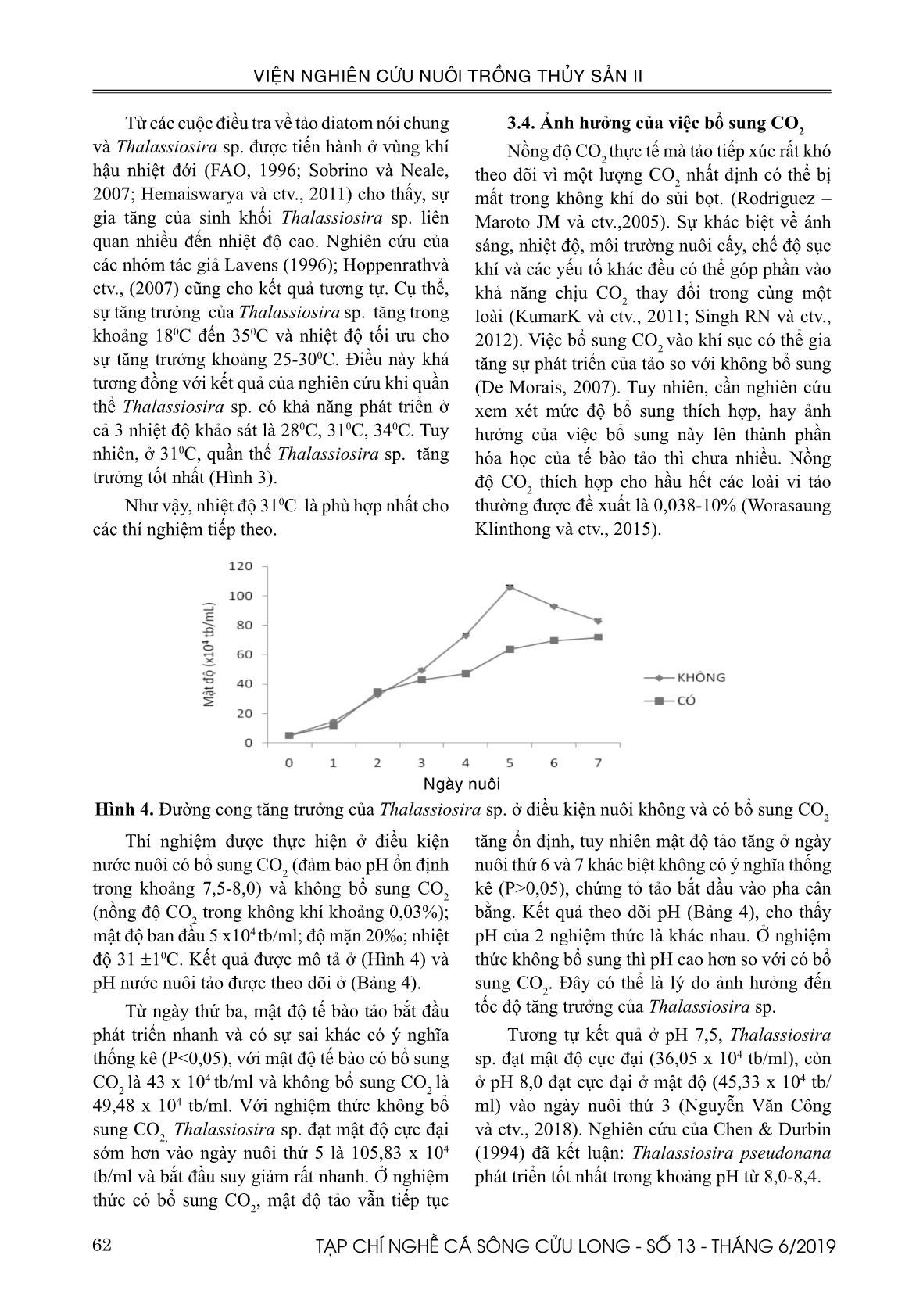
b/ml; môi trường F/2; độ mặn 20‰. Kết quả thu được trình bày ở Hình 3. Sau ngày nuôi thứ 2, tốc độ tăng trưởng của quần thể ở cả 3 nhiệt độ này đều khá cao và có sự khác biệt (P<0,05). Quần thể ở 310C đạt cực đại về sinh trưởng vào ngày thứ 5 (36,84 x104 tb/ml) tương ứng với tốc độ tăng trưởng là 0,39 sớm hơn so với với hai quần thể ở hai nhiệt độ còn lại (Bảng 3). Sau ngày thí nghiệm thứ 5, mật độ quần thể suy giảm mạnh. Xu thế tăng trưởng của quần thể Thalassiosira sp. ở 280C và 340C tương đối giống nhau khi đều đạt được sinh khối tối đa vào ngày thứ 6 tương ứng với tốc độ tăng trưởng lần lượt là 0,31 và 0,30. Bảng 3. Tốc độ tăng trưởng của Thalassiosira sp. ở các điều kiện nhiệt độ khác nhau. Ngày nuôi 280C 310C 340C 1 0,898±0,014a 0,843±0,024a 0,650±0,012b 2 0,631±0,004a 0,719±0,007b 0,588±0,008a 3 0,547±0,009a,b 0,536±0,003b 0,544±0,003a,b 4 0,418±0,006a 0,463±0,004a 0,437±0,001a 5 0,335±0,007a 0,387±0,005b 0,360±0,002a 6 0,315±0,001a 0,295±0,004a 0,301±0,000a 7 0,254±0,002a 0,212±0,004b 0,247±0,002b Ghi chú: Số liệu trình bày là giá trị trung bình ± độ lệch chuẩn (SD) (x104 tb/ml). Trong cùng một hàng, các chữ cái viết kèm bên trên khác nhau chỉ sự khác nhau có ý nghĩa thống kê (p<0,05) 62 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II Từ các cuộc điều tra về tảo diatom nói chung và Thalassiosira sp. được tiến hành ở vùng khí hậu nhiệt đới (FAO, 1996; Sobrino và Neale, 2007; Hemaiswarya và ctv., 2011) cho thấy, sự gia tăng của sinh khối Thalassiosira sp. liên quan nhiều đến nhiệt độ cao. Nghiên cứu của các nhóm tác giả Lavens (1996); Hoppenrathvà ctv., (2007) cũng cho kết quả tương tự. Cụ thể, sự tăng trưởng của Thalassiosira sp. tăng trong khoảng 180C đến 350C và nhiệt độ tối ưu cho sự tăng trưởng khoảng 25-300C. Điều này khá tương đồng với kết quả của nghiên cứu khi quần thể Thalassiosira sp. có khả năng phát triển ở cả 3 nhiệt độ khảo sát là 280C, 310C, 340C. Tuy nhiên, ở 310C, quần thể Thalassiosira sp. tăng trưởng tốt nhất (Hình 3). Như vậy, nhiệt độ 310C là phù hợp nhất cho các thí nghiệm tiếp theo. 3.4. Ảnh hưởng của việc bổ sung CO2 Nồng độ CO 2 thực tế mà tảo tiếp xúc rất khó theo dõi vì một lượng CO2 nhất định có thể bị mất trong không khí do sủi bọt. (Rodriguez – Maroto JM và ctv.,2005). Sự khác biệt về ánh sáng, nhiệt độ, môi trường nuôi cấy, chế độ sục khí và các yếu tố khác đều có thể góp phần vào khả năng chịu CO2 thay đổi trong cùng một loài (KumarK và ctv., 2011; Singh RN và ctv., 2012). Việc bổ sung CO 2 vào khí sục có thể gia tăng sự phát triển của tảo so với không bổ sung (De Morais, 2007). Tuy nhiên, cần nghiên cứu xem xét mức độ bổ sung thích hợp, hay ảnh hưởng của việc bổ sung này lên thành phần hóa học của tế bào tảo thì chưa nhiều. Nồng độ CO2 thích hợp cho hầu hết các loài vi tảo thường được đề xuất là 0,038-10% (Worasaung Klinthong và ctv., 2015). 8 Thí nghiệm được thực hiện ở điều kiện nước nuôi có bổ sung CO2 (đảm bảo pH ổn định trong khoảng 7,5-8,0) và không bổ sung CO2 (nồng độ CO2 trong không khí khoảng 0,03%); mật độ ban đầu 5 x104 tb/ml; độ mặn 20‰; nhiệt độ 31 10C. Kết quả được mô tả ở (Hình 4) và pH nước nuôi tảo được theo dõi ở (Bảng 4). Từ ngày thứ ba, mật độ tế bào tảo bắt đầu phát triển nhanh và có sự sai khác có ý nghĩa thống kê (P<0,05), với mật độ tế bào có bổ sung CO2 là 43 x 104 tb/ml và không bổ sung CO2 là 49,48 x 104 tb/ml. Với nghiệm thức không bổ sung CO2, Thalassiosira sp. đạt mật độ cực đại sớm hơn vào ngày nuôi thứ 5 là 105,83 x 104 tb/ml và bắt đầu suy giảm rất nhanh. Ở nghiệm thức có bổ sung CO2, mật độ tảo vẫn tiếp tục tăng ổn định, tuy nhiên mật độ tảo tăng ở ngày nuôi thứ 6 và 7 khác biệt không có ý nghĩa thống kê (P>0,05), chứng tỏ tảo bắt đầu vào pha cân bằng. Kết quả theo dõi pH (Bảng 4), cho thấy pH của 2 nghiệm thức là khác nhau. Ở nghiệm thức không bổ sung thì pH cao hơn so với có bổ sung CO2. Đây có thể là lý do ảnh hưởng đến tốc độ tăng trưởng của Thalassiosira sp. Tương tự kết quả ở pH 7,5, Thalassiosira sp. đạt mật độ cực đại (36,05 x 104 tb/ml), còn ở pH 8,0 đạt cực đại ở mật độ (45,33 x 104 tb/ml) vào ngày nuôi thứ 3 (Nguyễn Văn Công và ctv., 2018). Nghiên cứu của Chen & Durbin (1994) đã kết luận: Thalassiosira pseudonana phát triển tốt nhất trong khoảng pH từ 8,0-8,4. Bảng 4. Kết quả theo dõi pH của nước nuôi tảo Thalassiosira sp. ở 2 điều kiện môi trường không và có bổ sung CO2 Ngày nuôi 0 1 2 3 4 5 6 7 Không bổ sung CO2 8,0 8,2 8,3 8,3 8,4 8,4 8,5 8,5 Có bổ sung CO2 7,5 7,5 7,6 7,6 7,7 7,6 7,7 7,8 Hình 4. Đường cong tăng trưởng của Thalassiosira sp. ở điều kiện nuôi không và có bổ sung CO2 Thí nghiệm được thực hiện ở điều kiện nước nuôi có bổ sung CO2 (đảm bảo pH ổn định trong khoảng 7,5-8,0) và không bổ sung CO2 (nồng độ CO2 trong không khí khoảng 0,03%); mật độ ban đầu 5 x104 tb/ml; độ mặn 20‰; nhiệt độ 31 ±10C. Kết quả được mô tả ở (Hình 4) và pH nước nuôi tảo được theo dõi ở (Bảng 4). Từ ngày thứ ba, mật độ tế bào tảo bắt đầu phát triển nhanh và có sự sai khác có ý nghĩa thống kê (P<0,05), với mật độ tế bào có bổ sung CO 2 là 43 x 104 tb/ml và không bổ sung CO 2 là 49,48 x 104 tb/ml. Với nghiệm thức không bổ sung CO2, Thalassiosira sp. đạt mật độ cực đại sớm hơn vào ngày nuôi thứ 5 là 105,83 x 104 tb/ml và bắt đầu suy giảm rất nhanh. Ở nghiệm thức có bổ sung CO2, mật độ tảo vẫn tiếp tục tăng ổn định, tuy nhiên mật độ tảo tăng ở ngày uôi thứ 6 và 7 khác biệt không có ý nghĩa thống kê (P>0,05), chứng tỏ tảo bắt đầu vào pha cân bằng. Kết quả theo dõi pH (Bảng 4), cho thấy pH của 2 nghiệm thức là khác nhau. Ở nghiệm thức không bổ sung thì pH cao hơn so với có bổ sung CO2. Đây có thể là lý do ảnh hưởng đến tốc độ tăng trưởng của Thalassiosira sp. Tương tự kết quả ở pH 7,5, Thalassiosira sp. đạt mật độ cực đại (36,05 x 104 tb/ml), còn ở pH 8,0 đạt cực đại ở mật độ (45,33 x 104 tb/ ml) vào ngày nuôi thứ 3 (Nguyễn Văn Công và ctv., 2018). Nghiên cứu của Chen & Durbin (1994) đã kết luận: Thalassiosira pseudonana phát triển tốt nhất trong khoả pH từ 8,0-8,4. Ngày nuôi Hình 4. Đường cong tăng trưởng của Thalassiosira sp. ở điều kiện nuôi không và có bổ sung CO2 63TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II Bảng 4. Kết quả theo dõi pH của nước nuôi tảo Thalassiosira sp. ở 2 điều kiện môi trường không và có bổ sung CO2 Ngày nuôi 0 1 2 3 4 5 6 7 Không bổ sung CO2 8,0 8,2 8,3 8,3 8,4 8,4 8,5 8,5 Có bổ sung CO2 7,5 7,5 7,6 7,6 7,7 7,6 7,7 7,8 Chen, C.Y., & E.G. Durbin, 1994. Effects of pH on the growth and carbon uptake of marine phytoplankton. Marine Ecology Progress Series 109(1): 83-94. Coutteau, P., 1996. Microalgae (in P. Lavens and P. Sorgeloos (ed.)) Manual on the production and use of live food for aquaculture. FAO Fisheries Technical Paper: 361. Coutteau, P., Sorgeloos, P., 1992. The use of algal substitutes and the requirement for live algae in hatchery and nursery rearing of bivalve molluscs: an international survey. J. Shellfish Res. 11: 467- 476. De Morais, M.G. and Costa, J.A.V. (2007a). Isolation and Selection of Microalgae from Coal Fired Thermoelectric Power Plant for Biofixation of Carbon Dioxide. Energy Convers. Manage. 48: 2169–2173. De Morais, M.G. and Costa, J.A.V. (2007b). Carbon Dioxide Fixation by Chlorella kessleri, C. vulgaris, Scenedesmus obliquus and Spirulina sp. Cultivated in Flasks and Vertical Tubular Photobioreactors. Biotechnol. Lett. 29: 1349– 1352. FAO, 1996. Manual on the Production and Use of Live Food for Aquaculture. FAO. Fisheries Technical Paper. No. 361: Rome. Garcia, N., Lopez Elias, J. A., Miranda A., Martinez Porchas, M., Huerta, N., and Garcia A., 2012. Effect of salinity on growth and chemical composition of the diatom Thalassiosira weissflogii at three culture phases. Latin American Journal of Aquatic Research. 40(2), 435-440. Guillard, R.R.L. and Ryther, J.H. 1962. “Studies of marine planktonic diatoms- i. Cyclotella nana hustedt, and Detonula a confervacea (cleve) gran.” Canadian Journal of Microbiology 8: 229 - 239. Hemaiswarya, S., Raja, R., Ravi Kumar, R., Ganesan, V. and Anbazhagan, C., 2011. Microalgae: a Ngoài ra, vi tảo có thể đồng hóa CO2 làm cho pH tăng. Sự thay đổi này là điều kiện bất lợi cho sự tăng trưởng và phát triển của tảo, tốc độ tăng trưởng của tảo bị ức chế khi pH>7,5 (Kain JM & Fogg GE.,1958). Việc bổ sung CO2 khi mật độ tảo bắt đầu pha tăng trưởng sẽ giúp ổn định pH môi trường nuôi, từ đó có thể kéo dài pha cân bằng và tảo lâu tàn hơn (Ishida và ctv., 2000). IV. KẾT LUẬN VÀ ĐỀ XUẤT 4.1. Kết luận: Vi tảo Thalassiosira sp. phát triển đạt mật độ cực đại (105,83 x 104 tb/ml) trong thời gian ngắn nhất, vào ngày nuôi thứ 5; ở điều kiện nuôi với môi trường dinh dưỡng F/2, độ mặn 20‰, nhiệt độ 310C và không có bổ sung CO2. 4.2. Đề xuất: Cần có những nghiên cứu sâu hơn về mối tương quan giữa mật độ quần thể tảo và chất lượng nước để có những điều chỉnh hợp lý giúp kéo dài pha ổn định. Nghiên cứu thêm về thành phần sinh hóa của tảo ở các điều kiện và giai đoạn nuôi cấy. TÀI LIỆU THAM KHẢO Aleikar Vásquez-Suárez, Miguel Guevara, Mayelys González. 2013. Growth and biochemical composition of Thalassiosira pseudonana (Thalassiosirales: Thalassiosiraceae) cultivated in semicontinuous system at different culture media and irradiances. Revista de biologia tropical. Bastidas, O., 2013. Cell counting with Neubauer chamber, basic hemocytometer usage. Celeromics. Brown, M.R., Jeffrey, S.W., Volkman, J.K., Dunstan, G.A., 1997. Nutritional properties of microalgae for mariculture, Aquaculture. 315– 331. doi:10.1016/S0044-8486(96)01501-3 64 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II sustainable feed source for aquaculture. World Journal of Microbiology and Biotechnology 27(8): 1737-1746. Hoppenrath M., Beszteri B., Drebes G., Halliger H., Beusekomj.E.E.V., Janisch S. & Wiltshire K.J., 2007. Thalassiosira species (Bacillariophyceae, Thalassiosirales) in the North Sea at Helgo-land (German Bight) and Sylt (North Frisian Wadden Sea) – afirst approach to assessing diversity. European Journal of Phycology 42: 271–288 Ishida, Y., Hiragushi, N., Kitaguchi, H., Mitsutani, A., Nagai, S., & Yoshimura, M., 2000. A highly CO2-tolerant diatom, Thalassiosira weissflogii H1, enriched from coastal sea, and its fatty acid composition. Fisheries Science. https://doi. org/10.1046/j.1444-2906.2000.00105.x. Kain JM, Fogg GE.,1958. Studies on the growth of marine phytoplakton. 1. Asterionella japonica Gran. J Mar Biol Assoc UK 37:397-413 Kiatmetha, P., W. Siangdang, B. Bunnag, S. Senapin & B. Withyachumnarnkul., 2010. Enhancement of survival and metamorphosis rates of Penaeus monodon larvae by feeding with the diatom Thalassiosira weissflogii. Aquacult. Int. DOI 10.1007/s 10499-010-9375-y. Knuckey, M. and Brown, M.R. 1998. “Microalgal concentrates as aquaculture feeds.” J. Shellfish Res. 17: 329-330. Kumar K., Dasgupta CN., Nayak B., Lindblad P., Das D., 2011. Development of suitable photobioreactors for CO 2 sequestration addressing global warrming using green algae and cyanobacteria. Bioresource Technology 102 (2011), 4945-4953. Lavens, P., and Sorgeloos, P., eds. 1996. Manual on the production and use of live food for aquaculture. FAO Fisheries Technical Paper No. 361, Rome, FAO,pp: 295. Li W. K. W., 1979. Cellular composition and physiological characteristic of the diatom Thalassiosira weissflogii adapted to cadmium stress. Mar. Biol., 55: 171-180. Mata T.M., Martins A.A., Caetano N.S., 2010. Microalgae for biodiesel production and other applications, Renew. Sust. Energ. Rev. 14, 217- 232. McCausland M.A., Barrett S.M., Brown M.R., Diemar J.A., Heasman M.P 1999. “Evaluation of live microalgae and microalgal pastes as supplementary food for juvenile Pacific oysters Crassostrea gigas.” Aquaculture 174: 323- 342. Nguyen Van Cong, Tran Dinh Quang, Nguyen Kim Duong, Do Thi Hoa Vien, 2018. Effects of initial density and pH on the growth of Thalassiosira pseudonana under laboratory conditions. Tap chí khoa học, Tập 46, số 4A (2017), tr.11-20. Radchenko, I.G. & L.V. Il’yash. 2006. Growth and photosynthetic activity of diatom Thalassiosira weissflogii at decreasing salinity. Plant Physiol., 33(3): 242-247. Richmond, A., 2004. Handbook of Microalgal Culture: Biotechnology and Applied Phycolog. (A. Richmond, B.t.v). Blackwell Publishing. Rodriguez-Maroto JM, Jimenez C, Aguilera J, Niell FX., 2005. Air bubbling results in carbon loss during microalgal cultivation in bicarbonate - enriched media: experimental data and process modeling. Aquac Eng. 9 (3): 493 – 508. Singh RN, Sharma S. Development of suitable photobioreactor for algae production – A review. Renew Sustain Energy Rev. 2012;9(4):2347–2353. Sobrino and Neale., 2007. Short – term and Long – term effects of temperature on photosynthessis in the diatom Thalassiosira pseudonana under UVR exposures. J.Phycol.43,426-436. Walne, P.R., 1966. Large scale culture of larvae Ostrea edulis L. Fish. Invest. Ser. II XXV 4: 1-52. Worasaung Klinthong, Yi-Hung Yang, Chih-Hung Huang, Chung-Sung Tan., 2015. A Review: Microalgae and Their Applications in CO2 Capture and Renewable Energy. Aerosol and Air Quality Research, 15:712-742. Zhang, C.W., Zmora, O., Kopel, R. and Richmond, A. 2001. “An industrial-size flat plate glass reactor for mass production of Nannochloropsis sp. (Eustigmatophyceae).” Aquaculture 195: 35- 49. 65TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II A STUDY OF SOME ENVIRONMENTAL FACTORS EFFECTS ON THE GROWTH OF Thalassiosira sp. IN THE LABORATORY CONDITIONS Vo Truong Giang1, Ho Hong Nhung1, Nguyen Thi Mai Anh1, Nguyen Huu Thanh1* ABSTRACT This study was conducted to test the effect of nutrient medium, temperature, salinity and CO2 on the growth of microalgae Thalassiosira sp., in laboratory conditions to improve and complete protocol for mass culture of Thalassiosira sp.. The results showed that the highest density of Thalassiosira sp. was obtained with 105.83 ± 1.69 x104 cells / ml on day 5 when culturing in F/2 medium without supplementation of CO2 at 31 0C and salinity of 20 ‰ Keywords: Thalassiosira sp., microalgae, temperature, salinity, growth rate. Người phản biện: TS. Trần Sương Ngọc Ngày nhận bài: 16/5/2019 Ngày thông qua phản biện: 26/6/2019 Ngày duyệt đăng: 28/6/2019 1 National Breeding Center for Southern Marine Aquaculture, Research Institute for Aquaculture No.2. *Email: thanhmarinefish@yahoo.com
File đính kèm:
 khao_sat_anh_huong_cua_mot_so_yeu_to_moi_truong_den_su_phat.pdf
khao_sat_anh_huong_cua_mot_so_yeu_to_moi_truong_den_su_phat.pdf

