Khả năng kiểm soát sinh học Edwardsiella ictaluri của hai chủng Bacillus subtilis Q16 và Bacillus subtilis Q111 trong điều kiện cảm nhiễm trên cá tra (Pangasianodon hypophthalmus) giống
TÓM TẮT
Hiện nay, dịch bệnh gan thận mủ do vi khuẩn Edwardsiella ictaluri gây thiệt hại rất lớn đối với
nghề nuôi cá tra. Có nhiều biện pháp để phòng và điều trị, trong đó biện pháp sinh học đang được
tập trung nghiên cứu. Trong nghiên cứu này, 2 chủng Bacillus subtilis (Q16 và Q111) cho thấy có
khả năng đối kháng với E. ictaluri bằng phương pháp vạch vuông góc và giếng khuếch tán. Đồng
thời, thử nghiệm đánh giá tính an toàn và thử nghiệm khả năng bảo vệ đối với cá tra giống trong
điều kiện cảm nhiễm E. ictaluri cho thấy cả 2 chủng B. subtilis (Q16 và Q111) đều an toàn và có
khả năng bảo vệ vật chủ với chỉ số RPS là 56,44% đối với chủng B. subtilis Q16, 100% đối với B.
subtilis Q111 và 100% đối với chủng B. subtilis (Q16 + Q111). Những kết quả này cho thấy rằng
2 chủng B. subtilis (Q16 và Q111) phân lập từ ao nuôi cá tra có tiềm năng để sản xuất chế phẩm
probiotic dùng cho cá tra.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6

Trang 7

Trang 8
Tóm tắt nội dung tài liệu: Khả năng kiểm soát sinh học Edwardsiella ictaluri của hai chủng Bacillus subtilis Q16 và Bacillus subtilis Q111 trong điều kiện cảm nhiễm trên cá tra (Pangasianodon hypophthalmus) giống

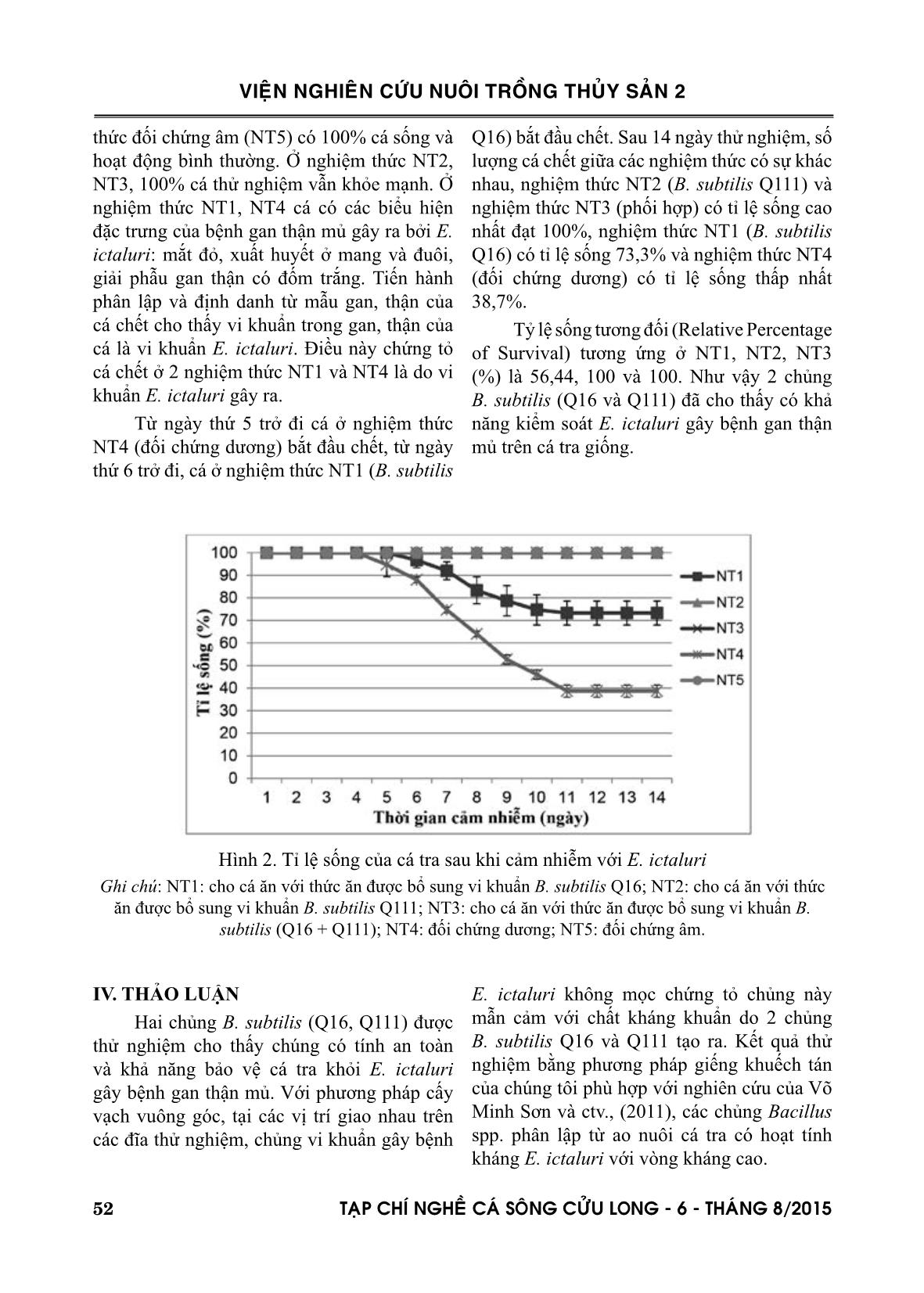
OD610 và mật độ tế bào vi khuẩn E. ictaluri và (Trần Linh Thước, 2010). Ngâm vi khuẩn E. ictaluri (mật độ thử nghiệm 108, 109, 1010, 1011 CFU.ml-1) trong 15 l nước.10 con cá-1.lô-1. Sau 60 phút, bơm nước để đạt 40 l (Capkin và ctv., 2009). Cá thử nghiệm nhịn đói trong 12 giờ sau khi cảm nhiễm. Mỗi nghiệm thức được lặp lại 3 lần. Ghi nhận số cá chết hằng ngày cho đến khi cá ngưng chết liên tục trong 3 ngày (Newaj- Fyzul và ctv., 2007). LD 50 được tính dựa vào công thức của Reed và Muech (1938): LD 50 = 10 (lũy thừa của nồng độ gây chết nhỏ nhất nhưng trên 50% - PD). Trong đó, PD = [(tỉ lệ cá nhiễm thấp nhất nhưng trên 50% - 50%) (tỉ lệ cá nhiễm thấp nhất nhưng trên 50% - tỉ lệ cá nhiễm cao nhất nhưng dưới 50%)-1]. LD50 được tính dựa vào công thức của Reed và Muech (1938): LD 50 = 10 (lũy thừa của nồng độ gây chết nhỏ nhất nhưng trên 50% - PD). Trong đó, PD = [(tỉ lệ cá nhiễm thấp nhất nhưng trên 50 - 50%)×(tỉ lệ cá nhiễm thấp nhất nhưng trên 50% - tỉ lệ cá nhiễm cao nhất nhưng dưới 50%)-1]. 2.2.5. Đánh giá khả năng bảo vệ cá tra giống trong điều kiện gây nhiễm E. ictaluri của hai chủng vi khuẩn B. subtilis (Q16, Q111) Các lô thí nghiệm và thức ăn được chuẩn bị tương tự mục thí nghiệm đánh giá tính an toàn của 2 chủng thử nghiệm lên cá tra giống, trong đó bột đông khô được thay bằng chế phẩm thử nghiệm. Thí nghiệm được tiến hành ở 5 nghiệm thức: 2 nghiệm thức đơn chủng, 1 nghiệm thức phối hợp chủng, đối chứng dương và đối chứng âm. Mỗi nghiệm thức được lặp lại 3 lần. Ở nghiệm thức thử nghiệm, thức ăn được bổ sung vi khuẩn tương ứng với liều lượng: 3% trọng lượng cá×lần-1, 2 lần×ngày-1 (Essa và ctv., 2010). Sau 28 ngày, các nghiệm thức thử nghiệm và đối chứng dương được cảm nhiễm với E. ictaluri mật độ 2. LD 50 (Newaj-Fyzul, 2007). Bể đối chứng âm bổ sung môi trường canh BHI. Theo dõi và ghi nhận số cá chết trong 14 ngày cho ăn thức ăn bổ sung vi khuẩn thử nghiệm. Tỉ lệ sống của cá được tính theo công thức: % sống = số cá sống.tổng số cá thí nghiệm-1. Xác định chỉ số RPS (Relative Percentage of Survival) theo công thức: RPS = (1- (số cá chết ở nghiệm thức vừa có probiotic vừa có E. ictaluri/số cá chết ở nghiệm thức không bổ sung vi khuẩn (đối chứng âm)-1) x 100 (Amend, 1981). Kết quả được xử lý thống kê ANOVA của phần mềm Excel của Microsoft và phần mềm Stargraphic 3.0. Kết quả trình bày gồm giá trị trung bình sai số. Cá chết sau khi được kiểm tra dấu hiệu bệnh lý, đồng thời tiến hành phân lập định danh vi khuẩn trong gan, thận, lách của cá bằng các thử nghiệm sinh hoá theo khoá phân loại Bergey’s (Holt và ctv., 1994). III. KẾT QUẢ 3.1. Khả năng đối kháng E. ictaluri của các chủng B. subtilis (Q16, Q111) Hai chủng vi khuẩn B. subtilis Q16 và B. subtilis Q111 được thử khả năng đối kháng với E. ictaluri gây bệnh trên cá tra. Bằng phương pháp cấy vạch vuông góc, tại các vị trí giao nhau ở 24 giờ, 48 giờ và 72 giờ, chủng E. ictaluri đều không mọc. Điều này cho thấy, cả 2 chủng thử nghiệm đều đối kháng với E. ictaluri (Hình 1). Bằng phương pháp giếng khuếch tán, 2 chủng B. subtilis Q16 và Q111 ± VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 51 3.3. Sản xuất thử nghiệm chế phẩm Chế phẩm sau khi đông khô được kiểm tra mật độ và phối trộn với chất mang là bột khoai mì với tỉ lệ thích hợp, sao cho thành phẩm đạt 109 CFU.g-1. Đóng gói thành phẩm với khối lượng tịnh 500 g.gói-1. 3.4. Kết quả liều gây chết trung bình - LD50 của E. ictaluri lên cá tra giống Kết quả khảo sát liều gây chết trung bình LD 50 được trình bày ở bảng 1. Hình 1. Khả năng đối kháng E. ictaluri của các chủng thử nghiệm Nghiệm thức Liều gây độc (CFU.ml-1) Tổng chết (con) Tổng sống (con) Tổng chết dồn (con) Tổng sống dồn (con) Tỷ lệ chết dồn (%) NT1 1 x 108 4 26 4 50 7,41 NT2 1 x 109 15 15 19 24 44,19 NT3 1 x 1010 21 9 40 9 81,63 NT4 1 x 1011 30 0 70 0 100,00 PD 0,84481 LD 50 1 x 109 Bảng 1. Kết quả liều gây chết LD50 Kết quả khảo sát ở bảng 1 cho thấy ở mật độ E. ictaluri 109 CFU/mL, cá tra chết 50% sau khi cảm nhiễm. Dựa vào kết quả LD 50 , chúng tôi sử dụng liều 2. LD 50 tức 2.109 CFU. ml-1 để sử dụng cho thí nghiệm tiếp theo. 3.5. Khả năng bảo vệ cá tra giống trong điều kiện gây nhiễm E. ictaluri của 2 chủng vi khuẩn B. subtilis (Q16 và Q111) Sau 14 ngày theo dõi, kết quả thí nghiệm được chúng tôi trình bày ở hình 2. Nghiệm tạo vòng kháng mạnh với đường kính vòng kháng khuẩn tương ứng là 23 ± 0,3 mm và 21,5 ± 0,3 mm. 3.2. Tính an toàn của 2 chủng vi khuẩn B. subtilis (Q16 và Q111) Cả 2 chủng B. subtilis (Q16 và Q111) đều không có khả năng dung huyết ( ) và an toàn đối với cá tra giống với tỷ lệ sống là 100% và không có sự khác biệt đối với nghiệm thức đối chứng. γ VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 52 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 Q16) bắt đầu chết. Sau 14 ngày thử nghiệm, số lượng cá chết giữa các nghiệm thức có sự khác nhau, nghiệm thức NT2 (B. subtilis Q111) và nghiệm thức NT3 (phối hợp) có tỉ lệ sống cao nhất đạt 100%, nghiệm thức NT1 (B. subtilis Q16) có tỉ lệ sống 73,3% và nghiệm thức NT4 (đối chứng dương) có tỉ lệ sống thấp nhất 38,7%. Tỷ lệ sống tương đối (Relative Percentage of Survival) tương ứng ở NT1, NT2, NT3 (%) là 56,44, 100 và 100. Như vậy 2 chủng B. subtilis (Q16 và Q111) đã cho thấy có khả năng kiểm soát E. ictaluri gây bệnh gan thận mủ trên cá tra giống. thức đối chứng âm (NT5) có 100% cá sống và hoạt động bình thường. Ở nghiệm thức NT2, NT3, 100% cá thử nghiệm vẫn khỏe mạnh. Ở nghiệm thức NT1, NT4 cá có các biểu hiện đặc trưng của bệnh gan thận mủ gây ra bởi E. ictaluri: mắt đỏ, xuất huyết ở mang và đuôi, giải phẫu gan thận có đốm trắng. Tiến hành phân lập và định danh từ mẫu gan, thận của cá chết cho thấy vi khuẩn trong gan, thận của cá là vi khuẩn E. ictaluri. Điều này chứng tỏ cá chết ở 2 nghiệm thức NT1 và NT4 là do vi khuẩn E. ictaluri gây ra. Từ ngày thứ 5 trở đi cá ở nghiệm thức NT4 (đối chứng dương) bắt đầu chết, từ ngày thứ 6 trở đi, cá ở nghiệm thức NT1 (B. subtilis Hình 2. Tỉ lệ sống của cá tra sau khi cảm nhiễm với E. ictaluri Ghi chú: NT1: cho cá ăn với thức ăn được bổ sung vi khuẩn B. subtilis Q16; NT2: cho cá ăn với thức ăn được bổ sung vi khuẩn B. subtilis Q111; NT3: cho cá ăn với thức ăn được bổ sung vi khuẩn B. subtilis (Q16 + Q111); NT4: đối chứng dương; NT5: đối chứng âm. IV. THẢO LUẬN Hai chủng B. subtilis (Q16, Q111) được thử nghiệm cho thấy chúng có tính an toàn và khả năng bảo vệ cá tra khỏi E. ictaluri gây bệnh gan thận mủ. Với phương pháp cấy vạch vuông góc, tại các vị trí giao nhau trên các đĩa thử nghiệm, chủng vi khuẩn gây bệnh E. ictaluri không mọc chứng tỏ chủng này mẫn cảm với chất kháng khuẩn do 2 chủng B. subtilis Q16 và Q111 tạo ra. Kết quả thử nghiệm bằng phương pháp giếng khuếch tán của chúng tôi phù hợp với nghiên cứu của Võ Minh Sơn và ctv., (2011), các chủng Bacillus spp. phân lập từ ao nuôi cá tra có hoạt tính kháng E. ictaluri với vòng kháng cao. VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 53 một số chủng Bacillus spp. phân lập từ ao nuôi cá tra. Tạp chí Khoa học và Công nghệ 51(3A), 1-16. Nguyễn Văn Minh (b), Nguyễn Thị Diệu Hiền, Nguyễn Thị Thúy, Võ Ngọc Yến Nhi, Dương Nhật Linh, 2013. Tối ưu hóa môi trường lên men thu sinh khối chủng vi khuẩn Bacillus subtilis Q16 bằng phương pháp bề mặt đáp ứng. Hội nghị Khoa học Công nghệ Quốc tế ISCE 2013. Nguyễn Đức Lượng, 2002. Công nghệ vi sinh – tập 2. NXB Đại học Quốc gia Tp. HCM, 372 trang. Nguyễn Đức Lượng, Phan Thị Huyền, Nguyễn Thị Ánh Tuyết, 2003. Thí nghiệm Công nghệ Sinh học – tập 2: Thí nghiệm vi sinh vật học. NXB Đại học Quốc gia Tp. HCM, 462 trang. Võ Minh Sơn, Văn Thị Thuý, Nguyễn Ngọc Tĩnh, 2011. Phân lập và đánh giá hoạt tính sinh học của hai chủng vi khuẩn Bacillus spp. có tiềm năng sử dụng là pzrobiotic trong phòng bệnh gan thận mủ trên cá tra (Pangasianodon hypophthalmus). Tạp chí nông nghiệp và phát triển nông thôn ISSNN 0866-7020, 144-152. Nguyễn Thị Thúy, Nguyễn Thị Diệu Hiền, Dương Nhật Linh, Nguyễn Văn Minh, 2013. Tối ưu hóa môi trường lên men thu sinh khối chủng vi khuẩn Bacillus subtilis Q111 bằng phương pháp đáp ứng bề mặt. Hội nghị CNSH Toàn quốc năm 2013, quyển 2, 578-581. Trần Linh Thước, 2010. Phương pháp phân tích vi sinh vật trong nước, thực phẩm và mỹ phẩm. NXB Giáo dục Việt Nam, 70 trang. Tài liệu tiếng Anh Amend, D.F., 1981. Potency testing of fish vaccines. Dev. Biol. Standard 49, 447-454. Capkin, E., Altinok, I., 2009. Effect of dietary probiotic supplementation on prevention/ treatment of yersiniosis disease. Journal of Applied Microbiology 106, 1147-1149. Chao, R., Abel, C., Malachi, A.W., Nancy, C., Bui, C.T.D., Joseph, C.N., Joseph, W.K., EiL, O., Craig, L.B., Jeffery, S.T., Mark, R.L., 2012. Identification of Bacillus strains for Từ thí nghiệm khả năng bảo vệ cá tra giống trong điều kiện gây nhiễm E. ictaluri, có thể nhận thấy rằng 100% cá ở nghiệm thức NT5 (đối chứng âm) sống và hoạt động bình thường nghĩa là các yếu tố môi trường không ảnh hưởng đến cá. Đồng thời, cá ở các nghiệm thức NT4 (đối chứng dương), NT1 (B. subtilis Q16) chết lần lượt 61,3 và 26,7 % là do nhiễm vi khuẩn E. ictaluri. Nghiệm thức NT2 (B. subtilis Q111) và NT3 (B. subtilis Q16 và Q111) 100% cá thử nghiệm vẫn khỏe mạnh cho thấy rằng hai chủng này có khả năng bảo vệ cá tra giống khỏi E. ictaluri gây bệnh gan thận mủ. Đặc biệt, bổ sung chủng B. subtilis Q111vào thức ăn riêng lẻ hay kết hợp với B. subtilis Q16 thì tỉ lệ sống của cá đạt 100%. Chao và ctv., (2012) cũng đã báo báo rằng khi bổ sung Bacillus vào thức ăn có khả năng kiểm soát E. ictaluri gây bệnh trên cá tra. V. KẾT LUẬN Với những kết quả thực nghiệm như đã trình bày ở trên, chúng tôi kết luận rằng 2 chủng B. subtilis (Q16 và Q111) vừa an toàn vừa có khả năng bảo vệ cá tra giống chống lại E. ictaluri gây bệnh gan thận mủ trên cá tra trong điều kiện thí nghiệm. Đây là những chủng có tiềm năng lớn để đưa vào ứng dụng làm probiotic sử dụng trong nuôi cá tra. TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Lại Thúy Hiền, Đỗ Bá Tú, Đỗ Thu Phương, Phạm Thị Hằng, Nguyễn Thị Yên, Vương Thị Nga, Võ Mai Hương, Phạm Ngọc Lan, Nguyễn Thu Thủy, Bùi Lê Thanh Nhàn, 2008. Nghiên cứu sản xuất chế phẩm sinh học Nitrobac ứng dụng trong xử lý nước nuôi tôm tại Thừa Thiên - Huế. Tạp chí Công nghệ Sinh học 62, 249-256. Nguyễn Văn Minh (a), Nguyễn Hoàng Tuấn Duy, Đỗ Phương Quỳnh, Võ Ngọc Yến Nhi, Dương Nhật Linh, Nguyễn Thị Ngọc Tĩnh, Lê Hồng Phước, 2013. Khả năng kiểm soát sinh học Edwardsiella ictaluri gây bệnh của VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 54 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 Holt, J.G., Krieg, N.R., Sneath, P.H.A., Staley, J.T., Williams, S.T., 1994. Bergey's Manual of Determinative Bacteriology 9th edition, Chapper V, 816 pages. Kwon, G.H., Lee, H.A., Park, J.Y., Kim, J.S., Lim, J., Park, C.S., Kwon, D.Y., Kim, Y.S., Kim, J.H., 2009. Development of a RAPD-PCR method for identification of Bacillus species isolated from Cheonggukjang. International Journal of Food Microbiology 129, 282-287. Newaj-Fyzul, A., Adesiyun, A.A., Mutani, A., Ramsubhag, A., Brunt, J., Austin, B., 2007. Bacillus subtilis AB1 control Aeromonas infection in rainbow trout (Oncohynchus mykiss, Walbaum). Journal of Applied Microbiology 103, 1-6. Purivirojkul, W., Areechon, N., 2007. Application of Bacillus spp. Isolated from the Intestine of BlackTiger Shrimp (Penaeus monodon Fabricius) from Natural Habitat for Control Pathogenic Bacteria in Aquaculture. Kasetsart J (Nat. Sci.) 41, 125-132. Reed, J.L., Muench, H., 1938. A simple method of estimating fifty percent Endpoints. The American journal of hygiene 27, 493-497. biological control of catfish pathogens. Plos one 7(9), 1-9. Chythanya, R., Karunasagar, I., 2002. Inhibition of shrimp pathogenic vibrios by a marine Pseudomonas I-2 strain. Aquaculture 208, 1-10. Crumlish, M., Dung, T.T., Turnbull, J.F., Ngoc, N.T.N., Ferguson, H.W., 2002. Indentification of E. ictaluri from diseased freshwater catfish, P. hypoththalmus (Sauvage), cultured in the Mekong Delta, Vietnam. Journal of Fish Diseases 25 (12), 733-736. Essa, A.M., El-Serafy, S.S., El-Ezabi M.M., Daboor, M.S., Esmael, A.N., Lall, P.S., 2010. Effect of different dietary probiotics on growth, feed utilization and digestive enzymes activities of Nile Tilapia, Oreochromis niloticus. Journal of the Arabian Aquaculture society 5(2), 143-161. Gerhardt, P., Murray, R.G.E., Costilow, R.N., Nester, E.W., Wood, W.A., Krieg, N.R., Phillips, G.B., 1981. Manual of methos for general bacteriology. American Society for Microbilogy. VIEÄN NGHIEÂN CÖÙU NUOÂI TROÀNG THUÛY SAÛN 2 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 6 - THAÙNG 8/2015 55 BIOCONTROL CAPABILITY OF Edwardsiella ictaluri IN TRA CATFISH FINGERLINGS (Pangasianodon hypophthalmus) BY Bacillus subtilis Q16 AND Bacillus subtilis Q111 UNDER EXPERIMENTAL INFECTION CONDITIONS Nguyen Van Minh1*, Do Phuong Quynh1, Vo Ngoc Yen Nhi1, Duong Nhat Linh1, Nguyen Thi Ngoc Tinh2, Le Hong Phuoc2 ABSTRACT Currently, Bacillary Necrosis of Pangassius (BNP) in Tra catfish (Pangasianodon hypophthalmus) caused by bacteria Edwardsiella ictaluri brings about detrimental losses to catfish farming. Many measures have been developed for prevention and treatment of BNP, among them biological control measure is being focused. In this study, two strains of Bacillus subtilis (Q16, Q111) have showed strong inhibition toward E. ictaluri using cross-streak and well-diffusion methods. At the same time, trials on safety and protection capability assessment were conducted on Tra catfish larvae challenged with E. ictaluri. The results indicated both strains (Q16 and Q111) are safe for Tra catfish and have a good protection ability toward the host with RPS of 56.44% for B. subtilis Q16, of 100% for B. subtilis Q111 and 100% for B. subtilis (Q16 + Q111). These results show that these two strains of B. subtilis, that were isolated from Tra catfish ponds, can be potential probiotic strains that can be used in disease prevention for farmed Tra catfish. Keywords: Biocontrol, Bacillus subtilis Q16, Bacillus subtilis Q111, Bacillary Necrosis Pangasius (BNP), Edwardsiella ictaluri. Người phản biện: ThS. Nguyễn Thị Hiền Ngày nhận bài: 29/5/2015 Ngày thông qua phản biện: 03/8/2015 Ngày duyệt đăng: 07/8/2015 1Falcuty of Biotechnology, Open University, HCMC *Email: nguyenminhou@gmail.com 2Research Institute of Aquaculture No.2
File đính kèm:
 kha_nang_kiem_soat_sinh_hoc_edwardsiella_ictaluri_cua_hai_ch.pdf
kha_nang_kiem_soat_sinh_hoc_edwardsiella_ictaluri_cua_hai_ch.pdf

