Hiệu quả phòng bệnh hoại tử gan tụy cấp trên tôm thẻ (Penaeus vannamei) của cao chiết khổ sâm (Croton tonkinensis) ở quy mô trang trại
TÓM TẮT
Các chế phẩm thảo dược có vai trò quan trọng trong kiểm soát dịch bệnh vì chúng có chứa các thành
phần hoạt tính bao gồm chất chống oxy hoá, chống vi khuẩn, chống stress, kích thích tăng trưởng,
kích thích sự thèm ăn và tăng cường miễn dịch ở cá và tôm. Các tính chất này liên quan đến các hợp
chất trong thực vật như alkaloids, flavonoid, polyphenol, terpenoid, và steroid. Dịch chiết từ cây
khổ sâm (Croton tonkinensis) được cho là có chứa các lớp chất chủ yếu là các hợp chất hữu cơ như
là flavonoid, alkaloid, polyphenol. Trong hầu hết các trường hợp, các hoạt chất như là polyphenol,
polysaccharides, proteoglycans và flavonoids đóng một vai trò chính trong việc ngăn ngừa hoặc
kiểm soát các vi khuẩn lây nhiễm. Mục tiêu của nghiên cứu này là đánh giá hiệu quả ứng dụng của
cao chiết khổ sâm trong việc phòng bệnh hoại tử gan tuỵ cấp - AHPND trên tôm nuôi ở quy mô
trang trại. Thí nghiệm phòng bệnh trên 4 ao nuôi ở Bạc Liêu (tổng diện tích nuôi là 1 ha) và 6 ao
nuôi ở Sóc Trăng (tổng diện tích nuôi là 0,9 ha) với liều trộn vào thức ăn là 20 g/kg thức ăn/ngày
và tôm được cho ăn liên tục suốt tuần, bao gồm các tuần 3, 5, 7 và 9 sau khi thả nuôi. Kết quả thử
nghiệm ở thử nghiệm ở Sóc Trăng, tất cả 5 ao nuôi thử nghiệm và 1 ao nuôi đối chứng đều thành
công, với năng suất thu hoạch từ 9,8-12,5 tấn/ha và tỷ lệ sống từ 80,6-88,4%. Do bệnh không xảy
ra trong vụ nuôi nên chưa có cơ sở để đánh giá hiệu quả ứng dụng khổ sâm ở Sóc Trăng. Đối với
thử nghiệm ở Bạc Liêu cho thấy các ao nuôi thử nghiệm đã được ứng dụng thành công, hiệu quả
phòng bệnh đạt 100% ở 3 ao nuôi thử nghiệm sử dụng khổ sâm, với năng suất thu hoạch từ 9,5-11
tấn/ha và tỷ lệ sống khá cao từ 89,4-91,3%. Trong khi ở ao nuôi đối chứng, tôm bị bệnh AHPND
sau 28 ngày thả nuôi. Từ các kết quả trên, nghiên cứu này kết luận cao chiết khổ sâm có khả năng
phòng AHPND ở tôm thẻ chân trắng ở quy mô trang trại với liều 2% (20 g/kg) trộn vào thức ăn, với
phương cách cho tôm ăn liên tục và cách tuần.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5
Trang 6

Trang 7

Trang 8
Trang 9
Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Hiệu quả phòng bệnh hoại tử gan tụy cấp trên tôm thẻ (Penaeus vannamei) của cao chiết khổ sâm (Croton tonkinensis) ở quy mô trang trại

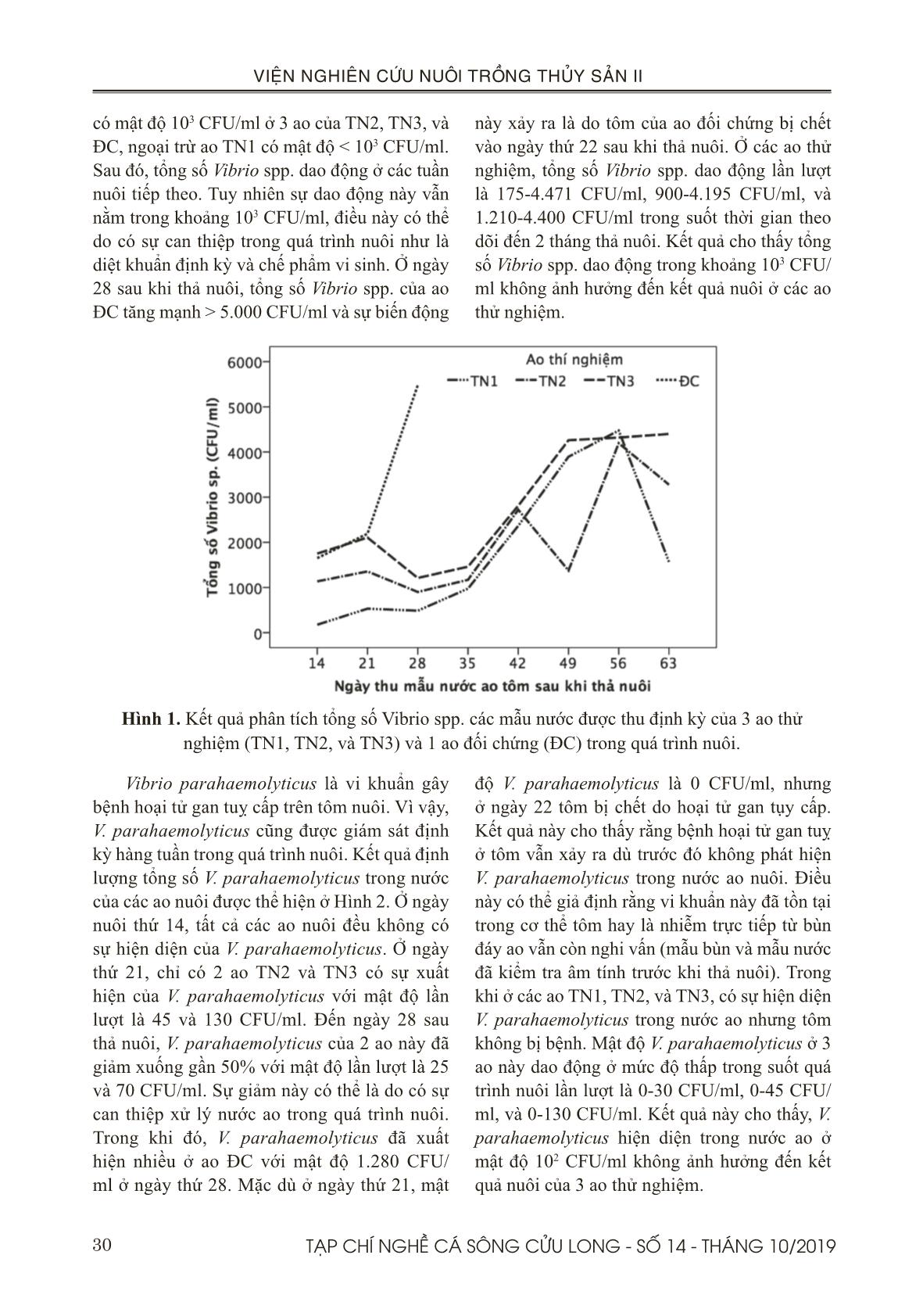
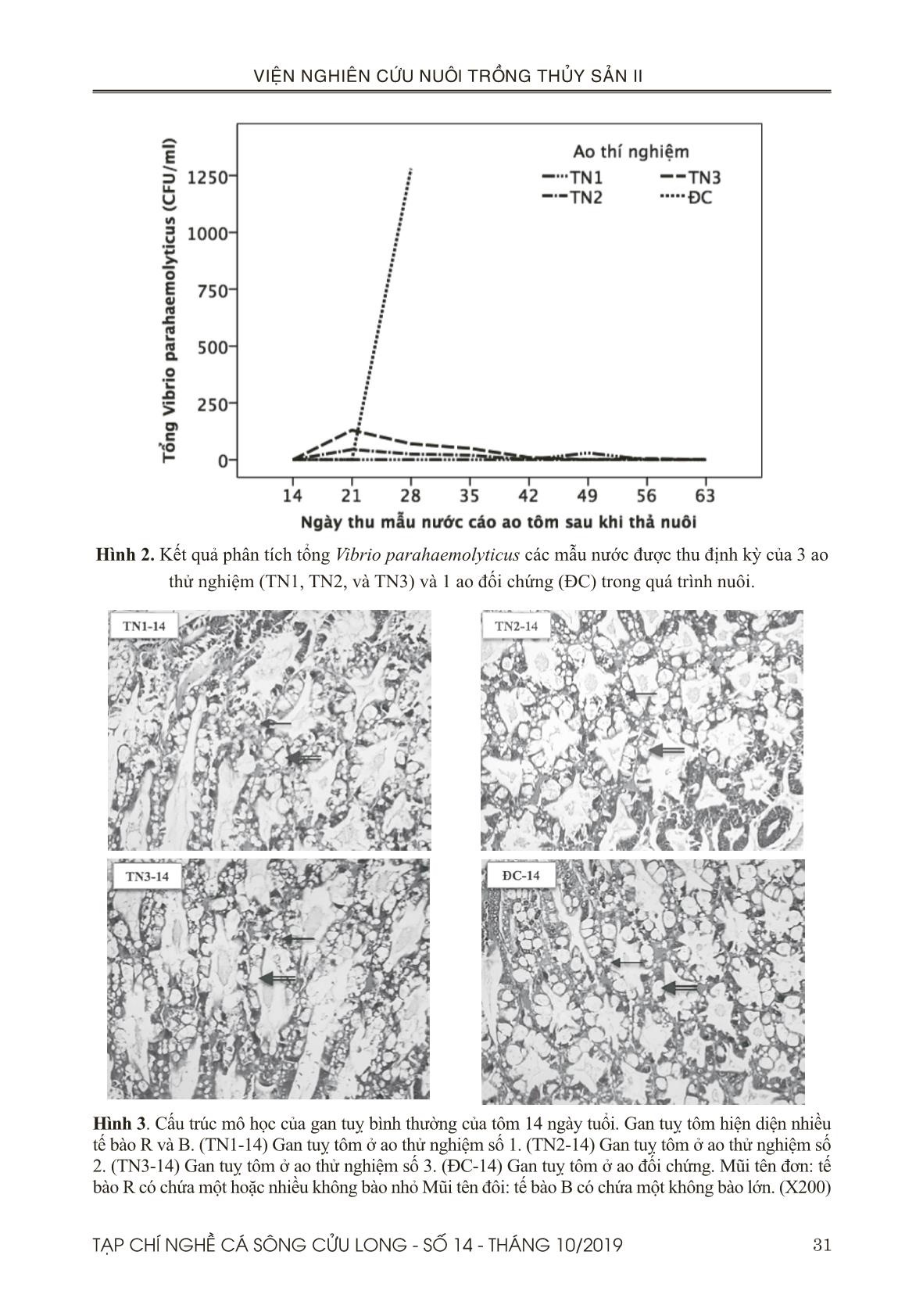
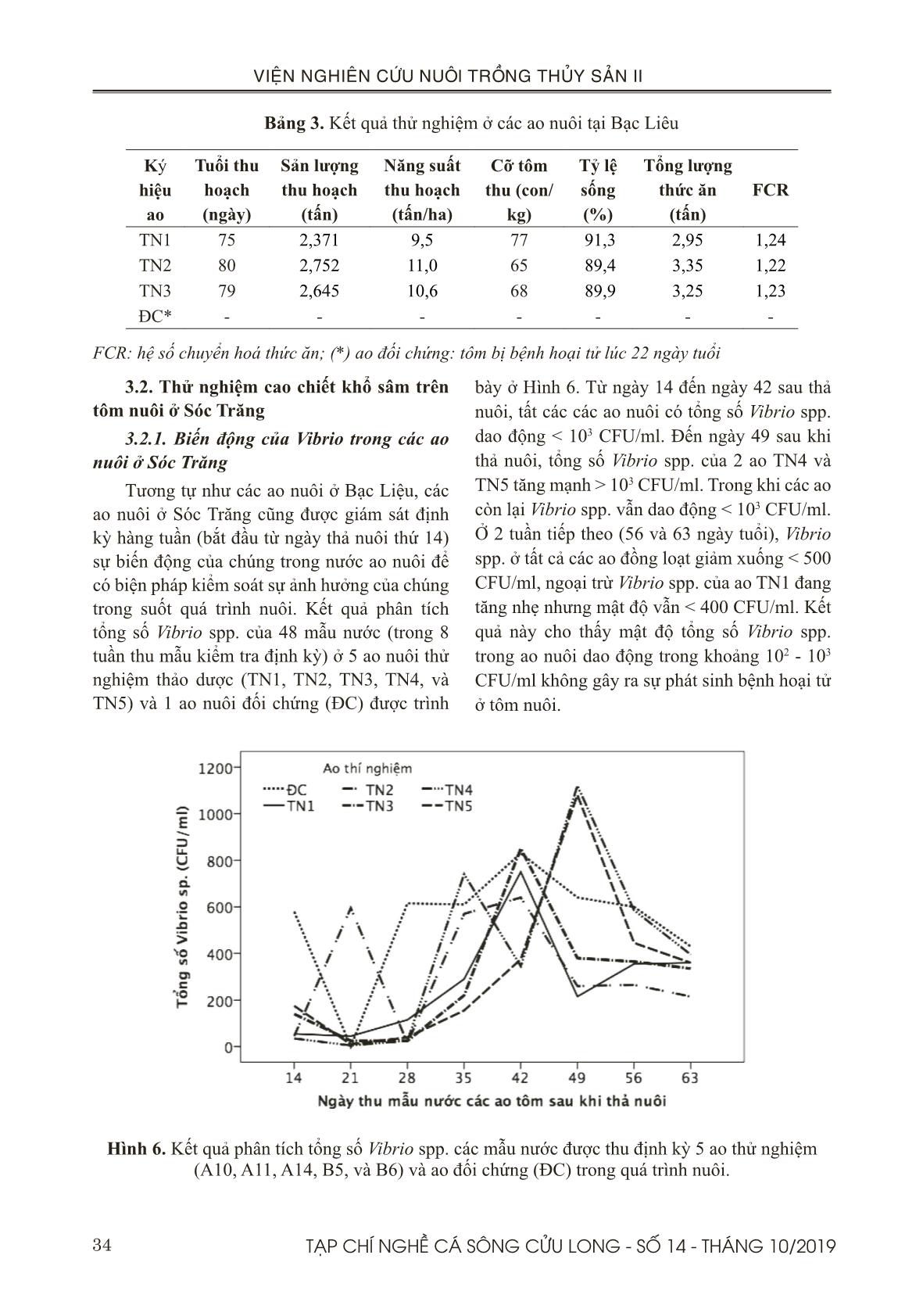
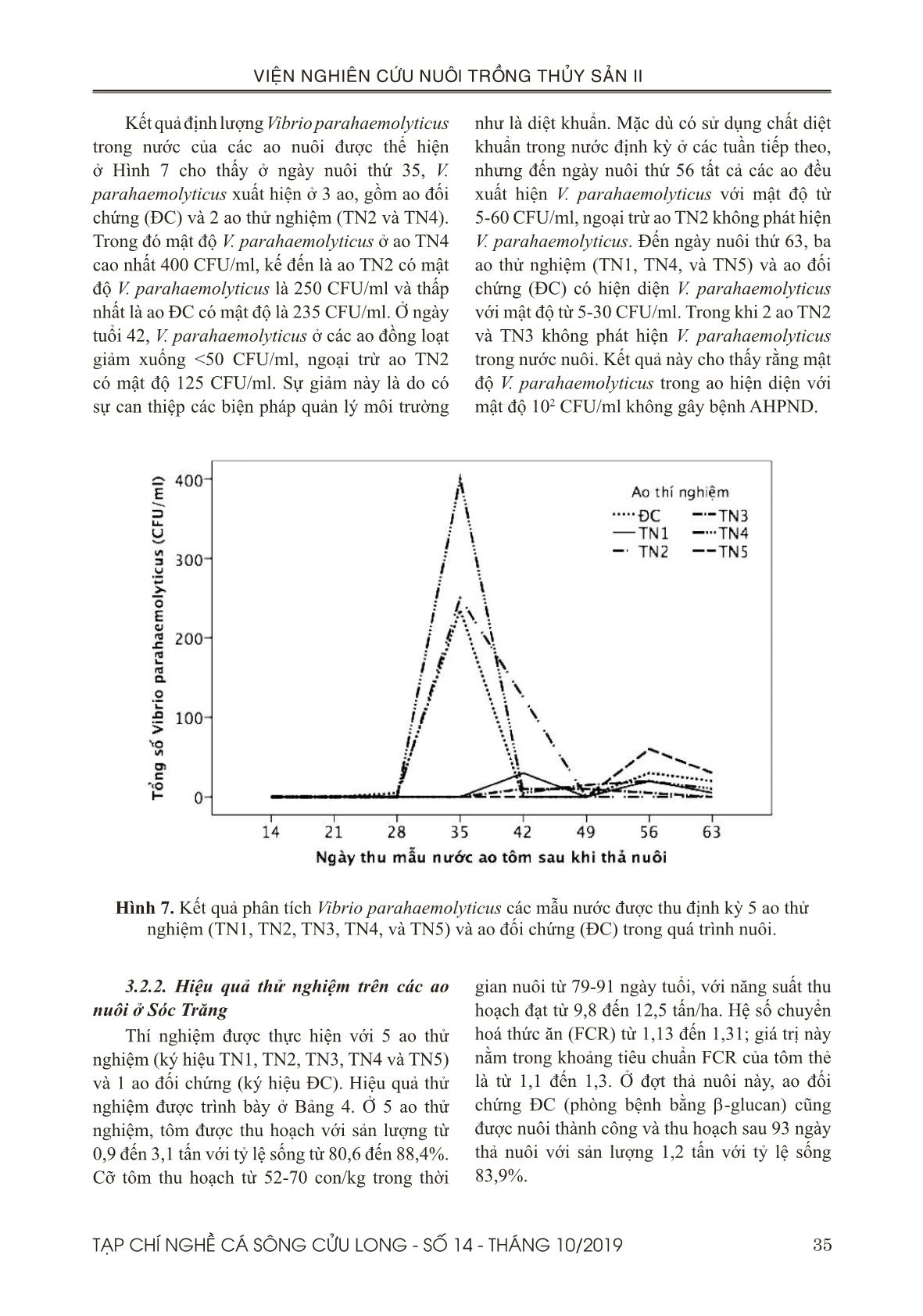
t 100% sau 6 ngày. Theo báo cáo 9 tháng đầu năm 2018 của Chi Cục Thú Y tỉnh Bạc Liêu, diện tích thiệt hại lũy kế là 3.314 ha chiếm 47,1%, trong đó diện tích thiệt hại >70% là 2.902 ha chiếm 41,3% (tôm sú thâm canh và bán thâm canh 1.787 ha chiếm 25,4%; tôm chân trắng thâm canh 1.021 ha chiếm 14,5%). Ở 3 ao thử nghiệm, năng suất thu hoạch từ 9,5-11 tấn/ ha. Cỡ tôm thu hoạch từ 65-77 con/kg sau thời gian nuôi 75-80 ngày với tỷ lệ sống khá cao từ 89,4-91,3%. Hệ số chuyển hoá thức ăn (FCR) từ 1,22-1,24; giá trị này nằm trong khoảng tiêu chuẩn FCR của tôm thẻ là từ 1,1-1,3. Điều này cho thấy cao chiết khổ sâm có hiệu quả trong phòng bệnh AHPND khi được thử nghiệm với diện tích 1 ha ở Bạc Liêu. Đối với thử nghiệm 0,9 ha ở Sóc Trăng, 5 ao thử nghiệm đạt năng suất thu hoạch từ 9,8-12,5 tấn/ha. Cỡ tôm thu hoạch từ 52-70 con/kg trong thời gian nuôi từ 79-91 ngày tuổi, với tỷ lệ sống từ 80,6-88,4%. Hệ số chuyển hoá thức ăn (FCR) từ 1,13-1,31; giá trị này nằm trong khoảng tiêu chuẩn FCR của tôm thẻ là từ 1,1-1,3. Theo báo cáo của Chi Cục Thú Y tỉnh Sóc Trăng, vụ nuôi tôm nước lợ được thả nuôi từ giữa tháng 1 và kết thúc vào cuối tháng 9 năm 2018, tổng diện tích thả nuôi 54.738 ha. Tổng diện tích nuôi tôm bị thiệt hại 11.569 ha, chiếm 21,1%; trong đó, thị xã Vĩnh Châu là nơi có diện tích thiệt hại lớn nhất. Điều này cho thấy các ao thử nghiệm ở Thị xã Vĩnh Châu, tỉnh Sóc Trăng không bị thiệt hại trong thời điểm xảy ra dịch bệnh. Việc thử nghiệm phòng trị bệnh trên tôm nuôi ở Sóc Trăng chưa thể khẳng định được tính hiệu quả của cao chiết khổ sâm. Bởi vì, tất cả 5 ao nuôi thử nghiệm và 1 ao đối chứng được nuôi ở Trung tâm Tập huấn và Chuyển giao Công nghệ Nông nghiệp vùng Đồng bằng sông Cửu Long, ở thị xã Vĩnh Châu, Tỉnh Sóc Trăng đều thành công. Điều này có thể 38 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 14 - THÁNG 10/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II giải thích rằng quy trình quản lý và kỹ thuật nuôi tốt nên không bị lây nhiễm mầm bệnh. Ngoài ra, trang trại ở vị trí độc lập và cách ly với các nông hộ nuôi xung quanh nên không bị thiệt hại trong thời điểm xảy ra dịch bệnh tại địa phương. Một lý do khác nhưng không kém phần quan trọng, các ao nuôi thí nghiệm vừa được cải tạo lại sau thời gian bỏ hoang nên việc ngăn chặn nhiễm mầm bệnh có thể được kiểm soát tốt hơn. V. KẾT LUẬN Bước đầu ứng dụng cao chiết khổ sâm ở quy mô trang trại đã được thử nghiệm hiệu quả và thành công. Năng suất thu hoạch từ 9,8-12,5 tấn/ha (ở Sóc Trăng) và 9,5-11 tấn/ ha (ở Bạc Liêu). Vì vậy, nghiên cứu này kết luận cao chiết khổ sâm có khả năng phòng bệnh hoại tử gan tuỵ cấp trong suốt quá trình nuôi với liều trộn vào thức ăn là 20 g/kg thức ăn, bằng phương pháp cho tôm ăn liên tục và cách tuần cho đến khi tôm được 60 ngày tuổi. LỜI CẢM ƠN Đề tài này được thực hiện từ kinh phí của hợp đồng đề tài nhánh số 02/HĐ-TS với Viện Hoá học và các Hợp chất thiên nhiên. TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Đỗ Tất Lợi, 2004. Những cây thuốc và vị thuốc Việt Nam. Nhà xuất bản Y học. Trương Hồng Việt, Đỗ Thị Cẩm Hồng, Vũ Thiên Ân, Trần Bảo Ngọc, Nguyễn Trần Gia Bảo, Trần Minh Trung, 2017. Hiệu quả các dịch chiết khổ sâm (Croton tonkinensis) và đơn châu chấu (Aralia armata ) trong phòng trị bệnh hoại tử gan tụy cấp trên tôm thẻ chân trắng (Penaeus vannamei) ở điều kiện phòng thí nghiệm. Tạp chí Nghề cá sông Cửu Long. số 10 - Tháng 12/2017. Trang 23-41. Võ Văn Chí, 1997. Từ điển cây thuốc Việt Nam. Nhà xuất bản Y dược: Thành phố Hồ Chí Minh. Trang 622-623. Tài liệu tiếng Anh Al-Mohann, S.Y. and Nott, J.A., 1986. B-cells and digestion in the hepatopancreas of Penaeussemisulcatus (Crustacea, Decapoda). J. Mar. Biol. Assoc. U. K, 66, 403–414. Bell, T.A. and Lightner, D.V., 1988. “A Handbook of Normal Penaeid Shrimp Histology. World Aquaculture Society, Baton Rouge, LA. Bhavan, P.S. and Geraldine, P., 2000. Histopathology of the hepatopancreas and gills of the prawn Macrobrachium malcolmsonii exposed to endosulfan. Aquat. Toxicol, 50, 331–339. Boonsri, N., Rudtanatip, T., Withyachumnarnkul, B., and Wongprasert, K., 2016. Protein extract from red seaweed Gracilaria fisheri prevents acute hepatopancreatic necrosis disease (AHPND) infection in shrimp.J Appl Phycol. DOI 10.1007/ s10811-016-0969-2. Caceci, T., Neck, K.F., Lewis, D.H., and Sis, R.F., 1988. Ultrastructure of the hepatopancreas of the Pacific white. shrimp, Penaeus vannamei (Crustacea: Decapoda). J. Mar. Biol. Assoc, U. K. 68, 323–327. Chaweepack, T., Muenthaisong, B., Chaweepack, S., and Kamei, K., 2015a. The Potential of Galangal (Alpinia galanga Linn.) Extract against the Pathogens that Cause White Feces Syndrome and Acute Hepatopancreatic Necrosis Disease (AHPND) in Pacific White Shrimp (Litopenaeus vannamei). International Journal of Biology; Vol.7, No.3. Chaweepack, T., Chaweepack, S., Muenthaisong, B., Ruangpan, L., Nagata, K., and Kamei, K., 2015b. Effect of galangal (Alpinia galanga Linn.) extract on the expression of immune-related genes and Vibrio harveyi resistance in Pacific white shrimp (Litopenaeus vannamei). Aquacult Int., 23(1), 385-399. Citarasu T, Babu, M.M., Punitha, S.M.J., Venketramalingam, K. and Marian, M.P., 2001. Control of pathogenic bacteria using herbal biomedicinal products in the larviculture system of Penaeus monodon. International Conference on Advanced Technologies in Fisheries and Marine Sciences, MS University, India. Citarasu, T., Venkatramalingam, K., , Micheal babu, M., , Raja jeya sekar, R. & Petermarian, M., 2003. Influence of the antibacterial herbs, Solanum trilobatum, Andrographis paniculata and Psoralea corylifolia on the survival, growth and bacterial load of Penaeus monodon post larvae. Aquaculture International 11: 583–595. Citarasu, T., 2010. Herbal biomedicines: a new 39TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 14 - THÁNG 10/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II opportunity for aquaculture industry. Aquaculture International, 18, 403-414. De Schryver, P., Defoirdt, T., and Sorgeloos, P., 2014. Early mortality syndrome outbreaks: a microbial management issue in shrimp farming? PLoS Pathog. 10: e1003919. Ding, Y., Ding, C., Ye, N., Liu, Z., Wold, EA., Chen, H., Wild, C., Shen, Q., and Zhou, J., 2016. Discovery and development of natural product oridonin-inspired anticancer agents. Eur J Med Chem 122:102–117. Gibson, R. and Barker, P. L., 1979. The decapod hepatopancreas. Oceanography and Marine Biology, 17: 285-346. Joshi, J., Srisala, J., Truong, V. H., Chen, I.- T., Nuangsaeng, B., Suthienkul, O., Thitamadee, S., 2014. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture, 428-429, 297–302. Latha, C., Shriram, V. D., Jahagirdar, S. S., Dhakephalkar P. K., and Rojatkar, S. R., 2009. Antiplasmid activity of 1’-acetoxychavicol acetate from Alpinia galanga against multi-drug resistant bacteria. Ethnopharmacology, 123, 522-525. Lee, J-Y. and Gao, Y., 2012. Review of the application of garlic, Allium sativum in aquaculture. World Aquaculture Society. P447-458. V43 (4). Li, E., Chen, L., Zeng, C., Yu, N., Xiong, Z., Chen, X., and Qin, J.G., 2008. Comparison of digestive and antioxidant enzymes activities, haemolymph oxyhemocyanin contents and hepatopancreas histology of white shrimp, Litopenaeusvannamei, at various salinities. Aquaculture 274 (2008) 80–86. Lin, LG., Ung, CO., Feng, ZL., Huang, L., and Hu, H., 2016. Naturally occurring diterpenoid dimers: source. biosynthesis. chemistry and bioactivities. Planta Med 82:1309–1328. Lightner, D.V., Hasson, K.W., White, B.L., and Redman, R.M., 1996. Chronic toxicity and histopathological studies with Benlate, a commercial grade of benomyl, in Penaeus vannamei (Crustacea: Decapoda). Aquat. Toxicol, 34, 105–118. Loizzi, R. F., 1971. Interpretation of crayfish hepatopancreatic function based on fine structural analysis of epithelial cell lines and muscle network. Zeitschrift fuer Zellforschung und mikroscopische Anatomic, 113: 420-440. Lyon, R. and Simkiss, K., 1984. The ultrastructure and metal-containing inclusions of mature cell types in the hepatopancreas of a crayfish. Tissue and Cell, Volume 16, issue 5. Page 805 - 817. Available online 2005. Madhuri, S., Mandloi, A. K., Govind, P. and Sahni, Y.P., 2012. Antimicrobial activity of some medicinal plants against fish pathogens. IRJP, 3 (4). ISSN. 2230-8407. Mooney, A., 2012. An emerging shrimp disease in Vietnam, microsporidiosis or liver disease? Available at: http:// aquatichealth.net/ issues/38607 (accessed 24 Feb 2012). NACA, 2012. Final Report Asia Pacific Emergency regional Consultation on the Emerging Shrimp Disease: Early Mortality Syndrome (EMS)/ Acute Hepatopancreatic Necrosis syndrome (AHPNS). Network of Aquaculture Centres in Asia-Pacific. Newman, DJ. and Cragg, G.M.. 2016. Natural products as sources of new drugs from 1981 to 2014. J Nat Prod 79:629–661. Oonmetta-aree, J., Suzuki, T., Gasaluck, P., và Eumkeb., G., 2006. Antimicrobial and action of galangal (Alpinia galanga Linn.) on Staphylococus aureus. Food Science and Technology., 39, 959-965. Rodrigues, T., Reker, D., Schneider, P., and Schneider, G., 2016. Counting on natural products for drug design. Nat Chem 8:531–541. Syahidah, A., 2014. Status and potential of herbal applications in aquaculture. Iranian Journal of Fisheries Sciences, 14, 27-44. Tachakittirungrod, S., and Chowwanapoonpohn, S., 2007. Comparison of Antioxidant and Antimicrobial activities of Essential Oils from Hyptis suaveolens and Alpinia galangal Growing in Northern Thailand, CMU, J Nat Sci., 6, 31-42. Thitamadee, S., Prachumwat, A., Srisala, J., Jaroenlak, P., Salachan, P.V., and Sritunyalucksana, K., 2016. Review of current disease threats for cultivated Penaeid shrimp in Asia. Aquaculture.; 452: 69–87. doi: 10.1016/j. aquaculture.2015.10.028. Tran, L., Nunan, L., Redman, R.M., Mohney, L.L., Pantoja, C.R., Fitzsimmons, K., and Lightner, 40 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 14 - THÁNG 10/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II D.V., 2013. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Dis Aquat Org 105:45−55 Turker, A., and Usta, C., 2002. Biological activity of some medicinal plants sold in Turkish Health- food stores. Biodiversity Ecosyst., 34(19), 105- 113. Venketramalingam, K., Christopher, J. G., and Citarasu, T., 2007. Zingiber officinalis an herbal appetizer in the tiger shrimp Penaeus monodon (Fabricius) larviculture. Aquac Nutr, 13(6): 439–443. Vogt, G., 1993. Differentiation of B-cells in the hepatopancreas of the prawn Penaeus monodon. Acta Zool, 74: 51-60. Vuddhakul, V., Bhoopong, P., Hayeebilan, F., and Subhadhirasakul, S., 2007. Inhibitory activity of Thai condiments on pandemic strain of Vibrio parahaemolyticus. Food Microbiology, 24, 413- 418. Wang, L., Li, D., Wang, C., Zhang, Y., and Xu, J., 2011. Recent progress in the development of natural ent-kaurane diterpenoids with anti-tumor activity. Mini Rev Med Chem 11:910–919. Yin, G., Ardo, L., Jeney, Z., Xu, P., and Jeney, G., 2008. Chinese herbs (Lonicera japonica and Ganoderma lucidum) enhance non-specific immune response of tilapia, Oreochromis niloticus and protection against Aeromonas hydrophila. In: Diseases in Asian Aquaculture VI, Fish Health Section. Asian FisheriesSociety, Manila, Philippines, 269-282. Zhang, Y., Liu, J., Jia, W., Zhao, AH., and Li, T., 2005. Distinct immunosuppressive effect by Isodon serra extracts. Int Immunopharmacol 5:1957–19. 41TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 14 - THÁNG 10/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II 1 Research Institute for Aquaculture No.2. 2 International University, Vietnam Naional University, HCMC. 3 Training Center & Agricultural technology transfer, Mekong Deta, Vietnam. 4 Shrimp farm, Kim Hawaii Group. * Email: truonghongviet@yahoo.com PROTECTION EFFECT OF ACUTE HEPATOPANCREATIC NECROSIS DISEASE IN WHITE-LEG SHRIMP (Penaeus vannamei) OF Croton tonkinensis EXTRACT ON THE FARM SCALE Truong Hong Viet1 *, Do Thi Cam Hong1, Tran Bui Truc Quan2, Vu Thien An1, Nguyen Cong Thanh3, Thai Thanh Trung3, Pham Ba Vu Tung4 ABSTRACT Herbal preparations have an important role in disease control because they contain active ingredients including antioxidants, anti-bacteria, anti-stress, stimulating growth, stimulating appetite, and enhance immunity in fish and shrimp. These properties relate to plant compounds such as alkaloids, flavonoids, polyphenols, terpenoids, and steroids. The Croton tonkinensis extract is thought to contain mainly organic compounds such as flavonoids, alkaloids, polyphenols... Almost cases, bioactive substances such as polyphenols, polysaccharides, proteoglycans and flavonoids play a major role in preventing or controlling bacterial infectious disease. The objective of this study is to evaluate the application effect of Croton extract in preventing AHPND on whiteleg shrimp under the farm scale. Trials for AHPND prevention on 4 ponds in Bac Lieu province (culture area as 1 ha) and 6 ponds in Soc Trang province (culture area as 0.9 ha) with dose mixed with feed is 20 g/kg feed per day, and shrimp are continuously fed throughout the week, including weeks of 3, 5, 7 and 9 after stocking. Experimental results in the Soc Trang trial, all 5 experimental ponds and 1 control ponds were successful, with a yield of 9.8-12.5 tons/ha and a survival rate of 80.6-88.4%. Because AHPND does not occur in the crop, there is no basis to evaluate the effectiveness of Croton extract application. For the trial in Bac Lieu, the experimental ponds have been successfully applied, the prevention effect reached 100% in the three experimental ponds using Croton extract, with a yield of 9.5-11 tons/ha and a high survival rate of 89.4-91.3%. While in the control ponds, shrimp were infected with AHPND after 28 days of culturing. From the above results, this research conclude that Croton tonkinensis extract is capable of preventing AHPND in cultured whiteleg shrimp with a feeding dose of 2% (20 g/kg) mixed with shrimp feed, with a weekly interval feeding method. Keywords: AHPND, extract, croton tonkinensis, plant compound, white leg shrimp. Người phản biện: TS. Lê Hồng Phước Ngày nhận bài: 27/5/2019 Ngày thông qua phản biện: 25/6/2019 Ngày duyệt đăng: 31/10/2019 Người phản biện: TS. Ngô Huỳnh Phương Thảo Ngày nhận bài: 08/10/2019 Ngày thông qua phản biện: 28/10/2019 Ngày duyệt đăng: 31/10/2019
File đính kèm:
 hieu_qua_phong_benh_hoai_tu_gan_tuy_cap_tren_tom_the_penaeus.pdf
hieu_qua_phong_benh_hoai_tu_gan_tuy_cap_tren_tom_the_penaeus.pdf

