Ảnh hưởng của acid béo không no Astaxanthin trong thức ăn lên sự sinh trưởng và tỷ lệ sống của tôm hùm bông (Panulirus ornatus) giai đoạn puerulus đến con giống đen <1,5g
Tóm tắt
Một thử nghiệm trong 6 tuần đã được tiến hành với tôm hùm (Panulirus ornatus) giai
đoạn puerulus giống trắng có trọng lượng trung bình (0,027g ÷ 0,029g), để đánh giá sự cần
thiết phải bổ sung astaxanthin (Carophyll Pink 10%) trong khẩu phần ăn cho tôm hùm được
nuôi trong hệ thống ngoài trời với thức ăn tự chế biến. Các chế độ ăn được xây dựng với mức
protein là 55 ÷ 60%. Ba mức của astaxanthin bổ sung (60mg.kg-1, 70mg.kg-1, 80mg.kg-1), Kết
quả nghiên cứu cho thấy tỷ lệ sống ở các nghiệm thức đều >73%; với chế độ ăn có chứa
80mg.kg-1 astaxanthin, tôm hùm có sức tăng trưởng (1,19 ± 0,024)(g), thấp nhất ở thức ăn bổ
sung 60mg.kg-1 tương ứng (1,07± 0,031); cao nhất ở nghiệm thức 70mg.kg-1 tương ứng (1,21 ±
0,021)(g). Tuy nhiên, thống kê (One-way ANOVA) cho thấy không có sự khác biệt về tăng
trưởng và tỷ lệ sống giữa các lô thí nghiệm (P ≥ 0.05) khi cho tôm ăn thức ăn có chứa các mức
độ khác nhau của astaxanthin.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6

Trang 7
Tóm tắt nội dung tài liệu: Ảnh hưởng của acid béo không no Astaxanthin trong thức ăn lên sự sinh trưởng và tỷ lệ sống của tôm hùm bông (Panulirus ornatus) giai đoạn puerulus đến con giống đen <1,5g

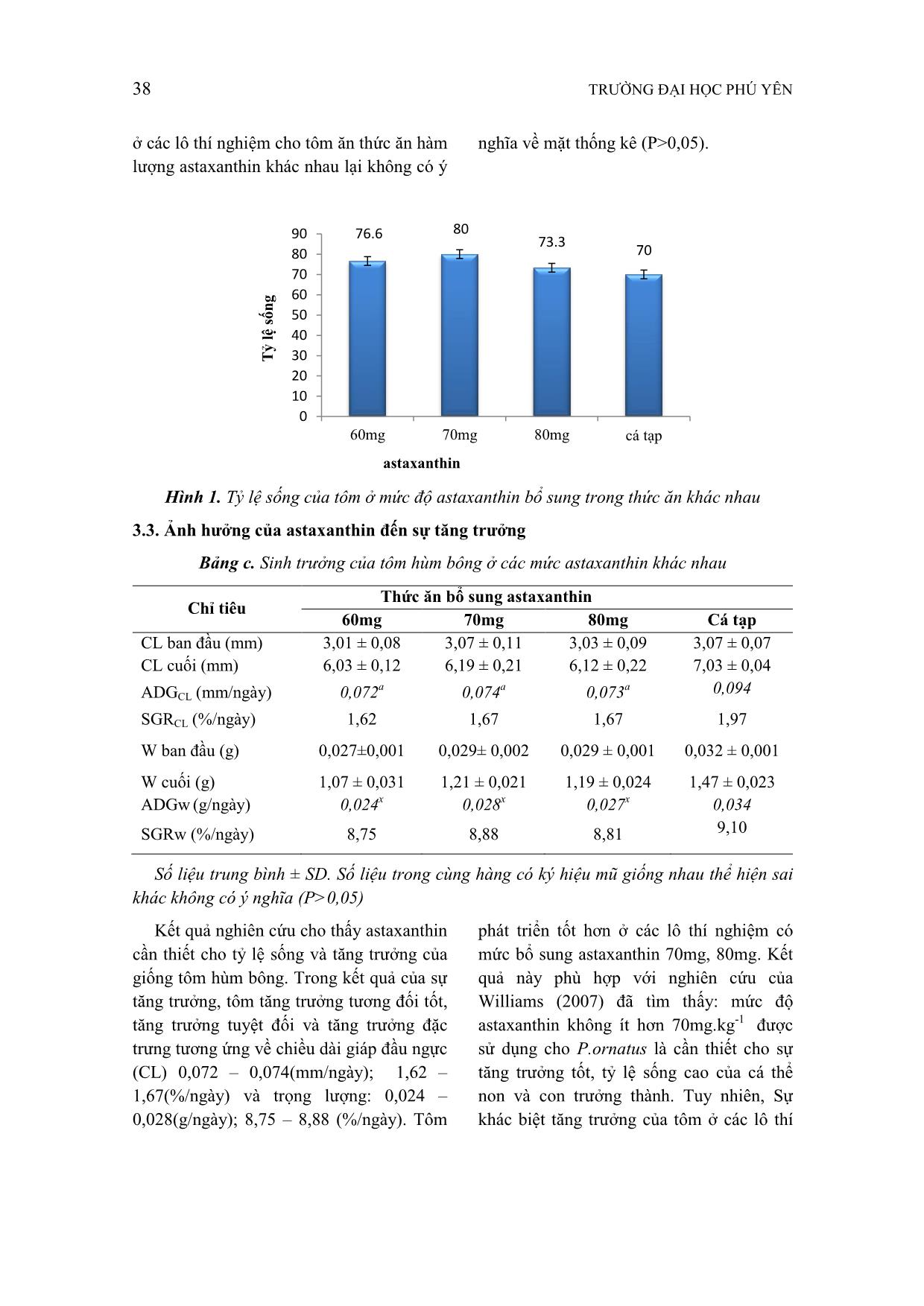
thể. Hơn nữa, việc nuôi tôm bằng thức ăn cá tạp dễ phát tán ra môi trường xung quanh và bồi lắng đáy biển nhất là những nơi có tốc độ dòng chảy thấp hoặc mật độ nuôi dày vượt quá khả năng chịu đựng của môi trường, điều này làm cho hệ sinh thái biển bị thay đổi nghiêm trọng, tăng nguy cơ dịch bệnh dẫn đến tỷ lệ sống của đối tượng nuôi thấp. Astaxanthin đã được chứng minh có ___________________________ * ThS, Trường Đại học Phú Yên chức năng trong hỗ trợ phát triển hậu ấu trùng (Dall, 1995), tăng khả năng chịu đựng stress (Meyers and Latscha 1997; Linan – Cabello et al. 2002; Chien et al. 2003), đồng thời được đề nghị là yếu tố cần thiết bổ sung cho phát triển giai đoạn nhỏ của P.semisulcatus (Dall, 1995). Những nghiên cứu nhằm xác định nhu cầu thực astaxanthin trên tôm hùm cũng đã được tiến hành (Barclay et al. 2006; Simon et al. 2005). Sự tăng trưởng chậm, tỷ lệ sống thấp của tôm hùm P.ornatus ăn Pcanaliculus trong thí nghiệm của Smith (2005) đã thúc đẩy những nghiên cứu xa hơn để kiểm tra nhu cầu astaxanthin của loài này. Nghiên cứu của Barclay et al. (2006) khi cho P.ornatus ăn thức ăn có hàm lượng carotenoid dao động từ 30 đến 120 mg/kg và hai loại thân mềm P.canaliculus và M.edulus. Thí nghiệm đã không chỉ ra được phản ứng ảnh hưởng của astaxanthin trong TẠP CHÍ KHOA HỌC SỐ 14 * 2017 35 thức ăn lên tốc độ sinh trưởng và tỷ lệ sống của tôm hùm bông. Theo Kristiansen et al. (2004); Tlusty & Hyland (2005), yêu cầu hàm lượng astaxanthin để thúc đẩy sự tăng trưởng, cần thiết để duy trì màu sắc của tôm hùm tương tự như con trưởng thành trong tự nhiên khoảng 50 mg astaxanthin/kg trong khẩu phần thức ăn (Crear et al. 2002; Barclay et al. 2006). Mặc dù đã có một số nghiên cứu về nhu cầu hàm lượng astaxanthin ở tôm biển nhưng vẫn còn hạn chế. Nhu cầu astaxanthin cụ thể cho từng giai đoạn khác nhau vẫn chưa được rõ ràng. Đây vẫn là câu hỏi được đặt ra nhằm hoàn thiện những mảnh ghép về dinh dưỡng cần thiết cho ấu trùng tôm biển, đặc biệt là tôm hùm. Trong bài báo này, nghiên cứu được thực hiện sự bổ sung hàm lượng astaxanthin khác nhau nhằm ảnh hưởng tích cực lên tăng trưởng và tỷ lệ sống của tôm hùm P.ornatus. 2. Phương pháp và vật liệu nghiên cứu 2.1. Đối tượng - Đối tượng: Panulirus ornatus (Tôm hùm bông; Tôm hùm sao) 2.2. Phương pháp nghiên cứu - Tôm giống được mua từ các vựa giống tại tỉnh Phú Yên với cỡ giống : 3 - 4 (mmCL); được phân ngẫu nhiên các lồng thử nghiệm với 10 con giống/mỗi lồng. Mỗi nghiệm thức được lặp lại 4 lần. - Kích thước lồng thí nghiệm (1mL x 0,5mR) - Một lồng bổ sung (1mLx 1mW x 1mH) nuôi 30 tôm hùm được cho ăn cá tạp. Lồng này không thống kê, chỉ xem xét để so sánh hiệu suất của tôm hùm ăn các khẩu phần thí nghiệm . - Thức ăn sử dụng trong nuôi thí nghiệm được xây dựng dựa trên nhu cầu protein cao (55 - 60%) và lipit thấp(8,5 - 10%). - Tất cả các yếu tố khác đều đồng nhất ở các lô thí nghiệm. Nguyên liệu làm thức ăn: Nguyên liệu cân theo đúng tỷ lệ. Hỗn hợp nguyên liệu này bỏ vào máy xay nhuyễn và hấp cách thủy ở nhiệt độ 100oC. Sau khi hấp hỗn hợp thức ăn được để nguội và bổ sung thêm Vitamin. Bảng a. Thành phần nguyên liệu và dinh dưỡng thức ăn thí nghiệm NFE = nitrogen-free extract Thành phần thức ăn Astaxanthin (mg.kg-1) 60 70 80 Cá tạp Thịt cua 40 40 40 Thịt ghẹ 40 40 40 Tôm 15 15 15 Dầu mực 2,0 2,0 2,0 Dầu hào 2,0 2,0 2,0 Cholesterol 0,3 0,3 0,3 Vitamin Premix 0,7 0,7 0,7 Tổng 100 100 100 Thành phần hóa học (% chất khô) Protein 55,1 - 55,5 50.3 36 TRƯỜNG ĐẠI HỌC PHÚ YÊN - Thức ăn đối chứng: cá tạp 2.3. Phương pháp phân tích và xử lý số liệu - Phương pháp phân tích hóa học: + Xác định độ ẩm theo tiêu chuẩn VN + Xác định hàm lượng protein theo phương pháp Kiejdal theo TCVN + Xác định hàm lượng tro tổng số bằng phương pháp nung theo TCVN 4588 – 1988 + Xác định hàm lượng lipid bằng phương pháp Folch - Các mẫu nước được phân tích theo các phương pháp thông dụng. + Nhiệt độ: đo bằng nhiệt kế, có độ chính xác 0,1 + pH : Đo bằng máy đo pH, có độ chính xác 0,1. + Độ mặn được đo bằng khúc xạ kế + Các yếu tố (NH3, H2S, NO3, NO2...) được kiểm tra định kỳ 2lần/tuần. Các yếu tố được kiểm tra định kỳ bằng máy Quang phổ khả biến. - Theo dõi tỷ lệ sống của tôm hằng ngày: quan sát trực tiếp bằng mắt thường - Kiểm tra tốc độ tăng trưởng vào cuối kỳ nuôi, xác định tỷ lệ sống và cân nặng. a. Xác định thông số - Khối lượng tôm trong các đơn vị thí nghiệm được cân tại thời điểm thả nuôi (W0) và 15 ngày cân 1 lần (Wn) bằng cân điện tử có độ chính xác 0,001g. - Chiều dài giáp đầu ngực của tôm (CL) đo từ rìa trước của gai hốc mắt đến mép sau của giáp đầu ngực, và tổng chiều dài (TL) được đo từ rìa trước của gai hốc mắt đến cuối telson bằng thước chia vạch có độ chính xác 0,1mm. - Khi cân đo phải cẩn thận, tránh làm tôm bị xây xát, trầy xước. Số mẫu n >= 10 con/mẫu (cân, đo). * Tăng trưởng tuyệt đối theo ngày: ADGW (g/ngày) = ADGL (mm/ngày) = * Tốc độ tăng trưởng đặc trưng theo ngày SGRW (%/ngày) = SGRL (%/ngày) = Trong đó: W0 : Khối lượng tôm trung bình tại thời điểm thả. W1 : Khối lượng tôm trung bình vào thời điểm thu hoạch. L0 : Chiều dài tôm trung bình vào thời điểm thả. L1 : Chiều dài tôm trung bình tại thời điểm thu hoạch. t : Thời gian nuôi. * Tỷ lệ sống (%): Trong đó: : Tổng số tôm thu hoạch. : Số tôm thả ban đầu. b. Xử lý số liệu Số liệu thu thập được trình bày dưới dạng (TB ± SD). Xử lý số liệu thu được bằng phương pháp sử dụng phần mềm thống kê sinh học (Anova) với phép kiểm định DUCAN trong phần mềm SPSS được sử dụng để kiểm định sự sai khác giữa các t WW 01 t LL 01 10001 x t LnLn WW 10001 x t LnLn LL %100(%) xTLS Bd Thu Thu Bd Lipid tổng số 9,2 - 9,3 9.6 tro 1,5 - 1,6 1.6 NFEc 34,0 - 34,4 38.5 TẠP CHÍ KHOA HỌC SỐ 14 * 2017 37 trung bình nghiệm thức với mức ý nghĩa P<0,05 trong chương trình Microsoft office Excel. 3. Kết quả nghiên cứu và thảo luận Kết quả sinh trưởng của tôm hùm bông sau 6 tuần nuôi được trình bày 3.1. Chất lượng nước trong vùng thực hiện thí nghiệm Các yếu tố trong nước được kiểm tra định kỳ cho kết quả: Bảng b. Chất lượng nước tại vùng nuôi STT Xét nghiệm hoá lý Dao động min - max GTTB ± Se P.P thử 1 Nhiệt độ (toC) 26 ÷ 30 27,2 ± 2,0 Nhiệt kế 2 pH 7,5 ÷ 8 7,7 ± 0,3 Máy đo pH 3 Oxy (mg/l) 5,8 ÷ 7,5 6,6 ± 0,8 Kits 3 Độ mặn (S‰) 34 ÷ 36 35 ± 1,0 Khúc xạ kế 4 Hàm lượng NO2-N (mg/l) 0,04 ÷ 0,05 0,041 ± 0,002 Disazozation 5 Hàm lượng NO3-N (mg/l) 8 ÷15,5 10,9 ± 0,1 Cadmium Reduction 6 Hàm lượng NH3-N (mg/l) 0,06 ÷ 0,24 0,12 ± 0,02 Method Salicylate Trong quá trình thí nghiệm, Yếu tố nhiệt độ, pH chi phối rất lớn đến tốc độ tăng trưởng của tôm. Vì vậy, các yếu tố này được được xác định hàng ngày, kết quả nhiệt độ nước nằm trong khoảng giới hạn tôm chịu đựng và phát triển bình thường, nhưng sự biến động lớn của nhiệt độ trong khoảng thời gian nuôi thử nghiệm (dao động trong khoảng 26- 30oC) ảnh hưởng nhiều đến hoạt động sống và bắt mồi của tôm, từ đó ảnh hưởng đến tốc độ tăng trưởng của ấu trùng. Độ pH của nước dao động 7,5-8,0. Sự biến thiên không lớn của pH, đồng thời lại nằm trong khoảng thích hợp cho tôm phát triển. Đây là điều kiện thuận lợi cho tôm sinh trưởng, phát triển tốt. Oxy hòa tan trong quá trình thí nghiệm dao động 5,8 – 7,5 mg/l. hàm lượng này nằm trong khoảng thích hợp nhất cho sự phát triển của ấu trùng puerulus. Hàm lượng của các yếu tố khác trong nước chưa thích hợp lắm cho sự phát triển của tôm. Tuy nhiên, trong thực tế, tôm hùm được duy trì và phát triển tương đối tốt. 3.2. Ảnh hưởng của Astaxanthin lên tỷ lệ sống Tỷ lệ sống trung bình ở tất cả các lô thí nghiệm đều lớn hơn lô đối chứng (cá tạp) và lớn hơn 70%. Lớn nhất ở lô thí nghiệm cho tôm ăn thức ăn có bổ sung hàm lượng astaxanthin 70mg.kg-1, thấp nhất ở lô thí nghiệm cho tôm ăn thức ăn bổ sung 80mg.kg-1 astaxanthin. Tất cả các lô thí nghiệm cho tôm ăn thức ăn bổ sung astaxanthin đều có tỷ lệ sống lớn hơn lô thí nghiệm cho ăn cá tạp. Tuy nhiên, tỷ lệ sống 38 TRƯỜNG ĐẠI HỌC PHÚ YÊN ở các lô thí nghiệm cho tôm ăn thức ăn hàm lượng astaxanthin khác nhau lại không có ý nghĩa về mặt thống kê (P>0,05). Hình 1. Tỷ lệ sống của tôm ở mức độ astaxanthin bổ sung trong thức ăn khác nhau 3.3. Ảnh hưởng của astaxanthin đến sự tăng trưởng Bảng c. Sinh trưởng của tôm hùm bông ở các mức astaxanthin khác nhau Chỉ tiêu Thức ăn bổ sung astaxanthin 60mg 70mg 80mg Cá tạp CL ban đầu (mm) 3,01 ± 0,08 3,07 ± 0,11 3,03 ± 0,09 3,07 ± 0,07 CL cuối (mm) 6,03 ± 0,12 6,19 ± 0,21 6,12 ± 0,22 7,03 ± 0,04 ADGCL (mm/ngày) 0,072 a 0,074 a 0,073 a 0,094 SGRCL (%/ngày) 1,62 1,67 1,67 1,97 W ban đầu (g) 0,027±0,001 0,029± 0,002 0,029 ± 0,001 0,032 ± 0,001 W cuối (g) 1,07 ± 0,031 1,21 ± 0,021 1,19 ± 0,024 1,47 ± 0,023 ADGw (g/ngày) 0,024 x 0,028 x 0,027 x 0,034 SGRw (%/ngày) 8,75 8,88 8,81 9,10 Số liệu trung bình ± SD. Số liệu trong cùng hàng có ký hiệu mũ giống nhau thể hiện sai khác không có ý nghĩa (P>0,05) Kết quả nghiên cứu cho thấy astaxanthin cần thiết cho tỷ lệ sống và tăng trưởng của giống tôm hùm bông. Trong kết quả của sự tăng trưởng, tôm tăng trưởng tương đối tốt, tăng trưởng tuyệt đối và tăng trưởng đặc trưng tương ứng về chiều dài giáp đầu ngực (CL) 0,072 – 0,074(mm/ngày); 1,62 – 1,67(%/ngày) và trọng lượng: 0,024 – 0,028(g/ngày); 8,75 – 8,88 (%/ngày). Tôm phát triển tốt hơn ở các lô thí nghiệm có mức bổ sung astaxanthin 70mg, 80mg. Kết quả này phù hợp với nghiên cứu của Williams (2007) đã tìm thấy: mức độ astaxanthin không ít hơn 70mg.kg-1 được sử dụng cho P.ornatus là cần thiết cho sự tăng trưởng tốt, tỷ lệ sống cao của cá thể non và con trưởng thành. Tuy nhiên, Sự khác biệt tăng trưởng của tôm ở các lô thí 76.6 80 73.3 70 0 10 20 30 40 50 60 70 80 90 60mg 70mg 80mg cá tạp T ỷ l ệ số n g astaxanthin TẠP CHÍ KHOA HỌC SỐ 14 * 2017 39 nghiệm lại không có ý nghĩa về mặt thống kê (P>0,05). Tuy nhiên, quan sát bằng cảm quan cho thấy sự khác biệt rõ rệt giữa tôm ăn thức ăn đối chứng (cá tạp) cao hơn rõ rệt so với các lô thí nghiệm cho ăn thức ăn tự chế biến có bổ sung astaxanthin. Có thể trong thức ăn tự nhiên (cá tạp) có một số chất dinh dưỡng cần thiết (acid amin không thay thế) còn thiếu trong thức ăn tự chế biến. Tuy nhiên, astaxanthin được cung cấp có thể làm giảm khả năng giảm stress, duy trì hệ thống miễn dịch và tăng khả năng chịu đựng stress, giảm tỷ lệ chết ở giai đoạn giống. 4. Kết luận Sử dụng các loại thức ăn với bổ sung hàm lượng astaxanthin khác nhau không cho thấy sự khác biệt nào về trọng lượng, không ảnh hưởng đến sức sản xuất của tôm hùm, nó có thể tồn tại trong mô như thành phần quan trọng cho hệ miễn dịch của giáp xác, làm giảm tỷ lệ chết ở ấu trùng TÀI LIỆU THAM KHẢO [1] Barclay M.C., Irvin S.J., Williams K.C. and Smith D.M (2006), “Comparison of diets for the tropical spiny lobster Panulirus ornatus: astaxanthin supplemented feeds and mussel flesh”. Aquaculture Nutrition 12, 117–125. [2] Chien Y., Pan C. and Hunter B.(2003), “The resistance to physical stresses by Penaeus monodon juveniles fed diets supplemented with astaxanthin”, Aquaculture 216, 177–191 [3] Hung L.V, Phong N.T.D, Michael F. Tlusty (2010), Effect of astaxanthin and cholesterol on growth,survival, and pigmentation of adult spiny lobster, Panulirus ornatus (Decapoda, Palinuridae),AACL Bioflux, Vol 3, Issue 3. 261-268 [4] Irwin S.J., Williams K.C.(2009), “Panulirus ornatus lobster feed development: from trash fish to formulated feeds”, In ed. by K.C. Williams, Spiny lobster aquaculture in the Asia–Pacific region, ACIAR Proceedings No. 132, 147–156. [5] Kanazawa A., Shimaya, M., Kawasaki, K. (1970), “Nutrition requiments of Prawn – I”. Feeding on artificial diet. Bull. Japan Soc. Sci. Fish. 36: 949 – 954. [6] Linan-Cabello M.A., Paniagua-Michel J. and Hopkins P.M. (2002), “Bioactive roles of carotenoids and retinoids in crustaceans”, Aquaculture Nutrition 8, P.299–309. [7] Meyers S.F. and Latscha L.(1997), “Carotenoids in Crustacean nutrition”. Advances in world aquaculture, ed. by L.R. D’Abramo, D.E. Conklin and D.M. Akiyama, vol 6, P. 164–193 [8] Takeuchi. T, Mukarami.K(2007), “Crustacea nutrition and larval, with emphasis on japanese spiny lobster, Panulirus japonnicus”, Bull. Fish. Res. Agen.No 20, 15-23. [9] Tuan, L. A and Mao, Ng. D (2009), “Effect of trash fish species and vitamin supplemention on productivity of panulirus ornatus juveniles fed moist diets”, Spiny lobster aquaculture in the Asia – Pacific region, (No.132) (Ed. By Kenvin C. Williams) ACIAR Proceedings, P126-130. [10] Tlusty, M. & Hyland, C.(2005), “Astaxanthin deposition in the cuticle of juvenile American lobster (Homarus americanus): implications for phenotypic and genotypic coloration”. Marine Biology,147, 113-119 40 TRƯỜNG ĐẠI HỌC PHÚ YÊN [11] Pangantihon-Kuhlmann M.P., Millamena O.and Chern Y.(1998), “Effect of dietary astaxanthin and vitamin A onthe reproductive performance of Penaeus monodon broodstock”. Aquatic Living Resource 11, 403–409. [12] Perez-Velazquez M., Gonzalez-Felix M.L., Lawrence A.L., Bray W.A. and Gattlin III D.M. (2003), “Dietary effects on sperm quality of Litopenaeus vannamei”. Journal of the World Aquaculture Society 34, 92–98 [13] Smith D.M., Williams K.C. and Irvin S.J.(2005), “Response of the tropical spiny lobster Panulirus ornatus to protein content of pelleted feed and to a diet of mussel flesh”, Aquaculture Nutrition 11, 209–217 Abstract Effects of different Astaxanthin in diets on growth and survival of lobsters (Panulirus ornatus) in puerulus stage to <1,5g A 6-week feeding trial was conducted with juvenile (0.027g ÷ 0.029g) white puerulus, Panulirus ornatus, to evaluate the needs for astaxanthin supplements in the diets for lobsters reared in an outdoor system in the presence of hand made foods. The basal diet was formulated with crude protein levels of 55÷60% and three levels of supplemented astaxanthin (60mg.kg -1 , 70mg.kg -1 , 80mg.kg -1 ). The results of the study showed that the survival in all experiments are higher than 73%. The average growth (of about CL length and weight) after six-week feeding was found with 80mg.kg -1 (1.19 ± 0.024)(g); in the experiment 60mg.kg -1 (1.07± 0.031)(g); meanwhile the highest growth found in the experiment 70mg.kg -1 (1.21 ± 0.021)(g). One-way ANOVA showed a no significant difference (P ≥ 0.05) among lobsters fed diets containing the various levels of astaxanthin Key words: panulirus ornatus; puerulus; hand made foods.
File đính kèm:
 anh_huong_cua_acid_beo_khong_no_astaxanthin_trong_thuc_an_le.pdf
anh_huong_cua_acid_beo_khong_no_astaxanthin_trong_thuc_an_le.pdf

