Thử nghiệm in vitro đối với kháng sinh thích hợp trong phòng trị bệnh hoại tử gan tụy cấp tính
TÓM TẮT
Bệnh hoại tử gan tụy cấp tính (AHPND) gây ra bởi vi khuẩn Vibrio parahaemolyticus đã gây thiệt hại
kinh tế đáng kể trong nghề nuôi tôm tại Việt Nam. Nghiên cứu trước cho thấy V. parahaemolyticus
kháng với nhiều loại kháng sinh do việc lạm dụng thuốc kháng sinh để kiểm soát bệnh nhiễm khuẩn
trong nuôi trồng thủy sản. Các nghiên cứu về nồng độ sử dụng thuốc kháng sinh cho tôm nuôi
trong phòng trị vi khuẩn V. parahaemolyticus gây bệnh AHPND còn rất hạn chế ở Đồng bằng sông
Cửu Long, Việt Nam. Mục tiêu của nghiên cứu này là sàng lọc danh mục kháng sinh thử nghiệm
nhằm xác định nồng độ ức chế tối thiểu - MIC và nồng độ ức chế 50% (IC50) và 90% (IC90) của
V. parahaemolyticus gây bệnh AHPND phân lập được từ các mẫu tôm bệnh tại Việt Nam. Nghiên
cứu được thực hiện qua 7 chủng V. parahaemolyticus gây bệnh AHPND gồm 5 chủng phân lập trên
tôm bệnh AHPND tại ao nuôi miền Nam và 2 chủng trên tôm bệnh tại miền Bắc với 6 loại kháng
sinh. Kết quả cho thấy nồng độ MIC của 7 chủng V. parahaemolyticus với Norfloxacin ≤ 0,25-1
mg/l, Ciprofloxacin ≤ 0,25-1 mg/l, Doxycycline 1-32 mg/l, Gentamicin 4-16 mg/l, Tetracycline
1-128 mg/l và Oxytetracycline 1 - ≥ 128 mg/l. IC50 của Norfloxacin, Ciprofloxacin, Doxycyclin,
Gentamicin và Tetracycline lần lượt là 0,32, 0,36, 1,46, 9,33 và 1,75 µg/ml. IC90 lần lượt là 0,76,
0,71, 22,80, 11,40 và 97,92 µg/ml.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6

Trang 7
Tóm tắt nội dung tài liệu: Thử nghiệm in vitro đối với kháng sinh thích hợp trong phòng trị bệnh hoại tử gan tụy cấp tính

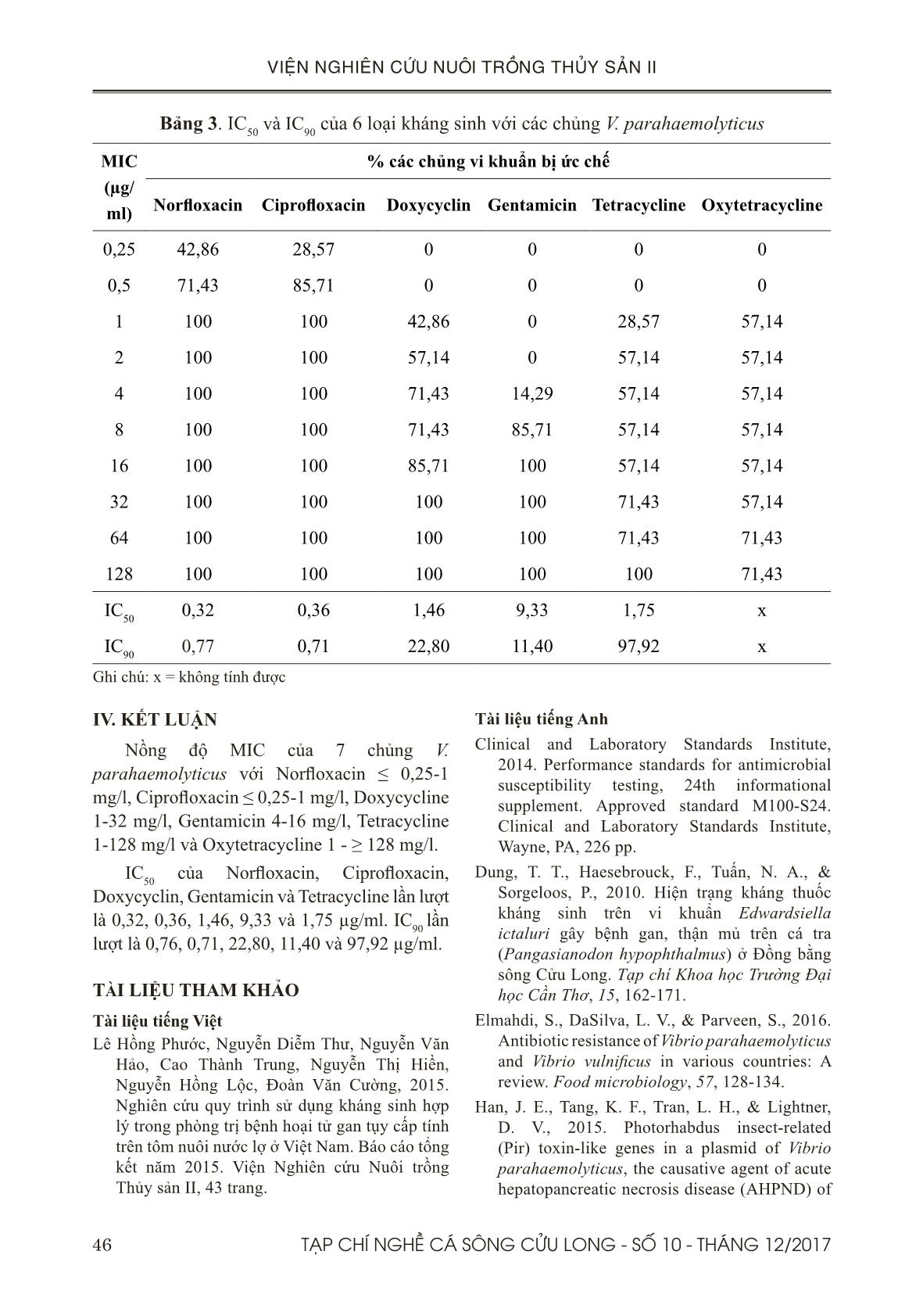
ẢN II parahaemolyticus gây bệnh AHPND phân lập được từ các mẫu tôm bệnh tại Việt Nam làm cơ sở cho các nghiên cứu thử nghiệm cho việc phòng trị loại bệnh này trên tôm. II. VẬT LIỆU VÀ PHƯƠNG PHÁP 2.1. Chủng vi khuẩn Vibrio parahaemolyticus Bảy chủng V. parahaemolyticus gây bệnh AHPND gồm 5 chủng phân lập trên tôm bệnh AHPND tại ao nuôi miền Nam và 2 chủng trên tôm bệnh tại miền Bắc (Bảng 1) được chọn để thử nghiệm xác định nồng độ ức chế tối thiểu. Mẫu được lưu trữ trong glycerol 20% và bảo quản -70oC tại Trung tâm Quan Trắc, Viện Nghiên cứu Nuôi trồng Thủy sản II. Bảng 1. Các chủng vi khuẩn V. parahaemolyticus phân lập trên tôm STT Ký hiệu mẫu Phân lập từ Tỉnh 1 KG11T1 Tôm thẻ Kiên Giang 2 ST8T Tôm sú Sóc Trăng 3 ST11T Tôm sú Sóc Trăng 4 ST13T Tôm thẻ Sóc Trăng 5 CMT14 Tôm thẻ Cà Mau 6 PR15.10 Tôm thẻ Nghệ An 7 PR15.20 Tôm thẻ Nghệ An 2.2. Sàng lọc danh mục kháng sinh thử nghiệm Căn cứ vào đặc tính sinh học cũng như cơ chế gây bệnh của tác nhân gây bệnh; căn cứ vào bản chất hóa học của kháng sinh; kết hợp với kết quả các nghiên cứu trước; điều tra bổ sung của nghiên cứu này về sử dụng loại kháng sinh, mức độ kháng, hiệu quả,trong nuôi tôm. Tiến hành chọn 5 loại kháng sinh có tỉ lệ nhạy cao nhất đối với các mẫu V. parahaemolyticus đã phân lập từ 3 miền để thử nồng độ ức chế tối thiểu làm cơ sở cho việc chọn liều thử nghiệm trên tôm. 2.3. Phương pháp xác định nồng độ ức chế tối thiểu-MIC (Minimal inhibitory concentration) MIC được xác định theo quy trình có thay đổi của Ruangpan (2004) bằng cách pha loãng thuốc kháng sinh trong môi trường đĩa thạch với 6 loại kháng sinh đã chọn. Giá trị MIC được xác định là nồng độ thấp nhất của thuốc kháng sinh, ở đó không có sự phát triển của vi khuẩn (Ruangpan, 2004). Các bước tiến hành như sau: 2.3.1. Chuẩn bị các dung dịch kháng sinh Pha dung dịch kháng sinh gốc: pha 10ml dung dịch gốc nồng độ 1.280 µg/ml theo công thức: X(g) = [10 (ml) x 1.280 (µg/ml) x 100] / a. Trong đó: a là % hoạt lực của kháng sinh. Kháng sinh bột được pha với dung môi thích hợp (nước cất được dùng pha 5 loại kháng sinh sử dụng trong nghiên cứu này). Cho một lượng dung môi vừa đủ để hòa tan hoàn toàn kháng sinh, bồi phụ đủ thể tích bằng dung môi hoà tan. Từ dung dịch gốc pha loãng ½ đến nồng độ thấp nhất cần dùng là 2,5 µg/ml (10 nồng độ pha loãng là 1.280 µg/ml, 640 µg/ml, 320 µg/ml, 160 µg/ml, 80 µg/ml, 40 µg/ml, 20 µg/ml, 10 µg/ml, 5 µg/ ml, 2,5 µg/ml). 2.3.2. Chuẩn bị các đĩa thạch kháng sinh Đĩa thạch Mueller-Hinton Agar được chuẩn bị theo hướng dẫn của từng hãng sản xuất, có bổ sung 2% muối và hòa tan vào môi trường nước cất. Đun sôi để hoà tan hoàn toàn thạch và hấp tiệt trùng 120oC/15 phút, để nguội môi trường tới 50oC. Sau đó, cho vào đĩa petri 9 ml thạch và 1ml dung dịch kháng sinh cần dùng (10 nồng 44 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II độ kháng sinh đã được pha ở trên, mỗi nồng độ 3 đĩa) và lắc đều. Các đĩa thạch được dùng ngay trong ngày. Đánh dấu phía trên và phía dưới đĩa thạch để tránh nhầm lẫn số thứ tự chủng khi đọc kết quả. Hai đĩa môi trường MHA không có kháng sinh cũng được chuẩn bị để làm chứng dương. 2.3.3. Chuẩn bị chủng vi khuẩn và pha hỗn dịch vi khuẩn 7 chủng vi khuẩn Vibrio parahaemolyticus được chọn làm thử nghiệm được cấy vào môi trường thạch dinh dưỡng (BHIA), ủ 18-24 giờ ở 30oC để tạo ra các khuẩn lạc thuần riêng rẽ. Các khuẩn lạc hòa tan vào 10 ml nước muối 2% vô trùng đến khi đạt nồng độ 108 vi khuẩn/ml (độ đục của huyền dịch vi khuẩn tương ứng với độ đục chuẩn 0,5 McFarland). Pha loãng 100 lần huyền dịch vi khuẩn này để được huyền dịch nồng độ 106 vi khuẩn/ml. 2.3.4. Tiến hành Hút 10 µl huyền dịch vi khuẩn nồng độ 106 vi khuẩn/ml cho vào mỗi vị trí giếng/ vòng tròn (nhỏ giọt) trên đĩa thạch MHA với 10 nồng độ kháng sinh khác nhau (từ nồng độ thấp đến nồng độ cao), mỗi nồng độ lặp lại 3 lần. Hai đĩa môi trường MHA không có kháng sinh cũng được cho 10 µl huyền dịch vi khuẩn để làm chứng dương. Sau đó để các đĩa thạch ở nhiệt độ phòng cho đến khi khô, lộn ngược các đĩa và ủ ở 300C trong vòng 18-24 giờ. 2.3.5. Đọc và phân tích kết quả Trước tiên kiểm tra sự phát triển của các chủng vi khuẩn thử nghiệm ở 2 đĩa thạch đối chứng không có kháng sinh. Nếu các chủng đảm bảo mọc tốt thì tiếp tục đọc kết quả của các chủng thử nghiệm. Nếu các chủng vi khuẩn không mọc thì tiến hành làm lại thí nghiệm. Đọc kết quả lần lượt từ đĩa thạch có nồng độ kháng sinh thấp nhất đến nồng độ cao nhất. Nồng độ MIC được xác định ở đĩa môi trường mà ở đó các vi khuẩn bị ức chế phát triển (mật độ vi khuẩn giảm hẳn chỉ còn 1-2 khuẩn lạc mọc). Kết quả MIC của các chủng với mỗi kháng sinh được ghi nhận lại. Ở nồng độ thấp nhất, không có vi khuẩn mọc thì kết quả được ghi nhận là: nhỏ hơn hoặc bằng nồng độ đó (≤). Trong trường hợp đến nồng độ cao nhất mà vẫn thấy vi khuẩn mọc thì kết quả được ghi nhận là lớn hơn nồng độ đó (≥). 2.4. Phương pháp xác định nồng độ ức chế 50% (IC50) và 90% (IC90) Sau khi xác định được giá trị MIC, IC 50 và IC 90 được tính toán để xác định liều lượng kháng sinh thử nghiệm điều trị bệnh trên động vật nhằm tìm ra loại kháng sinh điều trị bệnh hiệu quả. IC 50 và IC 90 được tính toán theo công thức sau (Ruangpan, 2004): IC 50 = A+B , trong đó 2 A = 50 x nồng độ MIC gần nhất của các chủng vi khuẩn bị ức chế thấp hơn 50% tỉ lệ % gần nhất thấp hơn 50% B = 50 x nồng độ MIC gần nhất của các chủng vi khuẩn bị ức chế cao hơn 50% tỉ lệ % gần nhất cao hơn 50% IC 90 = C+D , trong đó 2 C = 90 x nồng độ MIC gần nhất của các chủng vi khuẩn bị ức chế thấp hơn 90% tỉ lệ % gần nhất thấp hơn 90% D = 90 x nồng độ MIC gần nhất của các chủng vi khuẩn bị ức chế cao hơn 90% tỉ lệ % gần nhất cao hơn 90% 45TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II 2.5. Phương pháp phân tích số liệu Dữ liệu được nhập và phân tích thống kê bằng phần mềm SPSS 16.0 (SPSS Inc., USA). III. KẾT QUẢ VÀ THẢO LUẬN 3.1. Kết quả sàng lọc danh mục kháng sinh thử nghiệm Căn cứ vào kết quả thử kháng sinh đồ của 47 mẫu V. parahaemolyticus đã phân lập năm 2015 (Báo cáo tổng kết đề tài, 2015). Năm loại kháng sinh được chọn do có tỉ lệ nhạy cao nhất đối với các mẫu V. parahaemolyticus đã phân lập là Norfloxacin, Ciprofloxacin, Doxycycline, Gentamicin và Tetracyline. Oxytetracycline là loại kháng sinh đang được người nuôi sử dụng phổ biến (qua điều tra thực tế), cũng được lựa chọn cho thử nghiệm. Sáu loại kháng sinh này được dùng để thử nồng độ ức chế tối thiểu làm cơ sở cho việc chọn liều thử nghiệm trên tôm. Norfloxacin và Ciprofloxacine bị cấm sử dụng trong nuôi trồng thủy sản từ tháng 10/2016 (thông tư 10/2016/TT-BNNPTNT). Tuy nhiên, 2 loại kháng sinh này được sử dụng khá phổ biến tại ao nuôi nên cũng được chọn cho thử nghiệm này. 3.2. Kết quả xác định nồng độ ức chế tối thiểu-MIC Kết quả cho thấy nồng độ MIC của 7 chủng V. parahaemolyticus với Norfloxacin ≤ 0,25-1 mg/l, Ciprofloxacin ≤ 0,25-1 mg/l, Doxycycline 1-32 mg/l, Gentamicin 4-16 mg/l, Tetracycline 1-128 mg/l và Oxytetracycline 1 - ≥ 128 mg/l (Bảng 2). Nghiên cứu trước cho thấy kết quả MIC của V. parahaemolyticus phân lập trên tôm nuôi ở Thái Lan với Gentamicin < 1-2 mg/l và Oxytetracycline < 0,5-64 mg/l (Yano et al., 2014). Kết quả của Vaseeharan et al., (2005) cho thấy tất cả các chủng V. parahaemolyticus phân lập từ ao nuôi tôm kháng với oxytetracycline, với MIC dao động từ 32,5-88,6 mg/l. Bảng 2. Nồng độ ức chế tối thiểu của các chủng V. parahaemolyticus với 6 loại kháng sinh Kháng sinh Số chủng vi khuẩn Số chủng vi khuẩn với MIC (mg/l) ≤ 0,25 0,5 1 2 4 8 16 32 64 ≥ 128 Norfloxacin 7 3 2 2 Ciprofloxacin 7 2 4 1 Doxycycline 7 3 1 1 1 1 Gentamicin 7 1 5 1 Tetracycline 7 2 2 1 2 Oxytetracycline 7 4 1 2 3.3. Kết quả xác định nồng độ ức chế IC50 và IC90 Dựa trên kết quả MIC, IC 50 và IC 90 của 6 loại kháng sinh với các chủng V. parahaemolyticus được trình bày qua Bảng 3. IC 50 của Norfloxacin có giá trị thấp nhất là 0,32 µg/ml và Gentamicin có giá trị cao nhất là 9,33 µg/ml. IC 90 của Ciprofloxacin có giá trị thấp nhất là 0,71 µg/ ml và Tetracycline có giá trị cao nhất là 97,92 µg/ ml. Chưa xác định được liều IC 50 và IC 90 của Oxytetracycline với 10 nồng độ kháng sinh đã thử nghiệm. Dung và ctv., (2010) đã báo cáo giá trị IC50 và IC90 của Gentamicin trên vi khuẩn Edwardsiella ictaluri gây bệnh gan thận mủ trên cá tra lần lượt là 2 và 4 µg/ml. 46 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II IV. KẾT LUẬN Nồng độ MIC của 7 chủng V. parahaemolyticus với Norfloxacin ≤ 0,25-1 mg/l, Ciprofloxacin ≤ 0,25-1 mg/l, Doxycycline 1-32 mg/l, Gentamicin 4-16 mg/l, Tetracycline 1-128 mg/l và Oxytetracycline 1 - ≥ 128 mg/l. IC 50 của Norfloxacin, Ciprofloxacin, Doxycyclin, Gentamicin và Tetracycline lần lượt là 0,32, 0,36, 1,46, 9,33 và 1,75 µg/ml. IC 90 lần lượt là 0,76, 0,71, 22,80, 11,40 và 97,92 µg/ml. TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Lê Hồng Phước, Nguyễn Diễm Thư, Nguyễn Văn Hảo, Cao Thành Trung, Nguyễn Thị Hiền, Nguyễn Hồng Lộc, Đoàn Văn Cường, 2015. Nghiên cứu quy trình sử dụng kháng sinh hợp lý trong phòng trị bệnh hoại tử gan tụy cấp tính trên tôm nuôi nước lợ ở Việt Nam. Báo cáo tổng kết năm 2015. Viện Nghiên cứu Nuôi trồng Thủy sản II, 43 trang. Tài liệu tiếng Anh Clinical and Laboratory Standards Institute, 2014. Performance standards for antimicrobial susceptibility testing, 24th informational supplement. Approved standard M100-S24. Clinical and Laboratory Standards Institute, Wayne, PA, 226 pp. Dung, T. T., Haesebrouck, F., Tuấn, N. A., & Sorgeloos, P., 2010. Hiện trạng kháng thuốc kháng sinh trên vi khuẩn Edwardsiella ictaluri gây bệnh gan, thận mủ trên cá tra (Pangasianodon hypophthalmus) ở Đồng bằng sông Cửu Long. Tạp chí Khoa học Trường Đại học Cần Thơ, 15, 162-171. Elmahdi, S., DaSilva, L. V., & Parveen, S., 2016. Antibiotic resistance of Vibrio parahaemolyticus and Vibrio vulnificus in various countries: A review. Food microbiology, 57, 128-134. Han, J. E., Tang, K. F., Tran, L. H., & Lightner, D. V., 2015. Photorhabdus insect-related (Pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of Bảng 3. IC 50 và IC 90 của 6 loại kháng sinh với các chủng V. parahaemolyticus MIC (µg/ ml) % các chủng vi khuẩn bị ức chế Norfloxacin Ciprofloxacin Doxycyclin Gentamicin Tetracycline Oxytetracycline 0,25 42,86 28,57 0 0 0 0 0,5 71,43 85,71 0 0 0 0 1 100 100 42,86 0 28,57 57,14 2 100 100 57,14 0 57,14 57,14 4 100 100 71,43 14,29 57,14 57,14 8 100 100 71,43 85,71 57,14 57,14 16 100 100 85,71 100 57,14 57,14 32 100 100 100 100 71,43 57,14 64 100 100 100 100 71,43 71,43 128 100 100 100 100 100 71,43 IC 50 0,32 0,36 1,46 9,33 1,75 x IC 90 0,77 0,71 22,80 11,40 97,92 x Ghi chú: x = không tính được 47TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II shrimp. Diseases of aquatic organisms, 113(1), 33-40. Lightner D.V., Redman C.R., Pantoja B.L., Noble L.M., Nunan, Loc Tran, 2013. Documentation of an Emerging Disease (Early Mortality Syndrome) in SE Asia & Mexico. OIE Reference Laboratory for Shrimp Diseases, Department of Veterinary Science & Microbiology, School of Animal and Comparative Biomedical Sciences. Ruangpan, L., 2004. Minimal inhibitory concentration (MIC) test and determination of antimicrobial resistant bacteria. In Laboratory manual of standardized methods for antimicrobial sensitivity tests for bacteria isolated from aquatic animals and environment (pp. 31-55). Aquaculture Department, Southeast Asian Fisheries Development Center. Vaseeharan, B., Ramasamy, P., Murugan, T. and Chen, J.C., 2005. In vitro susceptibility of antibiotics against Vibrio spp. and Aeromonas spp. isolated from Penaeus monodon hatcheries and ponds. International journal of antimicrobial agents, 26(4), pp.285-291. Yano, Y., Hamano, K., Satomi, M., Tsutsui, I., Ban, M. and Aue-Umneoy, D., 2014. Prevalence and antimicrobial susceptibility of Vibrio species related to food safety isolated from shrimp cultured at inland ponds in Thailand. Food control, 38, pp.30-36. Zorriehzahra, M. J., & Banaederakhshan, R., 2015. Early mortality syndrome (EMS) as new emerging threat in shrimp industry. Adv. Anim. Vet. Sci, 3(2s), 64-72 48 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 10 - THÁNG 12/2017 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II IN VITRO TRIALS OF ANTIBIOTICS ON THE ABILITY TO INHIBIT ACUTE HEPATOPANCREATIC NECROSIS DISEASE PATHOGEN Nguyen Diem Thu1*, Le Hong Phuoc1, Vo Hong Phuong1, Pham Vo Ngoc Anh1, Ma Tu Lan1, Tran Minh Trung1 ABSTRACT Acute hepatopancreatic necrosis disease (AHPND) caused by Vibrio parahaemolyticus has resulted in significant economic losses in shrimp production in Vietnam. Previous studies reported that V. parahaemolyticus showed multiple-antibiotic resistance due to the misuse of antibiotics to control pathogenic infections in aquaculture. There is a lack of information on the doses of antibiotic usage for shrimp farmers in prevention of V. parahaemolyticus in the Mekong Delta, Vietnam. This study aimed to select the effective antibiotics by determining the minimum inhibitory concentration (MIC) and inhibitory concentrations at 50% (IC50) and inhibitory concentrations at 90% (IC90) of AHPND pathogenic V. parahaemolyticus isolates from AHPND shrimp samples in Vietnam. The study was carried out on 7 strains of AHPND pathogenic V. parahaemolyticus, including 5 trains from the South and 2 strains from the North of Vietnam, using 6 different antibiotics. The results showed that MIC values of these 7 strains were ≤ 0,25-1 mg/l for Norfloxacin, ≤ 0,25-1 mg/l for Ciprofloxacin, 1-32 mg/l for Doxycycline, 4-16 mg/l for Gentamicin, 1-128 mg/l for Tetracycline and 1 - ≥ 128 mg/l for Oxytetracycline. IC 50 values of Norfloxacin, Ciprofloxacin, Doxycycline, Gentamicin and Tetracycline were 0.32; 0.36; 1.46; 9.33 and 1.75 µg/ml, respectively. IC 90 values were 0.76; 0.71; 22.80; 11.40 and 97.92 µg/ml, respectively. Keywords: AHPND pathogenic Vibrio parahaemolyticus, antibiotics, MIC, IC 50 , IC90, farmed shrimp. Người phản biện: TS. Lý Thị Thanh Loan Ngày nhận bài: 26/11/2017 Ngày thông qua phản biện: 15/12/2017 Ngày duyệt đăng: 18/12/2017 1 Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No.2. * Email: thu_seven@yahoo.com
File đính kèm:
 thu_nghiem_in_vitro_doi_voi_khang_sinh_thich_hop_trong_phong.pdf
thu_nghiem_in_vitro_doi_voi_khang_sinh_thich_hop_trong_phong.pdf

