Thành phần loài và đặc điểm tăng trưởng các loài tảo phân lập từ ống tiêu hóa của nghêu vân (Meretrix lusoria)
TÓM TẮT
Nghêu vân, Meretrix lusoria, là loài nhuyễn thể hai mảnh vỏ khá phổ biến trong khu vực Đông
và Đông Nam Á (Yoosukh & Matsukuma, 2001). Trong ống tiêu hóa của nghêu vân thu tại cảng
Gomso, Hàn Quốc đã ghi nhận được tổng cộng có 34 loài vi tảo. Trong đó, 32 loài vi tảo được phân
loại dựa trên đặc điểm hình thái dưới kính hiển vi quang học. Tuy nhiên, chỉ có hai giống tảo thuần
là Neorhodella sp. và Minutocellus sp. được phân lập và nuôi thành công. Tốc độ tăng trưởng và tỉ
lệ phân chia tế bào của cả hai loài tảo này đều đạt cao nhất khi nuôi ở nhiệt độ 18oC cụ thể là 1,62
± 0,39 và 2,24 ở Neorhodella sp. và 0,39 ± 0,01 và 0,56 ở Minutocellus sp.

Trang 1

Trang 2

Trang 3
Trang 4
Trang 5

Trang 6

Trang 7

Trang 8
Bạn đang xem tài liệu "Thành phần loài và đặc điểm tăng trưởng các loài tảo phân lập từ ống tiêu hóa của nghêu vân (Meretrix lusoria)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Thành phần loài và đặc điểm tăng trưởng các loài tảo phân lập từ ống tiêu hóa của nghêu vân (Meretrix lusoria)

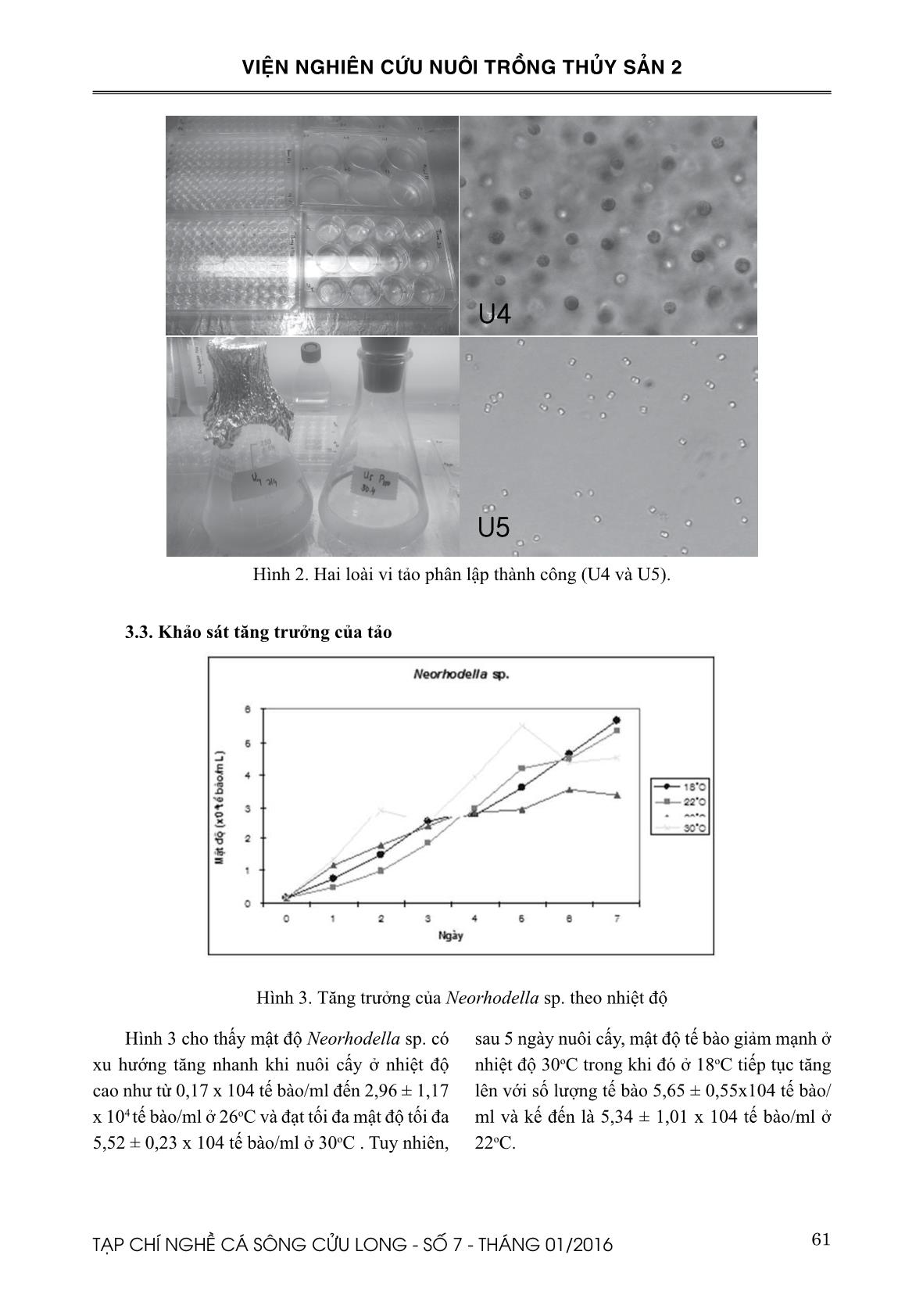
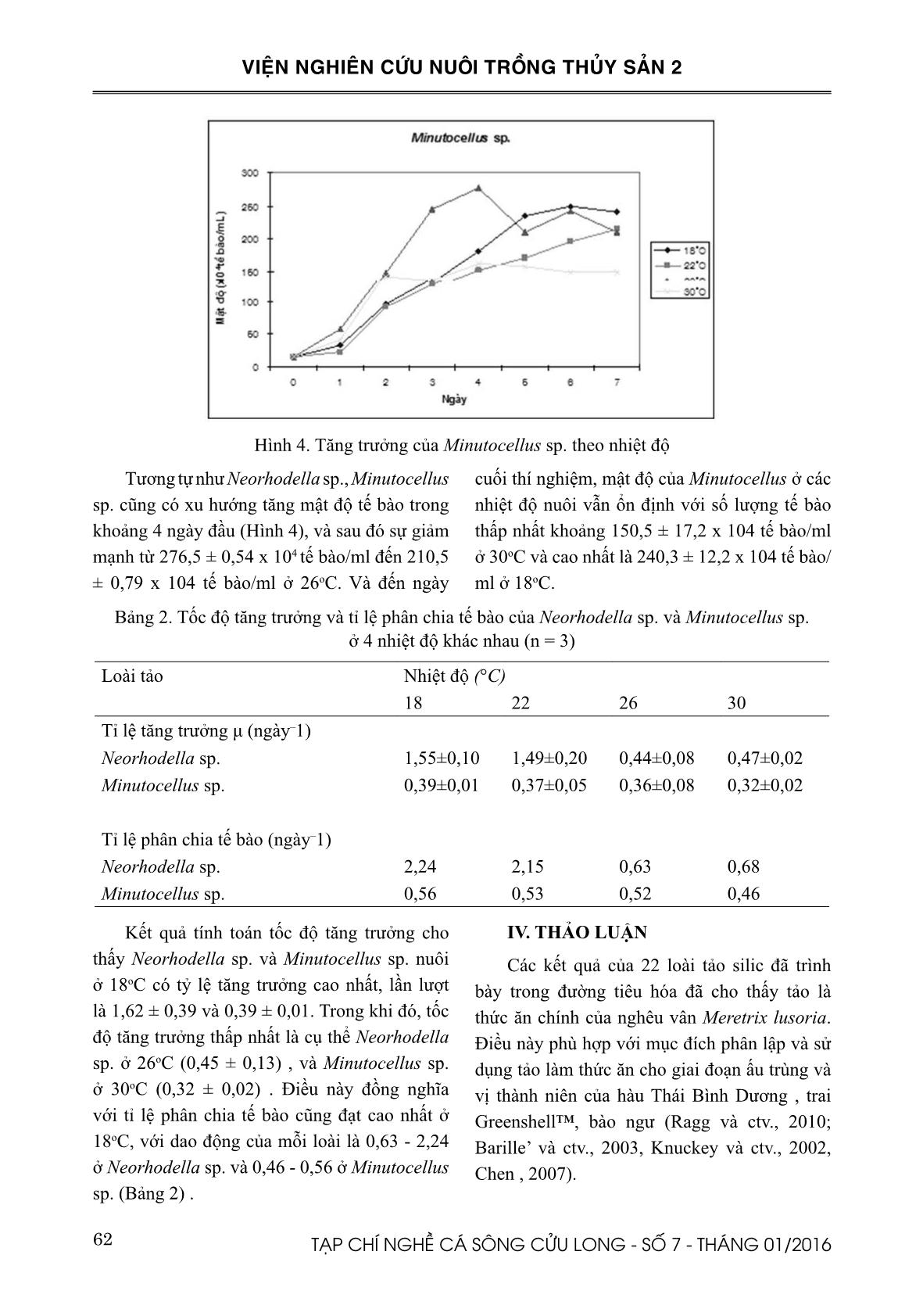
), trai Greenshell ™ Perna canaliculus (Ragg et al., 2010), hàu Châu Âu Ostrea edulis (Ronquillo et al., 2012), bào ngư Haliotis diversicolor (Chen, 2007). Mục tiêu của nghiên cứu này là xác định thành phần loài và phân lập một số loài tảo trong ống tiêu hóa của nghêu vân Meretix lusoria, nhằm góp phần trong nghiên cứu đa dạng nguồn thức ăn tươi trong nuôi trồng thủy sản. 59TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 II. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU 2.1. Phân loại tảo thông qua đặc điểm hình thái Hình 1. Nghêu vân thu tại cảng Gomso Nghêu vân được thu thập từ các cảng Gomso, Buan-gun, Jeollabuk, Hàn Quốc vào tháng 10 năm 2014. Vi tảo thu từ đường tiêu hóa của nghêu được xác định dựa trên các đặc điểm hình thái thông qua việc sử dụng kính hiển vi quang học kết nối với máy ảnh kỹ thuật số. Khóa phân loại tảo được thực hiện theo các phương pháp của Tomas, 1997 và Presscott, 1951. 2.2. Phân lập tảo Vi tảo được phân lập trong phòng thí nghiệm bằng phương pháp Pasteur pipette dưới kính hiển vi đảo ngược (Hoshaw và Rosowski, 1973). Vi tảo được nuôi trong môi trường f/2 (Guillard và Ryther, 1962; Fritz Industries, Inc 1997) ở 18oC dưới 12:12 giờ chu kỳ sáng/tối dưới ánh sáng huỳnh quang màu trắng 90 mmol photon. Để có giống tảo thuần, loài tảo được phân lập được kiểm tra hàng ngày dưới kính hiển vi đảo ngược và trên môi trường thạch LB nhằm kiểm tra nhiễm khuẩn. Trong trường hợp loài tảo nuôi này vẫn còn xen tạp các loài tảo khác, thì việc phân lập sẽ phải thực hiện tiếp cho đến khi có được giống tảo thuần. Và trong trường hợp vi tảo nuôi bị nhiễm khuẩn, chúng sẽ được xử lý bằng Spenicillin 100µg/ml sau đó kiểm tra trên lại trên môi trường thạch LB để đảm bảo không còn khuẩn lạc vi khuẩn. 2.3. Khảo sát tăng trưởng của tảo nuôi Mỗi giống tảo sẻ được nuôi trong các giếng nuôi cấy mô, có chứa 5 ml môi trường nuôi cấy f/2 vô trùng với các điều kiện nuôi không thay đổi, ngoại trừ tại yếu tố nhiệt độ như 18, 22, 26, 30 oC. Thí nghiệm cho mỗi giống tảo được lập lại 3 lần. Số lượng tế bào được đếm mỗi 24 giờ trên buồng đếm hồng cầu Neubauer, và tất cả thí nghiệm sẽ được thu hoạch sau 1 tuần. Tốc độ tăng trưởng của tảo được tính như sau: µ (ngày- 1) = ln (F1/F0)/(t1-t0), trong đó F = sinh khối tại thời điểm thu hoạch t1 (tế bào/ml) và F0 = sinh khối tại thời điểm bắt đầu, t0 (tế bào/ml) (Guillard, 1973). Từ tốc độ tăng trưởg (μ), tỉ lệ phân chia tế bào mỗi ngày (n) được ước tính bằng cách sử dụng phương trình sau: n = μ/[ln (2)], trong đó n là tỉ lệ phân chia tế bào mỗi ngày (Giovagnetti và ctv., 2012). III. KẾT QUẢ 3.1. Phân loại tảo thông qua đặc điểm hình thái Thông qua đặc điểm hình thái của các vi tảo đã ghi nhận được thu tổng số 34 loài tảo hiện diện trong ống tiêu hóa của nghêu vân (Bảng 1), trong đó có 1 loài vi khuẩn lam (Cyanobacteria), 8 loài tảo lục (Chorophyceae), 2 loài tảo hai roi (Dianophyceae), 21 loài tảo silic (Bacillariophyceae) và 2 loài chưa xác định là U4 và U5. 60 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Bảng 1. Thành phần loài tảo hiện diện trong ống tiêu hóa của nghêu vân Meretrix lusoria Bacillariophyceae Cyanobacteria Actinoptychus undulatus Cyclotella striata Cocconeis sp. Coscinodiscus excentricus Coscinodiscus oculus-iridis Coscinodiscus radiatus Coscinodiscus sp. Coscinodiscus subtilis Coscinodiscus wailesii Cylindrotheca closterium Diploneis crabro Navicula rhynchocephala Navicula sp1. Navicula sp2. Navicula sp3. Nitzschia sp1. Nitzschia sp2. Paralia sulcata Pleurosigma sp. Triceratium favus Trachyneis aspera Merimopedia sp. Chlorophyceae Botryococcus sp. Chlorella sp. Coelastrum sp. Crucigenia tetrapedia Pandorina sp. Pediastrum duplex Scenedesmus sp. Tetrastrum sp. Dinophyceae Diplosalis sp. Prorocentrum micans Chưa xác định U4 U5 3.2. Phân lập tảo Trong 34 loài vi tảo được ghi nhận chỉ phân lập thành công và nuôi thuần hai giống tảo U4 và U5 (Hình 2). Sau khi có giống tảo thuần, hai tảo này đã được phân loại bằng phương pháp sinh học phân tử tại phòng thí nghiệm của khoa vi sinh của trường Đại học Pukyong, Hàn Quốc với U4 là Neorhodella sp. thuộc tảo đỏ Rhodellophyceae và U5 là Minutocellus sp. thuộc tảo silic Bacillariophyceae. 61TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Hình 2. Hai loài vi tảo phân lập thành công (U4 và U5). 3.3. Khảo sát tăng trưởng của tảo Hình 3. Tăng trưởng của Neorhodella sp. theo nhiệt độ Hình 3 cho thấy mật độ Neorhodella sp. có xu hướng tăng nhanh khi nuôi cấy ở nhiệt độ cao như từ 0,17 x 104 tế bào/ml đến 2,96 ± 1,17 x 104 tế bào/ml ở 26oC và đạt tối đa mật độ tối đa 5,52 ± 0,23 x 104 tế bào/ml ở 30oC . Tuy nhiên, sau 5 ngày nuôi cấy, mật độ tế bào giảm mạnh ở nhiệt độ 30oC trong khi đó ở 18oC tiếp tục tăng lên với số lượng tế bào 5,65 ± 0,55x104 tế bào/ ml và kế đến là 5,34 ± 1,01 x 104 tế bào/ml ở 22oC. 62 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Hình 4. Tăng trưởng của Minutocellus sp. theo nhiệt độ Tương tự như Neorhodella sp., Minutocellus sp. cũng có xu hướng tăng mật độ tế bào trong khoảng 4 ngày đầu (Hình 4), và sau đó sự giảm mạnh từ 276,5 ± 0,54 x 104 tế bào/ml đến 210,5 ± 0,79 x 104 tế bào/ml ở 26oC. Và đến ngày cuối thí nghiệm, mật độ của Minutocellus ở các nhiệt độ nuôi vẫn ổn định với số lượng tế bào thấp nhất khoảng 150,5 ± 17,2 x 104 tế bào/ml ở 30oC và cao nhất là 240,3 ± 12,2 x 104 tế bào/ ml ở 18oC. Bảng 2. Tốc độ tăng trưởng và tỉ lệ phân chia tế bào của Neorhodella sp. và Minutocellus sp. ở 4 nhiệt độ khác nhau (n = 3) Loài tảo Nhiệt độ (°C) 18 22 26 30 Tỉ lệ tăng trưởng μ (ngày–1) Neorhodella sp. 1,55±0,10 1,49±0,20 0,44±0,08 0,47±0,02 Minutocellus sp. 0,39±0,01 0,37±0,05 0,36±0,08 0,32±0,02 Tỉ lệ phân chia tế bào (ngày–1) Neorhodella sp. 2,24 2,15 0,63 0,68 Minutocellus sp. 0,56 0,53 0,52 0,46 Kết quả tính toán tốc độ tăng trưởng cho thấy Neorhodella sp. và Minutocellus sp. nuôi ở 18oC có tỷ lệ tăng trưởng cao nhất, lần lượt là 1,62 ± 0,39 và 0,39 ± 0,01. Trong khi đó, tốc độ tăng trưởng thấp nhất là cụ thể Neorhodella sp. ở 26oC (0,45 ± 0,13) , và Minutocellus sp. ở 30oC (0,32 ± 0,02) . Điều này đồng nghĩa với tỉ lệ phân chia tế bào cũng đạt cao nhất ở 18oC, với dao động của mỗi loài là 0,63 - 2,24 ở Neorhodella sp. và 0,46 - 0,56 ở Minutocellus sp. (Bảng 2) . IV. THẢO LUẬN Các kết quả của 22 loài tảo silic đã trình bày trong đường tiêu hóa đã cho thấy tảo là thức ăn chính của nghêu vân Meretrix lusoria. Điều này phù hợp với mục đích phân lập và sử dụng tảo làm thức ăn cho giai đoạn ấu trùng và vị thành niên của hàu Thái Bình Dương , trai Greenshell™, bào ngư (Ragg và ctv., 2010; Barille’ và ctv., 2003, Knuckey và ctv., 2002, Chen , 2007). 63TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Trung tâm Nuôi trồng vi tảo nước mặn Hàn Quốc Marine (KMMCC) cũng sử dụng các kỹ thuật mao dẫn pipette và môi trường f/2 vừa để phân lập và nuôi cấy các loài tảo tại Hàn Quốc (Hur, 2008). Tuy nhiên, họ nuôi cấy vi tảo ở các mức nhiệt độ 15, 20 và 25°C trong khi các mẫu của chúng tôi đã được duy trì trong 18°C. Ngoài ra, một số loài được trình bày trong nghiên cứu này cũng đã được nuôi cấy tại KMMCC, như Cyclotella striata (Kützing Grunow), Paralia sulcata (Ehrenberg Cleve), Trachyneis aspera (Ehrenberg Cleve) và Prorocentrum micans Ehrenberg. Hai loài Neorhodella sp. và Minutocellus sp. tốc độ tăng trưởng tối đa đạt ở nhiệt độ 18oC, và chúng có tốc độ tăng trưởng chậm hơn và mật độ tế bào cũng giảm khi nuôi ở nhiệt độ trên 26oC. Điều này cho thấy khoảng nhiệt độ tối ưu cho sự phát triển tốt nhất của hai chủng trên là từ 18oC đến 22oC. Theo công bố của Giovagnetti và ctv., (2012), Minutocellus RCC967 tăng trưởng tối ưu trong điều kiện ánh sáng có cường độ 100 mmol photon m-2 s-1 ở 20oC, với điều kiện này nó đạt được tốc độ tăng trưởng cao nhất (0,82 ± 0,02) nhưng sau đó sẽ giảm nếu cường độ ánh sáng tăng cao hơn. Ngược lại, tỷ lệ tăng trưởng của Minutocellus RCC703 dần dần tăng lên trong phạm vi ánh sáng là 500 mmol photon m-2 s-1 đạt tốc độ tăng trưởng cao nhất (1,97 ± 0,15). Dựa trên kết quả của tốc độ tăng trưởng, Minutocellus sp. nuôi ở điều kiện 90 m-2 s-1 ở 18oC tương ứng với giống Minutocellus RCC967. Kết quả nghiên cứu cho thấy Minutocellus sp. có xu hướng giảm phân chia tế bào khi nhiệt độ tăng lên. Còn với hai chủng Minutocellus RCC967 và RCC703 thì có xu hướng tăng phân chia tế bào khi tăng cường độ ánh sáng. V. KẾT LUẬN Từ ống tiêu hóa của nghêu vân, Meretrix lusoria, đã ghi nhận được 34 loài vi tảo. Trong đó đã nuôi cấy thành công hai loài tảo thuần là Neorhodella sp. và Minutocellus sp. Đồng thời xác định được nhiệt độ tốt nhất cho sự phát triển của hai loài tảo trên là từ 18ºC đến 22ºC. 64 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 TÀI LIỆU THAM KHẢO Barille´, L., Haure, J., Pales-Espinosa, E., Morançais, M., 2003. Finding new diatoms for intensive rearing of the pacific oyster (Crassostrea gigas): energy budget as a selective tool. Aquaculture, 217: 501–514. Brown, M.R., Jeffrey, S.W., Volkman, J.K., Dunstan, G.A., 1997. Nutritional properties of microalgae for mariculture. Aquaculture, 151: 315-331. Chen, Y. C., 2007. Immobilization of twelve benthic diatom species for long-term storage and as feed for post-larval abalone Haliotis diversicolor. Aquaculture, 263: 97–106. Chung, E. Y., 2007. Oogenesis and sexual maturation in Meretrix lusoria (Röding 1798) (Bivalvia: Veneridae) in Western Korea. Journal of Shellfish Research, 26(1): 71–80. Coutteau, P., Sorgeloos, P., 1992. The use of algal substitutes and the requirement for live algae in the hatchery and nursery rearing of bivalve molluscs: an international survey. J. Shellfish Res., 11: 467– 476. Fritz Industries, Inc., 1997. Supplied Fritz f/2 Algae Food. Dallas, TX U.S.A. 75217. Giovagnetti, V., Cataldo, M. L., Conversano, F., Bru- net, C., 2012. Growth and photophysiological responses of two picoplanktonic Minutocellus species, strains RCC967 and RCC703 (Bacillariophyceae). European Journal of Phycology. 47(4): 408–420 Guillard, R.R.L., 1973. Methods for microflagellates and nanoplankton. In: Stein, J. (Ed.), Handbook of Phycological Methods. Cambridge Univ. Press, Cambridge: 80–81. Guillard, R.R.L., and Ryther, J. H., 1962. Studies on marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacaea (Cleve) Gran. Canadian Journal of Microbiology, 8: 229-239. Hoshaw, R.W., Rosowski, J.R., 1973. Methods for microscopic algae. In: Stein, J.R. (Ed.), Handbook of Phycological Methods. Culture Method and Growth Measurement. Cambridge Univ. Press, Cambridge, 53– 68. Hur, S.B., 2008. Korea Marine Microalgae Culture Center - List of Strains. Algae. Volume 23(3): 1-68 Kirsten M.M., Michael D. J. L., Robert G. S., 2010. Bangiophytes: From one Class to Six; Where Do We Go from Here?. Red Algae in the Genomic Age. Cellular Origin, Life in Extreme Habitats and Astrobiology Volume 13, 2010, pp 241-259 Karnjanapratum, S., Benjakul, S., Kishimura, H., Tsai, Y. H., 2013. Chemical compositions and nutritional value of Asian hard clam (Meretrix lusoria) from the coast of Andaman Sea. Food Chemistry, 141: 4138–4145. Knuckey, R. M., Brown, M. R., Barrett, S. M., Hallegraeff, G. M., 2002. Isolation of new nanoplanktonic diatom strains and their evaluation as diets for juvenile Pacific oysters (Crassostrea gigas). Aquaculture, 211: 253–274. Lake Michigan Mass Balance (LMMB) Methods Compendium,1997. ESS Method 150.1: Chlorophyll – Spectrophotometric. Volume 3, Chapter 4. Lee, A.C., Lin, Y. H., Lin, C. R., Lee, M.C., Chen, Y.P., 2007. Effects of components in seawater on the digging behavior of the hard clam (Meretrix lusoria). Aquaculture, 272: 636–643. Pettersen, A. K., Turchini, G. M., Jahangard, S., Ingram, B. A., Sherman, A. D. H., 2010. Effects of different dietary microalgae on survival, growth, settlement and fatty acid composition of blue mussel (Mytilus galloprovincialis) larvae. Aquaculture, 309: 115–124. Presscott, G. W., 1951. Algae of the Western Great Lakes Area. Cranbrook Institute of Science, Bloomfield Hills, MI . Bulletin No. 31. Ragg, N. L. C., King, N., Watts, E., Morrish, J., 2010. Optimising the delivery of the key dietary diatom Chaetoceros calcitrans to intensively cultured Greenshell™ mussel larvae, Perna canaliculus. Aquaculture, 306: 270–280. Ronquillo, J. D., Fraser, J., McConkey, A. J., 2012. Effect of mixed microalgal diets on growth and polyunsaturated fatty acid profile of European oyster (Ostrea edulis) juveniles. Aquaculture, 360-361: 64–68. Sarno, D., Kooistra, W. H. C. F., Medlin L. K., Perco- po, I., Zingone, A., 2005. Diversity in the genus Skeletonema (Bacillariophyceae): Skeletonema costatum (Bacillariophyceae) consists of several genetically and morphologically distinct species with the description of four new species. J Phycol, 41: 151–176. Tomas, C. R., 1997. Identifying Marine Phytoplankton. Florida Marine Research Institute, St. Petersburg, U.S.A. Academic Press. Yoosukh, W., & Matsukuma, A., 2001. Taxonomic study on Meretrix (Mollusca: Bivalvia) from Thailand. Phuket Marine Biological Center, 25(2): 451–460. 65TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 THE SPECIES COMPOSITION AND GROWTHS OF MICROALGAE ISOLATED FROM THE DIGESTIVE SYSTEM OF HARD CLAM (Meretrix lusoria) Dang Ngoc Thuy1* ABSTRACT Hard clam, Meretrix lusoria, is an abundant bivalve species in East and Southeast Asia (Yoosukh & Matsukuma, 2001). A total of 34 microalgae species were isolated from the digestive tract of hard clam in Gomso, Korea. Among them, 32 species were identified based on morphological characteristics by microscopic observation. Besides, Neorhodella sp. and Minutocellus sp. were successfully isolated to monospecies. Both Neorhodella sp. and Minutocellus sp. showed the highest growth at 18 oC with the specific growth rate and number of divisions per day of 1.62±0.39 and 2.24, and 0.39±0.01 and 0.56, respectively. Keywords: Meretrix lusoria, Neorhodella, Minutocellus, microalgae, hard clam. Người phản biện: TS. Nguyễn Thị Ngọc Tĩnh Ngày nhận bài: 18/11/2015 Ngày thông qua phản biện: 18/12/2015 Ngày duyệt đăng: 25/12/2015 1. Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No2 * Email: thdolly@yahoo.com
File đính kèm:
 thanh_phan_loai_va_dac_diem_tang_truong_cac_loai_tao_phan_la.pdf
thanh_phan_loai_va_dac_diem_tang_truong_cac_loai_tao_phan_la.pdf

