Nghiên cứu một số nhóm vi sinh vật phân giải tinh bột trong ao nuôi tôm ở Đầm Sam - Chuồn, Phú Vang, Thừa Thiên Huế
TÓM TẮT Hiện nay chất lượng nước tại các ao nuôi tôm ở vùng đầm phá Tam Giang - Cầu Hai đang giảm sút nghiêm trọng. Do đó việc đánh giá và tuyển chọn các chủng vi sinh vật bản địa có khả năng phân giải các hợp chất hữu cơ cao, đồng thời tạo các chế phẩm để xử lý ao nuôi là có ý nghĩa khoa học và thực tiễn. Từ các mẫu bùn ao nuôi tôm, đã phân lập tuyển chọn và tuyển chọn được chủng vi khuẩn V94 và chủng xạ khuẩn X65 có khả năng phân giải tinh bột mạnh. Kết quả nghiên cứu cho thấy, thời gian nuôi cấy tối ưu đối với chủng V94 là 72 giờ và chủng X65 là 108 giờ, hai chủng này sinh trưởng tốt trong khoảng pH từ trung tính đến kiềm yếu, nhiệt độ 30 - 35 0C và nồng độ muối NaCl 0,5 - 15‰. Hai chủng này còn có khả năng phân giải mạnh đối với protein, cellulose và lipid. Đặc biệt hơn, chủng X65 có khả năng kháng với cả 5 loại vi sinh vật kiểm định, trong đó kháng mạnh với 2 đối tượng gây bệnh cho tôm là Vibrio sp. và Vibrio parahaemolyticus

Trang 1

Trang 2
Trang 3

Trang 4

Trang 5

Trang 6
Tóm tắt nội dung tài liệu: Nghiên cứu một số nhóm vi sinh vật phân giải tinh bột trong ao nuôi tôm ở Đầm Sam - Chuồn, Phú Vang, Thừa Thiên Huế

cao, đồng thời tạo các chế phẩm để xử lý ao nuôi là có ý nghĩa khoa học và thực tiễn.
Từ các mẫu bùn ao nuôi tôm, đã phân lập tuyển chọn và tuyển chọn được chủng vi khuẩn V94 và chủng
xạ khuẩn X65 có khả năng phân giải tinh bột mạnh. Kết quả nghiên cứu cho thấy, thời gian nuôi cấy tối ưu đối
với chủng V94 là 72 giờ và chủng X65 là 108 giờ, hai chủng này sinh trưởng tốt trong khoảng pH từ trung tính
đến kiềm yếu, nhiệt độ 30 - 35 0C và nồng độ muối NaCl 0,5 - 15‰. Hai chủng này còn có khả năng phân giải
mạnh đối với protein, cellulose và lipid. Đặc biệt hơn, chủng X65 có khả năng kháng với cả 5 loại vi sinh vật kiểm
định, trong đó kháng mạnh với 2 đối tượng gây bệnh cho tôm là Vibrio sp. và Vibrio parahaemolyticus.
Từ khóa: vi sinh vật, tinh bột, bản địa, Phú Vang
ABSTRACT
Currently, the water quality at many shrimp ponds in Tam Giang-Cau Hai lagoon is being declined. Thus,
assessing and selecting the indigenous microorganisms with high ability to degrade organic materials as well as
the production of bio-preparations for treating shrimp ponds possess a practical and scientific significance.
From some sludge samples of many shrimp ponds, we isolated V94 bacterial strain and X65 actinomycetes strain
having high ability to degrade starch. Results showed that the optimal growth times for V94 and X65 were 72 and 108 hrs,
respectively; the pH, temperature and concentration of NaCl for their optimal growth were neutral to low pH, 30-350C and 0,5 -
15‰, respectively. Both strains also had the ability to strongly degrade protein, cellulose and lipid. Moreover, X65 strain had the
ability of antibacterian to 5 microorganisms especially two shrimps pathogens, Vibrio sp. and Vibrio parahaemolyticus.
Key words: microorganism; starch; indigenous; Phu Vang
1. Đặt vấn đề
Trong những năm gần đây, nghề nuôi tôm
ở đầm phá Tam Giang - Cầu Hai phát triển mạnh
mẽ, đặc biệt là các vùng ao nuôi thuộc đầm Sam
- Chuồn, Phú Vang, Thừa Thiên Huế. Hiện trạng
môi trường nước trong các ao nuôi này ngày
càng ô nhiễm nặng do một số nguyên nhân chính
như lượng thức ăn dư thừa quá nhiều, thời gian
thay nước không hợp lý và tôm chết do dịch
bệnh [1]. Điều này không những tác động tiêu
cực đến năng suất thu hoạch mà còn gây ra
những ảnh hưởng xấu cho môi trường sinh thái.
Do đó phân lập, tuyển chọn các chủng vi sinh
vật có khả năng sử dụng và chuyển hóa các hợp
chất hữu cơ gây ô nhiễm trong nguồn nước có ý
nghĩa rất lớn trong hướng nghiên cứu về môi
trường và phát triển bền vững. Đồng thời đây là
cơ sở cho việc sản xuất các chế phẩm vi sinh bản
địa làm sạch ao nuôi, góp phần giảm thiểu ô
nhiễm môi trường [2], [3], [4].
2. Đối tượng và phương pháp nghiên cứu
2.1. Đối tượng nghiên cứu
Các chủng vi khuẩn và xạ khuẩn có khả
năng phân giải tinh bột được phân lập từ bùn ao
nuôi tôm ở đầm Sam - Chuồn, Phú Vang, Thừa
Thiên Huế.
Các vi sinh vật kiểm định: Bacillus
pumilus, Staphylococcus aureus, Escherichia
coli, Vibrio sp. và Vibrio parahaemolyticus.
2.2. Phương pháp nghiên cứu
* Xác định hoạt tính enzyme amylase bằng
phương pháp khuếch tán trên thạch
- Nguyên tắc: Enzyme phản ứng với cơ
chất trong môi trường thạch làm cho môi trường
trở nên trong suốt. Độ lớn của vòng phân giải
TẠP CHÍ KHOA HỌC XÃ HỘI, NHÂN VĂN VÀ GIÁO DỤC TẬP 3, SỐ 2 (2013)
13
phản ánh hoạt tính của enzyme.
- Phương pháp tiến hành: Nuôi cấy vi sinh
vật trong môi trường dịch thể để thu dịch lọc
enzyme. Chuẩn bị môi trường thạch – tinh bột để
tạo giếng enzyme. Sau khi ủ dịch enzyme ở nhiệt
độ 300C trong thời gian 72 giờ, tiến hành nhuộm
màu bằng thuốc thử Lugol để xác định vòng
phân giải tinh bột [5].
* Thăm dò ảnh hưởng của một số điều
kiện nuôi cấy đến hoạt tính của amylase và sự
tích lũy sinh khối của các chủng vi sinh vật
Tiến hành nuôi cấy các chủng vi khuẩn
và xạ khuẩn đã được tuyển chọn trong môi trường
dịch thể tương ứng (môi trường Vinogradski đối
với chủng V94 và môi trường Gause I đối với
chủng X65) với nguồn carbon được thay bằng
tinh bột trong các điều kiện thời gian, pH môi
trường, nhiệt độ và nồng độ muối NaCl khác
nhau. Sau khi nuôi cấy, ly tâm tách riêng phần
dịch lọc và sinh khối. Xác định hoạt tính amylase
bằng phương pháp khuếch tán trên thạch và xác
định sinh khối theo phương pháp cân.
* Nghiên cứu đặc tính sinh lý, sinh hóa
của các chủng vi sinh vật
Khả năng phân giải protein, celllulose
và lipid: Tiến hành theo phương pháp khuếch
tán trên thạch. Khảo sát với protein, thay nguồn
nitrogen bằng casein với cellulose và lipid, thay
nguồn carbon tương ứng bằng CMC (Carboxyl
Methyl Cellulose) và dầu nành.
Khả năng kháng khuẩn: Tiến hành nuôi
cấy vi sinh vật, thu dịch lọc để kiểm tra khả năng
kháng khuẩn. Môi trường kiểm định sau khi khử
trùng và để nguội đến khoảng 450C, cho vi sinh
vật kiểm định vào rồi phân đều vào các đĩa petri.
Khi thạch nguội, tạo giếng, nhỏ dịch lọc kiểm tra
vào, đặt lạnh 40C từ 3 -5 giờ, rồi nuôi ở 300C sau
12 - 24 giờ, xác định hiệu số vòng vô khuẩn.
3. Kết quả và biện luận
3.1 Tuyển chọn
Với 206 chủng vi khuẩn và 96 chủng xạ
khuẩn có khả năng phân giải tinh bột phân lập
được từ những mẫu bùn trong các ao nuôi tôm ở
đầm Sam - Chuồn, chúng tôi tiến hành tuyển
chọn bằng phương pháp khuếch tán trên thạch,
kết quả thu được chủng vi khuẩn V94 và chủng
xạ khuẩn X65 có hoạt tính amylase mạnh nhất.
Hai chủng này được chọn cho các nghiên cứu
tiếp theo.
3.2. Ảnh hưởng của một số điều kiện nuôi cấy
đến hoạt tính amylase và sự tích lũy sinh khối
của chủng vi khuẩn V94 và chủng xạ khuẩn X65
3.2.1. Ảnh hưởng của thời gian nuôi cấy
Các chủng vi sinh vật được nuôi cấy trong
môi trường dịch thể tương ứng với các khoảng
thời gian khác nhau. Sau đó xác định hoạt tính
amylase và sinh khối khô.
Bảng 1. Ảnh hưởng của thời gian nuôi cấy đến hoạt tính amylase và sự tích lũy sinh khối của chủng V94 và X65
Thời gian (giờ)
Chủng V94 Chủng X65
D - d (mm)
SKK (mg/ml) D - d (mm)
SKK (mg/ml)
24 26,00 + 0,33 9,63 + 0,22 15,00 + 0,33 3,23 + 0,12
36 28,50 + 0,00 12,67 + 0,30 17,50 + 0,00 4,49 + 0,21
48 30,00 + 0,33 16,28 + 0,12 19,00 + 0,33 5,22 + 0,11
60 33,00 + 0,67 18,37 + 0,24 21,00 + 0,33 5,50 + 0,10
72 34,00 + 0,00 20,68 + 0,50 22,00 + 0,00 6,43 + 0,13
84 25,00 + 0,33 19,14 + 0,21 24,00 + 0,00 7,81 + 0,16
96 23,50 + 0,67 16,95 + 0,20 29,00 + 0,67 8,17 + 0,12
108 19,50 + 0,33 15,05 + 0,12 35,00 + 0,33 8,79 + 0,12
120 16,50 + 0,67 14,34 + 0,14 30,50 + 0,67 8,41 + 0,17
132 13,50 + 0,67 12,46 + 0,14 25,00 + 0,67 7,83 + 0,13
("D -d": đường kính vòng phân giải, "SKK": sinh khối khô)
UED JOURNAL OF SOCIAL SCIENCES, HUMANITIES AND EDUCATION VOL.3, NO.2 (2013)
14
Kết quả thu được cho thấy thời gian nuôi
cấy tối ưu của chủng V94 là 72 giờ và chủng
X65 là 108 giờ. Tốc độ sinh trưởng và sinh khối
cực đại của chủng V94 cao hơn hẳn so với chủng
X65. Tuy nhiên chủng X65 lại cho hoạt tính
amylase mạnh hơn.
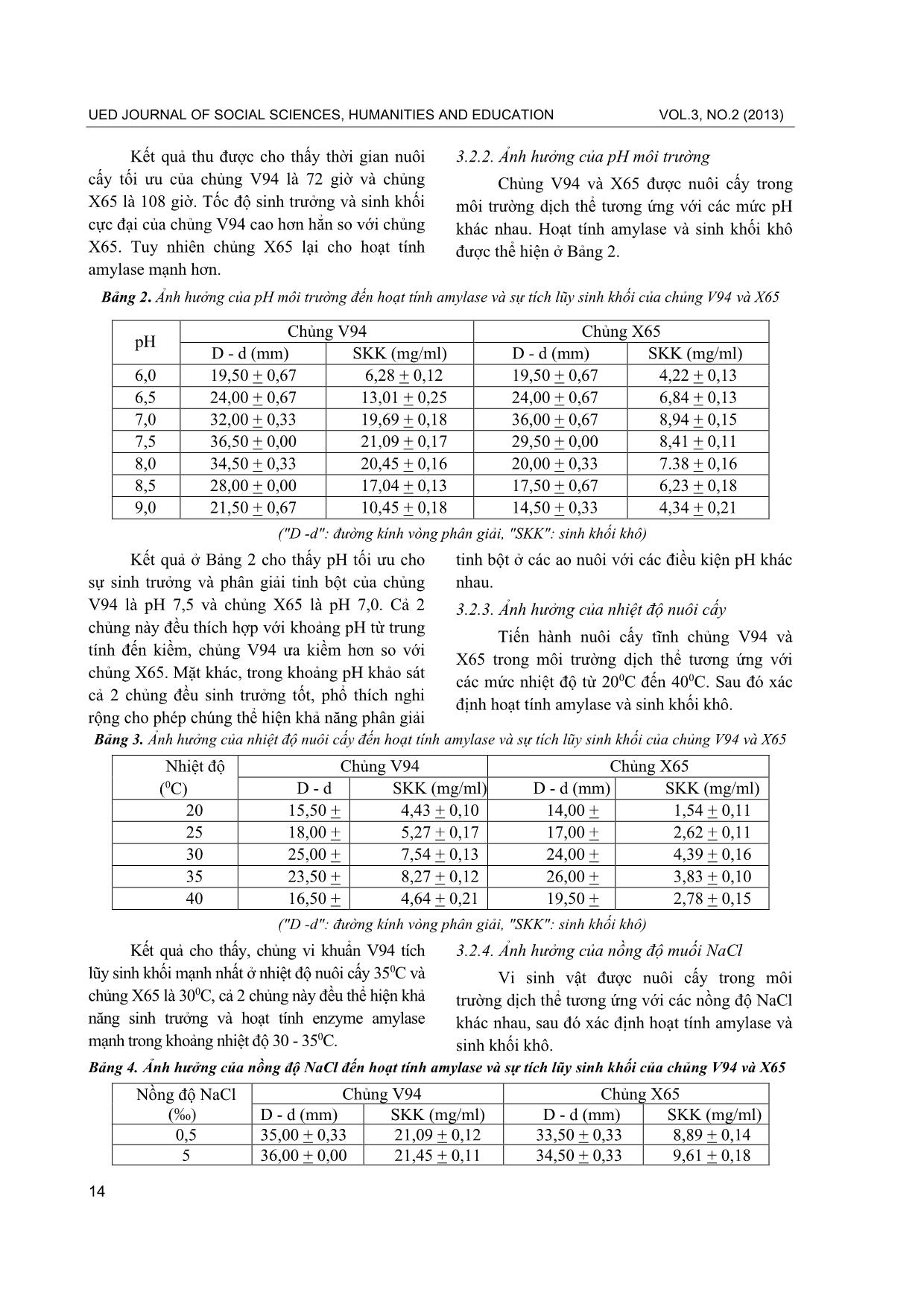
3.2.2. Ảnh hưởng của pH môi trường
Chủng V94 và X65 được nuôi cấy trong
môi trường dịch thể tương ứng với các mức pH
khác nhau. Hoạt tính amylase và sinh khối khô
được thể hiện ở Bảng 2.
Bảng 2. Ảnh hưởng của pH môi trường đến hoạt tính amylase và sự tích lũy sinh khối của chủng V94 và X65
pH
Chủng V94 Chủng X65
D - d (mm)
SKK (mg/ml) D - d (mm)
SKK (mg/ml)
6,0 19,50 + 0,67 6,28 + 0,12 19,50 + 0,67 4,22 + 0,13
6,5 24,00 + 0,67 13,01 + 0,25 24,00 + 0,67 6,84 + 0,13
7,0 32,00 + 0,33 19,69 + 0,18 36,00 + 0,67 8,94 + 0,15
7,5 36,50 + 0,00 21,09 + 0,17 29,50 + 0,00 8,41 + 0,11
8,0 34,50 + 0,33 20,45 + 0,16 20,00 + 0,33 7.38 + 0,16
8,5 28,00 + 0,00 17,04 + 0,13 17,50 + 0,67 6,23 + 0,18
9,0 21,50 + 0,67 10,45 + 0,18 14,50 + 0,33 4,34 + 0,21
("D -d": đường kính vòng phân giải, "SKK": sinh khối khô)
Kết quả ở Bảng 2 cho thấy pH tối ưu cho
sự sinh trưởng và phân giải tinh bột của chủng
V94 là pH 7,5 và chủng X65 là pH 7,0. Cả 2
chủng này đều thích hợp với khoảng pH từ trung
tính đến kiềm, chủng V94 ưa kiềm hơn so với
chủng X65. Mặt khác, trong khoảng pH khảo sát
cả 2 chủng đều sinh trưởng tốt, phổ thích nghi
rộng cho phép chúng thể hiện khả năng phân giải
tinh bột ở các ao nuôi với các điều kiện pH khác
nhau.
3.2.3. Ảnh hưởng của nhiệt độ nuôi cấy
Tiến hành nuôi cấy tĩnh chủng V94 và
X65 trong môi trường dịch thể tương ứng với
các mức nhiệt độ từ 200C đến 400C. Sau đó xác
định hoạt tính amylase và sinh khối khô.
Bảng 3. Ảnh hưởng của nhiệt độ nuôi cấy đến hoạt tính amylase và sự tích lũy sinh khối của chủng V94 và X65
Nhiệt độ
(0C)
Chủng V94 Chủng X65
D - d
(mm)
SKK (mg/ml) D - d (mm)
SKK (mg/ml)
20 15,50 +
0,33
4,43 + 0,10 14,00 +
0,67
1,54 + 0,11
25 18,00 +
0,00
5,27 + 0,17 1 ,00 +
0,00
2,62 + 0,11
30 25,00 +
0,00
7,54 + 0,13 24,00 +
0,00
4,39 + 0,16
35 23,50 +
0,67
8,27 + 0,12 26,00 +
0,67
3,83 + 0,10
40 16,50 +
0,33
4,64 + 0,21 19,50 +
0,33
2,78 + 0,15
("D -d": đường kính vòng phân giải, "SKK": sinh khối khô)
Kết quả cho thấy, chủng vi khuẩn V94 tích
lũy sinh khối mạnh nhất ở nhiệt độ nuôi cấy 350C và
chủng X65 là 300C, cả 2 chủng này đều thể hiện khả
năng sinh trưởng và hoạt tính enzyme amylase
mạnh trong khoảng nhiệt độ 30 - 350C.
3.2.4. Ảnh hưởng của nồng độ muối NaCl
Vi sinh vật được nuôi cấy trong môi
trường dịch thể tương ứng với các nồng độ NaCl
khác nhau, sau đó xác định hoạt tính amylase và
sinh khối khô.
Bảng 4. Ảnh hưởng của nồng độ NaCl đến hoạt tính amylase và sự tích lũy sinh khối của chủng V94 và X65
Nồng độ NaCl
(‰)
Chủng V94 Chủng X65
D - d (mm) SKK (mg/ml) D - d (mm) SKK (mg/ml)
0,5 35,00 + 0,33 21,09 + 0,12 33,50 + 0,33 8,89 + 0,14
5 36,00 + 0,00 21,45 + 0,11 34,50 + 0,33 9,61 + 0,18
TẠP CHÍ KHOA HỌC XÃ HỘI, NHÂN VĂN VÀ GIÁO DỤC TẬP 3, SỐ 2 (2013)
15
10 37,00 + 0,33 20,24 + 0,10 35,00 + 0,00 10,24 + 0,12
15 34,50 + 0,67 15,44 + 0,35 36,00 + 0,33 8,39 + 0,14
20 28,50 + 0,00 11,13 + 0,28 25,00 + 0,67 6,85 + 0,13
25 25,00 + 0,33 7,55 + 0,28 21,00 + 0,00 5,72 + 0,13
30 20,50 + 0,33 2,37 + 0,23 18,50 + 0,33 4,87 + 0,16
("D -d": đường kính vòng phân giải, "SKK": sinh khối khô)
Kết quả cho thấy 2 chủng V94 và X65 thích
nghi với khoảng nồng độ muối NaCl khá rộng khoảng
0,5 - 15‰. Ở nồng độ muối cao 20 - 30‰ cả hai
chủng vẫn có khả năng sinh trưởng, phát triển và thể
hiện hoạt tính amylase khá mạnh. Đây là ưu điểm nổi
trội của chủng giống để chúng thể hiện khả năng phân
giải tinh bột khi sử dụng làm chế phẩm xử lý ao nuôi.
3.2.5. Đặc tính sinh lý, sinh hóa của vi sinh vật
- Khả năng phân giải các hợp chất hữu cơ
Tiến hành nuôi cấy để thăm dò khả năng
phân giải protein, cellulose và lipid của chủng
V94 và X65 bằng phương pháp khuếch tán trên
thạch đĩa. Kết quả được thể hiện qua Bảng 5 và
Hình 2 dưới đây.
Bảng 5. Khả năng phân giải các hợp chất hữu cơ của chủng V94 và X65
Cơ Chất
Chủng V94 Chủng X65
KTVPG (mm) ĐKVPG (mm) KTVPG (mm) ĐKVPG (mm)
Protein 27,00 + 0,33 23,50 + 0,00 30,00 + 0,00 22,50 + 0,33
Cellulose 28,00 + 0,00 35,00 + 0,33 24,00 + 0,67 28,00 + 0,67
Lipid 39,00 + 0,67 35,00 + 0,33 22,00 + 0,33 23,50 + 0,33
(KTVPG: kích thước vạch phân giải, ĐKVPG: đường kính vòng phân giải)
Kết quả cho thấy, 2 chủng V94 và X65
ngoài khả năng phân giải tinh bột mạnh, chúng
còn có khả năng phân giải mạnh các nguồn cơ
chất protein, cellulose và lipid. Khả năng phân
giải mạnh với nhiều chất hữu cơ khác nhau của 2
chủng này là một lợi thế rất lớn trong việc tạo
chế phẩm xử lý ô nhiễm ao nuôi tôm.
V94
X65
Hình 1. Vòng phân giải tinh bột của dịch enzyme amylase tách từ chủng
V94 và X65 nuôi cấy trong điều kiện tối ưu
Hình 2. Vòng phân giải protein, cellulose và lipid của dịch enzyme tách từ chủng V94 và X65
V9
4
V9
4
V9
4
X6
5
Pr
otein
Lip
id
Cellul
ose
X6
5
X6
5
UED JOURNAL OF SOCIAL SCIENCES, HUMANITIES AND EDUCATION VOL.3, NO.2 (2013)
16
- Khả năng kháng khuẩn
Tiến hành thăm dò khả năng kháng khuẩn
của chủng V94 và X65 đối với 5 loại vi sinh vật
kiểm định gồm B. pumilus, S. aureus, E. coli, Vibrio
sp. và V. parahaemolyticus. Kết quả được thể hiện
qua Bảng 6 và Hình 3 dưới đây.
Bảng 6. Khả năng kháng khuẩn của chủng V94 và X65 đối với các vi sinh vật kiểm định
Vi sinh vật kiểm định
Hiệu số vòng vô khuẩn (mm)
Chủng V94 Chủng X65
B. pumilus (G+) 0,00 22,00 + 0,33
S. aureus (G+) 0,00 23,00 + 0,00
E. coli (G-) 0,00 27,00 + 0,67
Vibrio sp. (G-) 0,00 24,50 + 0,33
V. parahaemolyticus (G-) 0,00 29,50 + 0,33
Các thí nghiệm thăm dò bước đầu cho thấy,
chủng vi khuẩn V94 không có khả năng kháng với các
chủng vi sinh vật kiểm định, trong khi đó chủng xạ
khuẩn X65 lại có khả năng kháng với cả 5 loại vi sinh
vật kiểm định, đặc biệt là kháng mạnh với 2 đối tượng
gây bệnh cho tôm là Vibrio sp. và V.
parahaemolyticus.
4. Kết luận
- Hai chủng vi khuẩn V94 và xạ khuẩn
X65 có khả năng phân giải tinh bột mạnh được
phân lập từ bùn ao nuôi tôm ở đầm Sam -
Chuồn, Phú Vang, Thừa Thiên Huế.
- Thời gian nuôi cấy tối ưu đối với chủng
V94 là 72 giờ và chủng X65 là 108 giờ. Hai
chủng này sinh trưởng tốt trong khoảng pH từ
trung tính đến kiềm yếu, nhiệt độ 30 - 350C,
nồng độ NaCl tối thích 0,5 - 15 ‰.
- Hai chủng V94 và X65 có khả năng phân
giải mạnh protein, cellulose và lipid. Chủng X65
có khả năng kháng với 5 loại vi sinh vật kiểm
định, đặc biệt kháng mạnh với 2 chủng Vibrio
gây bệnh cho tôm.
TÀI LIỆU THAM KHẢO
[1] Nguyen Van Hop, Hoang Thai Long, Nguyen Hai Phong, Thuy Chau To (2005), Water quality of Tam Giang -
Cau Hai Lagoon: status, concerns and control solution, Proceedings of National Conference on Thua Thien
Hue lagoon, Ministry of Science and Technology and Thua Thien Hue people's Committee: 231 - 245.
[2] Ngô Thị Tường Châu, Nguyễn Ngọc Thanh (2007), Khả năng phân giải protein của các chủng vi
khuẩn phân lập từ nước thải nuôi tôm ở Thừa Thiên Huế, Hội nghị Khoa học Quốc gia về Sinh
thái và Tài nguyên Sinh vật, NXB Khoa học & Kỹ thuật, Hà Nội, Trang 333 - 338.
[3] Phạm Thị Ngọc Lan, Nguyễn Công Minh (2005), Ảnh hưởng của một số điều kiện nuôi cấy đến
hoạt động phân giải protein của vi khuẩn phân lập từ ao nuôi tôm ở phá Tam Giang - Cầu Hai,
tỉnh Thừa Thiên Huế, Những vấn đề nghiên cứu cơ bản trong khoa học sự sống, NXB Khoa học
& Kỹ thuật, Hà Nội, Trang 1117 – 1120.
[4] Phạm Thị Ngọc Lan, Huỳnh Ngọc Thành (2012), “Nghiên cứu nấm mốc có khả năng phân giải
tinh bột phân lập từ ao nuôi tôm ở đầm Sam - Chuồn, Thừa Thiên Huế”, Tạp chí Khoa học, Đại
học Huế, tập 63, số 4. Trang 157 - 165.
Hình 3. Vòng vô khuẩn của dịch nuôi cấy chủng X65 đối với Vibrio sp. và V. parahaemolyticus
Vibrio sp. Vibrio
parahaemolytic
us
TẠP CHÍ KHOA HỌC XÃ HỘI, NHÂN VĂN VÀ GIÁO DỤC TẬP 3, SỐ 2 (2013)
17
[5] Phạm Thị Ngọc Lan (2012), Thực tập vi sinh vật học, NXB Đại học Huế.
File đính kèm:
 nghien_cuu_mot_so_nhom_vi_sinh_vat_phan_giai_tinh_bot_trong.pdf
nghien_cuu_mot_so_nhom_vi_sinh_vat_phan_giai_tinh_bot_trong.pdf

