Một số kết quả về nghiên cứu bệnh hoại tử gan tụy cấp tính trên tôm nuôi ở đồng bằng sông Cửu Long và biện pháp kiểm soát
TÓM TẮT
Nghiên cứu này được thực hiện nhằm xác định diễn biến của bệnh hoại tử gan tụy trên tôm nuôi
trong ao và phòng thí nghiệm và đề xuất một số giải pháp hạn chế bệnh hoại tử gan tụy cấp tính.
51 mẫu tôm thu theo định kỳ 10 ngày/lần và 35 mẫu thu lúc dịch bệnh được kiểm tra bằng phương
pháp mô bệnh học. Dấu hiệu hoại tử gan tụy xuất hiện sớm nhất ở ngày thứ 17 và muộn nhất vào
ngày thứ 77 sau khi thả tôm vào ao nuôi. Tần suất xuất hiện hoại tử cao nhất được ghi nhận từ 20-
45 ngày. Tôm chết tập trung ở giai đoạn 19-31 ngày tuổi. Tất cả mẫu thu từ ao có tôm chết đều ghi
nhận dấu hiệu hoại tử gan tụy khá cao và phải thu hoạch sớm ngay sau khi phát hiện hoại tử 2-3
ngày. Điều đáng ghi nhận là tỷ lệ hoại tử biến động lớn giữa các ao (từ 9-90%). Điều này cho thấy
mức độ nguy hiểm của hội chứng gan tụy mặc dù khi chỉ phát hiện tỷ lệ hoại tử thấp. Tất cả các ao
ghi nhận có dấu hiệu hoại tử đều phải thu hoạch sớm. Tôm từ ao nuôi bị nhiễm AHPND ở mức độ
nhẹ chyển về phòng thí nghiệm có tỷ lệ chết không đáng kể sau 1 tháng nuôi. Việc tầm soát Vibrio
sp. và V. parahaemolyticus hiện diện trong nước và tôm nuôi trong ao được xem là khá quan trọng
làm cơ sở cho người nuôi có biện pháp giải quyết.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6

Trang 7
Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Một số kết quả về nghiên cứu bệnh hoại tử gan tụy cấp tính trên tôm nuôi ở đồng bằng sông Cửu Long và biện pháp kiểm soát

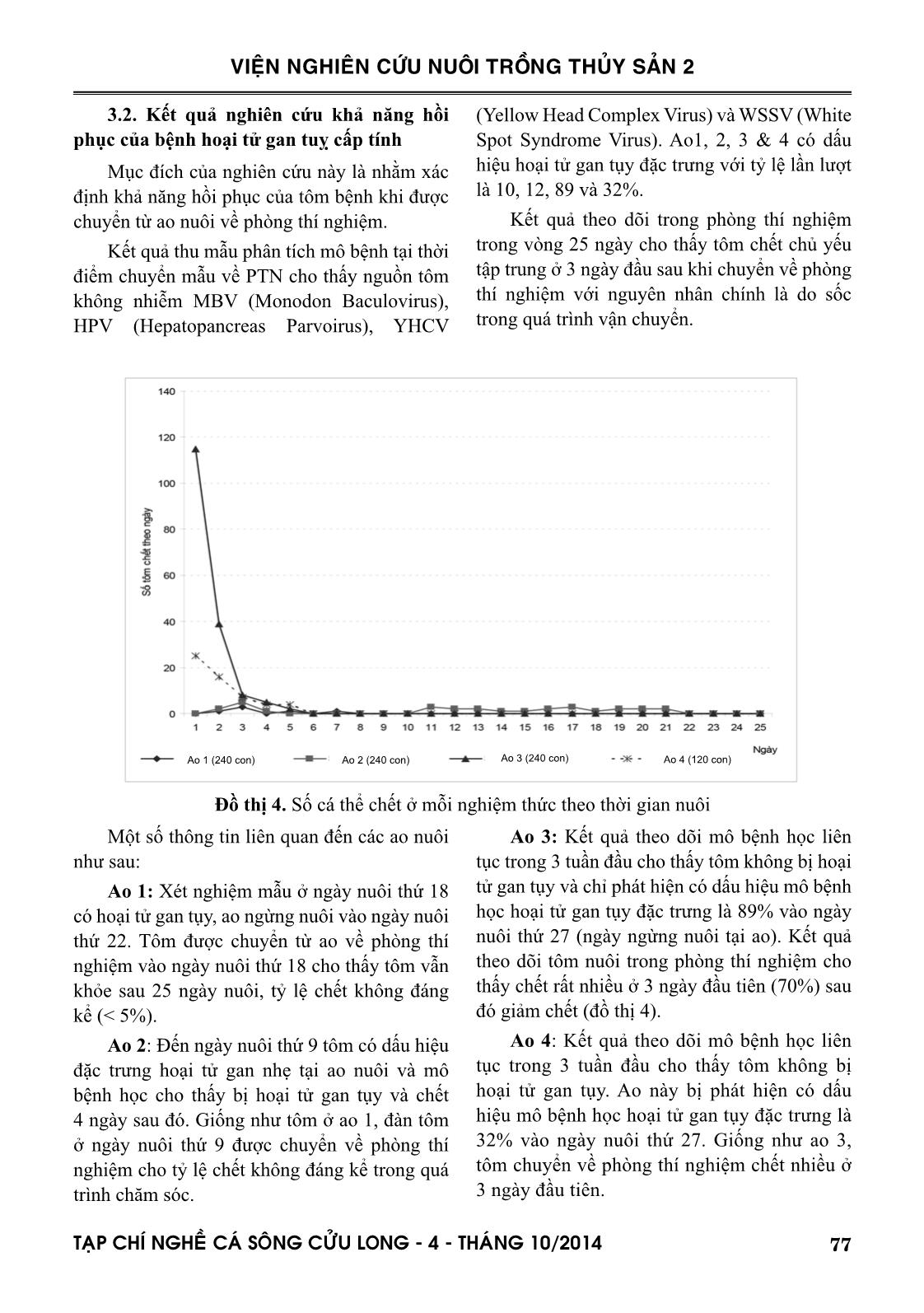
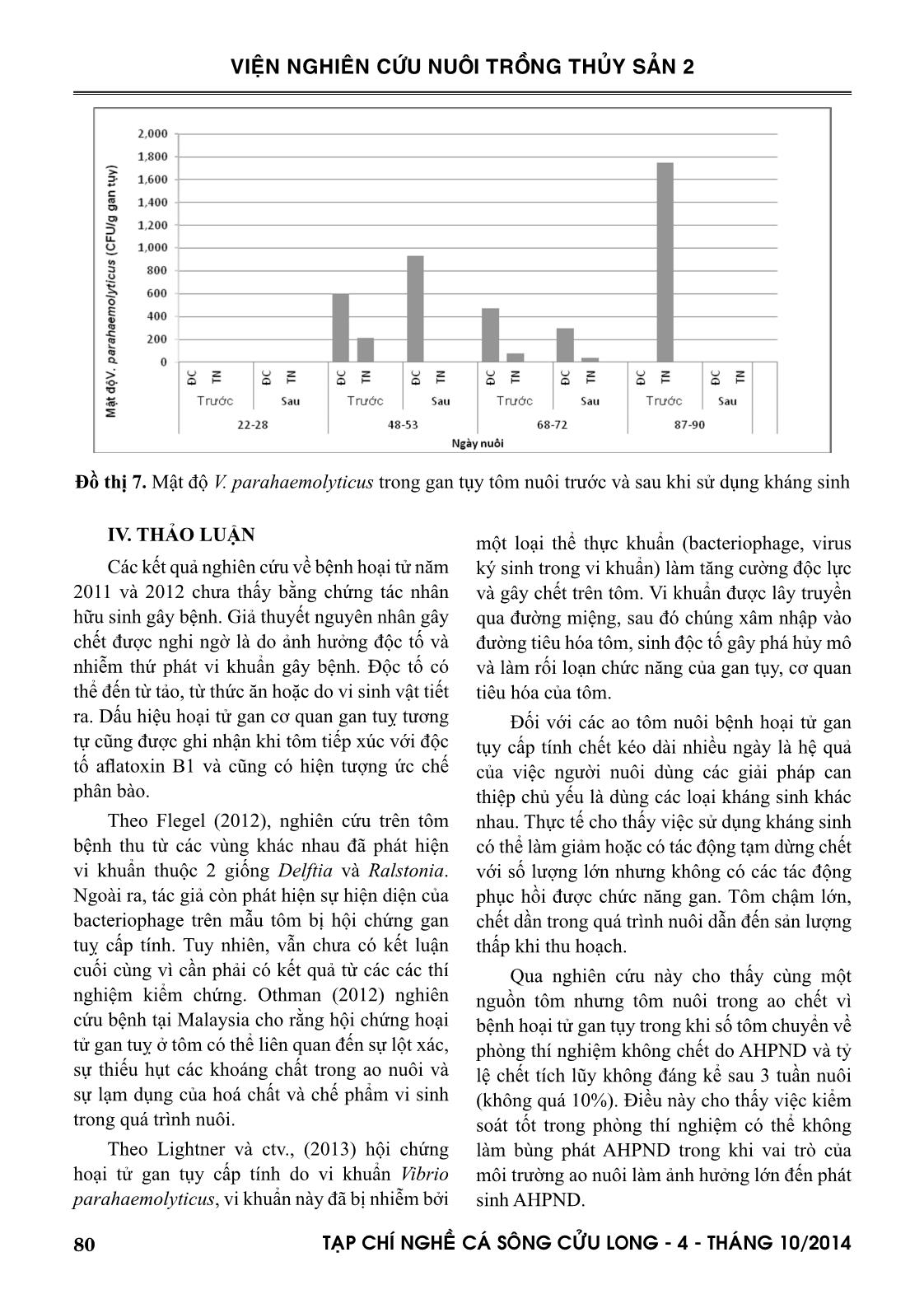
mẫu). Thời gian xuất hiện hoại tử từ 16-38 ngày tuổi. Tất cả các ao này đều phải thu hoạch sau 2-3 ngày phát hiện có hoại tử gan tụy (đồ thị 2). Qua khảo sát cho thấy đây là giai đoạn tập trung nhiều tôm chết nhất do AHPND. Đồ thị 2. Kết quả mô học khảo sát hoại tử gan tuỵ trên các mẫu tôm bệnh Đối với nhóm tôm chết kéo dài có tỷ lệ hoại tử thấp hơn tôm chết tại thời điểm thu mẫu (đồ thị 3). Đồ thị 3. Kết quả mô học xác định tỷ lệ hoại tử gan tuỵ trên nhóm tôm chết kéo dài hoặc có dấu hiệu hồi phục 77TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 4 - THAÙNG 10/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 3.2. Kết quả nghiên cứu khả năng hồi phục của bệnh hoại tử gan tuỵ cấp tính Mục đích của nghiên cứu này là nhằm xác định khả năng hồi phục của tôm bệnh khi được chuyển từ ao nuôi về phòng thí nghiệm. Kết quả thu mẫu phân tích mô bệnh tại thời điểm chuyển mẫu về PTN cho thấy nguồn tôm không nhiễm MBV (Monodon Baculovirus), HPV (Hepatopancreas Parvoirus), YHCV (Yellow Head Complex Virus) và WSSV (White Spot Syndrome Virus). Ao1, 2, 3 & 4 có dấu hiệu hoại tử gan tụy đặc trưng với tỷ lệ lần lượt là 10, 12, 89 và 32%. Kết quả theo dõi trong phòng thí nghiệm trong vòng 25 ngày cho thấy tôm chết chủ yếu tập trung ở 3 ngày đầu sau khi chuyển về phòng thí nghiệm với nguyên nhân chính là do sốc trong quá trình vận chuyển. Ao 1 (240 con) Ao 2 (240 con) Ao 3 (240 con) Ao 4 (120 con) Đồ thị 4. Số cá thể chết ở mỗi nghiệm thức theo thời gian nuôi Một số thông tin liên quan đến các ao nuôi như sau: Ao 1: Xét nghiệm mẫu ở ngày nuôi thứ 18 có hoại tử gan tụy, ao ngừng nuôi vào ngày nuôi thứ 22. Tôm được chuyển từ ao về phòng thí nghiệm vào ngày nuôi thứ 18 cho thấy tôm vẫn khỏe sau 25 ngày nuôi, tỷ lệ chết không đáng kể (< 5%). Ao 2: Đến ngày nuôi thứ 9 tôm có dấu hiệu đặc trưng hoại tử gan nhẹ tại ao nuôi và mô bệnh học cho thấy bị hoại tử gan tụy và chết 4 ngày sau đó. Giống như tôm ở ao 1, đàn tôm ở ngày nuôi thứ 9 được chuyển về phòng thí nghiệm cho tỷ lệ chết không đáng kể trong quá trình chăm sóc. Ao 3: Kết quả theo dõi mô bệnh học liên tục trong 3 tuần đầu cho thấy tôm không bị hoại tử gan tụy và chỉ phát hiện có dấu hiệu mô bệnh học hoại tử gan tụy đặc trưng là 89% vào ngày nuôi thứ 27 (ngày ngừng nuôi tại ao). Kết quả theo dõi tôm nuôi trong phòng thí nghiệm cho thấy chết rất nhiều ở 3 ngày đầu tiên (70%) sau đó giảm chết (đồ thị 4). Ao 4: Kết quả theo dõi mô bệnh học liên tục trong 3 tuần đầu cho thấy tôm không bị hoại tử gan tụy. Ao này bị phát hiện có dấu hiệu mô bệnh học hoại tử gan tụy đặc trưng là 32% vào ngày nuôi thứ 27. Giống như ao 3, tôm chuyển về phòng thí nghiệm chết nhiều ở 3 ngày đầu tiên. 78 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 4 - THAÙNG 10/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Tất cả 4 ao nuôi tôm đều chết vì bị hoại tử gan tụy cấp tính. 3.3. Kết quả theo dõi bệnh hoại tử gan tụy cấp tính đối với tôm nuôi trong phòng thí nghiệm và ngoài ao Mục đích của thí nghiệm này là theo dõi bệnh hoại tử gan tụy cấp tính trên cùng một nguồn tôm được nuôi song song trong ao và trong bể kính. Tôm nuôi được vận chuyển sống từ 2 ao tôm (Ao1&2) tại huyện Trần Đề, tỉnh Sóc Trăng về phòng thí nghiệm và nuôi trong bể kính. Số tôm bắt từ ao 1 là 125 con, tôm từ ao 2 có tổng số 175 con. Đối với tôm nuôi tại ao: Theo dõi và thu mẫu tôm định kỳ 7 ngày/lần để xem diễn biến của bệnh hoại tử gan tụy bằng phân tích mô học. Kết quả phân tích mô bệnh học trên mẫu thu định kỳ (Bảng 1) cho thấy nguồn mẫu thu định kỳ đều không nhiễm MBV, HPV, YHCV và WSSV, tất cả các mẫu thu định kỳ đều không có dấu hiệu hoại tử gan tụy đến tuần thứ 5. Tuy nhiên, mẫu thu định kỳ tuần 7 trên ao Ao 2 có hoại tử gan tụy phải thu hoạch. Ao 1 mặc dù không phát hiện hoại tử gan tụy ở tuần thứ 5 nhưng ở tuần thứ 6 tôm chết do hoại tử gan tụy phải thu hoạch. Điều này cho thấy diễn tiến của bệnh hoại tử gan tụy cấp tính là rất nhanh. Bảng 1. Kết quả phân tích mô bệnh học thu mẫu định kỳ tại ao nuôi Tuần thu mẫu Kết quả phân tích mô học Ao1 MBV HPV WSSV YHCV KST HT1 HT2 Tuần 1 (-) (-) (-) (-) (-) (-) (-) Tuần 2 (-) (-) (-) (-) (+) (-) (-) Tuần 3 (-) (-) (+) (-) (+) (-) (-) Tuần 4 (-) (-) (-) (-) (+) (-) (-) Tuần 5 (-) (-) (-) (-) (+) (-) (-) Ao2 Tuần 2 (-) (-) (-) (+) (-) (-) (-) Tuần 3 (-) (-) (-) (-) (+) (-) (-) Tuần 4 (-) (-) (-) (-) (+) (-) (-) Tuần 5 (-) (-) (-) (-) (+) (-) (-) Tuần 6 (-) (-) (-) (-) (+) (-) (-) Tuần 7 (+) (-) (-) (-) (+) (+) (+) KST: ký sinh trùng; HT1: Hoại tử 1: bong tróc tế bào gan tụy; HT2: Hoại tử 2: có sự xuất hiện của các thể granuloma Đối với tôm nuôi trong bể kính: Theo dõi và thu mẫu định kỳ mỗi tuần 1 lần (3 cá thể/ nghiệm thức) và thu mẫu cá thể tôm yếu sắp chết (nếu có) để phân tích mô học. Tôm nuôi trong bể kính được theo dõi hàng ngày trong suốt 3 tuần. Kết quả cho thấy tỷ lệ chết ở tôm chuyển từ 2 ao nói trên không quá 10% sau 3 tuần nuôi trong PTN. Kết quả phân tích mô học định kỳ trong quá trình theo dõi cũng không có dấu hiệu hoại tử gan tụy, không nhiễm các mầm bệnh MBV, HPV, YHCV, WSSV, KST. 3.4. Thực nghiệm giải pháp kiểm soát bệnh hoại tử gan tụy cấp tính trong điều kiện thực địa thông qua việc tầm soát Vibrio tổng số và V. parahaemolyticus Việc tầm soát sự hiện diện của Vibrio trong môi trường nước ao nuôi trong suốt vụ nuôi (nhất là 2 tháng nuôi đầu tiên) là rất cần thiết đối với việc kiểm soát bệnh hoại tử gan tụy cấp tính. Trên cơ sở đó có biện pháp can thiệp kịp thời bằng chất diệt khuẩn và cấy vi 79TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 4 - THAÙNG 10/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 sinh thích hợp. Kết quả ở đồ thị 5 và 6 cho thấy hiệu quả phần nào của chất diệt khuẩn và chế phẩm vi sinh đối với việc kiểm soát Vibrio và V. parahaemolyticus trong nước ao nuôi. Ở hầu hết các trường hợp cho thấy mật độ Vibrio tổng số và V. parahaemolyticus giảm đáng kể sau khi cấy chế phẩm vi sinh. Đồ thị 5. Mật độ Vibrio trong nước ao nuôi trước diệt khuẩn, sau diệt khuẩn-trước khi cấy vi sinh và sau khi cấy vi sinh Đồ thị 6. Mật độ Vibrio parahaemolyticus trong nước ao nuôi trước diệt khuẩn, sau diệt khuẩn- trước khi cấy vi sinh và sau khi cấy vi sinh Cũng giống như việc tầm soát sự hiện diện của Vibrio trong môi trường nước, kiểm tra Vibrio trong cơ thể tôm nuôi cũng rất cần thiết. Trên cơ sở đó có thể dùng chất kháng khuẩn hay kháng sinh thích hợp khi cần thiết. Kết quả ở đồ thị 7 cho thấy hiệu quả phần nào của việc dùng kháng sinh đối với việc kiểm soát Vibrio và V. parahaemolyticus trong gan tụy tôm nuôi, mật độ Vibrio giảm sau khi sử dụng kháng sinh. 80 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 4 - THAÙNG 10/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Đồ thị 7. Mật độ V. parahaemolyticus trong gan tụy tôm nuôi trước và sau khi sử dụng kháng sinh IV. THẢO LUẬN Các kết quả nghiên cứu về bệnh hoại tử năm 2011 và 2012 chưa thấy bằng chứng tác nhân hữu sinh gây bệnh. Giả thuyết nguyên nhân gây chết được nghi ngờ là do ảnh hưởng độc tố và nhiễm thứ phát vi khuẩn gây bệnh. Độc tố có thể đến từ tảo, từ thức ăn hoặc do vi sinh vật tiết ra. Dấu hiệu hoại tử gan cơ quan gan tuỵ tương tự cũng được ghi nhận khi tôm tiếp xúc với độc tố aflatoxin B1 và cũng có hiện tượng ức chế phân bào. Theo Flegel (2012), nghiên cứu trên tôm bệnh thu từ các vùng khác nhau đã phát hiện vi khuẩn thuộc 2 giống Delftia và Ralstonia. Ngoài ra, tác giả còn phát hiện sự hiện diện của bacteriophage trên mẫu tôm bị hội chứng gan tuỵ cấp tính. Tuy nhiên, vẫn chưa có kết luận cuối cùng vì cần phải có kết quả từ các các thí nghiệm kiểm chứng. Othman (2012) nghiên cứu bệnh tại Malaysia cho rằng hội chứng hoại tử gan tuỵ ở tôm có thể liên quan đến sự lột xác, sự thiếu hụt các khoáng chất trong ao nuôi và sự lạm dụng của hoá chất và chế phẩm vi sinh trong quá trình nuôi. Theo Lightner và ctv., (2013) hội chứng hoại tử gan tụy cấp tính do vi khuẩn Vibrio parahaemolyticus, vi khuẩn này đã bị nhiễm bởi một loại thể thực khuẩn (bacteriophage, virus ký sinh trong vi khuẩn) làm tăng cường độc lực và gây chết trên tôm. Vi khuẩn được lây truyền qua đường miệng, sau đó chúng xâm nhập vào đường tiêu hóa tôm, sinh độc tố gây phá hủy mô và làm rối loạn chức năng của gan tụy, cơ quan tiêu hóa của tôm. Đối với các ao tôm nuôi bệnh hoại tử gan tụy cấp tính chết kéo dài nhiều ngày là hệ quả của việc người nuôi dùng các giải pháp can thiệp chủ yếu là dùng các loại kháng sinh khác nhau. Thực tế cho thấy việc sử dụng kháng sinh có thể làm giảm hoặc có tác động tạm dừng chết với số lượng lớn nhưng không có các tác động phục hồi được chức năng gan. Tôm chậm lớn, chết dần trong quá trình nuôi dẫn đến sản lượng thấp khi thu hoạch. Qua nghiên cứu này cho thấy cùng một nguồn tôm nhưng tôm nuôi trong ao chết vì bệnh hoại tử gan tụy trong khi số tôm chuyển về phòng thí nghiệm không chết do AHPND và tỷ lệ chết tích lũy không đáng kể sau 3 tuần nuôi (không quá 10%). Điều này cho thấy việc kiểm soát tốt trong phòng thí nghiệm có thể không làm bùng phát AHPND trong khi vai trò của môi trường ao nuôi làm ảnh hưởng lớn đến phát sinh AHPND. 81TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 4 - THAÙNG 10/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 Theo Shrimp New International tháng 10/2014 với thông tin điều tra từ sở Thủy sản ở Thái Lan đã đưa ra khuyến cáo đối với tôm giống thả thì tổng số Vibrio trên tôm post là không qua 1.000 CFU/g. Trong số này thì nhiều nhất chỉ là 100 CFU/g với khuẩn lạc xanh và còn lại 900 CFU/g là khuẩn lạc vàng. V. harveyi không được phép có mặt. Theo Pitogo (2012) thì sự đa dạng của vi sinh vật trong ao nuôi giảm nhanh sau 2-3 tuần. Từ ngày 20 -30 sau khi thả tôm tổng vi sinh vật trong nước có xu thế giảm trong khi tổng vi khuẩn Vibrio và tổng vi khuẩn phát sáng có xu thế tăng cao nhất. Số lượng vi khuẩn phát sáng hiện diện với mức độ thấp trước khi có hiện tượng tôm chết trong ao và tăng cao nhất khi tôm bắt đầu chết và ổn định trong một thời gian dài (10 ngày kể từ tôm bắt đầu chết). Có trường hợp Vibrio harveyi hiện diện trong môi trường ở mức <10 CFU/ml nhưng sẽ gây chết tôm sau vài ngày khi mật độ tăng lên 10² CFU/ml. Mật độ Vibrio harveyi từ 10-99.000 CFU/pls ở trại giống so với 5-95 CFU/pls ngoài tự nhiên. Theo Lisuwan (2014), màu sắc của gan tụy tôm có liên quan đến tổng số Vibrio và tỷ lệ chết. Tổng số Vibrio trong gan tụy lên đến 6,02 x 107CFU/g đối với nhóm tôm có gan tụy trắng nhợt nhạt và chết trong vòng 10 ngày sau khi thả nuôi. Trong khi mật độ Vibrio thấp hơn (3,5 x 103CFU/g) trong nhóm tôm có gan tụy màu nâu biểu hiện tình trạng gan tụy tốt hơn và tỷ lệ sống trên 60%. V. KẾT LUẬN Bệnh hoại tử gan tụy xuất hiện gần như trong suốt chu kỳ nuôi. Tần suất xuất hiện bệnh hoại tử gan tụy cấp tính cao nhất từ 20-45 ngày sau khi thả nuôi. Đối với mẫu tôm thu lúc có tôm chết trong ao ghi nhận tỷ lệ hoại tử gan tụy cao trong quần đàn tuy nhiên ở mức biến động cao (10-90%). Đối với các ao ghi nhận có dấu hiệu hoại tử đều phải thu hoạch sớm. Việc thay đổi cũng như kiểm soát môi trường nuôi trong điều kiện thí nghiệm có ảnh hưởng phần nào đến khả năng hồi phục của tôm bệnh hoại tử gan tụy cấp tính. Việc tầm soát sự hiện diện của Vibrio và V. parahaemolyticus trong nước ao nuôi và trong cơ thể tôm được xem là quan trọng trong việc kiểm soát bệnh hoại tử gan tụy cấp tính. Dựa trên cơ sở của việc tầm soát này mà người nuôi có thể can thiệp kịp thời khi phát hiện bất thường trong ao nuôi. TÀI LIỆU THAM KHẢO Lightner, D.V., 1996. A Handbook of Pathology and Diagnostic Procedures for Diseases of Penaeid Shrimp. World Aquaculture Society, Baton Rouge, Louisiana, USA, p. 304. Lightner, D.V., Redman, R.M., Pantoja, C.R., Noble, B.L., Loc Tran, 2012 Early Mortality Syndrome. Global aquaculture advocate 2/2012, p40 Loc Tran, Linda Nunan, Rita, M., Redman, Leone L., Mohney, Carlos, R., Pantoja, Kevin Fitzsimmon, Donald., V., Lightner., 2013. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Disease of Aquatic Organisms 105, 45-55 NACA, 2012. Final report Asia Pacific Emergency Regional Consultation on the Emerging Shrimp Disease: Early Mortality Syndrome (EMS)/ Acute Hepatopancreatic Necrosis Syndrome (AHPNS) Panakorn, S., 2012. Opinion article: more on early mortality syndrome in shrimp. Aqua Culture Asia Pacific, 8 (1): 8-10. Prachumwat, A., Thitamadee, A., Sriurairatana, S., Chuchird, S., Limsuwan, N., Jantratit, C., Chaiyapechara, W., Flegel, T.W., 2012. Shotgun sequencing of bacteria from AHPNS, a new shrimp disease threat for Thailand. Poster, National Institute for Aquaculture Biotechnology, Mahidol University, Bangkok, Thailand. 82 TAÏP CHÍ NGHEÀ CAÙ SOÂNG CÖÛU LONG - 4 - THAÙNG 10/2014 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 SOME RESEARCH RESULTS ON ACUTE HEPATOPANCREATIC NECROSIS DISEASE IN SHRIMP CULTURED IN MEKONG DELTA AND INITIAL SOLUTIONS Nguyen Van Hao1*, Le Hong Phuoc2 ABSTRACT This study was conducted to determine the evolution of AHPND in shrimp cultured in pond and in laboratory conditions. The prevention solution is proposed based on these results. Histopathological method was used to analyse 51 shrimp samples collected periodically every 10 days and 36 samples collected at disease outbreak. The earliest and latest signs of necrosis appeared on day 17 and 77 after stocking respectively. The highest frequency of necrosis appearance was recorded from 20 to 45 days after stocking. Mortality was concentrated in the period of 19-31 days of age. All shrimp samples collected at outbreak showed high prevalence of necrosis and lead to early harvesting after 2-3 days of necrosis detecting. It is interesting that the high variation of necrosis rate have been recorded between ponds (9-90%). This result shows the severity of AHPND although only low necrosis rate was detected. The early harvesting has been applied in all shrimp ponds with signs of necrosis. Shrimp form the slightly infected pond can survive in the labolatory condition for one month when water parameters were controlled. Monotring of Vibrio sp. and V. parahaemolyticus in the water and in the shrimp body seems to be important in control of AHPND. Based on this result, the farmers can decide the solution at certain periods. Keywords: Hepatopancreatitic necrosis syndrome, shrimp, harvest Người phản biện: ThS. Ngô Thị Ngọc Thủy Ngày nhận bài: 10/8/2014 Ngày thông qua phản biện: 28/8/2014 Ngày duyệt đăng: 05/9/2014 1 Research Institute for Aquaculture No2. 2 Southern Monitoring Center for Aquaculture Environment and Epidemic, Research Institute for Aquaculture No2. * Email: haoria2@hcm.vnn.vn
File đính kèm:
 mot_so_ket_qua_ve_nghien_cuu_benh_hoai_tu_gan_tuy_cap_tinh_t.pdf
mot_so_ket_qua_ve_nghien_cuu_benh_hoai_tu_gan_tuy_cap_tinh_t.pdf

