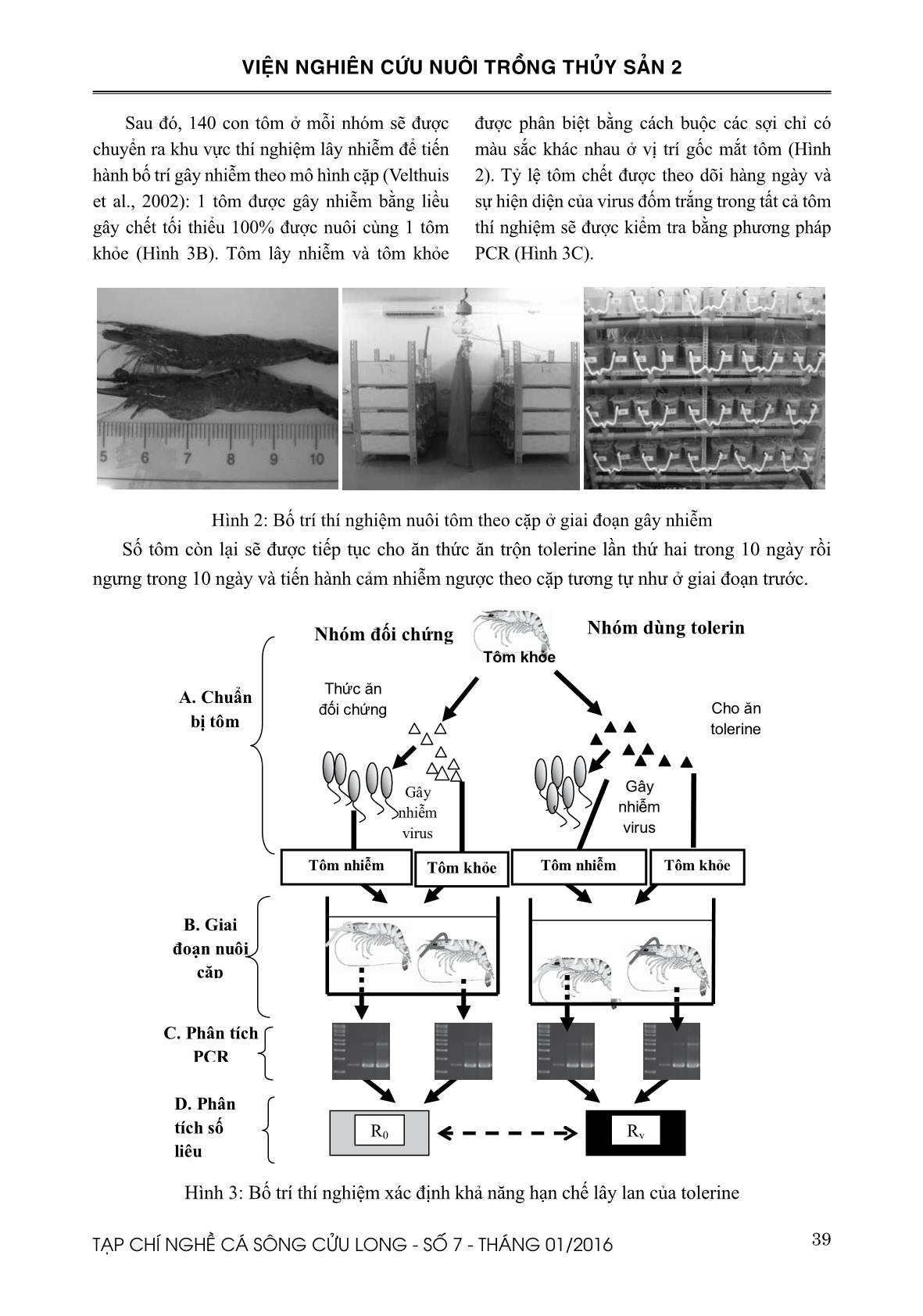
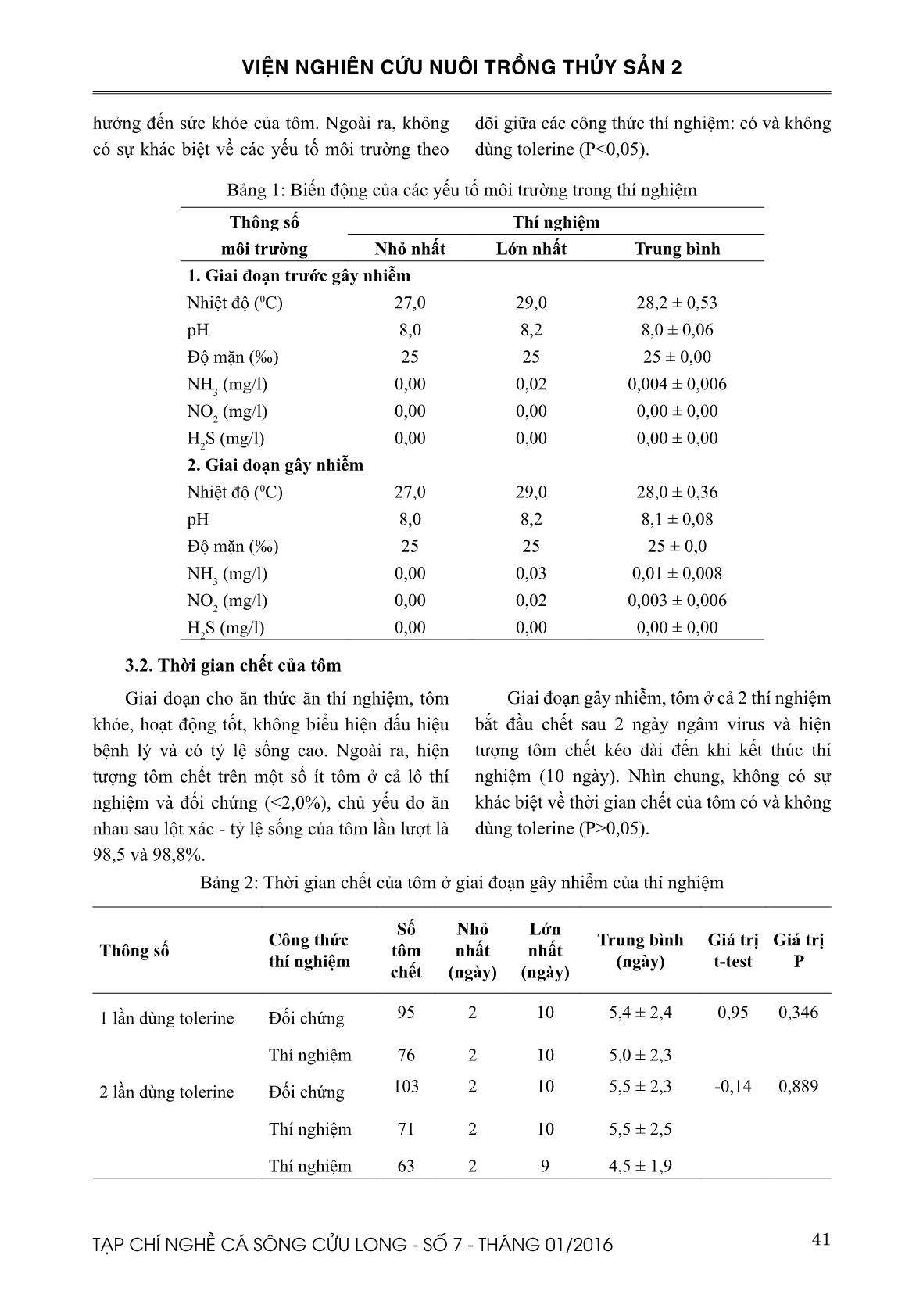
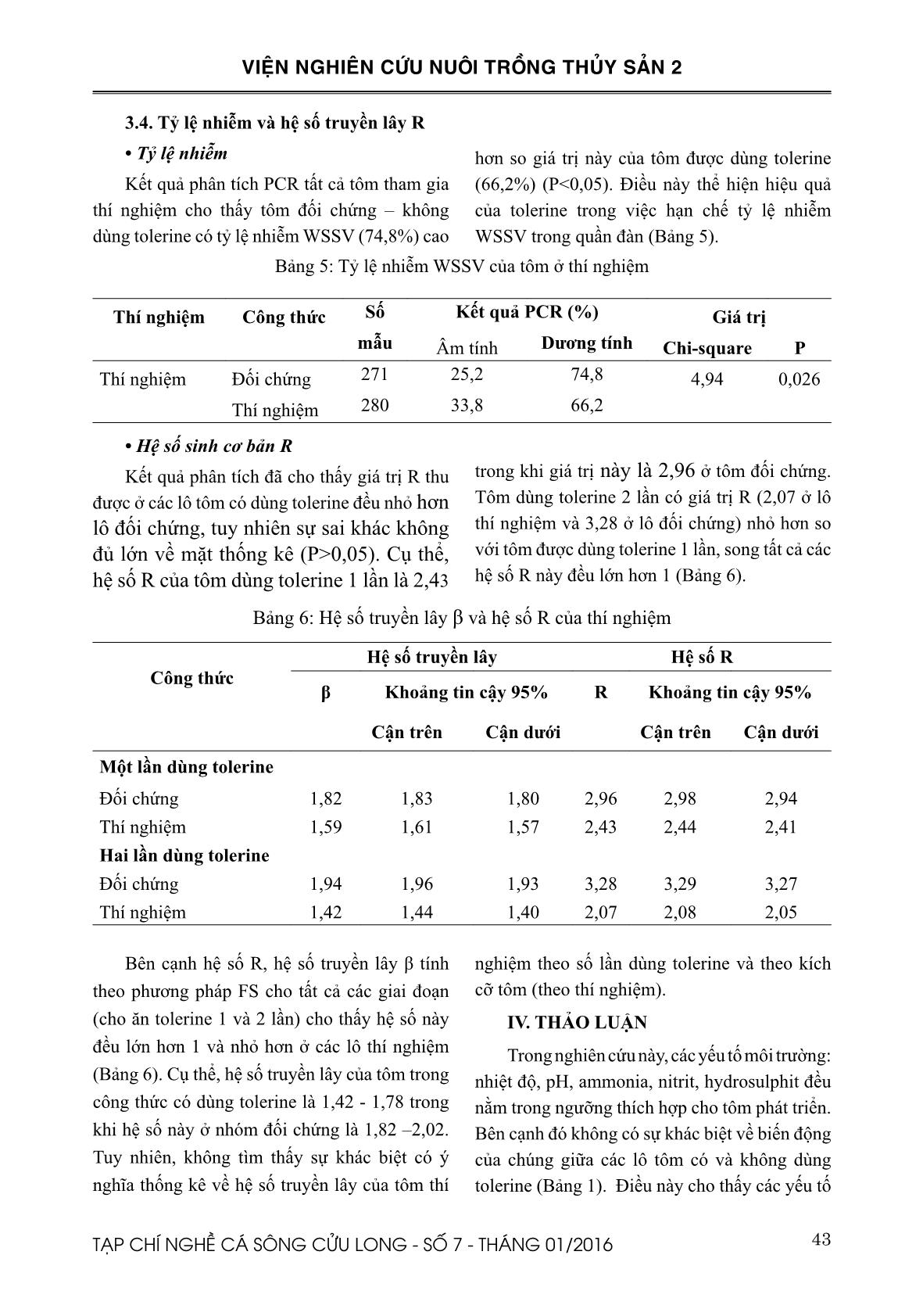
Hiệu quả của Tolerines trong việc hạn chế truyền lây virus gây bệnh đốm trắng cho tôm sú nuôi thương phẩm
TÓM TẮT
Tolerine - protein tái tổ hợp rVP28 - đã được nhiều nhà nghiên cứu xác định có khả năng bảo vệ tôm
trước virus gây bệnh đốm trắng (WSSV). Nghiên cứu này, ngoài xác định hiệu quả bảo vệ, hiệu quả
hạn chế truyền lây của protein tái tổ hợp rVP28 biểu hiện trong tế bào nấm men cũng được đánh giá
dựa trên hệ số sinh cơ bản R. Tôm được dùng tolerine 1 đợt hoặc 2 đợt (10 ngày đợt-1 và mỗi đợt
cách nhau 10 ngày). Sau đó, chúng được gây nhiễm theo cặp gồm 1 tôm khỏe và 1 tôm gây nhiễm
bằng WSSV trong cùng nhóm. Kết quả cho thấy tôm dùng tolerine có tỷ lệ chết (50,7 – 63,3%) và
tỷ lệ nhiễm (62,7 – 67,8%) thấp khác biệt có ý nghĩa thống kê với tôm đối chứng (72,4 – 75,7% và
74,8- 76,0%) (P < 0,05).="" ngoài="" ra,="" hệ="" số="" r="" của="" các="" lô="" tôm="" được="" dùng="" tolerine="" (2,07="" –="" 2,43)="" thấp="">
ở các lô tôm không dùng tolerine (2,96 – 3,28); tuy nhiên, các hệ số này đều lớn hơn 1 đã không
biểu thị khả năng hạn chế lây nhiễm virus gây bệnh đốm trắng của tolerine. Như vậy, việc nghiên
cứu các giải pháp kỹ thuật, quản lý kết hợp với việc sử dụng tolerine là cần thiết để góp phần làm
giảm khả năng lây lan của virus, hạn chế sự bùng phát của dịch bệnh.

Trang 1

Trang 2
Trang 3

Trang 4
Trang 5

Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Hiệu quả của Tolerines trong việc hạn chế truyền lây virus gây bệnh đốm trắng cho tôm sú nuôi thương phẩm

y đều lớn hơn 1 và nhỏ hơn ở các lô thí nghiệm (Bảng 6). Cụ thể, hệ số truyền lây của tôm trong công thức có dùng tolerine là 1,42 - 1,78 trong khi hệ số này ở nhóm đối chứng là 1,82 –2,02. Tuy nhiên, không tìm thấy sự khác biệt có ý nghĩa thống kê về hệ số truyền lây của tôm thí nghiệm theo số lần dùng tolerine và theo kích cỡ tôm (theo thí nghiệm). IV. THẢO LUẬN Trong nghiên cứu này, các yếu tố môi trường: nhiệt độ, pH, ammonia, nitrit, hydrosulphit đều nằm trong ngưỡng thích hợp cho tôm phát triển. Bên cạnh đó không có sự khác biệt về biến động của chúng giữa các lô tôm có và không dùng tolerine (Bảng 1). Điều này cho thấy các yếu tố 44 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 môi trường có diễn biến như nhau; do đó, ảnh hưởng giống nhau đến kết quả thí nghiệm ở các công thức. Nghiên cứu đã xác định tỷ lệ chết của tôm được dùng tolerine (50,7 – 63,3%) thấp khác biệt có ý nghĩa thống kê với tỷ lệ chết của các lô tôm không dùng tolerine (72,4 – 75,7%) (Bảng 4). Điều này cho thấy tolerine – protein tái tổ hợp VP28 biểu hiện trong tế bào nấm men P.pastoris– có khả năng bảo vệ cho tôm sú P.monodon nuôi thương phẩm trước WSSV. Kết quả tương tự đã được ghi nhận trong nghiên cứu của Witteveldt et al., (2004a) sau 21 ngày cho ăn tolerine – protein VP28 biểu hiện trong tế bào vi khuẩn E.coli, tôm sú có tỷ lệ chết sau gây nhiễm WSSV (50,0%) thấp hơn so với tôm đối chứng – không dùng tolerine (70,0%) và tỷ lệ này là 23,0% ở lô thí nghiệm và 93,0% ở lô đối chứng khi tôm được gây nhiễm ở giai đoạn 7 ngày sau dùng tolerine. Cùng sử dụng loại tolerine này trong một thí nghiệm khác trên tôm he Nhật Bản P. japonicus, các nhà nghiên cứu đã cho thấy tỷ lệ chết của tôm có dùng tolerine (22,0%) thấp hơn nhiều so với tôm đối chứng (73,0%) khi được gây nhiễm ở giai đoạn 10 ngày sau khi dùng tolerine (Satoh et al., 2008). Bên cạnh đó, mặc dù đã có nghiên cứu xác định khả năng bảo vệ cao hơn của tolerine với WSSV khi tôm được dùng 2 lần bằng phương pháp tiêm (Namikoshi et al., 2004). Tuy nhiên, kết quả phân tích không có sự khác biệt về tỷ lệ chết giữa tôm được dùng một và hai lần tolerine trong cùng một thí nghiệm (Bảng 4). Hiện chưa có nghiên cứu nào về hiệu quả bảo vệ của tolerine theo số lần cho ăn; song Jha et al., (2006b) đã xác định sau 3 ngày dùng tolerine lần cuối, tỷ lệ bảo hộ của tolerine - rVP28 biểu hiện trong tế bào E.coli–cho crayfish khi được tiêm hai lần (50,5%) tương đương với khi crayfish được cho ăn tolerine trong 25 ngày (52,0%). Trong các nghiên cứu trước đây về hiệu quả của tolerine, hầu hết các tác giả chỉ đánh giá mức độ nhiễm của tôm được dùng tolerine sống sót sau thí nghiệm. Ở các nghiên cứu này, tất cả tôm sống sót đều âm tính với WSSV bằng PCR một bước (one step PCR) (Wei và Xu, 2009; Witteveldt et al., 2004a; Xu et al., 2006). Ở nghiên cứu này, chúng tôi đã dùng phương pháp semi-nested PCR - Đây là phương pháp có độ nhạy cao, có thể xác định được 5 fg WSSV DNA (tương đương với 20 phân tử virus) để xác định sự hiện diện của WSSV trong mô cơ ở đốt thứ 6 của tôm tham gia thí nghiệm. Kết quả phân tích cho thấy tolerine có khả năng hạn chế khả năng nhiễm WSSV trong quần đàn thể hiện ở tỷ lệ nhiễm WSSV thấp khác biệt có ý nghĩa thống kê của tôm được dùng tolerine so với tôm đối chứng (P<0,05) (Bảng 5). Tôm được dùng tolerine khi gây nhiễm với WSSV liều gây chết tối thiểu 100% có tỷ lệ nhiễm WSSV là 66,2%. Kết quả này gần giống như kết quả nghiên cứu của Satoh et al., (2008) khi tác giả dùng liều gây chết 50% để đánh giá hiệu quả của tolerine thì tôm thí nghiệm có tỷ lệ nhiễm từ 10% - 52,5% tùy theo phương pháp gây nhiễm (cho ăn, nhúng và tiêm). Trong nghiên cứu này, hệ số sinh cơ bản R của các lô thí nghiệm (2,07-2,43) nhỏ hơn so với lô đối chứng (2,96 – 3,28); song các giá trị này đều lớn hơn 1 và không khác biệt có ý nghĩa (Bảng 6). Điều này có nghĩa rằng việc lây nhiễm WSSV trong quần đàn tôm có và không dùng tolerine đều đủ có thể gây thành dịch bệnh. Tương tự hệ số sinh cơ bản, hệ số truyền lây β cũng nhỏ hơn ở các lô thí nghiệm tuy nhiên không tìm thấy sự khác biệt giữa lô thí nghiệm (1,42 – 1,59); và lô đối chứng (1,82-1,94). Nếu hệ số truyền lây β này được tính theo giờ, nó sẽ tương đương với 0,0059 -0,0074.giờ-1 ở tôm có dùng tolerine và 0,0076 - 0,0084.giờ-1 ở lô không được dùng tolerine. Giá trị β thu được trên tôm 45TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 đối chứng tương đương với hệ số truyền lây Tuyen et al., (2014b) tìm được cho tôm sú và tôm chân trắng P. vannamei trong thí nghiệm nuôi cặp chung (hệ số truyền lây virus trực tiếp từ tôm sang tôm và hệ số truyền lây gián tiếp từ nước sang tôm đều bằng 0,0081.giờ-1). Nếu tính theo công thức của Soto và Lotz (2001), thì hệ số truyền lây β của thí nghiệm (0,012 – 0,017 – Bảng 7) nằm trong khoảng tin cậy 95% của hệ số truyền lây mà hai tác giả đã tìm được trên tôm thẻ P. vannamei bằng phương pháp nuôi chung (0,00 – 0,12). Tương tự như kết quả phân tích hệ số truyền lây bằng phương pháp FS, các hệ số truyền lây tính theo Soto và Lotz (2001) cũng nhỏ hơn ở các lô thí nghiệm nhưng không khác biệt có ý nghĩa thống kê. Bảng 7: Hệ số truyền lây của thí nghiệm được tính theo Solo và Lotz (2001) Thông số Số lần dùng β Khoảng tin cậy 95% Tolerine Cận trên Cận dưới Đối chứng 1 lần 0,015 0,030 -0,001 2 lần 0,015 0,029 0,000 Dùng tolerine 1 lần 0,013 0,028 -0,003 2 lần 0,012 0,028 -0,004 Như vậy, kết quả về hệ số sinh cơ bản và hệ số truyền lây ở trên cho thấy tolerine chưa thể hiện được hiệu quả trong việc giảm khả năng truyền lây của WSSV trong quần đàn. Điều này cũng giống như kết quả nghiên cứu của Thuy et al., (2014) về hiệu quả của tolerine – protein tái tổ hợp VP28 biểu hiện trong E.coli – trên tôm thẻ P.vannamei. Tác giả đã xác định rằng mặc dù có khả năng làm giảm tỷ lệ chết của tôm sau gây nhiễm, nhưng tolerine này không hạn chế được khả năng truyền lây của WSSV. V. KẾT LUẬN VÀ ĐỀ XUẤT 5.1. Kết luận Tolerine – protein tái tổ hợp VP28 biểu hiện trong tế bào nấm men có thể bảo vệ tôm sú P.monodon nuôi thương phẩm với WSSV biểu hiện bởi tỷ lệ chết (50,7 – 63,3%) và tỷ lệ nhiễm WSSV (62,7 – 67,8%) thấp của tôm có dùng tolerine so với tôm đối chứng (tỷ lệ chết 72,4 – 75,7% và tỷ lệ nhiễm WSSV 74,8 – 76,0%) (P<0,05). Tolerine chưa thể hiện khả năng hạn chế lây nhiễm WSSV trong quần đàn do hệ số sinh cơ bản R của cả hai nhóm đối chứng và thí nghiệm đều lớn hơn 1 và không có sự khác biệt có ý nghĩa về hệ số R giữa các lô có và không dùng tolerine. 5.2. Đề xuất Trong nghiên cứu này, mặc dù tolerine có thể bảo vệ được tôm trước WSSV, song chúng không hạn chế được khả năng lây lan của virus trong quần đàn. Do đó, cần có những nghiên cứu tiếp theo về các giải pháp kỹ thuật, quản lý kết hợp với việc sử dụng tolerine để làm giảm khả năng lây lan của virus, hạn chế sự bùng phát của dịch bệnh đốm trắng. 46 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 TÀI LIỆU THAM KHẢO Anderson, R.M., 1992. The concept of herb-immunity and the design of communit-based imunization programs. Vaccine 10, 928-935. Caipang, C.M.A., Verjan, N., Ooi, E.L., Kondo, H., Hirono, I., Aoki, T., Kiyono, H., Yuki, Y., 2008. Enhanced survival of shrimp, Penaeus (Marsupenaeus) japonicus from white spot syndrome disease after oral administration of recombinant VP28 expressed in Brevibacillus brevis. Fish & Shellfish Immunology 25, 315-320. Dejong, M.C.M., Kimman, T.G., 1994. Experimental quantification of vaccine-induced reduction in virus transmission. Vaccine 12, 761-766. Dieu, B.T.M., 2010. On the epidemiology and evolution of white spot syndrome virus of shrimp, Graduate school of production ecology and resources conservation. Wageningen University, p. 135. Jha, R.K., Xu, Z.R., Bai, S.J., Sun, J.Y., Li, W.F., Shen, J., 2007. Protection of Procambarus clarkii against white spot syndrome virus using recombinant oral vaccine expressed in Pichia pastoris. Fish & Shellfish Immunology 22, 295-307. Jha, R.K., Xu, Z.R., Pandey, A., 2006a. Protection of Procambarus clarkii against white spot syndrome virus using recombinant subunit injection vaccine expressed in Pichia pastoris. Fisheries Science 72, 1011-1019. Jha, R.K., Xu, Z.R., Shen, J., Bai, S.J., Sun, J.Y., Li, W.F., 2006b. The efficacy of recombinant vaccines against white spot syndrome virus in Procambarus clarkii. Immunology Letters 105, 68-76. Kiatpathomchai, W., Boonsaeng , V., Tassanakajon, A., C., W., Jitrapakdee, S., Panyim, S., 2001. A non-stop, single-tube, semi-nested PCR technique for grading the severityof white spot syndrome virus infections in Penaeus monodon. Disease of Aquatoc Organisms 47, 235-239. Kumar, R.S., Venkatesan, C., Sarathi, M., Sarathbabu, V., Thomas, J., Basha, K.A., Hameed, A.S.S., 2009. Oral delivery of DNA construct using chitosan nanoparticles to protect the shrimp from white spot syndrome virus (WSSV). Fish & Shellfish Immunology 26, 429-437. Namikoshi, A., Wu, J.L., Yamashita, T., Nishizawa, T., Nishioka, T., Arimoto, M., Muroga, K., 2004. Vaccination trials with Penaeus japonicus to induce resistance to white spot syndrome virus. Aquaculture 229, 25-35. Ning, J.F., Zhu, W., Xu, J.P., Zheng, C.Y., Meng, X.L., 2009. Oral delivery of DNA vaccine encoding VP28 against white spot syndrome virus in crayfish by attenuated Salmonella typhimurium. Vaccine 27, 1127-1135. Rout, N., Kumar, S., Jaganmohan, S., Murugan, V., 2007. DNA vaccines encoding viral envelope proteins confer protective immunity against WSSV in black tiger shrimp. Vaccine 25, 2778- 2786. Satoh, J., Nishizawa, T., Yoshimizu, M., 2008. Protection against white spot syndrome virus (WSSV) infection in kuruma shrimp orally vaccinated with WSSV rVP26 and rVP28. Diseases of Aquatic Organisms 82, 89-96. Singh, I.S.B., Manjusha, M., Pai, S.S., Philip, R., 2005. Fenneropenaeus indicus is protected from white spot disease by oral administration of inactivated white spot syndrome virus. Diseases of Aquatic Organisms 66, 265-270. Soto, M.A., Lotz, J.M., 2001. Epidemiological parameters of white spot syndrome virus infections in Litopenaeus vannamei and L.setiferus. Journal of Invertebrate Pathology 78, 9-15 Tuyen, N.X., Verreth, J., Vlak, J.M., de Jong, M.C.M., 2014b. Horizontal transmission dynamics of white spot syndrome virus by cohabitation trials in juvenile Penaeus monodon and P. vannnamei. Preventive Veterinary Medicine 117, 286-294. Thuy, N.T.N., M.P., Z., Vlak, J.M., De Jong, M.C.M., 2014. Transmission of white spot syndrome virus (WSSV) in vaccinated shrimp Penaeus vanamei, 9th Symposium on Diseases on Asian Aquaculture, Ho Chi Minh city, Vietnam. Xie, X.X., Li, H.Y., Xu, L.M., Yang, F., 2005. A simple and efficient method for purification of intact white spot syndrome virus (WSSV) viral particles. Virus Research 108, 63-67. Xu, Z., Du, H., Xu, Y., Sun, J., Shen, J., 2006. Crayfish Procambarus clarkia protected against white spot syndrome virus by oral administration of viral proteins expressed in silkworms. Aquaculture 253, 179-183. Velthuis, A.G.J., De Jong, M.C.M., De Bree, J., Nodelijk, G., Van Boven, M., 2002. Quantification of transmission in one-to-one experiments. Epidemiology and Infection 128, 193-204. Wei, K.Q., Xu, Z.R., 2009. Effects of oral recombinant VP28 expressed in silkworm (Bombyx mori) pupa on immune response and disease resistance of Procambarus clarkii. World Journal of Microbiology & Biotechnology 25, 1321-1328. Witteveldt, J., Cifuentes, C.C., Vlak, J.M., van Hulten, 47TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 M.C.W., 2004a. Protection of Penaeus monodon against white spot syndrome virus by oral vaccination. Journal of Virology 78, 2057-2061. Witteveldt, J., Vlak, J.M., van Hulten, M.C.W., 2004b. Protection of Penaeus monodon against white spot syndrome virus using a WSSV subunit vaccine. Fish & Shellfish Immunology 16, 571-579. Witteveldt, J., Vlak, J.M., van Hulten, M.C.W., 2006. Increased tolerance of Litopenaeus vannamei to white spot syndrome virus (WSSV) infection after oral application of the viral envelope protein VP28. Diseases of Aquatic Organisms 70, 167- 170. Zhu, F., Du, H.H., Miao, Z.G., Quan, H.Z., Xu, Z.R., 2009. Protection of Procambarus clarkii against white spot syndrome virus using inactivated WSSV. Fish & Shellfish Immunology 26, 685- 690. 48 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 7 - THÁNG 01/2016 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN 2 RECOMBINANT PROTEIN VP28 EXPRESSED IN Pichia pastoris AND ITS EFFECT ON TRANSMISSION OF WHITE SPOT SYNDROME VIRUS Ngo Thi Ngoc Thuy1*, Tran Ngoc Hieu1, Dang Thi Tra My1 ABSTRACT The effect of recombinant protein VP28 expressed in Pichia pastoris– tolerines - on prevention of white spot syndrome virus has been reported recently. In this study, effect of tolerines on WSSV was based on comparison not only on the mortalities but also on the basic reproduction ratio (R) between experimental groups. Black tiger shrimp Penaeus monodon in size of 2.6±0.5 gram/ individual were fed with tolerines for 1 and 2 times with a 10 day interval for experimental group and without tolerine for control group. On the 11th day after feeding on tolerine, half of shrimp number in each group were challenged with WSSV by immersion method, and then they were held in pairs in separate containers; in which, one WSSV challenged shrimp was reared with one healthy shrimp in the same group. The results showed that experimental shrimp group revealed significant lower rate of mortality (50.7 – 63.3%) and WSSV infection (62.7 – 67.8%) as compared to those of control group (72.4 – 75.7% and 74.8- 76.0%) (P<0.05). Additionally, the basic reproduction ration of experimental groups (2.07 – 2.43) were also lower than that of control groups (2.96 – 3.28). However, all those reproduction ratios were still higher than 1, consequently, recombinant protein VP28 expressed in P. pastoris did not reduce the transmission of WSSV. This suggests further study on management strategies along with tolerine utilization to prevent spread of WSSV in P.monodon shrimp should be taken. Keywords: Tolerine, transmission, white spot syndrome virus. Người phản biện: TS. Lê Hồng Phước Ngày nhận bài: 18/11/2015 Ngày thông qua phản biện: 18/12/2015 Ngày duyệt đăng: 25/12/2015 1. Research Sub-Institute for Nam Song Hau Fisheries, Research Institute for Aquaculture No.2. * Email: thuyngo08@yahoo.com
File đính kèm:
 hieu_qua_cua_tolerines_trong_viec_han_che_truyen_lay_virus_g.pdf
hieu_qua_cua_tolerines_trong_viec_han_che_truyen_lay_virus_g.pdf

