Đặc điểm sinh học sinh sản của loài ghẹ xanh Portunus pelagicus (Linnaeus, 1758) ở vùng biển Kiên Giang
Đặc điểm sinh học sinh sản của ghẹ xanh ở vùng biển Kiên Giang được phân tích dựa trên dữ liệu thu thập trong giai đoạn từ năm 2013 đến 2018. Kết quả đã cho thấy, mùa sinh sản của ghẹ xanh quanh năm, trong đó ghẹ đẻ tập trung ở tháng 3 và tháng 10. Ghẹ đực chiếm ưu thế trong cấu trúc quần đàn với tỷ lệ đực cái là 1,16:1,00. Kích thước ghẹ xanh thành thục và tham gia sinh sản lần đầu là 100 – 106 mm, trung bình 103 mm và có xu hướng giảm trong những năm gần đây. Sức sinh sản tuyệt đối của ghẹ xanh dao động 92 nghìn đến 2,266 triệu trứng, trung bình 641 nghìn trứng/cá thể. Sức sinh sản tương đối dao động 1,1-10 nghìn trứng/g cơ thể và trung bình 5 nghìn trứng/g cơ thể. Sức sinh sản tuyệt đối có tương quan với kích thước và khối lượng ghẹ theo phương trình Fe = 0,040303 * CW3,49377 và Fe = -134.700 + 6.267,28 * W. Dựa trên kết quả nghiên cứu, đề xuất giải pháp và kế hoạch quản lý bền vững nguồn lợi ghẹ xanh như: i) Cấm hoạt động khai thác vào tháng 3 và tháng 10; ii) Thả lại các cá thể ghẹ cái mang trứng (giai đoạn V) ở vùng biển chúng bị bắt; 3) Quy định kích thước mai ghẹ tối thiểu cho phép khai thác nên lớn hơn 10 cm

Trang 1

Trang 2
Trang 3
Trang 4

Trang 5

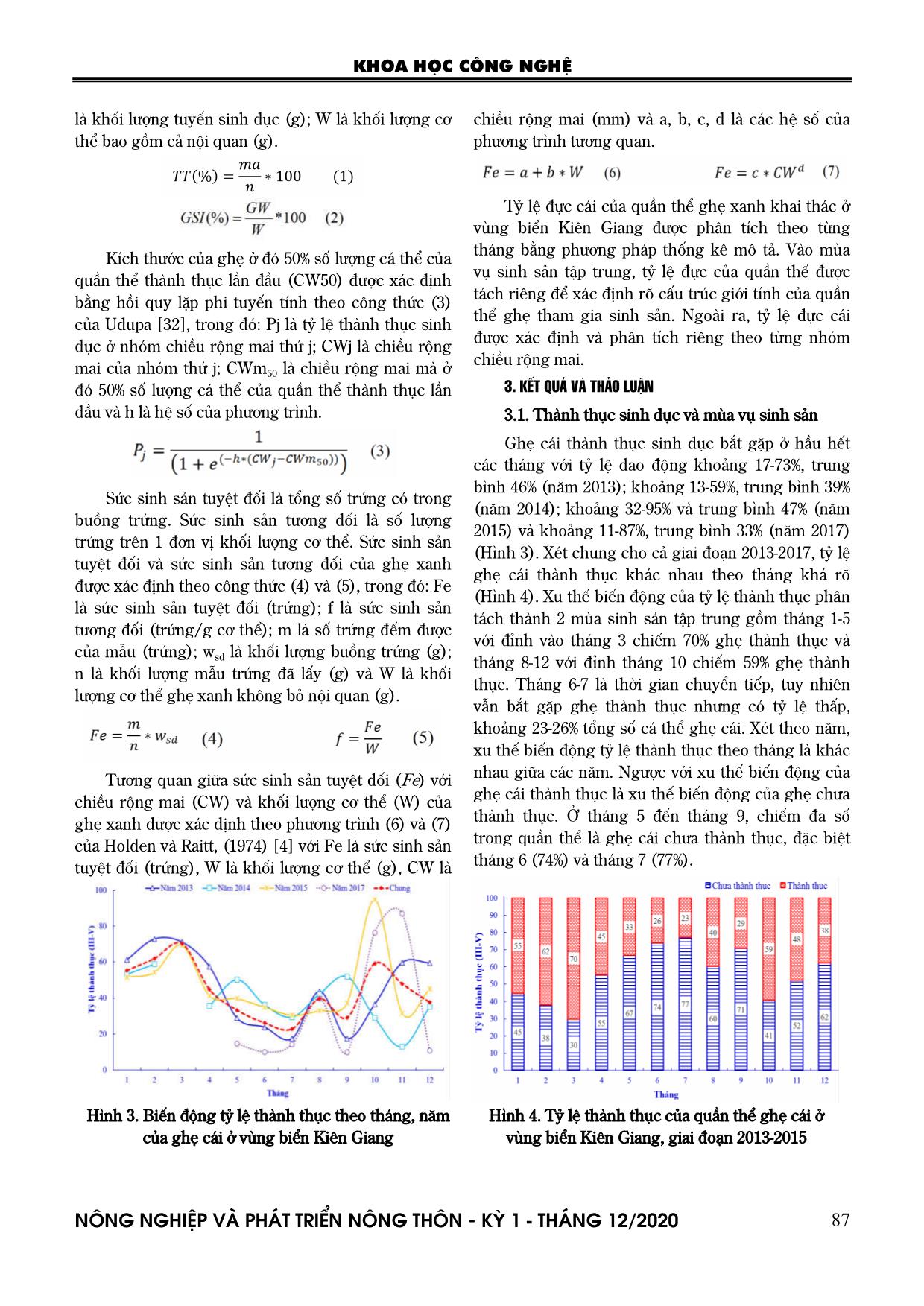
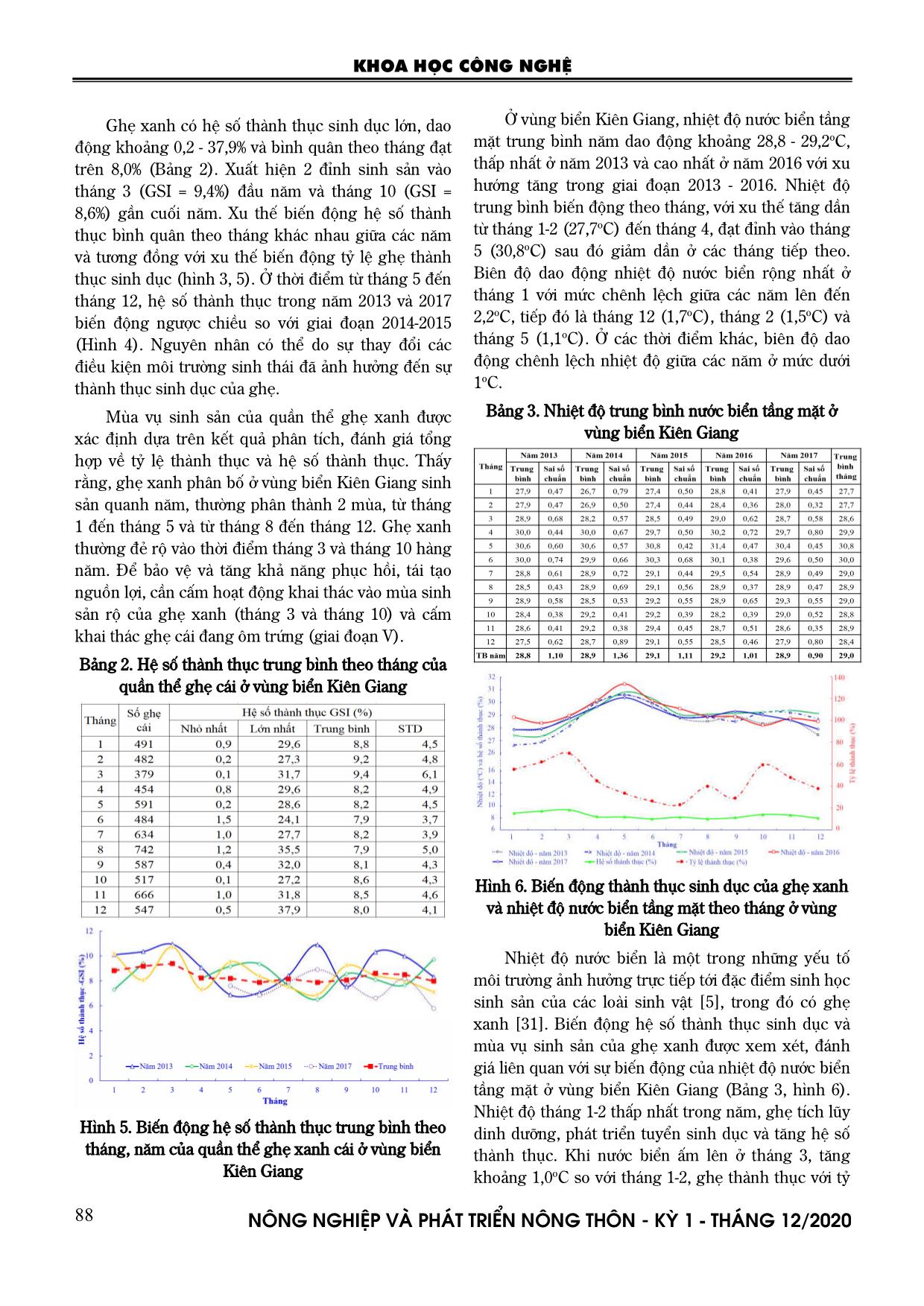
Trang 6
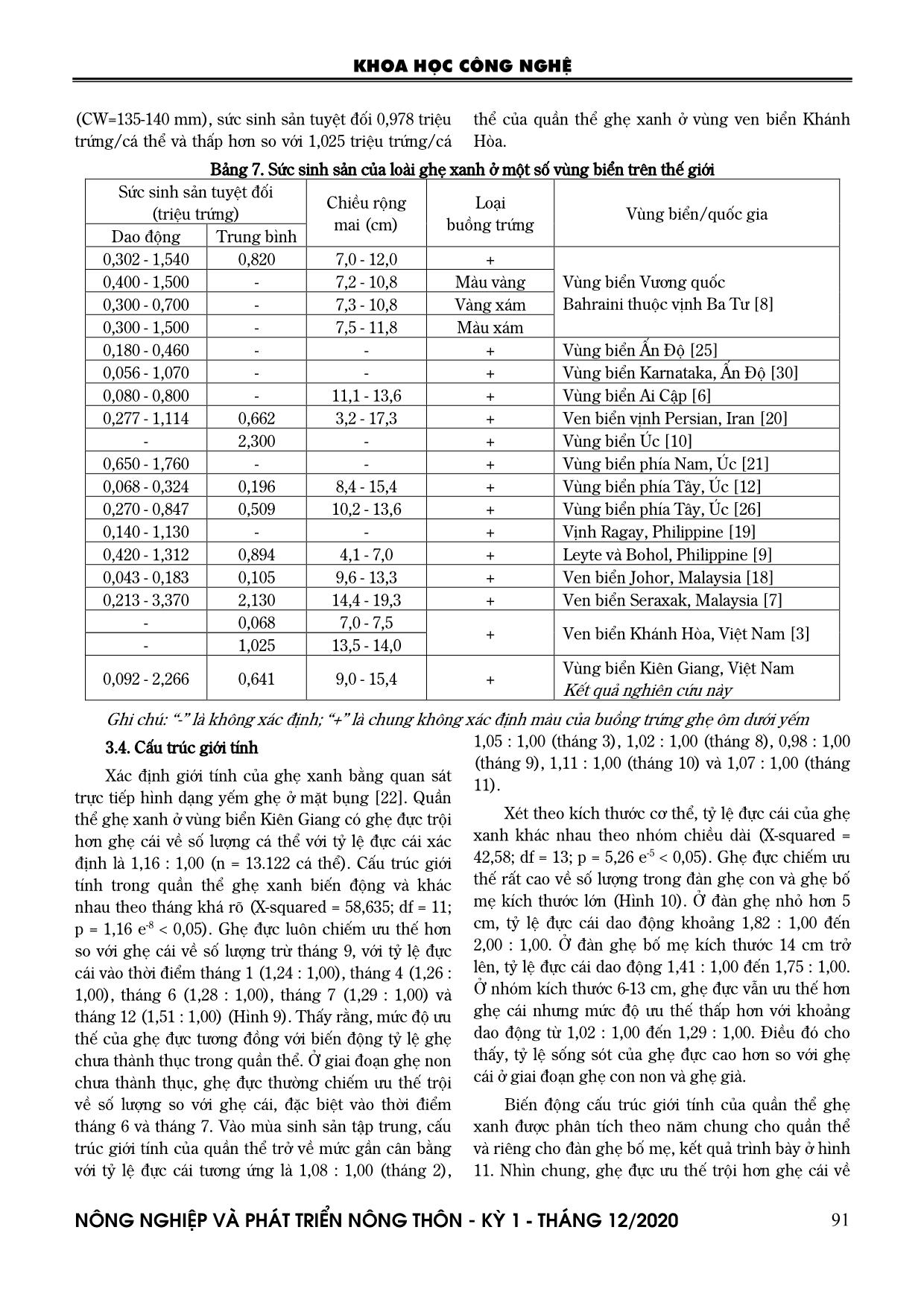
Trang 7
Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Đặc điểm sinh học sinh sản của loài ghẹ xanh Portunus pelagicus (Linnaeus, 1758) ở vùng biển Kiên Giang

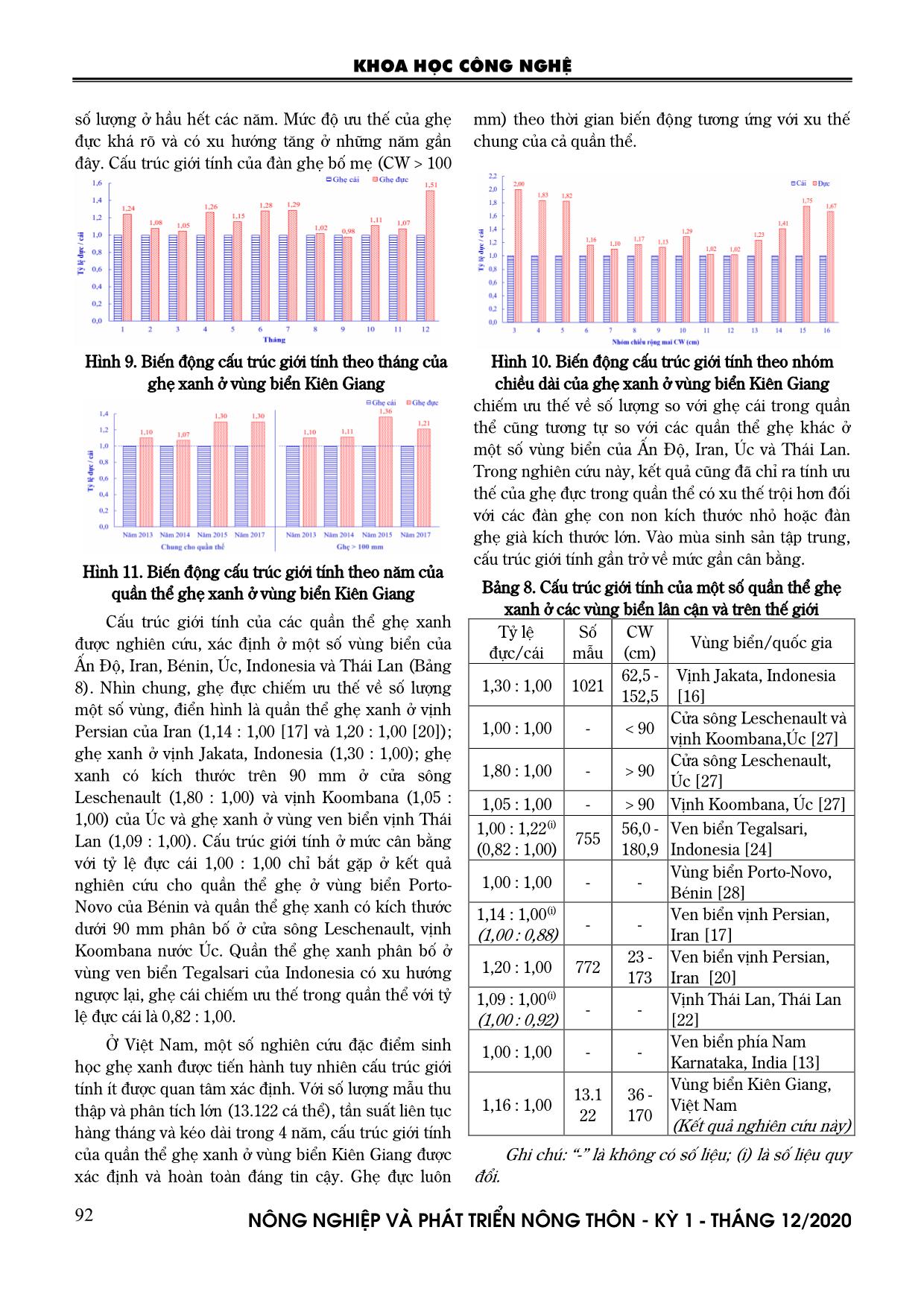
đàn ghẹ bố mẹ kích thước 14 cm trở lên, tỷ lệ đực cái dao động 1,41 : 1,00 đến 1,75 : 1,00. Ở nhóm kích thước 6-13 cm, ghẹ đực vẫn ưu thế hơn ghẹ cái nhưng mức độ ưu thế thấp hơn với khoảng dao động từ 1,02 : 1,00 đến 1,29 : 1,00. Điều đó cho thấy, tỷ lệ sống sót của ghẹ đực cao hơn so với ghẹ cái ở giai đoạn ghẹ con non và ghẹ già. Biến động cấu trúc giới tính của quần thể ghẹ xanh được phân tích theo năm chung cho quần thể và riêng cho đàn ghẹ bố mẹ, kết quả trình bày ở hình 11. Nhìn chung, ghẹ đực ưu thế trội hơn ghẹ cái về KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 12/2020 92 số lượng ở hầu hết các năm. Mức độ ưu thế của ghẹ đực khá rõ và có xu hướng tăng ở những năm gần đây. Cấu trúc giới tính của đàn ghẹ bố mẹ (CW > 100 mm) theo thời gian biến động tương ứng với xu thế chung của cả quần thể. Hình 9. Biến động cấu trúc giới tính theo tháng của ghẹ xanh ở vùng biển Kiên Giang Hình 10. Biến động cấu trúc giới tính theo nhóm chiều dài của ghẹ xanh ở vùng biển Kiên Giang Hình 11. Biến động cấu trúc giới tính theo năm của quần thể ghẹ xanh ở vùng biển Kiên Giang Cấu trúc giới tính của các quần thể ghẹ xanh được nghiên cứu, xác định ở một số vùng biển của Ấn Độ, Iran, Bénin, Úc, Indonesia và Thái Lan (Bảng 8). Nhìn chung, ghẹ đực chiếm ưu thế về số lượng một số vùng, điển hình là quần thể ghẹ xanh ở vịnh Persian của Iran (1,14 : 1,00 [17] và 1,20 : 1,00 [20]); ghẹ xanh ở vịnh Jakata, Indonesia (1,30 : 1,00); ghẹ xanh có kích thước trên 90 mm ở cửa sông Leschenault (1,80 : 1,00) và vịnh Koombana (1,05 : 1,00) của Úc và ghẹ xanh ở vùng ven biển vịnh Thái Lan (1,09 : 1,00). Cấu trúc giới tính ở mức cân bằng với tỷ lệ đực cái 1,00 : 1,00 chỉ bắt gặp ở kết quả nghiên cứu cho quần thể ghẹ ở vùng biển Porto- Novo của Bénin và quần thể ghẹ xanh có kích thước dưới 90 mm phân bố ở cửa sông Leschenault, vịnh Koombana nước Úc. Quần thể ghẹ xanh phân bố ở vùng ven biển Tegalsari của Indonesia có xu hướng ngược lại, ghẹ cái chiếm ưu thế trong quần thể với tỷ lệ đực cái là 0,82 : 1,00. Ở Việt Nam, một số nghiên cứu đặc điểm sinh học ghẹ xanh được tiến hành tuy nhiên cấu trúc giới tính ít được quan tâm xác định. Với số lượng mẫu thu thập và phân tích lớn (13.122 cá thể), tần suất liên tục hàng tháng và kéo dài trong 4 năm, cấu trúc giới tính của quần thể ghẹ xanh ở vùng biển Kiên Giang được xác định và hoàn toàn đáng tin cậy. Ghẹ đực luôn chiếm ưu thế về số lượng so với ghẹ cái trong quần thể cũng tương tự so với các quần thể ghẹ khác ở một số vùng biển của Ấn Độ, Iran, Úc và Thái Lan. Trong nghiên cứu này, kết quả cũng đã chỉ ra tính ưu thế của ghẹ đực trong quần thể có xu thế trội hơn đối với các đàn ghẹ con non kích thước nhỏ hoặc đàn ghẹ già kích thước lớn. Vào mùa sinh sản tập trung, cấu trúc giới tính gần trở về mức gần cân bằng. Bảng 8. Cấu trúc giới tính của một số quần thể ghẹ xanh ở các vùng biển lân cận và trên thế giới Tỷ lệ đực/cái Số mẫu CW (cm) Vùng biển/quốc gia 1,30 : 1,00 1021 62,5 - 152,5 Vịnh Jakata, Indonesia [16] 1,00 : 1,00 - < 90 Cửa sông Leschenault và vịnh Koombana,Úc [27] 1,80 : 1,00 - > 90 Cửa sông Leschenault, Úc [27] 1,05 : 1,00 - > 90 Vịnh Koombana, Úc [27] 1,00 : 1,22(i) (0,82 : 1,00) 755 56,0 - 180,9 Ven biển Tegalsari, Indonesia [24] 1,00 : 1,00 - - Vùng biển Porto-Novo, Bénin [28] 1,14 : 1,00(i) (1,00 : 0,88) - - Ven biển vịnh Persian, Iran [17] 1,20 : 1,00 772 23 - 173 Ven biển vịnh Persian, Iran [20] 1,09 : 1,00(i) (1,00 : 0,92) - - Vịnh Thái Lan, Thái Lan [22] 1,00 : 1,00 - - Ven biển phía Nam Karnataka, India [13] 1,16 : 1,00 13.1 22 36 - 170 Vùng biển Kiên Giang, Việt Nam (Kết quả nghiên cứu này) Ghi chú: “-” là không có số liệu; (i) là số liệu quy đổi. KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 12/2020 93 4. KẾT LUẬN Ghẹ xanh ở vùng biển Kiên Giang thành thục và sinh sản lần đầu ở kích thước mai khoảng 100-106 mm và trung bình 103 mm. Kích thước sinh sản lần đầu của ghẹ xanh có xu thế giảm dần trong những năm gần đây thể hiện áp lực khai thác tăng lên đối với quần thể ở vùng biển này. Ghẹ xanh sinh sản quanh năm và ghẹ đẻ rộ vào thời điểm tháng 3 và tháng 10. Nhiệt độ là một trong những yếu tố sinh thái có liên quan đến thời gian sinh sản tập trung của ghẹ. Ghẹ đực luôn chiếm ưu thế trong quần thể ở hầu hết các thời điểm với tỷ lệ đực cái chung cho cả năm là 1,16:1,00. Ở giai đoạn ghẹ non <5 cm và ghẹ trưởng thành >14 cm, ghẹ đực có tỷ lệ ưu thế trội hơn nhiều so với ghẹ cái. Sức sinh sản tuyệt đối của ghẹ xanh dao động 92 nghìn đến 2,266 triệu trứng, trung bình 641 nghìn trứng/cá thể. Sức sinh sản tương đối dao động 1,1-10 nghìn trứng/g, trung bình 5 nghìn trứng/g và tăng tỷ lệ thuận với sự gia tăng chiều dài và khối lượng cơ thể. Đề xuất và kiến nghị một số giải pháp quản lý nguồn lợi ghẹ xanh bền vững ở vùng biển Kiên Giang như sau: i) Cấm hoạt động khai thác vào tháng 3 và tháng 10; ii) Thả lại các cá thể ghẹ cái mang trứng (giai đoạn V) ở vùng biển chúng bị bắt; 3) Quy định kích thước mai ghẹ tối thiểu cho phép khai thác nên lớn hơn 10 cm. LỜI CẢM ƠN Tập thể tác giả trân trọng cảm ơn WWF Việt Nam, Hiệp hội Chế biến và Xuất khẩu Thủy sản Việt Nam (VASEP) đã tài trợ về kinh phí để thực hiện nghiên cứu này. Đồng thời, chúng tôi cũng xin gửi lời cảm ơn đến các cán bộ khoa học thuộc Phòng Nghiên cứu Nguồn lợi hải sản, Viện Nghiên cứu Hải sản đã tham gia trong suốt quá trình thu thập và phân tích mẫu ghẹ xanh tại các điểm lên ghẹ trong nhiều năm qua. TÀI LIỆU THAM KHẢO 1. Nguyễn Chung (2006). Kỹ thuật sản xuất giống và nuôi ghẹ xanh, cua biển. Nhà xuất bản Nông nghiệp. Thành phố Hồ Chí Minh. 2. Nguyễn Thị Bích Thúy và nnk (2000). Báo cáo tổng kết khoa học và kỹ thuật đề tài cấp Bộ: "Nghiên cứu đặc điểm sinh học sinh sản, sản xuất giống nhân tạo và công nghệ nuôi thương phẩm ghẹ xanh Portunus pelagicus". Trung tâm Nghiên cứu Thủy sản III. 3. Nguyễn Thị Diệu Thúy (2010). Chương trình cải thiện nghề khai thác ghẹ xanh Kiên Giang. Hội thảo xây dựng chương trình cải thiện nghề khai thác ghẹ xanh Kiên Giang, thị xã Hà Tiên, tỉnh Kiên Giang, 2010. 4. Holden, M. J.và D. F. S. Raitt, eds (1974). Manual of Fisheries Science, Part 2 - Methods of Resource Investigation and their Application. FAO - Food and Agriculture Organization: Rome. 5. Jennings, S., M. Kaiser, J. và J. D. Reynolds (2001). Marine Fisheries Ecology. Oxford, UK, Blackwell Publishing, 402 pages. 6. Abdel Razek, F. A. (1988). Some biological studies on the Egyptian crab Portunus pelagicus (Linnaeus, 1766), Acta driat., 29(1-2), p. 133-143. 7. Abdullah, I., J. H. Muhamad, S. M. Longvà A.-M. A. Bolong (2011). Fecundity of Blue swimming crab from sematan fishing district, Sarawak coastal water of south china sea, Borneo J. Resour. Sci. Tech., 1(1), p. 46-51. 8. Al-Rumaidh, M. H. (2002). The biology population dynamics and fishery management of the blue swimming crab, Portunus pelagicus (Linnaeus, 1758) in Bahraini waters. University of Wales - Bangor. p. 273p. 9. Batoy, C. B., J. F. Camargovà B. C. Pilapil (1987). Breeding season, sexual maturity and fecundity of the blue crab, Portunus pelagicus (L) in selected coastal waters in Lye and vicinity. Philippines, Annals of Tropical Research, 9, p. 157- 177. 10. Campbell, G. R. và D. R. Fielder (1988). Egg extrusion and egg development in three species of commercially important potunit crabs for E. E. Queensland, Proc. R. Soc. Queensl., 99, p. 93-100. 11. Clarke, K. và S. Ryan (2004). Ecological assessment of the Queensland bleu swimming crab pot fihsery: Department of Primary Industhi Fisheries. Queensland Government. p. 100p. 12. De Lestang, S., N. G. Hall và I. C. Potter (2003). Influence of a deep artificial entrance channel on the biological characteristics of the blue swimmer crab Portunus pelagicus in a large microtidal estuary. KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 12/2020 94 Journal of Experimental Marine Biology and Ecology, 295, p. 41-61. 13. Dineshbabu, A. P., B. Shridhara và Y. Muniyappa (2008). Biology and exploitation of the blue swimmer crab, Portunus pelagicus (Linnaeus, 1758), from south Karnataka coast, India, Indian J. Fish., 55, p. 215-220. 14. Edgar, G. J. (1990). Predator-prey interactions in sea grass beds. II. Distribution and diet of the blue manna crab Portunus pelagicus Linnaeus at Cliff Head, Western Australia. Jounrnal of Experimental Marine Biology and Ecology, 139(23-32). 15. Ehsan, K., S. A. Nabi và Y. Maziar (2010). Stock Assessment and Reproductive Biology of the Blue Swimming Crab, Portunua pelagicus in Bandar Abbas Coastal Waters, Northern Persian Gulf. Jounal of the Persian Gulf, 1(2), p. 11-22. 16. Hikmat Jayawiguna, M., M. Mulyono, E. Nugraha, H. Prayitnovà A. Basith (2017). Biology Aspect of Blue Swimming Crabs (Portunus pelagicus) In Jakarta Bay Waters, Indonesia. Vol. 11, 11-63. 17. Hosseini, M., A. Vazirizade, Y. Parsa và A. Mansori (2012). Sex Ratio, Size Distribution and Seasonal Abundance of Blue Swimming Crab, Portunus pelagicus (Linnaeus, 1758) in Persian Gulf Coasts, Iran. Vol. 17. 18. Ikhwanuddin, M., M. N. Azra, H. Siti-Aimuni và A. B. Abol-Munafi (2012). Fecundity, Embryonic and Ovarian Development of Blue swimming crab, Portunus pelagicus (Linnaeus, 1758) in Coastal water of Johor, Malaysia. Pakistan Jounal of Biological Sciences, 15(15), p. 720-728. 19. Ingles, J. A. và E. Braum (1989). Reproduction and larval ecology of the blue swimming crab Portunus pelagicus in Ragay Gulf, Philippine, Int. Revue. ges. Hydrobio., 74(5), p. 471- 490. 20. Kamrani, E., A. N. Sabili và M. Yahyavi (2012). Stock Assessment and Reproductive Biology of the Blue Swimming Crab, Portunus pelagicus in Bandar Abbas Coastal Waters, Northern Persian Gulf. Journal of the Persian Gulf (Marine Science), 1(2), p. 11-22. 21. Kumar, M. S., G. Ferguson, Y. Xiao, G. Hooper và S. Venema (2000). Studies on reproductive biology and distribution of the blue swimmer crab (Portunus pelagicus) in South Australian waters. SARDI Research Report Series No. 47. 22. Kunsook, C., N. Gajaseni và N. Paphavasit (2014). Stock Assessment of Blue Swimming Crab Portunus pelagicus for Sustainable Management in Kung Krabaen Bay. The Gulf of Thailan, Tropical Life Science Research, 25(1), p. 41-59. 23. Liu, Z., X. Wu, W. Wang, B. Yan và Y. Cheng (2014). Size distribution and monthly variation of ovarian development for the female blue swimmer crab. Portunus pelagicus in Beibu Gulf, off south China. Vol. 78, 257-268. 24. Mulyono, M. (2017). The frequency distribution of the length, gonad maturity stages, sex ratio, length at first mature and catch, width-weight relationship and fisheries factors of blue swimmer crab (Portunus pelagicus) caught by crab nets landed at Tegalsari coastal fisheries port in Central Java. Vol. Volume 5, 660-668. 25. Pillai, K. K. và N. B. Nair (1973). Observeration on the breeding biology fo some crabs from the southwest coast of India. J. Mar. Biol. As. India, 15(2), p. 754-770. 26. Potter, I. C., P. J. Chrystal và N. R. Loneragan (1983). The biology of the blue manna crab, Portunus pelagicus on an Australian estuary. Marine Biology, 78, p. 75-85. 27. Potter, I. C. và S. De Lestang (2000). Biology of the blue swimmer crab Portunus pelagicus in Leschenault Estuary and Koombana Bay, South Western Australia. Journal of the Royal Society of Western Australia, 83(4), p. 443-458. 28. Radhakrishnan, C. K. (1979). Studies on Portunid crabs of Porto Novo (Crustacea: Decapoda: Brachyura). 1979, Annamalai University, India. 29. Soundarapandian, P., D. Varadharajan và T. Anand (2016). Male Reproductive System of Blue Swimming Crab, Portunus pelagicus (Linnaeus, 1758). J Cytol Histol, 5(1). 30. Sukumaran, K. K. và B. Neelakantan (1997). Sex ratio, fecundity and reproductive potential in two marine portunid crabs, Portunus (portunus) KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 12/2020 95 sanguinolentus (Herbst) and Portunus (portunus) pelagicus (Linnaeus) (Brachyura: Portunidae) along Karnataka coast. Indian J. Mar. Sci., 26(1), p. 43-48. 31. Sumpton, W. D., M. A. Potter và G. S. Smith (1994). Reproduction and growth of commercial sand crab, portunus pelagicus (L.) in Moreton Bay, Queensland. Asian Fisheries Science, 7, p. 103-113. 32. Udupa, K. S. (1986). Statistical method of estimating the size at first maturity in fishes. Fishbyte, 4, p. 8-10. 33. Williams, M. J. (1982). Natural food and feeding in the commercial sand crab Portunus pelagicus Linnaeus 1766 (Crustacea: Dcapoda: Portunida) in Mereton Bay, Queensland. Experimental Marine Biology and Ecology, 59(2-3), p. 165-176. 34. Xiao, Y. và M. Kumar (2004). Sex ratio and probability of sexual maturity of female and size of the blue swimmer crab, Portunus pelagicus (Linnaeus) off southern Australia. Fisheries Research, 68, p. 271-281. REPRODUCTIVE BIOLOGY OF BLUE SWIMMING CRAB Portunus pelagicus (LINNAEUS, 1758) IN KIEN GIANG WATERS Tran Van Cuong, Vu Viet Ha Summary Reproductive biology of blue swimming crab (BSC) in Kien Giang waters were analysed using data collected in the period 2013-2018. The results showed that BSC spawn all year round with a peak spawning in march and october. The male is dominanted in population structure in comparison to the females with sex ratio approximately 1.16:1.00. Length at first maturity of BSC varied from 100 mm to106 mm and average 103 mm with a trend in recent years toward decseased. Absolute fecundity of BSC ranged from 92 thousand eggs/female to 2.266 million eggs/female, with average absolute fecundity of 641 thousand eggs/female. The relative fecundity of BSC ranged from 1.0 thousand eggs to 10 thousand eggs/gram, with average relative fecundity of 5 thousand eggs/gram. Absolute fecundity was related to crab size and crab weight as follows Fe = 0.040303 * CW 3,49377 and Fe = -134,700 + 6267.28 * W. Based on these results, a sustainable management planning for BSC was proposed as follows : i) Closing season applies in march and october; ii) Releasing egg-bearing female BSCs where they were caught ; iii) The legal minimum carapace width for BSC should be greater than 10 cm. Keywords: Blue swimming crab, Portunus pelagicus, spawning season, fecundity, sex ratio. Người phản biện: TS. Phạm Anh Tuấn Ngày nhận bài: 01/9/2020 Ngày thông qua phản biện: 02/10/2020 Ngày duyệt đăng: 9/10/2020
File đính kèm:
 dac_diem_sinh_hoc_sinh_san_cua_loai_ghe_xanh_portunus_pelagi.pdf
dac_diem_sinh_hoc_sinh_san_cua_loai_ghe_xanh_portunus_pelagi.pdf

