Bài giảng Kỹ thuật nhiệt - Chương 2: Tính chất của vật chất (Properties of Substances)
Khí lý tưởng
Là chất khí có một số đặc điểm:
Lực tương tác phân tử rất nhỏ, coi như không có;
Thể tích riêng của các phân tử rất nhỏ, coi như bằng không.
Khí rất “loãng”
Phương trình trạng thái
Là bất cứ phương trình nào mô tả quan hệ giữa các thông số trạng
thái (cường tính), cụ thể là P, v, T
HƠI (Vapor): chỉ môi chất ở trạng thái khí gần trạng thái
ngưng tụ
Khi môi chất ở xa trạng thái ngưng tụ và có nhiệt độ cao
hơn nhiệt độ tới hạn (critical temperature) thì gọi là KHÍ

Trang 1

Trang 2

Trang 3
Trang 4
Trang 5

Trang 6

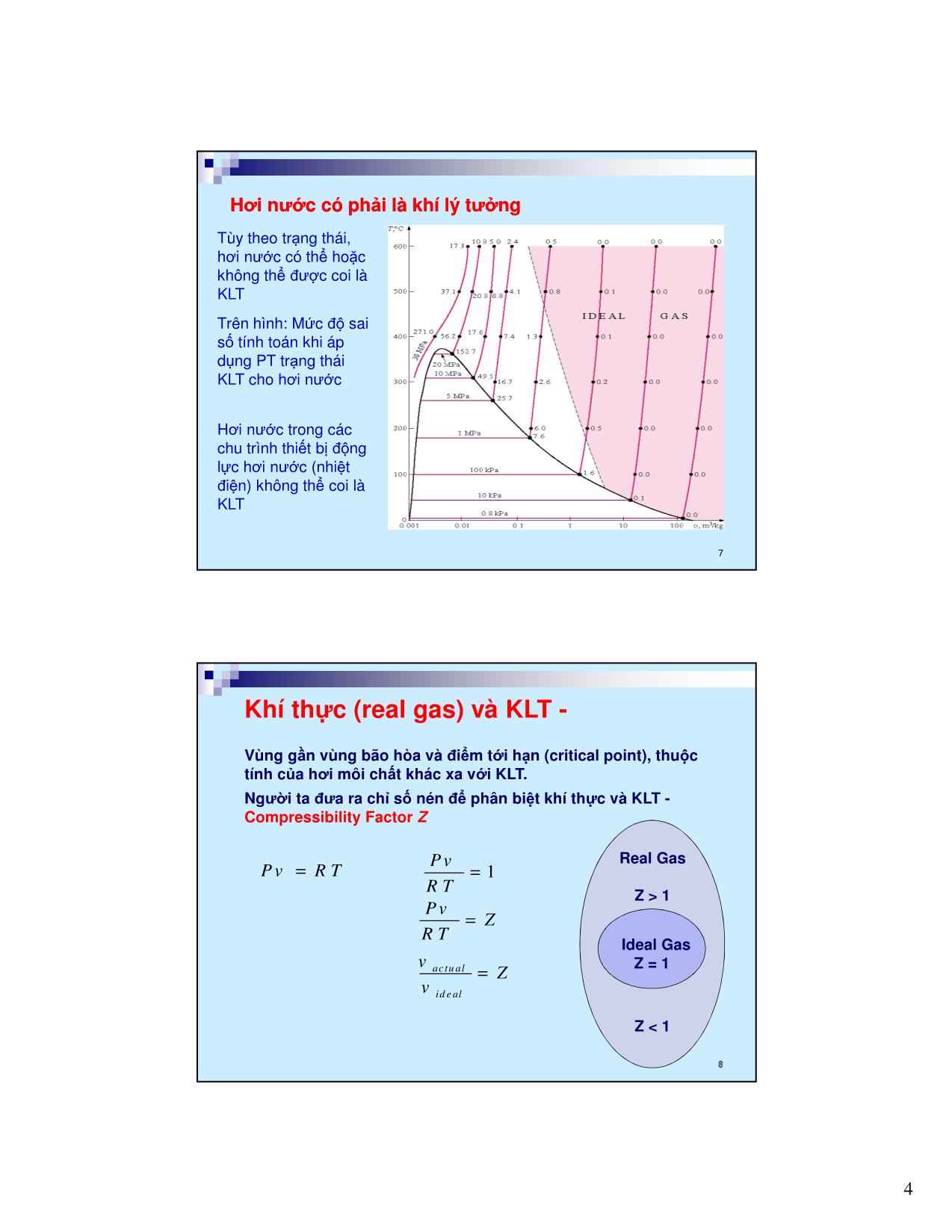
Trang 7

Trang 8

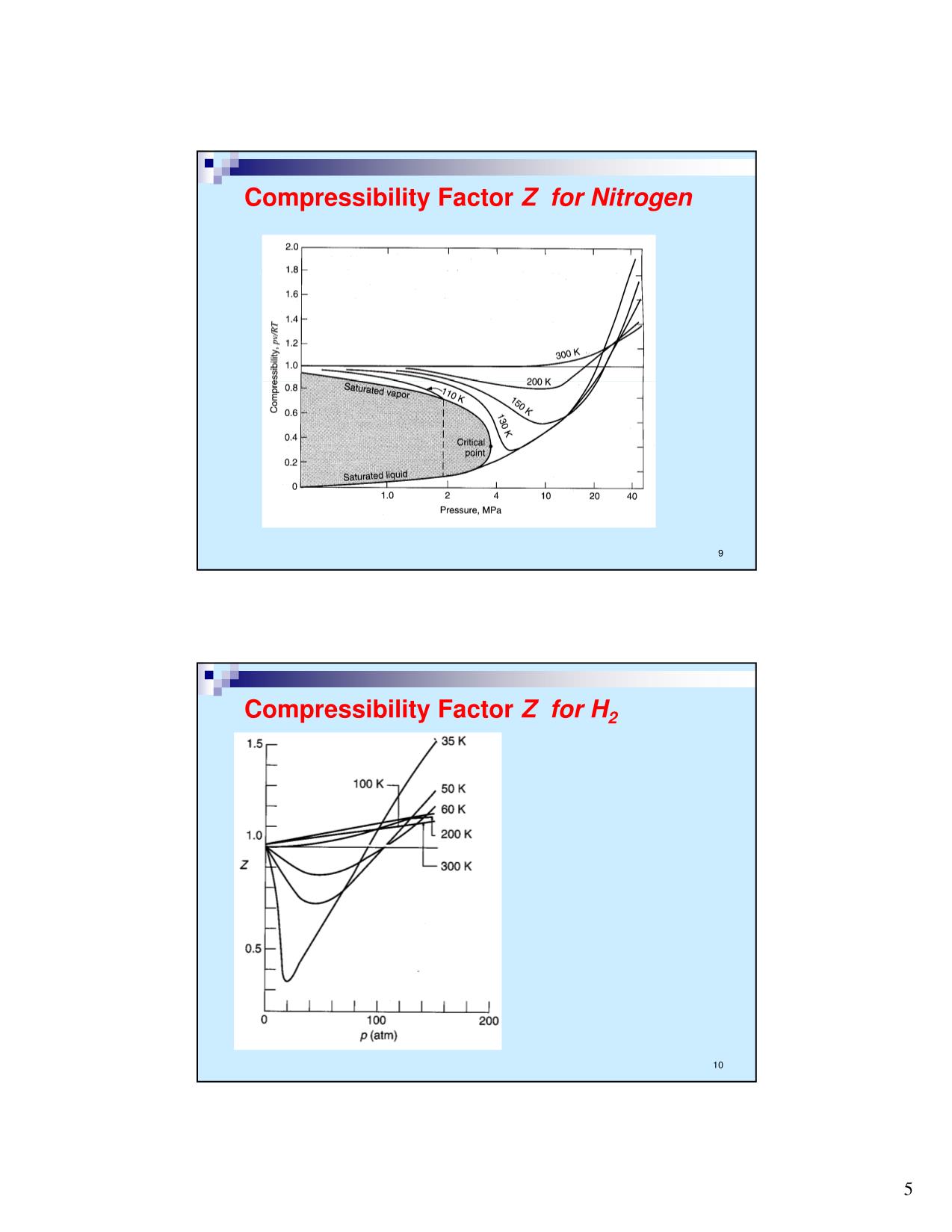
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài giảng Kỹ thuật nhiệt - Chương 2: Tính chất của vật chất (Properties of Substances)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Kỹ thuật nhiệt - Chương 2: Tính chất của vật chất (Properties of Substances)

Chapter#2 Tính ch ất c ủa v ật ch ất (Properties of Substances) • Nhi ệt dung riêng (Specific heat) • Khí lý tưở ng (Ideal gas) Khí lý t ưở ng (Ideal Gas) 2 1 Khí lý t ưở ng Là ch ất khí có m ột s ố đặ c điểm: Lực t ươ ng tác phân t ử r ất nh ỏ, coi nh ư không có; Th ể tích riêng c ủa các phân t ử r ất nh ỏ, coi nh ư b ằng không. Khí r ất “loãng” Ph ươ ng trình tr ạng thái Là b ất c ứ ph ươ ng trình nào mô t ả quan h ệ gi ữa các thông s ố tr ạng thái (c ườ ng tính), c ụ th ể là P, v, T Khí hay H ơi? HƠI (Vapor): ch ỉ môi ch ất ở tr ạng thái khí g ần tr ạng thái ng ưng t ụ Khi môi ch ất ở xa tr ạng thái ng ưng t ụ và có nhi ệt độ cao ơ ệ độ ớ ạ ọ h n nhi t t i h n (critical temperature) thì g i là KHÍ. 3 PT tr ạng thái KLT (Ideal gas equation of state) Năm 1802, Charles and Lussac xác đị nh b ằng th ực nghi ệm ph ươ ng trình (Ideal gas equation of state): = R – Hằng s ố khí (Gas constant) Pv RT R= R u / M Ru –Hắng s ố khí ph ổ bi ến (universal gas constant). R u = 8.314 KJ/Kmol . K M – Kh ối l ượ ng mole (molecular weight) M là kh ối l ượ ng mole (kmole) c ủa v ật ch ất (grams ho ặc kilograms) Giá tr ị c ủa R, M c ủa m ột s ố KLT ph ổ bi ến trong b ảng Table A-1. 4 2 Quan h ệ P-v-T PV= mRT( v = V / m ) Pv= RT PV= NRTu( mR = NMR = NR u ) Pv= RTu ( v = V / N ) Quan h ệ gi ữa hai tr ạng thái c ủa KLT nh ư sau: PV m = RT m1= m 2 PV PV PV PV 11= 22 and 11 = 22 RT1 RT 2 T 1 T 2 5 Ideal gas KLT là các ch ất khí “tưở ng t ượ ng” tuân theo PT tr ạng thái Pv = RT. Nh ững ch ất khí có m ật độ (density) gi ảm khi ở nhi ệt độ cao và áp su ất th ấp. Khi đó chúng có th ể đượ c coi là KLT. Các ch ất khí nh ư: không khí ( air) , nitrogen , oxygen , hydrogen , helium, Aragon, neon, krypton có th ể coi là KLT. Khí CO2 (carbon dioxide) cũng có th ể coi là KLT v ới sai s ố d ướ i 1 %. Các ch ất ở th ể h ơi nh ư water vapor trong các chu trình nhà máy nhi ệt điện, refrigerant vapor trong các máy l ạnh có m ất độ cao h ơn nên không th ể coi là KLT. V ới các ch ất này, thay vì s ử d ụng PT tr ạng thái, ng ươ i ta hay s ử d ụng các b ảng tra. 6 3 Hơi n ướ c có ph ải là khí lý t ưở ng Tùy theo tr ạng thái, hơi n ướ c có th ể ho ặc không th ể đượ c coi là KLT Trên hình: M ức độ sai số tính toán khi áp dụng PT tr ạng thái KLT cho h ơi n ướ c Hơi n ướ c trong các chu trình thi ết b ị độ ng lực h ơi n ướ c (nhi ệt điện) không th ể coi là KLT 7 Khí th ực (real gas) và KLT - Vùng g ần vùng bão hòa và điểm t ới h ạn (critical point), thu ộc tính c ủa h ơi môi ch ất khác xa v ới KLT. Ng ườ i ta đư a ra ch ỉ s ố nén để phân bi ệt khí th ực và KLT - Compressibility Factor Z Pv Real Gas Pv= RT = 1 R T Z > 1 P v = Z R T Ideal Gas v actual = Z Z = 1 v ideal Z < 1 � 4 Compressibility Factor Z for Nitrogen 9 Compressibility Factor Z for H 2 10 5 Example 2-11 Xác đị nh th ể tích riêng c ủa refiregerant- 134 ở 1 MPa và 50 °C, b ằng s ử d ụng: A. Thermodynamic tables B. The ideal gas low C. The generalized compressibility chart. Xác đị nh sai s ố c ủa ph ươ ng án B và C so v ới A. 11 Ph ươ ng trình tr ạng thái c ủa khí th ực Một s ố PTTT có th ể áp d ụng để xác đị nh quan h ệ P-v-T chính xác Pv= RT 12 6 Nhi ệt dung riêng (Specific Heats) 13 Nh ận xét Các v ật ch ất khác nhau thì c ần l ượ ng n ăng lượ ng khác nhau để nung nóng •Ví d ụ: Nung nóng 1kg nướ c c ần n ăng l ượ ng g ấp gần 10 lần 1kg n ướ c. 14 7 Specific Heat (heat capacity) Đị nh ngh ĩa: Là n ăng l ượ ng (nhi ệt) c ần cung cấp để làm t ăng m ột đơ n v ị (kh ối l ượ ng/th ể tích/mol) v ật ch ất lên m ột độ . Đơ n v ị: kJ/(kg 0C) or kJ/(kg K) cal/(g 0C) or cal/(g K) 0 Btu/(lb m F) or Btu/(lb m R) Công th ức chung: ∆E = mC ∆T 15 NDR đẳ ng tích, đẳ ng áp: C v,Cp Cv năng l ượ ng c ần c ấp để nhi ệt độ c ủa m ột đơ n v ị v ật ch ất t ăng lên 1 độ khi th ể tích của h ệ không đổ i. (Constant volume) . Cp năng l ượ ng c ần c ấp để nhi ệt độ c ủa m ột đơ n v ị v ật ch ất t ăng lên 1 độ khi áp su ất của h ệ không đổ i. (Constant Cp > Cv pressure) 16 8 Ý ngh ĩa toán h ọc c ủa C v Hệ th ống đẳ ng tích. C ấp nhi ệt để T 1 đế n T 2. E=U+KE +PE ∆Ε = ∆ U dΕ = dU dE = mC vdT ∂u du = CvdT Cv = ∂T v 17 Bi ểu di ễn toán h ọc c ủa C p ∂h C p = ∂T p h (enthalpy) bao g ồm n ội n ăng (u) và công giãn n ở (công làm d ịch chuy ển biên h ệ-system boundary khi P = constant). h = u + Pv 18 9 Quan sát Cp luôn l ớn h ơn C v. C ần nhi ều n ăng l ượ ng hơn để nung nóng v ật ch ất khi P = const do ph ải t ốn thêm n ăng l ượ ng làm d ịch chuy ển biên h ệ (giãn n ở). Nh ư v ậy n ăng l ượ ng (nhi ệt) đượ c c ấp đượ c dùng để : Tăng nội n ăng (u); Th ực hi ện công thay đổ i th ể tích. 19 Nh ận xét Cv và C p đượ c bi ểu di ễn qua các thông s ố u, h, T – là các thông s ố tr ạng thái. Vì v ậy C v và C p cũng là các thông s ố tr ạng thái. Vì C v và C p là các thông s ố tr ạng thái nên chúng độ c lập v ới quá trình. ∂u ∂h Cv = C p = ∂T v ∂T p 20 10 Cv và C p ch ỉ ph ụ thu ộc vào T (v ới KLT) ∂u du C = v Cv = ∂T v dT ∂h dh C = p C p = ∂T p dT 21 Nội n ăng và enthalpy c ủa KLT là hàm c ủa Cv và Cp: du = C v (T )dT 2 ∆u = u 2 − u1 = C v ()T dT 1 dh = C p (T )dT T 2 ∆h = h2 − h1 = C p ()T dT T 1 Mu ốn xác đị nh u, h thì c ần ph ải bi ết Cv, Cp 22 11 TABLE A-2: B ảng nhi ệt dung riêng c ủa KLT: Table A-2a: NDR ở 300K; Table A-2b: NDR ở các nhi ệt độ khác nhau; Table A-2c: NDR ph ụ thu ộc vào nhi ệt độ : Cp = a + bT + cT 2 + dT 3 23 Tính nhi ệt: Method 1 Sử d ụng công th ức: 2 2 2 3 ∆h = C pdT = (a + bT + cT + dT )dT 1 1 b(T 2 −T 2 ) c(T 3 −T 3 ) d(T 4 −T 4 ) ∆h = aT + 2 1 + 2 1 + 2 1 2 3 4 Quá ph ức t ạp!! Ch ỉ s ử d ụng khi c ần độ chính xác cao!! 24 12 Tính nhi ệt: Method 2 Tra b ảng u, h theo nhi ệt độ (các tích phân này đã đượ c tính s ẵn và l ập b ảng): Table A-17 cho không khí; Các b ảng A-18 đế n A-23 cho các KLT khác. T T uu−o = CdT v h − ho = C pdT T0 =0 T0 =0 25 Tính nhi ệt: Method 3 Sử d ụng NDR trung bình: NDR c ủa các ch ất khí ph ụ thu ộc vào nhi ệt độ và là các hàm liên t ục; Có th ể tuy ến tính hóa các hàm này trong các kho ảng nhi ệt độ nh ất đị nh (không quá lớn – có th ể đế n vài tram độ ) 26 13 Method 3 NDR trung bình trong kho ảng nhi ệt độ : Tav = (T 1+T 2)/2 u2-u1=C v,av (T 2-T1) h2-h1=C p,av (T 2-T1) 27 3 cách tính ∆u 28 14 Example Không khí ở nhi ệt độ 300 K, áp su ất 200 kpa đượ c c ấp nhi ệt đẳ ng áp đế n 600 K. Xác đị nh s ự bi ến thiên n ội n ăng (cho 1kg) b ằng cách s ử d ụng: Tra b ảng (Table A-17) Hàm NDR theo nhi ệt độ (Table A-2c) Theo NDR trung bình (Table A-2b). 29 Important Observation The previous relations are not restricted to any kind of process. The presence of constant volume specific heat in an equation should not lead to the concept that this equation is valid only for constant volume process. The constant volume or constant pressure part of the name defines only how they are measured for each substance (see figure). Once we have Cv or Cp as function of T, we can perform the integration for any process. 30 15 Quan h ệ gi ữa Cv và Cp c ủa KLT Trong Table A-2c, C p đượ c cho là hàm c ủa nhi ệt độ , nh ư v ậy có th ể tính dh=CpdT. Còn du=CvdT thì sao? Không có b ảng cho Cv !! Với KLT h=u+Pv = u+RT dh = du + RdT CpdT=C vdT+ RdT Cp=C v + R 31 Specific Heat Ratio C k cũng thay đổ i theo nhi ệt độ , k = p nh ưng r ất nh ỏ. Cv k = 1.4 cho khí 2 phân t ử (air) Table A-2 32 16 NRD c ủa Solids và Liquids Với ch ất r ắn, l ỏng, th ể tích riêng h ầu nh ư không thay đổ i trong m ột quá trình c ụ th ể. Không phân bi ệt Cv và Cp của các ch ất không ch ịu nén (r ắn, l ỏng). NDR c ủa chúng đượ c ký hi ệu là C. Cp = C v = C 33 Internal energy of Solids and Liquids du= CdTV = CdT ∆u= C∆ T= C() T2− T 1 34 17 Enthalpy of Solids h = u + Pv dv = 0 với các ch ất không dh = du + Pdv + vdP ch ịu nén 0 ∆h = ∆u + v∆P = C∆T + v∆P Rất nh ỏ với ∆h = ∆u ≅ Cavg ∆T solids �� Enthalpy of Liquids ∆h = ∆u + v∆P = C∆T + v∆P Có 2 tr ườ ng h ợp: Constant pressure process, ∆P = 0 ∆h = ∆u ≅ Cavg ∆T Constant temperature process, ∆T = 0 ∆h ≅ v∆P 36 18
File đính kèm:
 bai_giang_ky_thuat_nhiet_chuong_2_tinh_chat_cua_vat_chat_pro.pdf
bai_giang_ky_thuat_nhiet_chuong_2_tinh_chat_cua_vat_chat_pro.pdf

