Ảnh hưởng hufa đến tốc độ tăng trưởng, tỷ lệ sống của cá mú cọp (Epinephelus fuscoguttatus Forsskål, 1775) giai đoạn 1,0-1,5 cm đến giai đoạn 2,0-3,0 cm
ú có giá trị kinh tế, giá trị dinh dưỡng cao. Trên thị trường giá 1 kg cá mú cọp
từ 550000 đến 650000 đồng nên có tiềm năng xuất khẩu. Cá mú cọp được nghiên
cứu sản xuất giống nhân tạo, nuôi thương phẩm và có thị trường tiêu thụ chính là
Trung Quốc, Đài Loan, Nhật Bản, Malaysia, Indonesia, Philippines, Singapore,
Brunei, Thái Lan. [1]. Ở Việt Nam, cá mú cọp là đối tượng nuôi mới. Sản xuất
giống và ương nuôi cá mú cọp ở nước ta còn bộc lộ nhiều hạn chế, sản xuất giống
đại trà chưa được thực hiện mà chỉ đang trong giai đoạn nghiên cứu thử nghiệm [2].
Hiện nay, một số cơ sở sản xuất giống cá biển nhập trứng từ Indonesia về ương đến
khi cá đạt kích thước nuôi thương phẩm 5,0 - 6,0 cm. Tuy nhiên, do tỷ lệ sống giai
đoạn 1,0 - 1,5 cm đến giai đoạn 2,0 - 3,0 cm thấp, lợi nhuận không cao nên số lượng
cơ sở sản xuất không nhiều [3]. Chính vì vậy, nguồn giống cung cấp nuôi thương
phẩm hiện nay chủ yếu khai thác đánh bắt tự nhiên và giống nhập từ các nước Đài
Loan, Indonesia [2].

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5
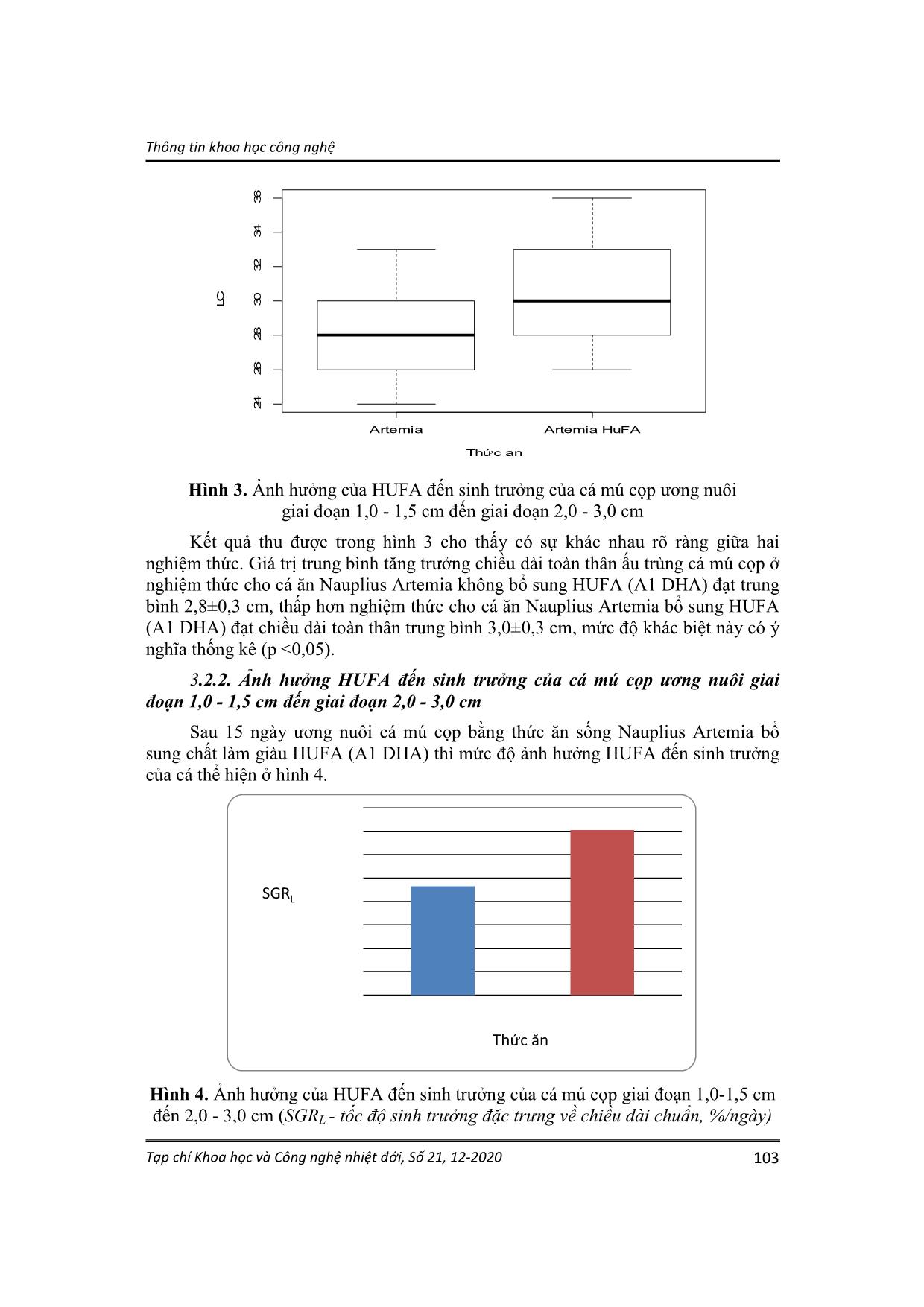
Trang 6
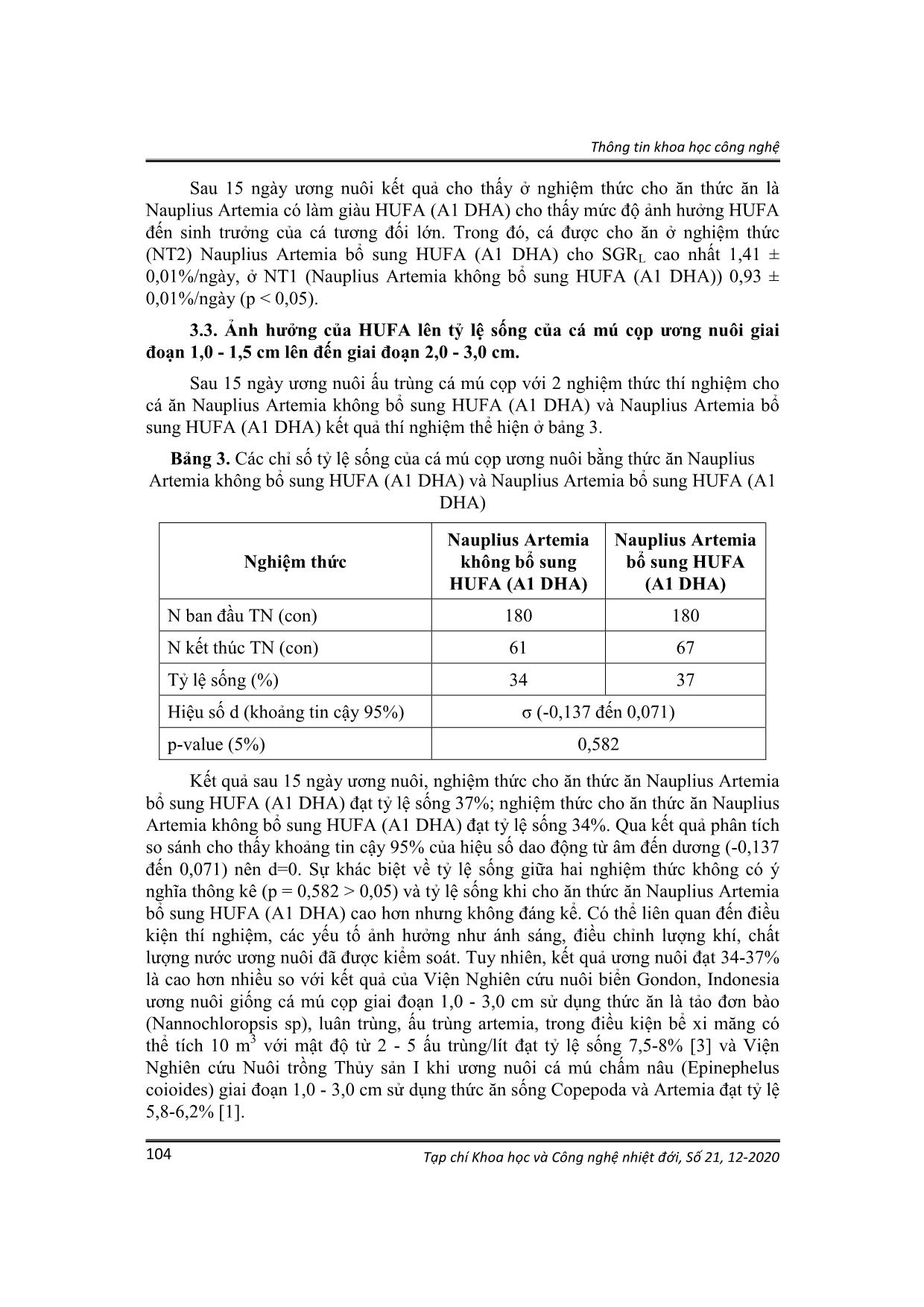
Trang 7

Trang 8

Trang 9
Tóm tắt nội dung tài liệu: Ảnh hưởng hufa đến tốc độ tăng trưởng, tỷ lệ sống của cá mú cọp (Epinephelus fuscoguttatus Forsskål, 1775) giai đoạn 1,0-1,5 cm đến giai đoạn 2,0-3,0 cm

thức ăn 3-5 con Nauplius Artemia/ml [4]. Hàng ngày vệ sinh xô thí nghiệm sau khi cho cá ăn khoảng 1 giờ, thay 20 - 30% nước/ngày. Tỷ lệ sống, tốc độ tăng trưởng được tính vào ngày thứ 15 khi kết thúc thí nghiệm. Thông tin khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 100 2.2.2. Thu số liệu các yếu tố môi trường. Theo dõi các yếu tố môi trường được thực hiện trong suốt quá trình bố trí thí nghiệm. + Nhiệt độ: dùng nhiệt kế đo nhiệt độ của nước ngày hai lần vào buổi sáng (7 giờ) và buổi chiều (14 giờ). + pH nước: dùng máy đo pH metter (Mi105) độ chính xác 0,1 đo ngày hai lần vào buổi sáng (7 giờ) và buổi chiều (14 giờ). + Độ mặn: dùng khúc xạ kế, độ chính xác 1‰. + Oxy hòa tan: sử dụng máy đo oxy Hanna HI914704 độ chính xác 0,01 mg/l. 2.2.3. Ấp, thu ấu trùng Nauplius Artemia Điều kiện và kỹ thuật ấp nở, thu ấu trùng Nauplius Artemia được tiến hành theo Lê Văn Bửu (2004) [4] như sau: Trước khi ấp, tiến hành khử vỏ trứng Artemia và xử lý mầm bệnh bằng nước ngọt kết hợp Chlorine 500 ppm, sục khí mạnh, sau 5 phút vớt trứng ra đưa vào ấp theo các điều kiện được trình bày trong bảng 1, sục khí mạnh trong quá trình ấp, sau 20 - 24h trứng nở, tiến hành lọc thu Nauplius Artemia và làm giàu A1 DHA trước khi cho ấu trùng cá ăn. Bảng 1. Điều kiện ấp nở trứng Artemia Mật độ trứng (g/lít) Nhiệt độ (oC) pH Độ mặn (‰) Thời gian nở (h) 1 - 2 26 - 30 7,5 - 8,5 25 - 28 20 - 24 Phương pháp thu Nauplius Artemia: Trước khi thu tắt sục khí, đồng thời đậy kín xô ấp để tránh ánh sáng, Nauplius Artemua không tập trung ở tầng mặt lẫn lộn với vỏ, khó lọc. Sau 5 - 10 phút vỏ trứng sẽ nổi lên trên, trứng không nở chìm xuống đáy xô, Nauplius Artemia ở tầng giữa. Lọc bỏ phần vỏ trên, lấy phần Nauplius Artemia ở tầng giữa. Sau khi lọc, rửa lại Nauplius Artemia bằng nước ngọt rồi cho vào dụng cụ thu Nauplius Artemia để lọc, loại bỏ tiếp phần vỏ để thu Nauplius Artemia sạch. 2.2.4. Kỹ thuật bổ sung HUFA cho Nauplius Artemia Áp dụng phương pháp của Lục Minh Diệp, 2010 [7]. Thu Nauplius Artemia (8 giờ sau khi nở) cho vào xô nhựa dung tích 20 lít có nước biển sạch với mật độ 300 Nauplius Artemia/ml. HUFA (A1 DHA) ở dạng nhũ tương được đánh tan với liều lượng 0,2 g/lít. Sục khí mạnh, nhiệt độ duy trì 26-30oC, thời gian làm giàu 6-12h. Sau đó, Nauplius Artemia được rửa sạch bằng nước biển trước khi cho cá ăn. Thông tin khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 101 2.3. Phương pháp thu thập và xử lý số liệu 2.3.1. Thu thập số liệu Phương pháp xác định tốc độ tăng trưởng của ấu trùng cá: Sử dụng thước kẹp có độ chính xác 1 mm để đo chiều dài của ấu trùng cá. Chiều dài toàn thân (LC) là khoảng cách từ miệng cá đến cuối vây đuôi. Cá thí nghiệm được đo 2 lần với toàn bộ số lượng cá khi thả thí nghiệm và khi kết thúc thí nghiệm. Phương pháp xác định tỷ lệ sống: Bằng cách đếm toàn bộ số cá tại thời điểm kết thúc thí nghiệm và tính toán theo công thức: TLS (%) = Sୡ Sđ × 100 Trong đó: TLS: Tỷ lệ sống (%); Sc: Số cá còn lại khi kết thúc thí nghiệm (con); Sđ: Số cá ban đầu (con). 2.3.2. Xử lý số liệu Số liệu nghiên cứu được tính toán và vẽ đồ thị trên phần mềm Excel 2010, số liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn (TB ± SD). Phân tích sự khác biệt giữa các giá trị trung bình về chiều dài toàn thân giống cá mú cọp của các nghiệm thức bằng phép kiểm định T test với thống kế có ý nghĩa khi p<0,05. Sử dụng hàm box plot vẽ biểu đồ hộp. Phân tích tỷ lệ sống của các nghiệm thức sử dụng phép kiểm định prop. test và thống kế có ý nghĩa khi p<0,05. 3. KẾT QUẢ VÀ BÀN LUẬN 3.1. Một số yếu tố môi trường trong hệ thống bể thí nghiệm Cá mú cọp giai đoạn 1,0 - 1,5 cm đến giai đoạn 2,0 - 3,0 cm, chúng rất nhạy cảm với điều kiện môi trường. Giai đoạn này rất dễ bị dính trên mặt nước do sức căng bề mặt của nước. Khi dính vào mặt nước, chúng tiết ra một chất nhầy, dính và nhanh chóng làm dính những ấu trùng khác. Kết quả một số lượng lớn cá giai đoạn này bị chết trong thời gian ngắn. Để ngăn ngừa do sự cố này, cần theo dõi thường xuyên các yếu tố môi trường và tiến hành các biện pháp như điều chỉnh sục khí, nhỏ dầu cá lên mặt nước bể ương, hạn chế bớt ánh sáng, duy trì tảo trong các lô thí nghiệm. Trong quá trình thí nghiệm chúng tôi đã duy trì ổn định các yếu tố môi trường như độ mặn, nhiệt độ, ánh sáng, hàm lượng oxy hòa tan thích hợp với điều kiện sinh trưởng của cá mú cọp giai đoạn 1,0 - 1,5 cm đến giai đoạn 2,0 - 3,0 cm theo phương pháp của Lê Xân và cộng sự (2003) [3] và Lê Văn Bửu (2004) [4] được thể hiện ở bảng 2. Thông tin khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 102 Bảng 2. Các yếu tố môi trường trong quá trình thí nghiệm Yếu tố môi trường Bể thí nghiệm ương nuôi cá mú cọp Môi trường thích hợp ương nuôi [3];[4] Độ mặn (‰) 30,66 ± 0,08 27,0 - 32,0 Nhiệt độ (oC) 26,80 ± 0,07 25,0 - 30,0 pH 7,93 ± 0,03 7,5 - 8,5 Hàm lượng oxy hòa tan (mg O2/l) 5,90 ± 0,05 > 4 Độ mặn ảnh hưởng đến khả năng điều hòa áp suất thẩm thấu của ấu trùng cá. Khi độ mặn giảm cá sử dụng oxy hòa tan nhiều hơn cho quá trình hô hấp, biểu hiện thông qua sự tăng quá trình trao đổi chất, quá trình điều hòa áp suất thẩm thấu, nếu không thủy sinh vật có thể chết khi độ muối giảm [8]. Trong quá trình thí nghiệm độ mặn luôn ổn định ở mức 30 - 31 ‰ nằm trong khoảng môi trường thích hợp ương nuôi ấu trùng cá mú cọp. Nhiệt độ: Nhiệt độ thích hợp cho ấu trùng cá mú sinh trưởng và phát triển khoảng 25,0-30,0oC [4]. Nhiệt độ trong quá trình ương nuôi luôn ổn định 26-27oC nằm trong khoảng thích hợp. Nếu nhiệt độ giảm dưới 20oC, cá bắt mồi kém, chậm phát triển, tỷ lệ sống thấp, nhiệt độ tiếp tục giảm đến 15oC cá bắt đầu chết [8]. pH: Có liên quan đến khả năng điều hòa áp suất thẩm thấu của thủy sinh vật và hàm lượng khí độc trong môi trường nước như: H2S, N H3..., do vậy pH có ảnh hưởng rất lớn. Độ pH thích hợp cho ấu trùng cá mú cọp sinh trưởng và phát triển là 7,5 - 8,5 [8]. Trong quá trình thí nghiệm pH luôn ổn định ở mức 7,5 - 8, nằm trong khoảng môi trường thích hợp ương nuôi ấu trùng cá mú cọp. Oxy hòa tan: Là nhân tố cần thiết cho ấu trùng cá mú cọp để thực hiện quá trình trao đổi chất, phục vụ cho hoạt động sống bình thường của cơ thể, nếu thiếu oxy ấu trùng cá sẽ chết. Hàm lượng oxy thích hợp cho ấu trùng cá mú cọp sinh trưởng và phát triển là trên 4 mg/l [8]. Trong quá trình thí nghiệm oxy hòa tan luôn ổn định ở mức thích hợp 5 - 6 mg/l. 3.2. Ảnh hưởng của HUFA đến sinh trưởng của cá mú cọp ương nuôi giai đoạn 1,0 - 1,5 cm đến giai đoạn 2,0 - 3,0 cm 3.2.1. Tăng trưởng chiều dài của cá mú cọp ương nuôi giai đoạn 1,0 - 1,5 cm đến giai đoạn 2,0 - 3,0 cm Sau 15 ngày ương nuôi ấu trùng cá mú cọp với 2 nghiệm thức cho cá ăn Nauplius Artemia không bổ sung HUFA (A1 DHA) và Nauplius Artemia bổ sung HUFA (A1 DHA). Kết quả thí nghiệm được thể hiện ở hình 3. Thông tin khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 103 Hình 3. Ảnh hưởng của HUFA đến sinh trưởng của cá mú cọp ương nuôi giai đoạn 1,0 - 1,5 cm đến giai đoạn 2,0 - 3,0 cm Kết quả thu được trong hình 3 cho thấy có sự khác nhau rõ ràng giữa hai nghiệm thức. Giá trị trung bình tăng trưởng chiều dài toàn thân ấu trùng cá mú cọp ở nghiệm thức cho cá ăn Nauplius Artemia không bổ sung HUFA (A1 DHA) đạt trung bình 2,8±0,3 cm, thấp hơn nghiệm thức cho cá ăn Nauplius Artemia bổ sung HUFA (A1 DHA) đạt chiều dài toàn thân trung bình 3,0±0,3 cm, mức độ khác biệt này có ý nghĩa thống kê (p <0,05). 3.2.2. Ảnh hưởng HUFA đến sinh trưởng của cá mú cọp ương nuôi giai đoạn 1,0 - 1,5 cm đến giai đoạn 2,0 - 3,0 cm Sau 15 ngày ương nuôi cá mú cọp bằng thức ăn sống Nauplius Artemia bổ sung chất làm giàu HUFA (A1 DHA) thì mức độ ảnh hưởng HUFA đến sinh trưởng của cá thể hiện ở hình 4. Hình 4. Ảnh hưởng của HUFA đến sinh trưởng của cá mú cọp giai đoạn 1,0-1,5 cm đến 2,0 - 3,0 cm (SGRL - tốc độ sinh trưởng đặc trưng về chiều dài chuẩn, %/ngày) Artemia Artemia HuFA 24 26 28 30 32 34 36 Thức an LC SGRL Thức ăn Thông tin khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 104 Sau 15 ngày ương nuôi kết quả cho thấy ở nghiệm thức cho ăn thức ăn là Nauplius Artemia có làm giàu HUFA (A1 DHA) cho thấy mức độ ảnh hưởng HUFA đến sinh trưởng của cá tương đối lớn. Trong đó, cá được cho ăn ở nghiệm thức (NT2) Nauplius Artemia bổ sung HUFA (A1 DHA) cho SGRL cao nhất 1,41 ± 0,01%/ngày, ở NT1 (Nauplius Artemia không bổ sung HUFA (A1 DHA)) 0,93 ± 0,01%/ngày (p < 0,05). 3.3. Ảnh hưởng của HUFA lên tỷ lệ sống của cá mú cọp ương nuôi giai đoạn 1,0 - 1,5 cm lên đến giai đoạn 2,0 - 3,0 cm. Sau 15 ngày ương nuôi ấu trùng cá mú cọp với 2 nghiệm thức thí nghiệm cho cá ăn Nauplius Artemia không bổ sung HUFA (A1 DHA) và Nauplius Artemia bổ sung HUFA (A1 DHA) kết quả thí nghiệm thể hiện ở bảng 3. Bảng 3. Các chỉ số tỷ lệ sống của cá mú cọp ương nuôi bằng thức ăn Nauplius Artemia không bổ sung HUFA (A1 DHA) và Nauplius Artemia bổ sung HUFA (A1 DHA) Nghiệm thức Nauplius Artemia không bổ sung HUFA (A1 DHA) Nauplius Artemia bổ sung HUFA (A1 DHA) N ban đầu TN (con) 180 180 N kết thúc TN (con) 61 67 Tỷ lệ sống (%) 34 37 Hiệu số d (khoảng tin cậy 95%) σ (-0,137 đến 0,071) p-value (5%) 0,582 Kết quả sau 15 ngày ương nuôi, nghiệm thức cho ăn thức ăn Nauplius Artemia bổ sung HUFA (A1 DHA) đạt tỷ lệ sống 37%; nghiệm thức cho ăn thức ăn Nauplius Artemia không bổ sung HUFA (A1 DHA) đạt tỷ lệ sống 34%. Qua kết quả phân tích so sánh cho thấy khoảng tin cậy 95% của hiệu số dao động từ âm đến dương (-0,137 đến 0,071) nên d=0. Sự khác biệt về tỷ lệ sống giữa hai nghiệm thức không có ý nghĩa thông kê (p = 0,582 > 0,05) và tỷ lệ sống khi cho ăn thức ăn Nauplius Artemia bổ sung HUFA (A1 DHA) cao hơn nhưng không đáng kể. Có thể liên quan đến điều kiện thí nghiệm, các yếu tố ảnh hưởng như ánh sáng, điều chỉnh lượng khí, chất lượng nước ương nuôi đã được kiểm soát. Tuy nhiên, kết quả ương nuôi đạt 34-37% là cao hơn nhiều so với kết quả của Viện Nghiên cứu nuôi biển Gondon, Indonesia ương nuôi giống cá mú cọp giai đoạn 1,0 - 3,0 cm sử dụng thức ăn là tảo đơn bào (Nannochloropsis sp), luân trùng, ấu trùng artemia, trong điều kiện bể xi măng có thể tích 10 m3 với mật độ từ 2 - 5 ấu trùng/lít đạt tỷ lệ sống 7,5-8% [3] và Viện Nghiên cứu Nuôi trồng Thủy sản I khi ương nuôi cá mú chấm nâu (Epinephelus coioides) giai đoạn 1,0 - 3,0 cm sử dụng thức ăn sống Copepoda và Artemia đạt tỷ lệ 5,8-6,2% [1]. Thông tin khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 105 Thực tế cho thấy, ương nuôi cá mú cọp giai đoạn 1,0 - 1,5 cm lên đến giai đoạn 2,0 - 3,0 cm cho cá ăn Nauplius Artemia bổ sung HUFA (A1 DHA) thì quá trình hoàn thiện các bộ phận trên cơ thể cá nhanh, chất lượng cá giống khỏe hơn. Kết quả này phù hợp với kết quả nghiên cứu của Koven và cộng sự (2001) khi ương nuôi ấu trùng cá tráp vàng (Sparus aurata) bằng thức ăn Nauplius Artemia làm giàu HUFA (A1 DHA) đã nâng cao tỷ lệ sống, tăng trưởng và khả năng chịu sốc với môi trường [8] và Cutts và cộng sự (2006) khi ương nuôi giống cá tuyết Đại Tây Dương (Gadus morhua) giai đoạn cho ăn bằng thức ăn Nauplius Artemia làm giàu HUFA (A1 DHA) [9]. Ngoài ra, trong thời gian ương nuôi giai đoạn này thường xuyên kiểm tra môi trường bể ương nuôi để kịp thời điều chỉnh khí, ánh sáng và tảo, tránh hiện tượng cá chết do sốc môi trường. Hình 5. Cá mú cọp trước và sau thí nghiệm 4. KẾT LUẬN - HUFA có ảnh hưởng đến tăng trưởng chiều dài toàn thân giống cá mú cọp (Epinephelus fuscoguttatus) ương nuôi giai đoạn 1,0-1,5 cm lên đến giai đoạn 2,0-3,0 cm. Sau 15 ngày thí nghiệm, ở nghiệm thức cho cá ăn bằng thức ăn Nauplius Artemia bổ sung HUFA đạt 3,0 ± 0,3 cm, tốc độ tăng trưởng đạt 1,41 ± 0,01%/ngày; Nghiệm thức cho cá ăn thức ăn Nauplius Artemia không bổ sung HUFA đạt 2,8±0,3 cm, tốc độ tăng trưởng đạt 0,93±0,01%/ngày (p<0,05). - Tỷ lệ sống khi cho cá ăn thức ăn Nauplius Artemia bổ sung HUFA và cho ăn Nauplius Artemia không bổ sung HUFA có sự khác biệt không có ý nghĩa thông kê (p>0,05). Sau 15 ngày thí nghiệm, nghiệm thức cho cá ăn bằng thức ăn Nauplius Artemia bổ sung HUFA đạt tỷ lệ sống 37%; Nghiệm thức cho cá ăn thức ăn Artemia đạt tỷ lệ sống 34% (p>0,05). - Trong quá trình thí nghiệm các yếu tố môi trường luôn ổn định: Độ mặn 30- 31‰; nhiệt độ 26-27oC; pH 7,5-8; o xy hòa tan 4 mg/lít nằm trong khoảng thích hợp cho cá sinh trưởng và phát triển. Thông tin khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 106 TÀI LIỆU THAM KHẢO 1. Lê Anh Tuấn, Tình hình nuôi cá mú ở Việt Nam, hiện trạng và các trở ngại về mặt kỹ thuật, Tạp chí Khoa học công nghệ thủy sản, Trường Đại học Nha Trang, 2004, tr.86-92. 2. Hoàng Thị Hiền, Lê Minh Hoàng, Nghiên cứu một số đặc tính lý, hóa học của tinh trùng cá mú cọp Epinephelus fuscoguttatus Forsskål, 1775, Đề tài cấp trường Đại học Nha Trang, 2013, tr.11-12. 3. Lê Xân, Nguyễn Xuân Sinh, Kết quả bước đầu về nghiên cứu xây dựng quy trình công nghệ sản xuất giống cá Song chấm nâu (Epinephelus coioides). Viện nghiên cứu nuôi trồng thủy sản I, Tuyển tập báo cáo Hội nghị Khoa học toàn quốc lần thứ 2, Bộ Nông nghiệp, 2003, tr.35-39. 4. Lê Văn Bửu, Kỹ thuật sản xuất giống cá mú, Dự án SUMA, 2004, tr.67. 5. Sổ tay kỹ thuật sản xuất giống cá mú chuột (Cromileptes altivelis), Chương trình hỗ trợ ngành thủy sản - Hợp phần hỗ trợ nuôi trồng thủy sản biển và nước lợ - SUMA, 2004, tr.40. 6. Lục Minh Diệp, Vai trò của HUFA đối với cá biển và ý nghĩa của việc làm giàu thức ăn sống và chuyển đổi thức ăn trong sản xuất giống cá biển nhân tạo, Chuyên đề nghiên cứu sinh, Trường Đại học Nha Trang, 2009, tr.31-35. 7. Lục Minh Diệp, Nghiên cứu bổ sung axit béo và các chế phẩm làm giàu thức ăn sống trong quá trình ương nuôi ấu trùng cá chẽm Lates Calcarifer (Bloch,1790), Luận án tiến sĩ, Trường Đại học Nha Trang, 2010. 8. Koven W., Barr Y., Lutzky S., Ben-Atia I., Weiss R., Harel M., Behrens P. and Tandler A., The effect of dietary arachidonic acid (20:4n-6) on growth, survival and resistance to handling stress in gilthead seabream (Sparus aurata) larvae, Aquaculture, 2001, 193:107-122. 9. Cutts C.J., Sawanboonchun J., Mazorra de Quero C. and Bell J.G., Diet- induced differences in the essential fatty acid (EFA) compositions of larval Atlantic cod (Gadus morhua L.) with reference to possible effects of dietary EFAs on larval performance, ICES Journal of Marine Science, 2006, 63:302- 310. Nhận bài ngày 09 tháng 5 năm 2019 Phản biện xong ngày 24 tháng 3 năm 2020 Hoàn thiện ngày 24 tháng 4 năm 2020 (1) Chi nhánh Ven Biển, Trung tâm Nhiệt đới Việt - Nga (2 Đại học Nha Trang
File đính kèm:
 anh_huong_hufa_den_toc_do_tang_truong_ty_le_song_cua_ca_mu_c.pdf
anh_huong_hufa_den_toc_do_tang_truong_ty_le_song_cua_ca_mu_c.pdf

