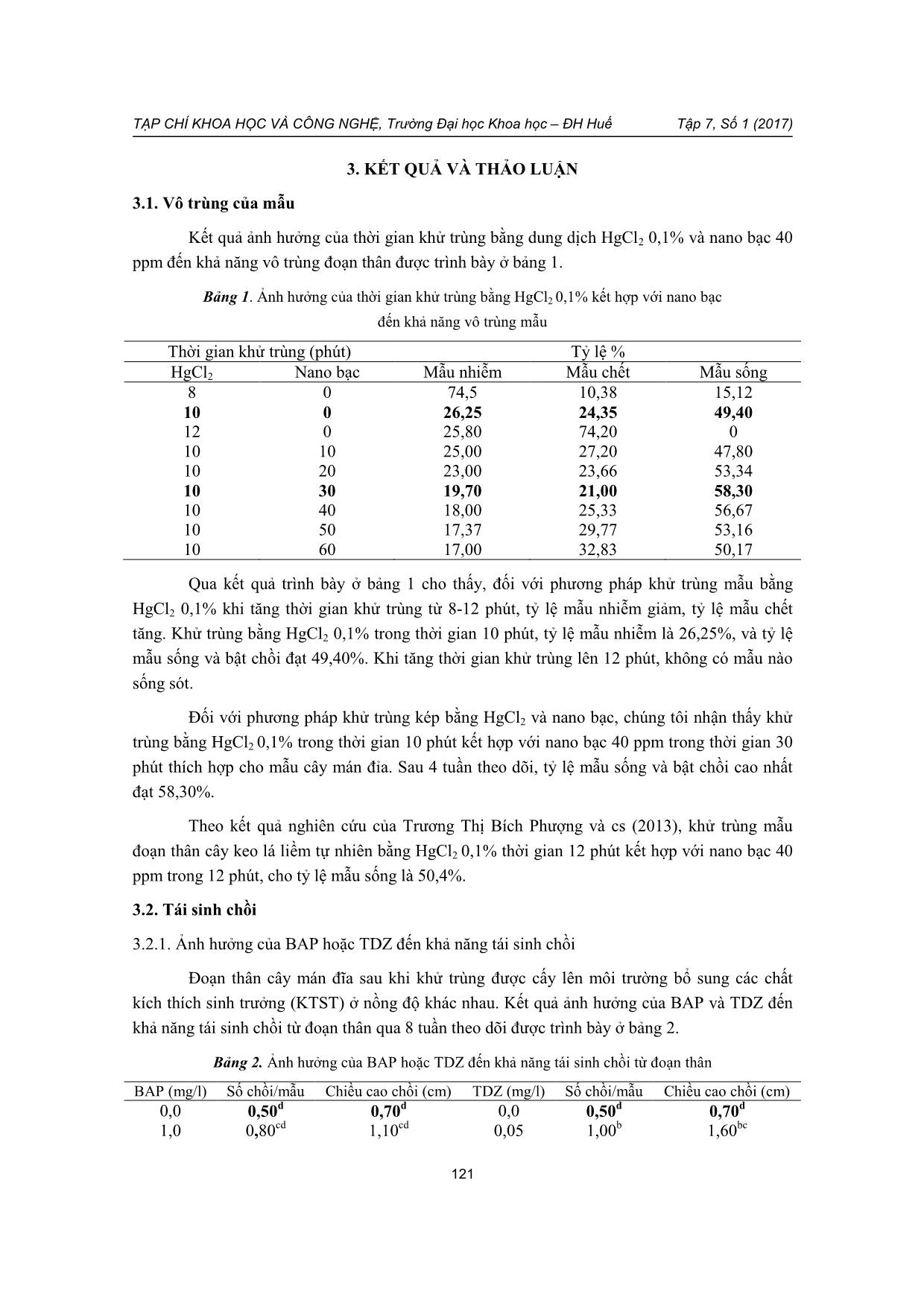
Nghiên cứu tái sinh chồi in vitro cây mán đỉa (Archidendron clypearia (Jack) Nielsen)
Cây mán đỉa (Archidendron clypearia (Jack) Nielsen) là một dược liệu có triển vọng phát
triển ở tỉnh Thừa Thiên Huế. Nghiên cứu kỹ thuật nhân giống in vitro cây mán đỉa sẽ góp
phần tạo tiền đề cho việc phát triển nguồn dược liệu sẵn có tại địa phương.
Trong ài áo này, ch ng t i tr nh ày kết qu ư c đầu về tái sinh chồi in vitro cây mán
đỉa. Đoạn thân (kho ng 4 cm) mang chồi nách của cây mán đỉa được khử trùng ằng
HgCl2 0,1% 10 phút, rồi tiếp tục khử trùng v i nano ạc 40 ppm trong 30 ph t. Kết qu cho
tỷ lệ mẫu kh ng nhiễm cao nhất đạt 58,30% sau 4 tuần nu i cấy. M i trường ổ sung 2,0
mg/l BAP (6-benzylaminopurine) là m i trường tối ưu cho sự tái sinh chồi in vitro từ đoạn
thân cây mán đỉa đạt 1,66 chồi/mẫu. M i trường MS có ổ sung 0,2 mg/l NAA (-
naphthaleneacetic acid) kết hợp 2,0 mg/l BAP (6-benzylaminopurine) cho sinh trưởng của
chồi tốt, chiều cao chồi đạt 3,11cm sau 8 tuần nu i cấy

Trang 1

Trang 2
Trang 3

Trang 4

Trang 5

Trang 6

Trang 7
Tóm tắt nội dung tài liệu: Nghiên cứu tái sinh chồi in vitro cây mán đỉa (Archidendron clypearia (Jack) Nielsen)

Đại học Huế *Email: vtmhuong61@gmail.com TÓM TẮT Cây mán đỉa (Archidendron clypearia (Jack) Nielsen) là một dược liệu có triển vọng phát triển ở tỉnh Thừa Thiên Huế. Nghiên cứu kỹ thuật nhân giống in vitro cây mán đỉa sẽ góp phần tạo tiền đề cho việc phát triển nguồn dược liệu sẵn có tại địa phương. Trong ài áo này, ch ng t i tr nh ày kết qu ư c đầu về tái sinh chồi in vitro cây mán đỉa. Đoạn thân (kho ng 4 cm) mang chồi nách của cây mán đỉa được khử trùng ằng HgCl2 0,1% 10 phút, rồi tiếp tục khử trùng v i nano ạc 40 ppm trong 30 ph t. Kết qu cho tỷ lệ mẫu kh ng nhiễm cao nhất đạt 58,30% sau 4 tuần nu i cấy. M i trường ổ sung 2,0 mg/l BAP (6-benzylaminopurine) là m i trường tối ưu cho sự tái sinh chồi in vitro từ đoạn thân cây mán đỉa đạt 1,66 chồi/mẫu. M i trường MS có ổ sung 0,2 mg/l NAA ( - naphthaleneacetic acid) kết hợp 2,0 mg/l BAP (6-benzylaminopurine) cho sinh trưởng của chồi tốt, chiều cao chồi đạt 3,11cm sau 8 tuần nu i cấy. Từ khóa: đoạn thân mang chồi nách, mán đỉa, khử trùng, tái sinh chồi in vitro. 1. MỞ ĐẦU Mán đỉa (Archidendron clypearia (Jach.) I. Niels) là cây nhỡ hay cây gỗ, mọc hoang ở nhiều tỉnh phía Bắc, các tỉnh miền Trung cho tới các tỉnh Nam bộ .... Cây mán đỉa có nhiều công dụng. Gỗ mán đỉa nhẹ, màu hồng nhạt, mềm, dễ gia công, thường dùng làm đồ dùng thông thường, làm gỗ trụ mỏ và làm củi. Vỏ cây chứa tanin có thể dùng thuộc da, dùng nhuộm lưới và nấu nước gội đầu. Lá dùng làm thuốc nhuộm đen, có thể dùng nấu nước tắm trị ghẻ, dùng trị đau chân, sưng tấy, thủy đậu, ho và đậu mùa dùng trị bỏng lửa, bỏng nước và các loại vết thương, lá phơi khô và tán bột dùng để điều trị các vết thương[1], [3]. Kết quả điều tra cộng đồng của Nguyễn Thị Hoài và cs cho thấy đây là một trong những loại cây thuốc được đồng bào dân tộc Pako, Vân Kiều sử có hiệu quả trong việc chữa các bệnh về gan (viêm gan, xơ gan, các bệnh gan mật). Các nghiên cứu tiếp theo đã phân tách được một số hoạt chất, phát hiện và chứng minh được hoạt tính chống oxy hoá rất mạnh của dịch chiết cao toàn phần trên tế bào gan và mán đỉa được xem là một loại cây có tiềm năng để phát 119 Nghiên cứu tái sinh chồi in vitro cây mán đỉa (Archidendron clypearia (Jack) Nielsen) triển thành thuốc từ nguồn dược liệu sẵn có tại địa phương. Đề tài nghiên cứu nhằm phát triển cây mán đỉa tạo nguồn dược liệu ở Thừa Thiên Huế đã được phê duyệt. Sử dụng kỹ thuật nhân giống in vitro cây mán đỉa sẽ góp phần tạo ra số lượng lớn cây con đồng đều về mặt di truyền, trong thời gian ngắn đáp ứng nhu cầu về cây giống trong cải tạo thảm thực vật rừng cũng như phát triển nguồn dược liệu chiết từ loại cây này. Trong bài báo ch ng tôi tr nh bày kết quả bước đầu về tái sinh chồi in vitro cây mán đỉa. 2. VẬT LIỆU VÀ PHƢƠNG PHÁP 2.1. Nguyên liệu Nguyên liệu nghiên cứu là đoạn thân mang chồi nách của cây mán đỉa 1 năm tuổi được lấy từ Vườn Quốc gia Bạch Mã. 2.2. Vô trùng mẫu Đoạn thân mang chồi nách (khoảng 4-5 cm) của cây mán đỉa 1 năm tuổi sau khi được khử trùng riêng rẽ bằng HgCl2 0,1% với thời gian từ 8-12 phút hoặc kết hợp với nano bạc nồng độ 40 ppm trong các khoảng thời gian khác nhau 10, 20, 30, 35, 40, 50, 60 ph t. Rửa sạch lại bằng nước cất vô trùng 5 lần trước khi cấy lên môi trường dinh dưỡng. Khả năng khử trùng mẫu của phương pháp trên được đánh giá thông qua theo dõi tỷ lệ mẫu chết, mẫu nhiễm và mẫu sống không nhiễm sau 4 tuần theo dõi. 2.3. Nuôi cấy ban đầu Đoạn thân mang chồi nách (khoảng 4 cm) sau khi khử trùng được cắt thành các mẫu nhỏ có kích thước khoảng 1,0-1,5 cm. Sau đó, mẫu được cấy lên môi trường cơ bản MS (Murashige – Skoog, 1962) [4] có 8 g/l agar; 30 g/l sucrose và bổ sung riêng lẻ các chất kích thích sinh trưởng BAP (1,0-3,0 mg/l); TDZ (thidiazuron) (0,05-0,7 mg/l); nồng độ BAP tối ưu kết hợp với NAA (0,05-0,3 mg/l); nồng độ TDZ tối ưu kết hợp với NAA (0,05-0,3 mg/l) để thăm dò khả năng tái sinh chồi của mẫu sau 8 tuần nuôi cấy. Mẫu được nuôi cấy trong b nh thủy tinh có thể tích 100 ml và 250 ml, phòng nuôi có nhiệt độ từ 25-270C; độ pH của môi trường nuôi cấy là 5,8; cường độ ánh sáng là 2000-3000 lux; thời gian chiếu sáng 12 giờ/ngày. 2.4. l th ng ê Mỗi thí nghiệm được tiến hành 3 lần lặp lại. Mỗi công thức nuôi cấy được lặp lại với số mẫu tối thiểu là 15. ết quả thí nghiệm được phân tích Duncan’s test bằng phần mềm SPSS 16.0 với mức xác suất có ý nghĩa p < 0,05. 120 TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học – ĐH Huế Tập 7, Số 1 (2017) 3. KẾT QUẢ VÀ THẢO LUẬN 3.1. Vô trùng của mẫu ết quả ảnh hưởng của thời gian khử trùng bằng dung dịch HgCl2 0,1% và nano bạc 40 ppm đến khả năng vô trùng đoạn thân được tr nh bày ở bảng 1. Bảng 1. Ảnh hưởng của thời gian khử trùng bằng HgCl2 0,1% kết hợp với nano bạc đến khả năng vô trùng mẫu Thời gian khử trùng (phút) Tỷ lệ % HgCl2 Nano bạc Mẫu nhiễm Mẫu chết Mẫu sống 8 0 74,5 10,38 15,12 10 0 26,25 24,35 49,40 12 0 25,80 74,20 0 10 10 25,00 27,20 47,80 10 20 23,00 23,66 53,34 10 30 19,70 21,00 58,30 10 40 18,00 25,33 56,67 10 50 17,37 29,77 53,16 10 60 17,00 32,83 50,17 Qua kết quả trình bày ở bảng 1 cho thấy, đối với phương pháp khử trùng mẫu bằng HgCl2 0,1% khi tăng thời gian khử trùng từ 8-12 phút, tỷ lệ mẫu nhiễm giảm, tỷ lệ mẫu chết tăng. Khử trùng bằng HgCl2 0,1% trong thời gian 10 phút, tỷ lệ mẫu nhiễm là 26,25%, và tỷ lệ mẫu sống và bật chồi đạt 49,40%. hi tăng thời gian khử trùng lên 12 phút, không có mẫu nào sống sót. Đối với phương pháp khử trùng kép bằng HgCl2 và nano bạc, chúng tôi nhận thấy khử trùng bằng HgCl2 0,1% trong thời gian 10 phút kết hợp với nano bạc 40 ppm trong thời gian 30 phút thích hợp cho mẫu cây mán đỉa. Sau 4 tuần theo dõi, tỷ lệ mẫu sống và bật chồi cao nhất đạt 58,30%. Theo kết quả nghiên cứu của Trương Thị Bích Phượng và cs (2013), khử trùng mẫu đoạn thân cây keo lá liềm tự nhiên bằng HgCl2 0,1 thời gian 12 ph t kết hợp với nano bạc 40 ppm trong 12 phút, cho tỷ lệ mẫu sống là 50,4%. 3.2. Tái sinh chồi 3.2.1. Ảnh hưởng của BAP hoặc TDZ đến khả năng tái sinh chồi Đoạn thân cây mán đĩa sau khi khử trùng được cấy lên môi trường bổ sung các chất kích thích sinh trưởng (KTST) ở nồng độ khác nhau. ết quả ảnh hưởng của BAP và TDZ đến khả năng tái sinh chồi từ đoạn thân qua 8 tuần theo dõi được tr nh bày ở bảng 2. Bảng 2. Ảnh hưởng của BAP hoặc TDZ đến khả năng tái sinh chồi từ đoạn thân BAP (mg/l) Số chồi/mẫu Chiều cao chồi (cm) TDZ (mg/l) Số chồi/mẫu Chiều cao chồi (cm) 0,0 0,50d 0,70d 0,0 0,50d 0,70d 1,0 0,80cd 1,10cd 0,05 1,00b 1,60bc 121 Nghiên cứu tái sinh chồi in vitro cây mán đỉa (Archidendron clypearia (Jack) Nielsen) 1,5 1,05bc 1,50bc 0,15 1,50a 2,05a 2,0 1,66a 2,70a 0,20 1,35ab 1,97ab 2,5 1,35ab 2,10b 0,25 1,10ab 1,82abc 3,0 1,20abc 2,00b 3,0 1,10ab 1,55bc Chú thích: Các chữ cái khác nhau trên cùng một cột chỉ ra sự sai khác có ý nghĩa thống kê của trung bình mẫu v i p<0,05 (Duncan's test). Nhìn chung, mẫu đoạn thân cây mán đĩa khó bật chồi trên các môi trường nuôi cấy bổ sung chất kích thích sinh trưởng. Môi trường bổ sung BAP 2,0 mg/l cho số chồi cao nhất chỉ đạt 1,66 chồi/mẫu. hi tăng nồng độ BAP trong môi trường nuôi cấy từ 1-2 mg/l, tỷ lệ mẫu tái sinh và khả năng sinh trưởng của chồi tăng, mẫu bật chồi nhanh, khoảng 2-3 tuần sau khi cấy, số chồi trên mẫu tăng từ 0,8 đến 1,66 chồi/mẫu. Tuy nhiên, khi tăng nồng độ BAP lên trên 2,0 mg/l, kết quả thu được ngược lại, mẫu bật chồi chậm, khoảng 3-4 tuần sau khi cấy, tỷ lệ mẫu tái sinh và khả năng sinh trưởng của chồi giảm. Môi trường có nồng độ TDZ từ 0,05-0,15 mg/l cho chồi sinh trưởng tốt, mẫu bật chồi nhanh, khoảng 2-3 tuần sau khi cấy. Môi trường bổ sung TDZ 0,15 mg/l cho số chồi cao nhất đạt 1,50 chồi/mẫu. Khi tăng nồng độ TDZ lên trên 0,3 mg/l, mẫu bật chồi chậm 3-4 tuần sau khi cấy, tỷ lệ mẫu tái sinh chồi và khả năng sinh trưởng của chồi giảm. Ở môi trường đối chứng không bổ sung chất kích thích sinh trưởng, khả năng tái sinh chồi của mẫu là thấp nhất chỉ đạt 0,5 chồi/mẫu. Những chồi mới tái sinh có kích thước nhỏ, yếu, màu xanh nhạt, chiều cao chồi thấp (0,7 cm). Như vậy, môi trường bổ sung BAP 2,0 mg/l là môi trường thích hợp nhất cho sự tái sinh chồi từ đoạn thân cây mán đỉa. Nồng độ này cao hơn so với kết quả nghiên cứu trên cây keo lá liềm. Ở keo lá liềm môi trường cơ bản MS bổ sung BAP 1,5 mg/l có ảnh hưởng tốt nhất đến khả năng tái sinh chồi từ đoạn thân, trung bình 4,96 chồi/mẫu [6]. 3.2.2. Ảnh hưởng của NAA kết hợp với BAP hoặc TDZ đến khả năng tái sinh chồi Các chất kích thích sinh trưởng, đặc biệt là các chất thuộc nhóm cytokinin có vai trò rất lớn trong việc kích thích sự hình thành chồi. Tuy nhiên, kết quả nghiên cứu của chúng tôi cho thấy khả năng tái sinh chồi và sinh trưởng của chồi mán đỉa trên môi trường bổ sung BAP và TDZ là chưa cao. Trong nuôi cấy mô thực vật người ta thường kết hợp tỉ lệ giữa auxin và cytokinin để tạo chồi, tạo mô sẹo, tái sinh chồi từ mô sẹo và tạo rễ. Sự kết hợp tùy vào từng nghiên cứu và mục đích định h nh cho mô thực vật. Vì vậy, chúng tôi tiếp tục nghiên cứu ảnh hưởng của kết hợp BAP hoặc TDZ với một loại auxin là NAA đến khả năng tái sinh chồì và sinh trưởng chồi cây mán đỉa. Kết quả ảnh hưởng của tổ hợp chất kích thích sinh trưởng đến khả năng tái sinh chồi từ đoạn thân sau 8 tuần nuôi cấy được trình bày ở bảng 3. 122 TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học – ĐH Huế Tập 7, Số 1 (2017) Bảng 3. Ảnh hưởng của NAA kết hợp với BAP hoặc TDZ đến khả năng tái sinh chồi sau 8 tuần nuôi cấy Chất TST (mg/l) Chiều Chất TST (mg/l) Chiều Số Số cao chồi cao chồi BAP NAA chồi/mẫu TDZ NAA chồi/mẫu (cm) (cm) 0,0 0,00 0,5b 0,70 d 0,00 0,00 0,5b 0,7 b 2,0 0,05 1,11a 2,11 bc 0,15 0,05 1,29a 2,1 a 2,0 0,10 1,19a 2,65 abc 0,15 0,10 1,40 a 2,75 a 2,0 0,15 1,22a 2,73 ab 0,15 0,15 1,30 a 2,49 a 2,0 0,20 1,32a 3,11 a 0,15 0,20 1,25 a 2,35 a 2,0 0,25 1,27a 2,69 abc 0,15 0,25 1,23 a 2,25 a 2,0 0,30 1,24a 2,52 c 0,15 0,30 1,0 a 2,15 a Chú thích: Các chữ cái khác nhau trên cùng một cột chỉ ra sự sai khác có ý nghĩa thống kê của trung bình mẫu v i p<0,05 (Duncan's test). Qua kết quả trình bày ở bảng 3 cho thấy, môi trường sử dụng tổ hợp chất kích thích sinh trưởng cho khả năng bật chồi mán đỉa tương đương nhau và tốt hơn đối chứng. Trên môi trường MS bổ sung 2,0 mg/l BAP kết hợp với 0,2 mg/l NAA thu được số chồi trên mẫu (1,32 chồi/ mẫu) và chiều cao chồi (3,11 cm) cao nhất. Trên môi trường này, chồi tái sinh sinh trưởng tốt, chồi mập, lá dày, màu xanh đậm Cùng với quá trình tạo chồi, phần tiếp xúc của mẫu vật với môi trường nuôi cấy xuất hiện callus. Callus tạo thành có kích thước khoảng 1 cm trên môi trường bổ sung 2 mg/l BAP kết hợp với 0,2 mg/l NAA. Trên môi trường MS bổ sung 0,15 TDZ mg/l kết hợp với 0,1 mg/l NAA, thu được 1,4 chồi/ mẫu và chiều cao chồi thu được trong tổ hợp này đạt 2,75 cm. Chồi tái sinh sinh trưởng tốt, chồi mập, lá dày, màu xanh đậm. So với môi trường bổ sung riêng rẽ BAP hoặc TDZ (bảng 2), môi trường bổ sung kết hợp NAA với BAP hoặc TDZ cho số chồi trên mẫu thấp hơn, tuy nhiên sự sinh trưởng của chồi là tốt hơn. D A B C Hình 1. Tái sinh chồi in vitro cây mán đỉa sau 8 tuần nuôi cấy A. Trên môi trường bổ sung 2 mg/l BAP; B. Trên môi trường bổ sung 1,5 mg/l BAP; C. Trên môi trường bổ sung 2 mg/l BAP và 0,2 mg/l NAA; D. Trên môi trường bổ sung 1,5 mg/l TDZ và 0,1 mg/l NAA. 123 Nghiên cứu tái sinh chồi in vitro cây mán đỉa (Archidendron clypearia (Jack) Nielsen) 4. KẾT LUẬN 1. hử trùng đoạn thân cây mán đỉa tự nhiên bằng HgCl2 0,1% trong 10 phút kết hợp với nano bạc 40 ppm trong 30 ph t là thích hợp nhất, cho tỷ lệ mẫu đoạn thân sống không nhiễm cao nhất đạt 58,30 . 2. Môi trường bổ sung BAP 2,0 mg/l là môi trường tối ưu cho sự tái sinh chồi in vitro từ đoạn thân cây mán đỉa đạt 1,66 chồi/mẫu, chồi cao 2,70 cm. 3. Môi trường bổ sung 0,2 mg/l NAA kết hợp với 2,0 mg/l BAP là môi trường tối ưu cho sinh trưởng của chồi mán đỉa với chiều cao đạt 3,11 cm. LỜI CÁM ƠN Nghiên cứu này nhận được sự hỗ trợ của đề tài cấp tỉnh Thừa Thiên Huế năm 2014- 2015. Chúng tôi xin chân thành cám ơn. TÀI LIỆU THAM KHẢO [1]. Phạm Hoàng Hộ (1999), Cây cỏ Việt Nam, quyển 1, Nxb Giáo dục, tr. 833-837. [2]. Nguyễn Thị Hoài, Trịnh Thị Điệp, Đỗ Thị Thảo, Nguyễn Khánh Thùy Linh, Nguyễn Bích Hiền, Hoàng Thị Diệu Hương (2012), Sàng lọc hoạt tính chống oxy hóa một số cây thuốc đồng bào Pako- Vân Kiều ở Quảng Trị, Tạp chí dược liệu, tập 17(1), tr.8-13. [3]. F. Mueller, Fragm (2010), “Archidendron”, Flora of China, 10, 66-71. [4]. Murashige T., Skoog F. (1962), A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiol Plant 15, 473-497 [5]. Trương Thị Bích Phượng, Nguyễn Xuân Hoàn, Hồ Thị Thùy Dung, Nguyễn Hữu Nhân, Đặng Thái Dương (2013). Ảnh hưởng của nano bạc đến nhân giống in vitro cây Keo lá liềm (Acacia crassicarpa A.cunn ex Benth), Báo cáo toàn văn Hội nghị Công nghệ sinh học toàn quốc năm 2013 (quyển 2), Trang: 1001-1005. [6]. Trương Thị Bích Phượng, Nguyễn Thị Hải Yến, Nguyễn Thị Ánh Hằng, Nguyễn Quang Thành, Đặng Thái Dương (2012). Nhân giống in vitro cây keo lá liềm (Acacia crassicarpa A. Cunn. ex Benth). Tạp chí Công nghệ sinh học 10 (4A): 907-914. 124 TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học – ĐH Huế Tập 7, Số 1 (2017) STUDY OF IN VITRO SHOOT REGENERATION OF ARCHIDENDRON CLYPEARIA (JACK) NIELSEN Vo Thi Mai Huong*, Truong Thi Bich Phuong, Nguyen Hong Ha Department of Biology, Hue University College of Sciences *Email: vtmhuong61@gmail.com ABSTRACT Archidendron clypearia (Jack) Nielsen is one of the potential medicinal herbs promising the development in Thua Thien Hue province. Studies of in vitro propagation techniques of this plant will contribute to creating the precondition for the development of available pharmaceutical resources in Thua Thien Hue. In this paper, we presented the procedure of in vitro regeneration of Archidendron clypearia plant. The stem segments (approximately 2.0 cm in length) consisting of a lateral shoot of Archidendron clypearia were sterilized with 0.1% (w/v) HgCl2 solution for 10 minutes and subsequently sterilized with 40 ppm nano-silver solution for 30 minutes. The highest rate of uncontaminated survival samples was up to 58.30% after four weeks of culture. MS medium supplemented with 2.0 mg/l BAP was optimal for shoot regeneration, reached about 1.66 shoots per explant. MS medium supplemented with 0.2 mg/l NAA and 2.0 mg/l BAP resulted in a good shoot development, 3.11 cm shoot in length was obtained after eight weeks of culture. Keywords: Archidendron clypearia, in vitro regeneration , stem segments, sterilized. 125
File đính kèm:
 nghien_cuu_tai_sinh_choi_in_vitro_cay_man_dia_archidendron_c.pdf
nghien_cuu_tai_sinh_choi_in_vitro_cay_man_dia_archidendron_c.pdf

