Bài giảng Kỹ thuật nhiệt - Chapter 4: Energy analysis of closed system
Công thay đổi thể tích (Moving boundary work) - Ứng
dụng cho các máy có chuyển động tịnh tiến
(reciprocating machines) như động cơ đốt trong, máy
nén khí;
Tính công giãn nở cho các quá trình, chu trình, đồ thị
công;
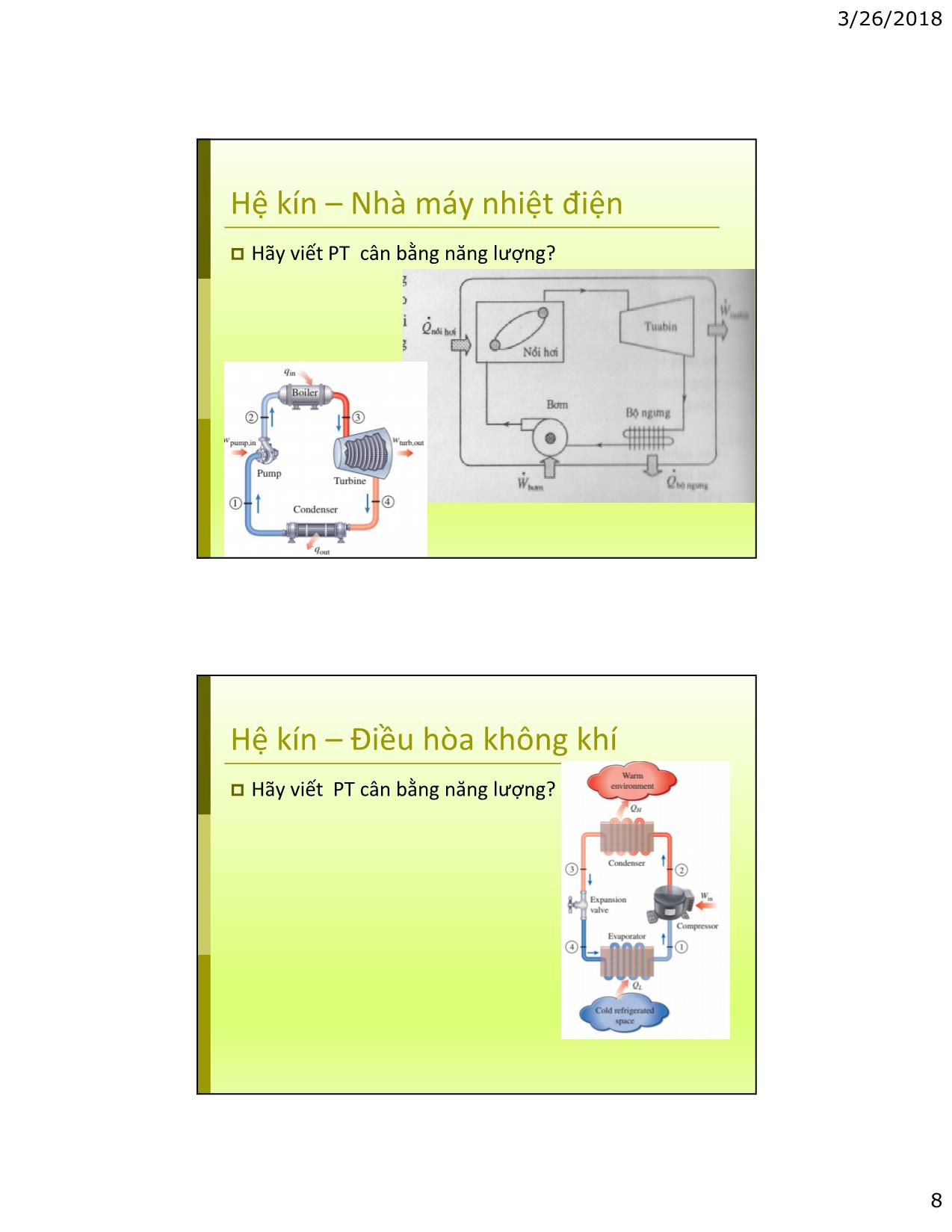
Cân bằng năng lượng đối với hệ kín;
Nội năng, enthalpy, nhiệt dung riêng của khí lý tưởng (hệ
kín);
Nội năng, enthalpy, nhiệt dung riêng của chất lỏng, chất
rắn.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7
Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài giảng Kỹ thuật nhiệt - Chapter 4: Energy analysis of closed system", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Kỹ thuật nhiệt - Chapter 4: Energy analysis of closed system

3/26/2018 School of Mechanical Engineering VIỆN CƠ KHÍ Chapter 4: Energy Analysis of Closed System - Bảo toàn năng lượng cho hệ kín - Định luật nhiệt động 1 cho hệ kín CONTENTS Công thay đổi thể tích (Moving boundary work) - Ứng dụng cho các máy có chuyển động tịnh tiến (reciprocating machines) như động cơ đốt trong, máy nén khí; Tính công giãn nở cho các quá trình, chu trình, đồ thị công; Cân bằng năng lượng đối với hệ kín; Nội năng, enthalpy, nhiệt dung riêng của khí lý tưởng (hệ kín); Nội năng, enthalpy, nhiệt dung riêng của chất lỏng, chất rắn. 1 3/26/2018 Closed systems Không có trao đổi môi chất với môi trường; Ví dụ: Piston-Cylinder trong các đ/cơ đốt trong: - Giả thiết quá trình nạp khí sạch/thải khí cháy triệt tiêu nhau về khối lượng: mass(in) = air + fuel = mass(out) = exhaust gas. - Quá trình cháy được thay bằng quá trình cấp nhiệt (Q in ); - Quá trình thải được thay bằng quá trình thải nhiệt (Q out ). 4.1. Công thay đổi thể tích Piston-Cylinder: Áp suất P; Diện tích A; Piston dịch chuyển ds. Công tạo ra: �� = ��� = �.�.�� = �.�� Nhận xét: Dấu phụ thuộc vào dV, dV dương (giãn nở) thì công dương; dV âm (nén) thì công âm; Phổ biến ở các thiết bị piston-cylinder (internal combustion engines, displacement compressors, ) 2 3/26/2018 Công giãn nở - đồ thị công Quá trình giãn nở (expansion) 1-2; Công giãn nở: � �� = ��� → ���� = � ��� � Nhận xét: Công thay đổi thể tích chính là diện tích phía dưới đường quá trình trên đồ thị P-V. Đồ thì P-V được gọi là đồ thị công. Work –function of path Quá trình giãn nở từ state 1 – state 2, theo các đường A, B, C. Nhận xét: Diện tích phía dưới đường quá trình phụ thuộc đường đi: �������� > �������� > �������� Công là hàm của quá trình. Công chỉ phát sinh khi hệ thống diễn ra quá trình bằng cách trao đổi với môi trường qua biên hệ. Khi V tăng, quá trình giãn nở (expansion), Công dương (sinh công); Khi V giám, quá trình nén (compression), Công âm (tiêu thụ công). 3 3/26/2018 Work of cycle Hệ kín thực hiện chu trình: ���� = ���� � ����� ��� = ���� � ���� = �������� � �������� Nhận xét: Các hệ luôn hoạt động theo chu trình. Công có ích theo chu trình Vận dụng: Động cơ đốt trong, - W sinh ra ở đâu (chi tiết nào)? - W chu trình có được sử dụng có ích cả không. Nếu không mất mát cho những gì? Công quá trình: Constant-Volume Đẳng tích, V = const: � �� = �� ��� = 0 Nhận xét: Quá trình đẳng tích không sinh công. Nhiệt cấp vào hay nhả ra chỉ làm thay đổi nội năng. 4 3/26/2018 Công quá trình: Constant-Pressure Áp suất không đổi: P 2 = P 1 = P 0 Nhận xét: Nhiệt lượng cấp vào làm hệ giãn nở, sinh công qua biên hệ. Quá trình đẳng nhiệt (Isothermal) Nhiệt độ không đổi: T 2 = T 1 = T 0 Với khí lý tưởng: (C = const) 5 3/26/2018 Công QT đa biến (Polytropic) Là quá trình có chỉ số nén đa biến (n) có thể thay đổi. �� � = � = �����. Công quá trình: Với KLT: Quá trình đa biến Nhận xét: Khi n = 1: �� = � → Quá trình đẳng nhiệt. Khi n = 0: �� � = ����� → � = ����� (Đẳng áp). Khi n = k: �� � = , quá trình đoạn ����� nhiệt. Khi n = ∞: quá trình đẳng tích. 6 3/26/2018 4.2. Cân bằng năng lượng hệ kín Phương trình cân bằng năng lượng tổng quát: 3 dạng truyền năng lượng: Dạng nhiệt (Heat); Dạng công (Work); Khi có trao đổi chất (Mass flow). Với hệ kín: Không có trao đổi mass. Hệ kín thực hiện chu trình Hệ kín: Hệ kín thực hiện Cycle: first state ≡ final state; → ∆̿ Ɣ 0. ���� = ����� Cân bằng năng lượng hệ kín: 0 ��� � ���� � ���� � ����� =� → ͋) /,$) Ɣ ͑) /,*0/ Nhận xét: Trong hệ kín làm việc theo chu trình, công sinh ra bằng lượng nhiệt thực nhận. 7 3/26/2018 Hệ kín – Nhà máy nhiệt điện Hãy viết PT cân bằng năng lượng? Hệ kín – Điều hòa không khí Hãy viết PT cân bằng năng lượng? 8 3/26/2018 Cân bằng năng lượng hệ kín (ĐL 1) 4.3. Specific Heat (heat capacity) Định nghĩa: Là năng lượng (nhiệt) cần cung cấp để làm tăng một đơn vị (khối lượng/thể tích/mol) vật chất lên một độ. Đơn vị: kJ/(kg 0C) or kJ/(kg K) cal/(g 0C) or cal/(g K) 0 Btu/(lb m F) or Btu/(lb m R) Công thức chung: ∆E = mC ∆T 18 9 3/26/2018 NDR đẳng tích, đẳng áp: C v,Cp Cv năng l ượ ng c ần c ấp để nhi ệt độ c ủa m ột đơ n v ị v ật ch ất t ăng lên 1 độ khi th ể tích của h ệ không đổ i. (Constant volume) . Cp năng l ượ ng c ần c ấp để nhi ệt độ c ủa m ột đơ n v ị v ật ch ất t ăng lên 1 độ khi áp su ất của h ệ không đổ i. (Constant Cp > Cv pressure) 19 Ý nghĩa toán học của C v Hệ th ống đẳ ng tích. C ấp nhi ệt để T 1 đế n T 2. E=U+KE +PE ∆Ε = ∆ U dΕ = dU dE = mCvdT du = CvdT ∂u Cv = ∂T v 20 10 3/26/2018 Bi ểu di ễn toán h ọc c ủa Cp ∂h C p = ∂T p h (enthalpy) bao g ồm n ội n ăng (u) và công thay đổ i th ể tích-system boundary khi P = constant). h = u + Pv 21 Quan sát Cp luôn lớn hơn C v. Cần nhiều năng lượng hơn để nung nóng vật chất khi P = const do phải tốn thêm năng lượng làm dịch chuyển biên hệ (giãn nở). Như vậy năng lượng (nhiệt) được cấp (trừ hệ đẳng tích) được dùng để: Tăng nội năng (u); Thực hiện công thay đổi thể tích. 22 11 3/26/2018 Nhận xét Cv và C p được biểu diễn qua các thông số u, h, T – là các thông số trạng thái. Vì vậy C v và C p cũng là các thông số trạng thái. Vì C v và C p là các thông số trạng thái nên chúng độc lập với quá trình. ∂u ∂h Cv = C p = ∂T v ∂T p 23 Xác định NDR TABLE A-2: Bảng nhiệt dung riêng của KLT: Table A-2a: NDR ở 300K; Table A-2b: NDR ở các nhiệt độ khác nhau; Table A-2c: NDR phụ thuộc vào nhiệt độ: Cp = a + bT + cT 2 + dT 3 24 12 3/26/2018 Tính nhi ệt: Method 1 Sử d ụng công th ức: 2 2 2 3 ∆h = C pdT = (a + bT + cT + dT )dT 1 1 b(T 2 −T 2 ) c(T 3 −T 3 ) d(T 4 −T 4 ) ∆h = aT + 2 1 + 2 1 + 2 1 2 3 4 Quá ph ức t ạp!! Ch ỉ s ử d ụng khi c ần độ chính xác cao!! 25 Tính nhi ệt: Method 2 Tra b ảng u, h theo nhi ệt độ (các tích phân này đã đượ c tính s ẵn và l ập b ảng): Table A-17 cho không khí; Các b ảng A-18 đế n A-23 cho các KLT khác. T T u− uo = C v dT h − ho = C pdT T0 =0 T0 =0 26 13 3/26/2018 Tính nhi ệt: Method 3 Sử d ụng NDR trung bình: NDR c ủa các ch ất khí ph ụ thu ộc vào nhi ệt độ và là các hàm liên t ục; Có th ể tuy ến tính hóa các hàm này trong các kho ảng nhi ệt độ nh ất đị nh (không quá lớn – có th ể đế n vài tr ăm độ ) 27 Method 3 NDR trung bình trong kho ảng nhi ệt độ : Tav = (T1+T2)/2 u2-u1=Cv,av(T2-T1) h2-h1=Cp,av(T2-T1) 28 14 3/26/2018 Cv và Cp đối với KLT �� � �� = � �� = � �� R là gì? k là gì? �� 4.4. Nội năng, enthalpy của KLT Với KLT, Nội năng và Enthalpy là hàm của nhiệt độ � = � � ; �� = ���� ℎ = ℎ � ; �ℎ = ���� Tính theo NDR thực: (tra bảng Table A-2c) Tính theo NDR trung bình: 15 3/26/2018 4.5. Nội năng, Enthalpy của liquids, solids Với chất rắn, lỏng, thể tích riêng hầu như không thay đổi trong một quá trình cụ thể. Không phân biệt Cv và Cp của các chất không chịu nén (rắn, lỏng). NDR của chúng được ký hiệu là C. Cp = Cv = C 31 Internal energy of Solids and Liquids du= CdTV = CdT ∆u= C∆ T= C() T2− T 1 32 16 3/26/2018 Enthalpy of Solids h = u + Pv dv = 0 với các ch ất không dh = du + Pdv + vdP ch ịu nén (l ỏng, rắn) 0 ∆h = ∆u + v∆P = C∆T + v∆P Rất nh ỏ với ∆h = ∆u ≅ Cavg ∆T solids �� Enthalpy of Liquids ∆h = ∆u + v∆P = C∆T + v∆P Có 2 tr ườ ng h ợp: Constant pressure process, ∆P = 0 ∆h = ∆u ≅ Cavg ∆T Constant temperature process, ∆T = 0 ∆h ≅ v∆P 34 17 3/26/2018 Summary Hệ kín; Công thay đổi thể tích trong hệ kín và ứng dụng trong kỹ thuật; Hệ kín thực hiện chu trình; Công chu trình; Bảo toàn năng lượng của hệ kín (Phương trình ĐL nhiệt động 1 cho hệ kín); Nhiệt dung riêng, Nội năng, Enthalpy của KLT, chất lỏng, chất rắn. Homework Làm bài tập đợt 2 (các chương 3, 4); Tuần sau giải đáp; Tuần tiếp theo nộp. 18 3/26/2018 Thank you for attention! 19
File đính kèm:
 bai_giang_ky_thuat_nhiet_chapter_4_energy_analysis_of_closed.pdf
bai_giang_ky_thuat_nhiet_chapter_4_energy_analysis_of_closed.pdf

