Vai trò của rừng thứ sinh trong việc bảo tồn đa dạng quần xã bọ hung ở hệ sinh thái núi đá vôi Việt Nam
Mặc dù rừng thứ sinh chiếm 1/2 tổng diện tích rừng nhiệt đới còn lại trên thế giới, nhưng giá trị bảo tồn đa dạng sinh học của chúng còn ít được biết đến. Nghiên cứu này được thực hiện để đánh giá vai trò của rừng thứ sinh trong việc bảo tồn đa dạng quần xã bọ hung ở hệ sinh thái núi đá vôi Việt Nam. Tổng số 60 bẫy hố có mồi nhử đã được thiết lập để điều tra quần xã bọ hung ở rừng thứ sinh lâu năm (>40 năm) và rừng nguyên sinh thuộc khu vực Vườn quốc gia (VQG) Pia Oắc (Cao Bằng) và Khu bảo tồn thiên nhiên (KBTTN) Pù Luông (Thanh Hóa). Nghiên cứu đã xác định được 38 loài bọ hung từ 1.266 cá thể ở hai khu vực nghiên cứu. Kết quả phân tích từ các mô hình tuyến tính tổng quát (GLM) cho thấy, không có sự khác biệt về số lượng loài, số lượng cá thể và sinh khối của quần xã bọ hung giữa rừng nguyên sinh và thứ sinh ở cả hai khu vực nghiên cứu. Phát hiện này mang lại hy vọng cho việc phục hồi các quần xã bọ hung trong quá trình diễn thế rừng. Tuy nhiên, cấu trúc quần xã bọ hung chỉ ra sự khác nhau ý nghĩa giữa hai kiểu rừng này theo phân tích hoán vị phương sai (PERMANOVA) (Pia Oắc: F=8,92, p<0,001; Pù Luông: F=6,78, p<0,001). Đặc biệt, sự suy giảm số lượng của nhóm bọ hung “đào hang” có kích thước lớn ở rừng thứ sinh có thể làm giảm khả năng di dời phân động vật của quần xã bọ hung, một chức năng sinh thái quan trọng trong hệ sinh thái rừng nhiệt đới

Trang 1

Trang 2

Trang 3
Trang 4

Trang 5

Trang 6
Tóm tắt nội dung tài liệu: Vai trò của rừng thứ sinh trong việc bảo tồn đa dạng quần xã bọ hung ở hệ sinh thái núi đá vôi Việt Nam

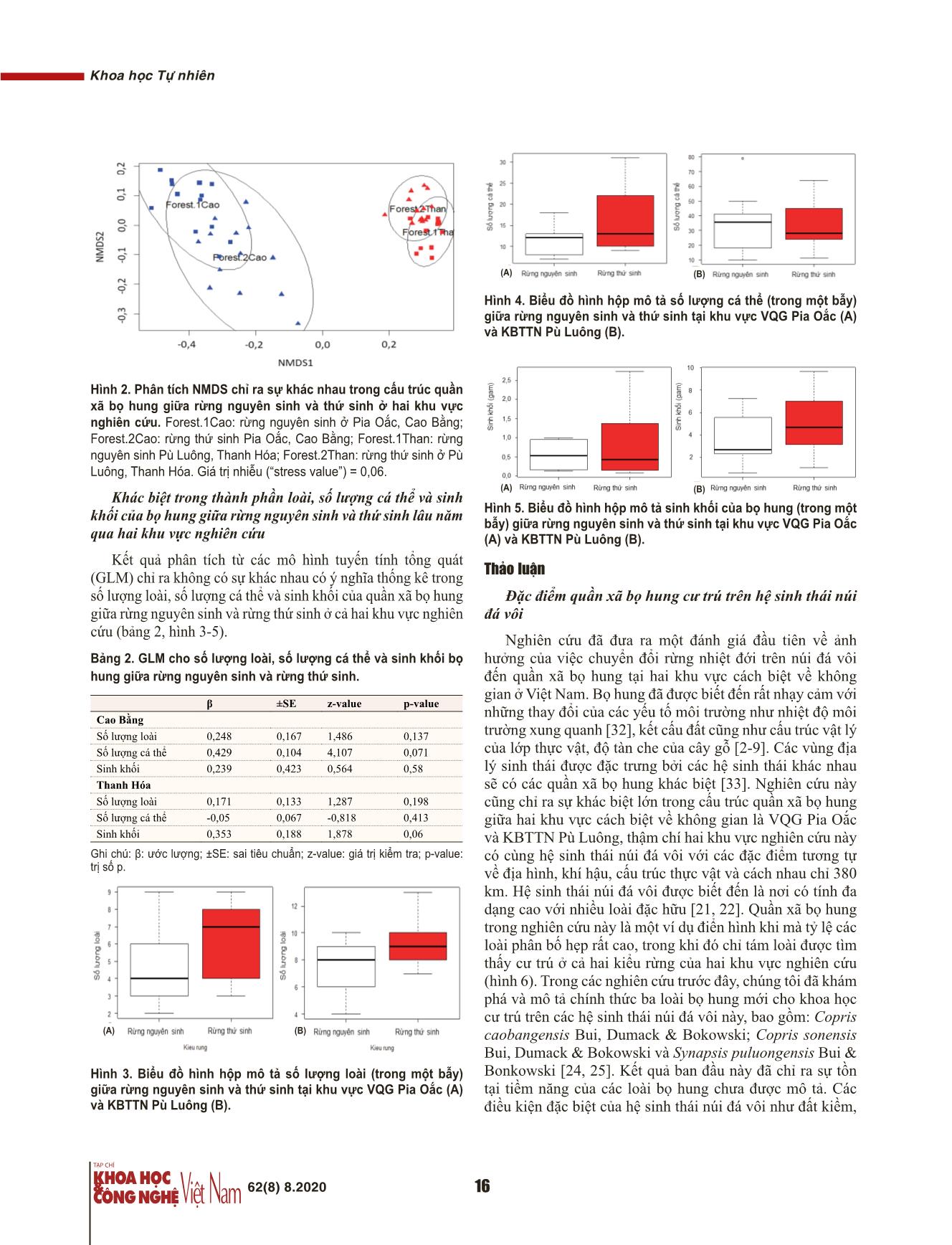
i khu vực VQG Pia Oắc qua hai khu vực nghiên cứu (A) và KBTTN Pù Luông (B). Kết quả phân tích từ các mô hình tuyến tính tổng quát Thảo luận (GLM) chỉ ra không có sự khác nhau có ý nghĩa thống kê trong số lượng loài, số lượng cá thể và sinh khối của quần xã bọ hung Đặc điểm quần xã bọ hung cư trú trên hệ sinh thái núi giữa rừng nguyên sinh và rừng thứ sinh ở cả hai khu vực nghiên đá vôi cứu (bảng 2, hình 3-5). Nghiên cứu đã đưa ra một đánh giá đầu tiên về ảnh Bảng 2. GLM cho số lượng loài, số lượng cá thể và sinh khối bọ hưởng của việc chuyển đổi rừng nhiệt đới trên núi đá vôi hung giữa rừng nguyên sinh và rừng thứ sinh. đến quần xã bọ hung tại hai khu vực cách biệt về không gian ở Việt Nam. Bọ hung đã được biết đến rất nhạy cảm với β ±SE z-value p-value Cao Bằng những thay đổi của các yếu tố môi trường như nhiệt độ môi Số lượng loài 0,248 0,167 1,486 0,137 trường xung quanh [32], kết cấu đất cũng như cấu trúc vật lý Số lượng cá thể 0,429 0,104 4,107 0,071 của lớp thực vật, độ tàn che của cây gỗ [2-9]. Các vùng địa Sinh khối 0,239 0,423 0,564 0,58 lý sinh thái được đặc trưng bởi các hệ sinh thái khác nhau Thanh Hóa sẽ có các quần xã bọ hung khác biệt [33]. Nghiên cứu này Số lượng loài 0,171 0,133 1,287 0,198 cũng chỉ ra sự khác biệt lớn trong cấu trúc quần xã bọ hung Số lượng cá thể -0,05 0,067 -0,818 0,413 giữa hai khu vực cách biệt về không gian là VQG Pia Oắc Sinh khối 0,353 0,188 1,878 0,06 và KBTTN Pù Luông, thậm chí hai khu vực nghiên cứu này Ghi chú: β: ước lượng; ±SE: sai tiêu chuẩn; z-value: giá trị kiểm tra; p-value: có cùng hệ sinh thái núi đá vôi với các đặc điểm tương tự trị số p. về địa hình, khí hậu, cấu trúc thực vật và cách nhau chỉ 380 km. Hệ sinh thái núi đá vôi được biết đến là nơi có tính đa dạng cao với nhiều loài đặc hữu [21, 22]. Quần xã bọ hung trong nghiên cứu này là một ví dụ điển hình khi mà tỷ lệ các loài phân bố hẹp rất cao, trong khi đó chỉ tám loài được tìm thấy cư trú ở cả hai kiểu rừng của hai khu vực nghiên cứu (hình 6). Trong các nghiên cứu trước đây, chúng tôi đã khám phá và mô tả chính thức ba loài bọ hung mới cho khoa học cư trú trên các hệ sinh thái núi đá vôi này, bao gồm: Copris caobangensis Bui, Dumack & Bokowski; Copris sonensis Bui, Dumack & Bokowski và Synapsis puluongensis Bui & Hình 3. Biểu đồ hình hộp mô tả số lượng loài (trong một bẫy) Bonkowski [24, 25]. Kết quả ban đầu này đã chỉ ra sự tồn giữa rừng nguyên sinh và thứ sinh tại khu vực VQG Pia Oắc (A) tại tiềm năng của các loài bọ hung chưa được mô tả. Các và KBTTN Pù Luông (B). điều kiện đặc biệt của hệ sinh thái núi đá vôi như đất kiềm, 62(8) 8.2020 16 Khoa học Tự nhiên những thay đổi không thể phục hồi trong các nhóm chức năng bọ hung, đặc biệt nhóm “đào hang” (hình 7). Phân tích NMDS chỉ ra mối quan hệ tỷ lệ thuận giữa lớp che phủ mặt đất của thảm tươi (GV) và số lượng cá thể của các loài bọ hung “đào hang” có kích thước nhỏ (STun) (hình 7). Dường như là các loài bọ hung kích thước nhỏ tập trung nhiều ở rừng thứ sinh phản ánh sự ưa thích của chúng với lớp thảm tươi, bởi vì sinh cảnh này có thể là địa điểm quan sát thích hợp cho chúng trong quá trình tìm kiếm thức ăn [1, 35-37]. Các loài bọ hung “đào hang” có kích thước lớn (LTun) được thu thập nhiều ở những khu vực có nhiều cây gỗ lớn (Di.t) Hình 6. Biểu đồ Venn chỉ ra số lượng các loài có sinh cảnh hẹp (hình 7), bởi vì rừng cây gỗ có thể cung cấp nơi cư trú và và số lượng loài phổ biến giữa hai kiểu rừng của hai khu vực thức ăn cho nhiều loài động vật lớn như các loài linh trưởng, nghiên cứu. cầy, lợn rừng, những loài quan trọng cung cấp nguồn thức ăn cho các loài bọ hung kích thước lớn [35, 36]. Sự thay đổi tầng đất mỏng, các ngọn núi cao với độ dốc lớn và bị cô lập không thể hồi phục trong các nhóm chức năng của quần xã có thể hạn chế quá trình trao đổi gen trong quần thể và thúc bọ hung ở rừng thứ sinh sẽ làm giảm hiệu quả các dịch vụ đẩy quá trình hình thành loài địa lý. Những loài côn trùng sinh thái của chúng ở kiểu rừng này. với đặc điểm di chuyển chậm và kích cỡ quần thể nhỏ (ví dụ như các loài bọ hung), có thể hình thành nên các loài đặc hữu ở những khu vực bị cô lập này. Giá trị của rừng thứ sinh lâu năm cho bảo tồn quần xã bọ hung Mặc dù nhiều nghiên cứu đã xem xét giá trị bảo tồn của rừng thứ sinh, nhưng vẫn chưa chắc chắn về giá trị của chúng trong việc bảo tồn tính đa dạng của quần xã bọ hung. Kết quả của nghiên cứu này phù hợp với các nghiên cứu [17-20], chỉ ra không có sự khác nhau ý nghĩa trong thành phần loài, số lượng cá thể và sinh khối giữa rừng thứ sinh và nguyên sinh. Trong khi đó, các nghiên cứu [15, 16] chỉ ra sự khác nhau ý nghĩa trong quần xã bọ hung giữa hai kiểu rừng. Điều này có thể được giải thích như sau. Thứ nhất, Hình 7. Phân tích NMDS chỉ ra mối quan hệ giữa các thuộc tính thành phần các loài bọ hung rất khác nhau giữa các vùng quần xã bọ hung với các yếu tố môi trường trong rừng thứ sinh địa lý sinh thái. Quần xã bọ hung vùng nhiệt đới Đông Nam (Forest.2) và rừng nguyên sinh (Forest.1). Các vec-tơ đậm nét biểu Á rất khác biệt bởi sự đa dạng của các loài bọ hung thuộc thị cho các yếu tố môi trường và thuộc tính quần xã ảnh hưởng ý nghĩa giống Onthophagus [16, 33, 34]. Trong nghiên cứu này, các tới cấu trúc quần xã (p<0,05). Vec-tơ mờ là các yếu tố môi trường và loài Onthophagus cũng chiếm ưu thế trong quần xã, chiếm thuộc tính quần xã không ảnh hưởng ý nghĩa tới cấu trúc quần xã hơn 50 và 30% tổng số loài và số lượng cá thể bọ hung ghi (p>0,05). Các vec-tơ: Stun - mô tả số lượng cá thể của các loài bọ nhận được. Trong khi đó, quần xã bọ hung ở hệ sinh thái hung kích thước nhỏ thuộc nhóm “đào hang”; Ltun - các loài bọ hung rừng ôn đới châu Âu được đặc trưng bởi các loài Aphodius “đào hang” kích thước lớn; De - các loài bọ hung “định cư” trong phân; spp. [1]. Sự khác nhau trong thành phần giữa các khu vực Lro - các loài bọ hung “lăn phân” có kích thước lớn. LLT - độ che phủ nghiên cứu cùng với mức độ nhạy cảm của các loài bọ hung mặt đất của thảm mục; LLC - chiều cao trung bình lớp thảm mục; Di.s- khác nhau đã dẫn đến những thay đổi trong quần xã bọ hung đường kính tán trung bình của cây bụi (chiều cao <3 m); Clay - tỷ lệ không giống nhau qua các vùng địa lý sinh thái. Thứ hai, phần trăm của đất sét; Di.t - đường kính trung bình tại vị trí 1,3 m của các trạng thái rừng thứ sinh được lựa chọn trong các nghiên các cây gỗ gần bẫy nhất; FC - độ tàn che của cây gỗ; GV - độ che phủ cứu có thể không giống nhau. Nhìn chung, rừng thứ sinh đã của lớp thảm tươi. Độ nhiễu (“stress value”) = 0,05. phục hồi sau thời gian dài (rừng thứ sinh lâu năm) có thể có giá trị bảo tồn loài và đa dạng cao cho quần xã bọ hung do Kết luận có thể cung cấp một nơi trú ẩn tương tự với rừng nguyên Nghiên cứu đã điều tra và xác định được 38 loài thuộc 10 sinh [nghiên cứu hiện tại, 17, 18]. Ngược lại, rừng thứ sinh giống từ 1.266 cá thể bọ hung thu bắt được từ hai khu vực mới phục hồi có thể thiếu đi những đặc trưng này [15, 16]. VQG Pia Oắc (26 loài, 8 giống) và KBTTN Pù Luông (25 Sự phân tách lớn trong cấu trúc quần xã bọ hung giữa loài, 9 giống). Phân tích thống kê theo các mô hình tuyến rừng nguyên sinh và rừng thứ sinh dường như phản ánh tính tổng quát (GLM) chỉ ra không có sự khác nhau về số 62(8) 8.2020 17 Khoa học Tự nhiên lượng loài, số lượng cá thể và sinh khối giữa rừng thứ sinh [17] K. Vulinec (2002), “Dung beetle communities and seed dispersal in primary lâu năm (>40 năm) và rừng nguyên sinh qua cả hai khu vực forest and disturbed land in Amazonia”, Biotropica, 34, pp.297-309. nghiên cứu. Kết quả này đã xác nhận vai trò quan trọng của [18] I. Quintero, T. Roslin (2005), “Rapid recovery of dung beetle communities rừng thứ sinh trong việc phục hồi tính đa dạng của quần xã following habitat fragmentation in central Amazonia”, Ecology, 12, pp.3303-3311. bọ hung trong quá trình diễn thế rừng. Tuy nhiên sự khác [19] K. Vulinec, et al. (2006), “Primate and dung beetle communities in secondary nhau trong cấu trúc quần xã giữa hai kiểu rừng này, đặc biệt growth rain forests: implications for conservation of seed dispersal systems”, là sự suy giảm số lượng các loài bọ hung “đào hang” có kích International Journal of Primatology, 27, pp.855-879. thước lớn thuộc giống Synapsis và Copris ở rừng thứ sinh [20] E. Nichols, et al. (2007), “Global dung beetle response to tropical forest có thể hạn chế khả năng di dời phân động vật của quần xã modification and fragmentation: a quantitative literature review and meta-analysis”, Biological Conservation, 137, pp.1-19. bọ hung, một chức năng sinh thái quan trọng của chúng ở rừng nhiệt đới. [21] R. Clements, et al. (2006), “Limestone karsts of Southeast Asia: imperiled arks of biodiversity”, BioScience, 56, pp.733-742. TÀI LIỆU THAM KHẢO [22] M. Schilthuizen, et al. (2005), “Effects of karst forest degradation on pulmonate and prosobranch land snail communities in Sabah, Malaysian Borneo”, [1] I. Hanski, Y. Cambefort (1991), Dung beetle ecology, Princeton University Conservation Biology, 19, pp.949-954. Press, pp.1-481. [23] V.B. Bui (2019), “Effects of land use change on Coprini dung beetles in [2] C. Costa, et al. (2017), “Variegated tropical landscapes conserve diverse dung tropical karst ecosystems of Puluong Nature Reserve”, VNU Journal of Science: beetle communities”, PeerJ, 5(e3125), pp.1-22. Natural Sciences and Technology, 35(4), pp.42-54. [3] R.P. Salomão, et al. (2018), “Landscape structure and composition define the [24] V.B. Bui, M. Bonkowski (2018), “Synapsis puluongensis sp. nov. and new body condition of dung beetles (Coleoptera: Scarabaeinae) in a fragmented tropical data on the poorly known species Synapsis horaki (Coleoptera: Scarabaeidae) from rainforest”, Ecol. Indic., 88(2018), pp.144-151. Vietnam with a key to Vietnamese species”, Acta Entomol. Musei Nationalis Pragae, [4] R.C. Campos, M.I.M. Hernández (2013), “Dung beetle assemblages 58, pp.407-418. (Coleoptera, Scarabaeinae) in Atlantic forest fragments in southern Brazil”, Revista Brasileira de Entomologia, 57(1), pp.47-54. [25] V.B. Bui, K. Dumack, M. Bonkowski (2018), “Two new species and one new record for the genus Copris (Coleoptera: Scarabaeidae: Scarabaeinae) from Vietnam [5] E. Nichols (2013), “Fear begets function in the ‘brown’ world of detrital food with a key to Vietnamese species”, Eur. J. Entomol., 115, pp.167-191. webs”, Journal of Animal Ecology, 82(4), pp.717-720. [26] V.B. Bui, T. Ziegler, M. Bonkowski (2019a), “Checklist of beetles in the [6] T. Tixier, et al. (2015), “Lumaret, Species-specific effects of dung beetle subgenus Copris (Paracopris) Balthasar from Asia with description of a new species, abundance on dung removal and leaf litter decomposition”, Acta Oecologica, 69, and redescription of Copris (Paracopris) punctulatus Wiedemann (Coleoptera: pp.31-34. Scarabaeidae: Scarabaeinae)”, Zootaxa, 4712(1), pp.51-64. [7] W. Beiroz, et al. (2017), “Dung beetle community dynamics in undisturbed [27] V.B. Bui, T. Ziegler, M. Bonkowski (2019b), “Morphological traits reflect tropical forests: implications for ecological evaluations of land-use change”, Insect dung beetle response to land use changes in tropical karst ecosystems of Vietnam”, Conservation and Diversity, 10, pp.94-106. Ecological Indicators, 108, pp.1-9. [8] P.M. Farias, et al. (2015), “Response of the copro-necrophagous beetle [28] O.N. Kabakov, A. Napolov (1999), “Fauna and ecology of Lamellicornia of (Coleoptera: Scarabaeinae) assemblage to a range of soil characteristics and livestock subfamily Scarabaeinae of Vietnam and some parts of adjacent countries: South China, management in a tropical landscape”, Journal of Insect Conservation, , pp.947-960. 19 Laos, and Thailand”, Latvijas Entomologs, 37, pp.58-96. [9] D.C. Osberg, et al. (1994), “Habitat specificity in African dung beetles: the [29] R. Core Team (2017), R: A language and environment for statistical effect of soil type on the survival ofdung beetle immatures (Coleoptera: Scarabaeidae)”, computing, https://www.R-project.org/ (accessed 15 May 2017). Tropical Zoology, 7, pp.1-10. [30] A. Chao (1984), “Non-Parametric estimation of the Nnumber of classes in a [10] E. Andresen, S.G.W. Laurance (2007), “Possible indirect effects of mammal population”, Scandinavian Journal of Statistics, 11, pp.265-270. hunting on dung beetle assemblages in Panama”, Biotropica, 39, pp.141-146. [31] J. Oksanen, et al. (2017), Vegan: Community Ecology Package, R package [11] H. Enari, S. Koike, H. Sakamaki (2013), “Influences of different large version 2.4-5, https://CRAN.R-project.org/packages=vegan. mammalian fauna on dung beetle diversity in beech forests”, J. Insect. Sci., 13(54), pp.1-13. [32] C.H. Scholtz, A.L.V. Davis, U. Kryger (2009), Evolutionary biology and conservation of dung beetles, Pensoft Sofia-Moscow. [12] A. Estrada, D.A. Anzures, R. Coates-Estrada (1999), “Tropical rain forest fragmentation, howler monkeys (Alouatta palliata), and dung beetles at Los Tuxtlas. [33] L. Hayes, et al. (2009), “Rapid assessments of tropical dung beetle and Mexico”, Am. J. Primatol., 48, pp.253-262. butterfly assemblages: contrasting trends along a forest disturbance gradient”, Insect Conservation and Diversity, 2, pp.194-203. [13] C.A. Harvey, J. Gonzalez, E. Somarriba (2006), “Dung beetle and terrestrial mammal diversity in forests, indigenous agroforestry systems and plantain [34] A.J. Davis, et al. (2001), “Dung beetles as indicators of change in the forests monocultures in Talamanca, Costa Rica”, Biodivers. Conserv., 15, pp.555-585. of northern Borneo”, J. Appl. Ecol., 38, pp.593-616. [14] K. Vulinec (2000), “Dung beetles (Coleoptera: Scarabaeidae), monkeys, and [35] H. Howden, V. Nealis (1978), “Observations on height of perching in some conservation in Amazonia”, Florida Entomol., 83(3), pp.229-241. tropical dung beetles (Scarabaeidae)”, Biotropica, 10, pp.43-46. [15] S. Boonrotpong, et al. (2004), “Species composition of dung beetles in the [36] S.B. Peck, A. Forsyth (1982), “Composition, structure, and competitive primary and secondary forests at Ton Nga Chang Wildlife Sanctuary”, ScienceAsia, behaviour in a guild of Ecuadorian rain forest dung beetles (Coleoptera; Scarabaeidae)”, 30, pp.59-65. Can. J. Zool., 60, pp.1624-1634. [16] Shahabuddin, et al. (2005), “Changes of dung beetle communities from [37] T.H. Larsen, A. Lopera, A. Forsyth (2008), “Understanding trait-dependent rainforests towards agroforestry systems and annual cultures in Sulawesi (Indonesia)”, community disassembly: dung beetles, density functions, and forest fragmentation”, Biodiversity and Conservation, 14, pp.863-877. Conserv. Biol., 22, pp.1288-1298. 62(8) 8.2020 18
File đính kèm:
 vai_tro_cua_rung_thu_sinh_trong_viec_bao_ton_da_dang_quan_xa.pdf
vai_tro_cua_rung_thu_sinh_trong_viec_bao_ton_da_dang_quan_xa.pdf

