Khảo sát khả năng kháng oxy hóa và kháng khuẩn của cây Muồng trâu và Mai dương tại Kiên Giang
Nghiên cứu được thực hiện nhằm đánh giá hoạt tính kháng oxy hóa và
kháng khuẩn gây bệnh trên thủy sản của hai loài thực vật thu tại tỉnh Kiên
Giang, Việt Nam. Khả năng kháng oxy hóa được xác định bằng phương
pháp DPPH, ABTS+, RP và TAA in vitro. Kết quả cho thấy, cao chiết
ethanol từ lá của cây Mai dương thể hiện hoạt tính kháng oxy hóa với giá trị
IC50 lần lượt là 67,12 µg/mL; 39,22µg/mL; 32,16 µg/mL và 71,86 µg/mL.
Tương tự, cao chiết Muồng trâu có giá trị IC50 tương ứng 357,19 µg/mL;
40,39 µg/mL; 331,03 µg/mL và 119,59 µg/mL. Hàm lượng polyphenol tổng
và flavonoid của cao chiết cây Muồng trâu được xác định lần lượt là 203,57
mg GAE/g; 46,31 mg QE/g. Tương tự, cao chiết Mai dương có hàm lượng
tương ứng là 306,08 mg GAE/g; 38,71 mg QE/g. Hoạt tính kháng khuẩn
được khảo sát bằng phương pháp khuyếch tán trên đĩa thạch với 4 dòng vi
khuẩn gây bệnh trên thủy sản. Kết quả cho thấy cao chiết Mai dương thể
hiện hoạt tính kháng khuẩn tốt đối với 4 chủng vi khuẩnAeromonas
dhakensis, Aeromonas hydrophila Edwardsiella ictaluri, Streptococcus
agalactiae. Từ kết quả nghiên cứu cho thấy, Mai dương là một dược liệu
tiềm năng chứa nhiều các hợp chất kháng oxy hóa và kháng khuẩn.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7
Trang 8

Trang 9
Tóm tắt nội dung tài liệu: Khảo sát khả năng kháng oxy hóa và kháng khuẩn của cây Muồng trâu và Mai dương tại Kiên Giang

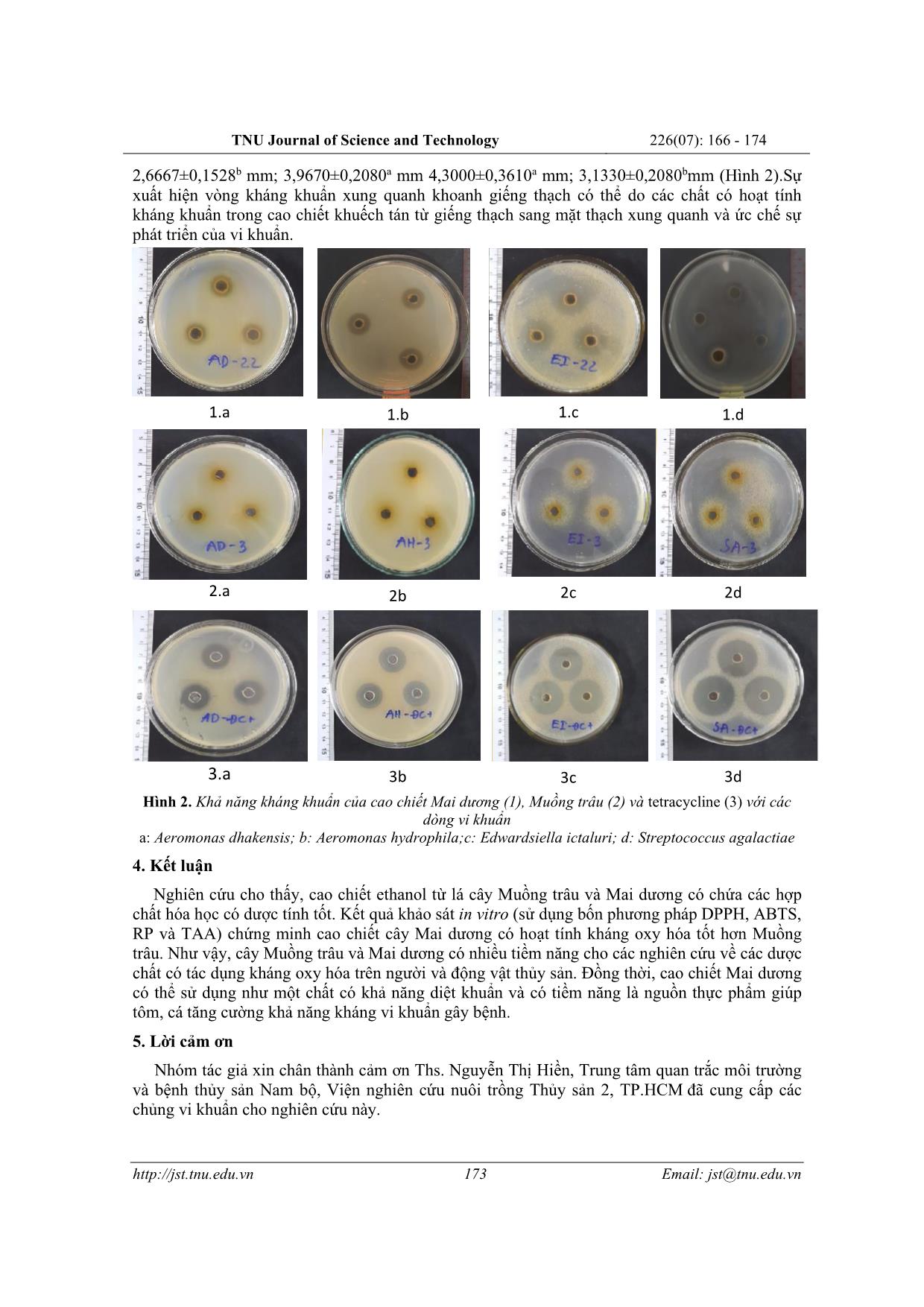
nh y = 0,0067x - 0,0025 (R² = 0,997). Trên cơ sở các đường chuẩn này, kết quả hàm lượng polyphenol tổng và flavonoid toàn phần được xác định và trình bày ở bảng 3. Bảng 3.Hàm lượng phenol tổng và flavonoid toàn phần của cao chiết ethanol từ lá của cây Muồng trâu và Mai dương Phương pháp định lượng Cao chiết Muồng trâu Cao chiết Mai dương TPC (mg GAE/g) 203,57 306,08 TFC (mg QE/g) 46,31 38,71 Theo kết quả được trình bày trong bảng 3, hàm lượng polyphenol tổng và flavonoid của cao chiết ethanol cây Muồng trâu lần lượt là 203,57 mgGAE/g; 46,31 mgQE/g thấp hơn cao chiết methanol trong nghiên cứu của Nornasriq và cộng sự(2019) [19]với hàm lượng polyphenol và flavonoid là385,37 mgGAE/g; 447.42 mgQE/g. Hàm lượng polyphenol tổng và flavonoid của cao chiết ethanol cây Mai dương là 306,08 mgGAE/g; 38,71 mgQE/g cao hơn nghiên cứu củaRakotomalala và cộng sự (2013) [20] ở các nồng độ chiết xuất khác nhau lần lượt là 42,25 ± 1,43 μg/mL; 33,36 ± 0,63 μg/mL. 3.2. Hiệu quả kháng oxy hóa in vitro của cao chiết Hiệu quả trung hòa gốc tự do DPPH Kết quả cho thấy, hiệu suất loại bỏ gốc tự do DPPH của cao chiết Muồng trâu tỷ lệ thuận với nồng độ cao chiết, khi nồng độ cao chiết tăng từ 25 µg/mL đến 800 µg/ml thì hiệu suất loại bỏ gốc tự do cũng tăng dần từ 5,48 ± 1,23% đến 83,30 ± 1,23% (Bảng 4). Bảng 4.Hiệu quả trung hòa gốc tự do DPPH của cao chiết ethanol lá Muồng trâu Nồng độ cao chiết Khả năng trung hòa gốc tự do DPPH (%) 0 0,00±0,00f 25 5,48±1,18ef 50 7,87±1,59e 100 17,38±4,52d 200 32,59±1,43c 400 54,06±0,50b 800 83,30±1,20a Kết quả thực nghiệm cho thấy, cao chiết cây Mai dương có khả năng trung hòa gốc tự do DPPH. Khi nồng độ cao chiết Mai dương tăng từ 25 µg/mL đến 125 µg/ml thì hiệu suất loại bỏ gốc tự do cũng tăng dần từ 12,08 ± 4,95% đến 86,61 ± 1,47% thể hiện ở bảng 5. Bảng 5.Hiệu quả trung hòa gốc tự do DPPH của cao chiết ethanol lá Mai dương Nồng độ cao chiết Khả năng trung hòa gốc tự do DPPH (%) 0 0,00±0,00e 25 12,08±4,95d 50 35,92±7,17c 75 66,34±3,00b 100 78,23±4,10a 125 86,61±1,47a 170 Email: jst@tnu.edu.vn TNU Journal of Science and Technology 226(07): 166 - 174 Từ kết quả bảng 4 và 5 cho thấy, hiệu suất loại bỏ gốc tự do DPPH của cao chiết ethanol lá cây Muồng trâu và Mai dương đều tăng tuyến tính với nồng độ cao chiết. Hiệu quả loại bỏ gốc tự do của hai cao chiết lá cây Muồng trâu, Mai dương được xác định thông qua giá trị IC50. Kết quả IC50 của hai loại cao chiết đều thấp hơn nhiều khi so với chất chuẩn là acid galic. Cụ thể, cao chiết ethanol lá Muồng trâu thấp hơn 109,3 lần (IC50= 357,19) và cao chiết lá Mai dương thấp hơn 18,5 lần (IC50= 67,12), với acid galic có IC50= 3,62. So với nghiên cứu cây khác loài, cao chiết Muồng trâu có khả năng hấp thu gốc tự do thấp hơn loài Senna italic với giá trị IC50 là 38,18 µg/ml khi khảo sát cùng phương pháp DPPH [21]. Hiệu quả trung hòa gốc tự do ABTS+ Khả năng kháng oxy hóa của hai cao chiết Muồng trâu và Mai dương được khảo sát dựa trên hàm lượng chất kháng oxy hóa có trong từng loại cao chiết của cây được tính tương đương µg/mL acid gallic. Phần trăm ức chế gốc tự do của acid gallic tăng từ 17,73% ở nồng độ 1 µg/mL đến 94,48% ở nồng độ 3,5 µg/mL. Để xác định khả năng trung hòa gốc tự do ABTS+, cao chiết ethanol lá Muồng trâu được pha loãng thành dãy nồng độ từ 10-70 µg/mL và Mai dương được pha loãng thành dãy nồng độ từ 15-90 µg/mL. Phần trăm ức chế gốc tự do của cao chiết Muồng trâu tăng từ 13,084±1,349% ở nồng độ 10 µg/mL đến 80,149±0,372% ở nồng độ 70 µg/mL. Tương tự, phần trăm ức chế gốc tự do của cao chiết Mai dương tăng từ 27,040±4,250% ở nồng độ 15 µg/mL đến 96,032±0,544% ở nồng độ 90 µg/mL. Khả năng kháng oxy hóa cũng như hiệu quả trung hòa gốc tự do của cao chiết từ lá cây Muồng trâu và Mai dương được so sánh dựa vào giá trị IC50. Giá trị IC50của hai cao được tính dựa vào phương trình hồi quy tuyến tính trình bày trong bảng 6. Bảng 6.Phương trình hồi quy tuyến tính hiệu suất trung hòa gốc tự do và IC50 Mẫu Phương trình hồi quy tuyến tính IC50 (µg/mL) Acid gallic y = 28,149x-3,1255 (R² = 0,9897) 1,88±0,0062b Cao Muồng trâu y = 1,1556x + 3,3229 (R² = 0,9901) 40,39±0,388a Cao Mai dương y = 1,0818x + 7,606 (R² = 0,9691) 39,22±1,186a Kết quả bảng 6 cho thấy khả năng trung hòa gốc tự do ABTS+ của hai loại cao chiết đều thấp hơn chất chuẩn acid gallic. Cao chiết Muồng trâu (IC50=40,39 µg/mL) và cao chiết Mai dương + (IC50= 39,22µg/mL) có khả năng trung hòa gốc tự do ATBS không khác biệt ý nghĩa thống kê mức 5%. Nhưng thấp hơn lần lượt là 21,49 lần và 20,86 lần khi so sánh với acid gallic (IC50= 1,88µg/mL).Tuy nhiên, cao chiết Muồng trâu (Senna alata) có khả năng trung hòa gốc tự do cao hơn Senna italic với giá trị IC50 là 43,18 µg/mL [21]. Hiệu quả trung hòa năng lực khử sắt Hiệu quả kháng oxy hóa của cây Muồng trâu và Mai dương dựa trên khả năng khử sắt được tính tương đương với nồng độ acid gallic (µg/mL). Kết quả được trình bày trong bảng 7 và 8. Bảng 7.Hiệu quả khử sắt của cao chiết ethanol Muồng trâu Nồng độ cao chiết Khả năng khử sắt (%) Hàm lượng acid gallic tương đương (µg/mL) f 0 0 ± 0,00 0,00f 30 29,89 ± 2,46e 3,1e 90 57,68 ± 1,60d 5,15d 120 65,17 ± 0,78c 6,24c 240 78,69 ± 0,61b 10,17b 400 84,34 ± 0,56a 13,83a Ghi chú: Các chữ cái giống nhau trên cùng một cột biểu diễn sự khác biệt không ý nghĩa 5% bằng phép thử Tukey Kết quả cho thấy, khi tăng dần nồng độ cao chiết Muồng trâu từ 30 - 400 µg/mL thì hàm lượng chất kháng oxy hóa tăng dần tương ứng từ 3,1 - 13,83 µg/mL (Bảng 7). Kết quả này cho thấy 171 Email: jst@tnu.edu.vn TNU Journal of Science and Technology 226(07): 166 - 174 rằng,hiệu quả kháng oxy hóa của cao chiết Muồng trâu (IC50= 331,03 ±14,32µg/mL) thấp hơn khả năng kháng oxy hóa của chất chuẩn là gallic acid (IC50= 10,31±0,0716 µg/mL) 32,10 lần. Tương tự, khi tăng nồng độ cao chiết Mai dương từ 5 - 30 µg/mL thì hàm lượng chất kháng oxy hóa tăng dần tương ứng từ 1,06- 10,7 µg/mL (Bảng 8). Bảng 8.Hiệu quả khử sắt của cao chiết ethanol Mai dương Nồng độ cao chiết Khả năng khử sắt (%) Hàm lượng acid gallic tương đương (µg/mL) 0 0 ± 0,00h 0,00h 5 24,25 ± 1,00f 1,06f 10 51,23 ± 1,12e 2,44e 15 65,14 ± 0,92d 3,98d 20 74,67 ± 0,50c 6,01c 35 79,35 ± 0,42b 7,69b 30 84,46 ± 0,34a 10,7a 3+ 2+ Kết quả cho thấy khả năng khử ion Fe thành Fe của cao chiết Mai dương (IC50= 32,16±0,24 µg/mL) thấp hơn khi 3,1 lần khi so sánh với acid gallic (IC50= 10,31 ± 0,0716 µg/mL). Điều này cho thấy khả năng kháng oxy hóa ở phương pháp khử sắt của cao chiết lá Mai dương tương đối cao. Hiệu quả trung hòa năng lực khử Phosphomolybdenum Xác định khả năng khử phức Mo của cao chiết ethanol Muồng trâu và Mai dương bằng cách pha loãng cao chiết thành dãy nồng độ tương ứng. Đối với cao chiết lá Muồng trâu là từ 23 - 182 µg/mL và cao chiết lá Mai dương là từ 14 – 68 µg/mL. Khả năng kháng oxy hóa của cao chiết ethanol từ lá cây Mai dương và Muồng trâu được so sánh dựa vào giá trị IC50. Giá trị IC50 của hai cao chiết được tính dựa vào phương trình hồi quy tuyến tính của từng cao được trình bày trong bảng 9. Bảng 9.Phương trình hồi quy tuyến tính giá trị hấp thu và IC50 Mẫu Phương trình hồi quy tuyến tính IC50 Acid gallic y = 0,015x + 0,1206 (R² = 0,9863) 24,91±0,463c Cao Muồng trâu y = 0,0039x + 0,0336 (R2 = 0,9928) 119,59±1,1a Cao Mai dương y = 0,0077x - 0,003 (R² = 0,9964) 65,32±1,128b Từ kết quả cho thấy khả năng khử phức Mo của cao chiết Muồng trâu và Mai dương có giá trị IC50 đều thấp hơn khi so sánh với IC50 của chất chuẩn acid gallic. Cụ thể cao chiết Muồng trâu thấp hơn 4,8 lần và cao chiết Mai dương thấp hơn 2,62 lần so với acid gallic. 3.3. Kết quả hoạt tính kháng khuẩn của cao chiết Khả năng kháng khuẩn của hai loại cao chiết được xác định dựa trên khả năng ức chế sự phát triển của vi khuẩn thể hiện qua đường kính vòng kháng khuẩn được tạo ra trên đĩa petri được trình bày ở bảng 10. Bảng 10.Khả năng kháng khuẩn của cao chiết Muồng trâu và Mai dương Chủng vi khuẩn Cao chiết Muồng trâu Cao chiết Mai dương Aeromonas hydrophila - + Edwardsiella ictaluri - + Streptococcus agalactiae - + Aeromonas dhakensis - + Ghi chú: (-): không có hoạt tính kháng khuẩn; (+) có hoạt tính kháng khuẩn Kết quả cho thấy, cao chiết Muồng trâu không kháng khuẩn đối với 4 loài vi khuẩn:A.dhakensis, A.hydrophila,E.ictaluri, S.agalactiae. Nhưng ngược lại cao chiết Mai dương có khả năng kháng khuẩn tốt đối với 4 loài vi khuẩn, đường kính kháng khuẩn lần lượt là 172 Email: jst@tnu.edu.vn TNU Journal of Science and Technology 226(07): 166 - 174 2,6667±0,1528b mm; 3,9670±0,2080a mm 4,3000±0,3610a mm; 3,1330±0,2080bmm (Hình 2).Sự xuất hiện vòng kháng khuẩn xung quanh khoanh giếng thạch có thể do các chất có hoạt tính kháng khuẩn trong cao chiết khuếch tán từ giếng thạch sang mặt thạch xung quanh và ức chế sự phát triển của vi khuẩn. 1.a 1.b 1.c 1.d 2.a 2b 2c 2d 3.a 3b 3c 3d Hình 2. Khả năng kháng khuẩn của cao chiết Mai dương (1), Muồng trâu (2) và tetracycline (3) với các dòng vi khuẩn a: Aeromonas dhakensis; b: Aeromonas hydrophila;c: Edwardsiella ictaluri; d: Streptococcus agalactiae 4. Kết luận Nghiên cứu cho thấy, cao chiết ethanol từ lá cây Muồng trâu và Mai dương có chứa các hợp chất hóa học có dược tính tốt. Kết quả khảo sát in vitro (sử dụng bốn phương pháp DPPH, ABTS, RP và TAA) chứng minh cao chiết cây Mai dương có hoạt tính kháng oxy hóa tốt hơn Muồng trâu. Như vậy, cây Muồng trâu và Mai dương có nhiều tiềm năng cho các nghiên cứu về các dược chất có tác dụng kháng oxy hóa trên người và động vật thủy sản. Đồng thời, cao chiết Mai dương có thể sử dụng như một chất có khả năng diệt khuẩn và có tiềm năng là nguồn thực phẩm giúp tôm, cá tăng cường khả năng kháng vi khuẩn gây bệnh. 5. Lời cảm ơn Nhóm tác giả xin chân thành cảm ơn Ths. Nguyễn Thị Hiền, Trung tâm quan trắc môi trường và bệnh thủy sản Nam bộ, Viện nghiên cứu nuôi trồng Thủy sản 2, TP.HCM đã cung cấp các chủng vi khuẩn cho nghiên cứu này. 173 Email: jst@tnu.edu.vn TNU Journal of Science and Technology 226(07): 166 - 174 TÀI LIỆU THAM KHẢO/ REFERENCES [1] S. Karbach, P. Wenzel, A. Waisman, T. Munzel, and A. Daiber, “eNOS uncoupling in cardiovascular diseases-the role of oxidative stress and inflammation,” Curr. Pharm. Des, vol. 20, pp. 3579-3594, 2014. [2] Y. Y.Wu, W. Li, Y. Xu, E. H. Jin, and Y. Y. Tu, “Evaluation of the antioxidant effects of four main theaflavin derivatives through chemiluminescence and DNA damage analyses,” Journal of Zhejiang University Science B.,vol. 12, no. 9, pp. 744-751, 2011. [3] K. Pholdaeng and S. Pongsamart, “Studies on the immunomodulatory effect of polysaccharide gel extracted from Durio zibethinus in Penaeus monodon shrimp against Vibrio harveyi and WSSV,” Fish Shellfish Immunol, vol. 28, pp. 555-561, 2010. [4] V. H. Ngo, “The use of medicinal plants as immunostimulants in aquaculture,” Aquaculture, vol. 446, pp. 88-96, 2015. [5] O. S. Oladeji, F. E. Adelowo, A. P. Oluyori, and D. T. Bankole, “Ethnobotanical Description and Biological Activities of Senna alata,” Evid Based Complement Alternat Med., vol. 2020, 2020, Art. no. 2580259, doi:10.1155/2020/2580259. [6] J. Anbu, M. Anita, and R. Sathiya, “In Vitro Anthelmintic activity of leaf ethanolic extract of Cassia alata and Typha angustifolia,” MSRUAS-SASTech Journal, vol. 14, no. 2, pp. 41-44, 2013. [7] W. M. Chen, E. K. James, J. H. Chou, S. Y. Sheu, S. Z. Yang, and J. I. Sprent, “β‐Rhizobia from Mimosa pigra, a newly discovered invasive plant in Taiwan,” New phytologist, vol. 168, no. 3, pp. 661-675, 2005. [8] G. Rakotomalala et al. "Extract from Mimosa pigra attenuates chronic experimental pulmonary hypertension," Journal of Ethnopharmacology, vol. 148, no.1, pp. 106-116, 2013. [9] A. Syahidah, C. R. Saad, H. M. Daud, and Y. M. Abdelhadi, “Status and potential of herbal applications in aquaculture,” Iranian Journal of Fisheries Sciences, vol. 14, no. 1, pp. 27-44, 2015. [10] T. Citarasu, “Herbal biomedicines: a new opportunity for aquaculture industry,” Aquaculture International,vol. 18, no. 3, pp. 403-414, 2010. [11] R. N. S. Yadav and M. Agarwala, “Phytochemical analysis of some medicinal plants,” J. Phytol., vol. 3, no. 12, pp. 10-14, 2011. [12] V. L. Singleton, R. Orthofer, and R. M. Lamuela-Raventos, “Analysis of total phenol and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent,” Methods in Enzymology,vol. 299C, no. 1, pp. 152-178, 1999. [13] G. C. Bag, P. G. Devi, and T. Bhaigyabati, “Assessment of total flavonoid content and antioxidant activity of methanolic rhizome extract of three Hedychium species of Manipur valley,” International Journal of Pharmaceutical Sciences Review and Research, vol. 30, no. 1, pp. 154-159, 2015. [14] O. P. Sharma and T. K. Bhat, “DPPH antioxidant assay revisited,” Food chemistry, vol. 113, no. 4, pp. 1202-1205, 2009. [15] N. Nikolaos, L. F. Wang, M. Tsimidou, and H. Y. Zhang, “Estimation of scavenging sctivity of phenolic compounds using the ABTS•+ assay,” Journal of Agricultural and Food Chemistry, vol. 52, no. 15, pp. 4669-4674, 2004. [16] R. Padma, N. G. Parvathy, V. Renjith, and P. R. Kalpana, “Quantitative estimation of tannins, phenols and antioxidant activity of methanolic extract of Imperata cylindrical,” International Journal of Research in Pharmaceutical Sciences, vol. 4, no. 1, pp. 73-77, 2013. [17] P. Prieto, M. Pineda, and M. Aguilar, “Spcctrophotometric quantification of antioxidant capacity through the formation of a phosphomolybdenum complex: Specific application to the determination of vitamin E,” Anal Biochem, vol. 269, pp. 337-341, 1999. [18] H. C. Chang, G. J. Huang, D. C. Agrawal, C. L. Kuo, C. R. Wu, and H. S. Tsay, “Antioxidant activities and polyphenol contents of six folk medicinal ferns used as “Gusuibu,” Botanical Studies,vol. 48, pp. 397-406, 2007. [19] N. A. Nordin, N. B. M. Zin, N. F. Fazilah, H. Wasoh, A. B. Ariff, and M. Halim., “Phytochemicals, antioxidant and antimicrobial properties of Senna alata and Senna tora leaf extracts against bacterial strains causing skin infections,”Scicell, vol. 2, no. 1, pp. 19-25, 2019. [20] G. Rakotomalala, C. Agard, P. Tonnerre, A. Tesse, S. Derbré, S. Michalet, and P. Pacaud, “Extract from Mimosa pigra attenuates chronic experimental pulmonary hypertension,” Journal of Ethnopharmacology, vol. 148, no. 1, pp. 106-116, 2013. [21] Jothi, R. Shunmuga, V. Bharathy, and F. Uthayakumari, "Antioxidant potential of aerial part of Senna italica Sub Species micrantha Mill," Journal of Pharmaceutical Sciences and Research, vol. 7, no. 9,2015, Art. no. 621. 174 Email: jst@tnu.edu.vn
File đính kèm:
 khao_sat_kha_nang_khang_oxy_hoa_va_khang_khuan_cua_cay_muong.pdf
khao_sat_kha_nang_khang_oxy_hoa_va_khang_khuan_cua_cay_muong.pdf

