Xử lý chất hoạt động bề mặt trong nước bằng hệ xúc tác quang học Cu2+/TiO2 và ánh sáng mặt trời
Trong nghiên cứu này, hệ xúc tác quang học bao gồm vật liệu Cu2+/TiO2 và ánh
sáng mặt trời (hầu hết là ánh sáng trong vùng nhìn thấy) được sử dụng để giảm COD
(Chemical Oxygen Demand) của nước có chứa chất hoạt động bề mặt (CHĐBM). Kết quả
nghiên cứu cho thấy vật liệu với 10% Cu2+(khối lượng) trên bề mặt TiO2 cho khả năng xử lý
cao nhất (giảm COD của nước nhiều nhất) gần 90% so với giá trị COD ban đầu của nước.
Nguyên nhân mà hệ xúc tác này hoạt động tốt trong vùng ánh sáng nhìn thấy có thể là do sự
thay đổi về cấu trúc của TiO2 bởi các ion Cu2+ so với cấu trúc TiO2 nguyên thủy. Đồng thời
ảnh hưởng của H2O2 đến hiệu quả xử lý cũng được nghiên cứu.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6

Trang 7
Bạn đang xem tài liệu "Xử lý chất hoạt động bề mặt trong nước bằng hệ xúc tác quang học Cu2+/TiO2 và ánh sáng mặt trời", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Xử lý chất hoạt động bề mặt trong nước bằng hệ xúc tác quang học Cu2+/TiO2 và ánh sáng mặt trời

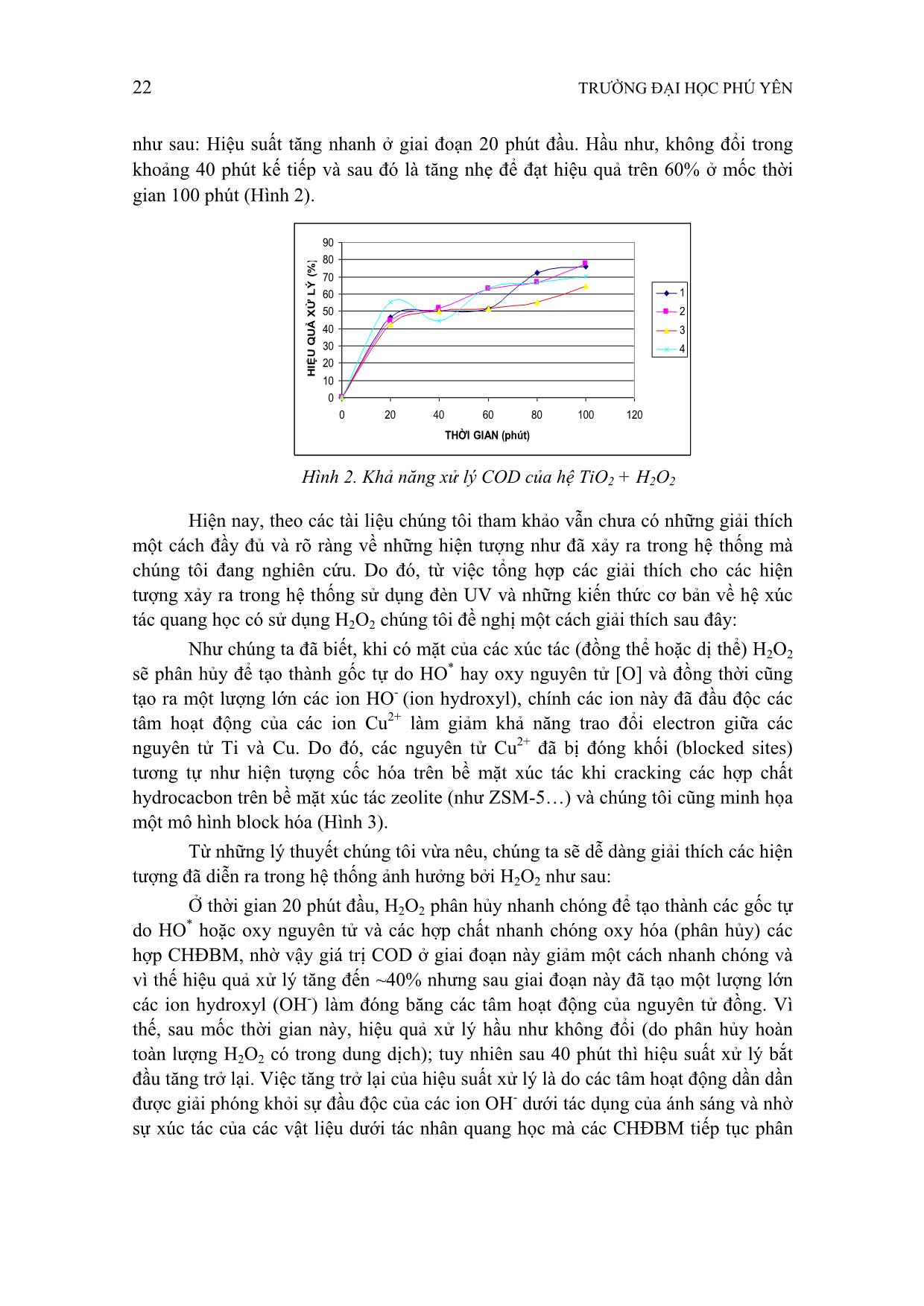
đổi các đặc tính của nước tự nhiên... Các chất ô nhiễm dạng này được xem là một dạng ô nhiễm khó xử lý so với các chất ô nhiễm khác và hiệu quả xử lý phụ thuộc rất nhiều vào cấu tạo của chúng. Ở Việt Nam, việc sử dụng các CHĐBM có ion là phổ biết nhất như các chế phẩm tẩy rửa gia đình, công nghiệp xi mạ, thực phẩmĐể đánh giá hiệu quả xử lý nước ô nhiễm này thì giá trị COD được ưu tiên xem xét đầu tiên. Bởi vì COD là lượng oxy cần thiết cho quá trình oxy hóa hóa học các chất hữu cơ trong nước thành CO2 và H2O. COD biểu thị lượng chất hữu cơ có thể oxy hóa bằng hóa học và COD được dùng rộng rãi để đặc trưng cho mức độ các chất hữu cơ trong nước ô nhiễm (kể cả chất hữu cơ dễ bị phân hủy và khó phân hủy sinh học). Thực tế cho thấy, việc sử dụng ánh sáng trong vùng nhìn thấy trong các phản ứng xúc tác quang hóa vẫn còn nhiều hạn chế so với ánh sáng có năng lượng trong vùng tử ngoại (tia UV). Trong nghiên cứu này, chúng tôi sử dụng xúc tác quang học trên cơ bản là TiO2 cùng với phụ gia để mở rộng “band gap” sang vùng nhìn thấy (visible range) với mục đích tận dụng nguồn năng lượng ánh sáng mặt trời dồi dào (đặc điểm nổi bật của địa lý Việt Nam) từ đó có thể nâng cao tính ứng dụng đề tài này vào thực tế tại Việt Nam. 2. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU 2.1. Hóa chất TiO2 công nghiệp, HCl (đậm đặc, 36%, Trung Quốc), NaOH (khan, Merck), Cu(NO3)2.2H2O (Trung Quốc), K2Cr2O7 (Merck), H2O2 (30%, Trung Quốc), Dung dịch FAS (chuẩn bị theo hướng dẫn xác định chỉ số COD, TCVN 6491:1999). 2.2. Thực nghiệm - Làm sạch TiO2 nguyên liệu: Cân chính xác khoảng 5 g TiO2 công nghiệp rửa vài lần với nước cất, sau đó TiO2 được ngâm 30 phút trong 30 mL dung dịch HCl-15% thể tích. TiO2 sạch thu được sau khi rửa vài lần với nước cất và sấy 24 giờ ở nhiệt độ 110oC. - Tổng hợp vật liệu Cu2+/TiO2 (đưa các ion Cu 2+ vào cấu trúc của TiO2): hòa tan hoàn toàn khoảng 2 g TiO2 nguyên liệu (sau khi được làm sạch) vào 50 mL dung dịch NaOH-2M. Hỗn hợp huyền phù này được khuấy đều 2 giờ ở nhiệt độ ổn định 50oC. Tiếp đó, một thể tích xác định của dung dịch Cu(NO3)2-0.5M được nhỏ từng giọt thật chậm vào hỗn hợp huyền phù ở trên. Lưu ý rằng hỗn hợp huyền phù vẫn tiếp tục được khuấy trộn và duy trì ở nhiệt độ 50oC cho đến 30 phút kể từ khi chấm dứt quá trình nhỏ giọt dung dịch Cu(NO3)2-0.5M. Tiếp theo, quá trình tổng hợp thủy nhiệt của vật liệu này được tiến hành trong thiết bị phản ứng autoclave bằng thép 20 TRƯỜNG ĐẠI HỌC PHÚ YÊN không gỉ bao bọc một ống hình trụ bằng Teflon chứa hỗn hợp trên. Sau quá trình thủy nhiệt này (24 giờ ở nhiệt độ 250oC) vật liệu Cu2+/TiO2 thu được tách ra bằng cách lọc, rửa nhiều lần với nước cất và sấy qua đêm ở nhiệt độ 110oC. Các vật liệu Cu2+/TiO2 với hàm lượng Cu 2+ khác nhau (3%, 5% và 10% Cu2+) được bảo quản trong bình hút ẩm bằng vật liệu silica chuẩn bị làm xúc tác cho phản ứng sau này. - Khả năng xử lý CHĐBM có trong nước tẩy rửa của chất xúc tác TiO2 được xác định bằng cách: Cho 5g chất xúc tác chứa 3% Cu2+ (tương tự với các chất xúc tác chứa 5% Cu2+, 10% Cu2+ và với mẫu TiO2 không chứa Cu 2+) vào 100 ml dung dịch nước rửa chén đã được pha loãng (0,0004%) thí nghiệm dưới điều kiện ánh nắng mặt trời chiếu trực tiếp vào trong các khoảng thời gian: 0, 20, 40, 60, 80, 100 phút. Lọc lấy dung dịch, phân tích COD bằng phương pháp đun hoàn lưu kín (sử dụng K2Cr2O7). Sự ảnh hưởng của H2O2 đến hoạt tính xúc tác của vật liệu được xác định theo các thí nghiệm tương tự nhưng cho thêm 0,5ml H2O2 cho mỗi thí nghiệm. Các thí nghiệm khảo sát tiến hành độc lập với chất xúc tác TiO2 và TiO2 + H2O2. 3. KẾT QUẢ VÀ THẢO LUẬN 3.1. Khả năng xử lý chất hoạt động bề mặt có trong nước tẩy rửa của chất xúc tác TiO2 0 50 100 150 200 250 300 350 400 450 0 20 40 60 80 100 120 THỜI GIAN (phút) C O D ( m g /l ) 1 2 3 4 0.0 10.0 20.0 30.0 40.0 50.0 60.0 70.0 80.0 90.0 100.0 0 20 40 60 80 100 120 THỜI GIAN (phút) H IỆ U Q U Ả X Ử L Ý ( % ) 1 2 3 4 Hình 1. Khả năng xử lý COD phụ thuộc vào nồng độ chất phụ gia (1) TiO2+3% Cu 2+ (2) TiO2 +5%Cu 2+ (3) TiO2 +10%Cu 2+ (4) TiO2 TẠP CHÍ KHOA HỌC SỐ 4 * 2013 21 Từ các số liệu thực nghiệm thu được cho thấy các vật liệu được chọn thể hiện một hoạt tính xúc tác rất cao (Hình 1); điều này đã được thể hiện thông qua sự giảm giá trị COD theo thời gian xử lý (hay chiếu sáng). Trong đó, khi tăng hàm lượng của chất phụ gia từ 3% đến giá trị 10% thì hiệu quả xử lý tăng lên đáng kể từ khoảng 50% đến gần 90% tương ứng với giá trị COD là 211,2 mgO2/L và 44,8 mgO2/L. Điều này có thể là do khi tăng hàm lượng của chất phụ gia (Cu2+) kết quả là làm tăng các tâm hoạt động cũng như đã mở rộng “band gap” sang vùng ánh sáng nhìn thấy (xúc tác quang cho hoạt tính trong vùng nhìn thấy) và kết quả này hầu như phù hợp với các kết quả của các quá trình nghiên cứu về loại xúc tác quang này ứng với quá trình oxy hóa glycerol (Paul T. Anastas, 2008). Và cũng từ các kết quả thu được cho thấy ở hàm lượng 10% phụ gia là một hàm lượng tối ưu vì ở điểm này xúc tác cho một hoạt tính khá cao cùng với sự ổn định hoạt tính (độ bền) rất tốt trong khoảng thời gian thực hiện nghiên cứu. Tuy nhiên, với vật liệu TiO2 (không có phụ gia Cu 2+) cũng cho một hoạt tính cao; nhưng về mặt lý thuyết thì vật liệu này có độ bền không cao vì thiếu sự dịch chuyển điện tử qua lại giữa các nguyên tử Ti và Cu. Như vậy, có thể đề xuất một trật tự vật liệu cho hoạt tính xúc tác giảm dần như sau TiO2+10%Cu 2+ > TiO2 > TiO2+5%Cu 2+ > TiO2+3%Cu 2+. Trật tự này hoàn toàn phù hợp với lý thuyết về tâm hoạt tính của xúc tác; vì khi chúng ta gắn Cu2+ lên bề mặt của TiO2 làm số lượng tâm hoạt động (tâm hấp phụ) trên bề mặt của TiO2 đồng loạt giảm, điều này dẫn đến hoạt tính xúc tác giảm theo; nhưng với hàm lượng 10% phụ gia lại cho hoạt tính khá cao, điều này có thể là do ở hàm lượng này các hợp chất Cu2+ và Ti4+ có thể đã tạo thành các spinel (một dạng phức chất rắn của các oxit) làm tăng cường mức độ và sự ổn định của quá trình truyền vận các electron. Như vậy, với hàm lượng tẩm 10% là một điểm tối ưu (vì đã cho một quá trình xử lý hiệu quả COD giảm từ 345,6 mg/L đến 44,8 mg/L) cho nguồn nước thải đầu ra loại A sau thời gian xử lý 100 phút. Tuy nhiên, để bước đầu nghiên cứu triển khai ra điều kiện thực tế, chúng tôi tiến hành nghiên cứu hoạt tính xúc tác của các vật liệu này ảnh hưởng bởi H2O2 (hydrogen peroxide) một hóa chất thông thường trong xử lý môi trường với mục đích là rút ngắn thời gian xử lý thực và tiết kiệm chi phí xây dựng - vận hành (Hình 2). 3.2. Khả năng xử lý chất hoạt động bề mặt có trong nước tẩy rửa của chất xúc tác TiO2 + H2O2 Khi có mặt của H2O2 thì hiệu quả xử lý ứng với các vật liệu đều đạt trên 60% chuyển hóa so với lượng COD ban đầu. Tuy nhiên trật tự của hoạt tính của vật liệu có một sự thay đổi đáng kể chỉ riêng với TiO2 cho một hoạt tính cao và không thấy ảnh hưởng của H2O2 đến hiệu quả xử lý; trật tự như sau: TiO2 > TiO2+3%Cu 2+ > TiO2+5%Cu 2+ > TiO2+10%Cu 2+. Điều đáng chú ý hơn là sau thời điểm 20 phút đầu của quá trình xử lý thì hiệu suất đạt trên 40% và với các vật liệu có phụ gia có các diễn biến khá phức tạp khi nghiên cứu hiệu suất trong suốt quá trình xử lý, cụ thể 22 TRƯỜNG ĐẠI HỌC PHÚ YÊN như sau: Hiệu suất tăng nhanh ở giai đoạn 20 phút đầu. Hầu như, không đổi trong khoảng 40 phút kế tiếp và sau đó là tăng nhẹ để đạt hiệu quả trên 60% ở mốc thời gian 100 phút (Hình 2). Hiện nay, theo các tài liệu chúng tôi tham khảo vẫn chưa có những giải thích một cách đầy đủ và rõ ràng về những hiện tượng như đã xảy ra trong hệ thống mà chúng tôi đang nghiên cứu. Do đó, từ việc tổng hợp các giải thích cho các hiện tượng xảy ra trong hệ thống sử dụng đèn UV và những kiến thức cơ bản về hệ xúc tác quang học có sử dụng H2O2 chúng tôi đề nghị một cách giải thích sau đây: Như chúng ta đã biết, khi có mặt của các xúc tác (đồng thể hoặc dị thể) H2O2 sẽ phân hủy để tạo thành gốc tự do HO* hay oxy nguyên tử [O] và đồng thời cũng tạo ra một lượng lớn các ion HO- (ion hydroxyl), chính các ion này đã đầu độc các tâm hoạt động của các ion Cu2+ làm giảm khả năng trao đổi electron giữa các nguyên tử Ti và Cu. Do đó, các nguyên tử Cu2+ đã bị đóng khối (blocked sites) tương tự như hiện tượng cốc hóa trên bề mặt xúc tác khi cracking các hợp chất hydrocacbon trên bề mặt xúc tác zeolite (như ZSM-5) và chúng tôi cũng minh họa một mô hình block hóa (Hình 3). Từ những lý thuyết chúng tôi vừa nêu, chúng ta sẽ dễ dàng giải thích các hiện tượng đã diễn ra trong hệ thống ảnh hưởng bởi H2O2 như sau: Ở thời gian 20 phút đầu, H2O2 phân hủy nhanh chóng để tạo thành các gốc tự do HO* hoặc oxy nguyên tử và các hợp chất nhanh chóng oxy hóa (phân hủy) các hợp CHĐBM, nhờ vậy giá trị COD ở giai đoạn này giảm một cách nhanh chóng và vì thế hiệu quả xử lý tăng đến ~40% nhưng sau giai đoạn này đã tạo một lượng lớn các ion hydroxyl (OH-) làm đóng băng các tâm hoạt động của nguyên tử đồng. Vì thế, sau mốc thời gian này, hiệu quả xử lý hầu như không đổi (do phân hủy hoàn toàn lượng H2O2 có trong dung dịch); tuy nhiên sau 40 phút thì hiệu suất xử lý bắt đầu tăng trở lại. Việc tăng trở lại của hiệu suất xử lý là do các tâm hoạt động dần dần được giải phóng khỏi sự đầu độc của các ion OH- dưới tác dụng của ánh sáng và nhờ sự xúc tác của các vật liệu dưới tác nhân quang học mà các CHĐBM tiếp tục phân 0 10 20 30 40 50 60 70 80 90 0 20 40 60 80 100 120 THỜI GIAN (phút) H IỆ U Q U Ả X Ử L Ý ( % ) 1 2 3 4 Hình 2. Khả năng xử lý COD của hệ TiO2 + H2O2 TẠP CHÍ KHOA HỌC SỐ 4 * 2013 23 hủy (đây cũng là cơ chế phân hủy các hợp chất hữu cơ trong trường hợp không có sự hiện diện của H2O2). Với nguyên nhân này mà vật liệu TiO2 (không có thành phần phụ gia đồng) sẽ cho một hoạt tính cao và ổn định hơn so với các vật liệu có phụ gia. Hình 3. Cơ chế đầu độc của các ion Cu2+ bởi ion hydroxyl Như đã biết mối quan hệ nghịch biến giữa chỉ số COD và thời gian (xem Hình 1) và mối quan hệ đồng biến giữa hiệu quả xử lý và thời gian (xem Hình 1 và 2). Tuy nhiên, đối với vật liệu TiO2 (không có phụ gia Cu 2+) lại có những đoạn bất thường, ví dụ như: mối quan hệ đồng biến giữa COD và thời gian trong khoảng thời gian từ 60 đến 80 phút và mối quan hệ nghịch biến giữa hiệu quả xử lý và thời gian trong khoảng thời gian từ 20 đến 40 phút (Hình 1) và từ 60 đến 80 phút (Hình 2). Điều bất thường này có thể là do ảnh hưởng của cấu trúc bề mặt xúc tác và mức độ che phủ của CHĐBM trên bề mặt xúc tác rắn đến quá trình khuếch tán (giải hấp) các sản phẩm phản ứng (các chất sau phản ứng oxy hóa) từ bề mặt xúc tác rắn ra môi trường dung dịch (Nguyễn Hữu Phú, 1998). Từ những kết quả đạt được, chúng ta có thể dễ dàng nhận thấy rằng hệ xúc tác này đã thể hiện một vai trò rất xuất sắc khi được kết hợp với nguồn ánh sáng trong vùng nhìn thấy để xử lý CHĐBM (dạng alkyl sulfunate) có trong nước với một chi phí thấp. Điều đó cho thấy, việc triển khai kết quả từ nghiên cứu này mang tính khả thi cao, nhất là triển khai sử dụng vật liệu này trong xử lý nước thải từ các khu dân cư bởi những ưu điểm vượt trội sau đây: - Xúc tác có hoạt tính cao; sản xuất dễ dàng với giá thành rẻ; có khả năng tái sử dụng nhiều lần (đây là một ưu điểm quan trọng của xúc tác rắn); - Điều kiện xử lý thân thiện với môi trường (pH trung tính, ánh sáng mặt trời); - Giá thành xử lý khoảng 700 VNĐ/1 m3 nước chứa CHĐBM (chi phí xử lý chủ yếu là chi phí cho quá trình tổng hợp vật liệu; và khả năng xử lý: 1,2 gam TiO2- 10% Cu2+/1 m3 nước thải, số liệu này sẽ được trình bày trong công bố tiếp theo). - Sử dụng nguồn ánh sáng mặt trời đây là một đặc điểm nổi bật của Việt Nam. 4. KẾT LUẬN Chúng tôi đã chế tạo được vật liệu TiO2 có 10% phụ gia (Cu 2+) dùng làm xúc TiO2 substrate (nền TiO2) Cu 2+ + OH- OH- OH- OH- OH- OH- OH- Trạng thái tự do của tâm Cu2+ và các ion hydroxyl TiO2 substrate (nền TiO2) Cu 2+ OH- OH- OH- OH- OH- OH- Trạng thái tâm Cu2+ bị đầu độc bởi các ion hydroxyl 24 TRƯỜNG ĐẠI HỌC PHÚ YÊN tác quang học cho hoạt tính xử lý CHĐBM trong nước cao (gần 90%). Đồng thời, nghiên cứu này đã cho thấy ảnh hưởng của H2O2 và đề xuất một cơ chế có thể xảy ra ảnh hưởng của ion OH- đến hoạt tính xúc tác của các vật liệu. Bên cạnh việc cho thấy khả năng áp dụng trong tương lai của vật liệu có hoạt tính quang học mà cụ thể là với phụ gia Cu2+ trên TiO2 cho hoạt tính cao thay cho hệ xúc tác quang học cổ điển (TiO2+ H2O2). Công trình nghiên cứu này là một bước khởi đầu đầy tiềm năng khi ứng dụng vật liệu mới trong xử lý môi trường với chi phí thấp và tận dụng nguồn năng lượng ánh sáng mặt trời phong phú tại Việt Nam TÀI LIỆU THAM KHẢO [1] Lâm Minh Triết (2006), Xử lý nước thải đô thị và công nghiệp - Tính toán thiết kế công trình, Nxb Đại học Quốc gia, TP Hồ Chí Minh. [2] Metcalf & Eddy (2004), Wastewater Engineering Treatment, Disposal, Reuse, Fourth Edition. [3] Phạm Phát Tân, Nguyễn Thị Dung và Trần Mạnh Trí (2007), Nghiên cứu điều chế và đặc tính xúc tác TiO2 được cấy thêm nguyên tố Nitơ nhằm nâng cao hoạt tính quang hóa ở vùng ánh sáng khả kiến, Nhà in Khoa học & Công nghệ, Viện Khoa học & Công nghệ Việt Nam. [4] Trần Đức Hạ (2002), Xử lý nước thải sinh hoạt quy mô nhỏ và vừa, Nxb Khoa học và kỹ thuật, Hà Nội. [5] Trần Mạnh Trí, Trần Mạnh Trung (2006), Các quá trình oxy hóa nâng cao trong xử lý nước và nước thải cơ sở ứng dụng khoa học, Nxb Khoa học & Kỹ thuật, Hà Nội. [6] Trịnh Xuân Lai (2000), Tính toán thiết kế các công trình xử lý nước thải, Công ty tư vấn cấp thoát nước số 2, Nhà xuất bản xây dựng. [7] Paul T. Anastas và Evan S. Beach, “Green chemistry: the emergence of a transformative framework”,Taylor & Francis, vol.1, issue 1, 2008, 9-24. [8] Nguyễn Hữu Phú (1998), Hấp phụ và xúc tác trên vật liệu mao quản, Nxb Khoa học & Kỹ thuật, Hà Nội. Abstract Treating surface active compounds in water by using photocatalyst system Cu2+ / TiO2 structure and sunlight In this research, the photocatalyst system, included Cu2+/TiO2 material and sunlight (most of which is the light in the visible range), was investigated in the significantly COD (Chemical Oxygen Demand) decreasing of the experimental liquid contented the organic surface active compounds. The results have shown that photocatalyst with 10% loading of Cu2+compound on the TiO2 surface brings about the highest treatment capacity in COD decreasing (around 90%) under the sun lighting. It could be implied by Cu2+ ions dropped into the TiO2 structure resulting the highly active catalyst in the visible range. Additionally, the effect of H2O2 compounds on the COD decreasing behavior of this photocatalyst is also concerned. Key words: photocatalyst, Cu2+/ TiO2, surface active compounds
File đính kèm:
 xu_ly_chat_hoat_dong_be_mat_trong_nuoc_bang_he_xuc_tac_quang.pdf
xu_ly_chat_hoat_dong_be_mat_trong_nuoc_bang_he_xuc_tac_quang.pdf

