Tuyển chọn, xác định điều kiện phù hợp và tối ưu hóa điều kiện sinh tổng hợp enzyme laccase của chủng BVP 10.2
Enzyme laccase có khả năng xúc tác phản ứng chuyển hóa các hợp chất phenol thành các gốc quinin vào sau đó oxy hóa chúng thành quinon, phản ứng oxy hóa gắn liền với sự khử phân tử oxy tạo thành nước. Chủng nấm mốc BVP 10.2 được phân lập, tuyển chọn từ các mẫu bùn thải tại một số cơ sở dệt nhuộm có sự tham gia xúc tác của các cơ chất đặc hiệu là Syringaldazine và ABTS với hoạt độ enzyme laccase cao nhất sau 5 ngày nuôi cấy đạt 85,5 U/ml. Enzyme laccase được tổng hợp cao nhất đạt 190 U/ml trong điều kiện môi trường với 2% tỷ lệ cấp giống ban đầu; 10 g/l glucose; 1,5 g pepton + 1,5 g (NH4)2SO4; 0,3 mM Veratryl alcohol, nồng độ CuSO4 là 250 µm, pH 6, trên máy lắc ở 350C với tốc độ lắc 200 vòng/phút. Tối ưu hóa điều kiện sinh tổng hợp enzyme laccase của nấm mốc BVP 10.2 ở nồng độ glucose 1,4%: Veratryl alcohol 0,04%, pH 6 laccase được tích lũy trong môi trường đạt 296 U/ml trong 7 ngày nuôi cấy

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6
Trang 7

Trang 8

Trang 9
Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Tuyển chọn, xác định điều kiện phù hợp và tối ưu hóa điều kiện sinh tổng hợp enzyme laccase của chủng BVP 10.2

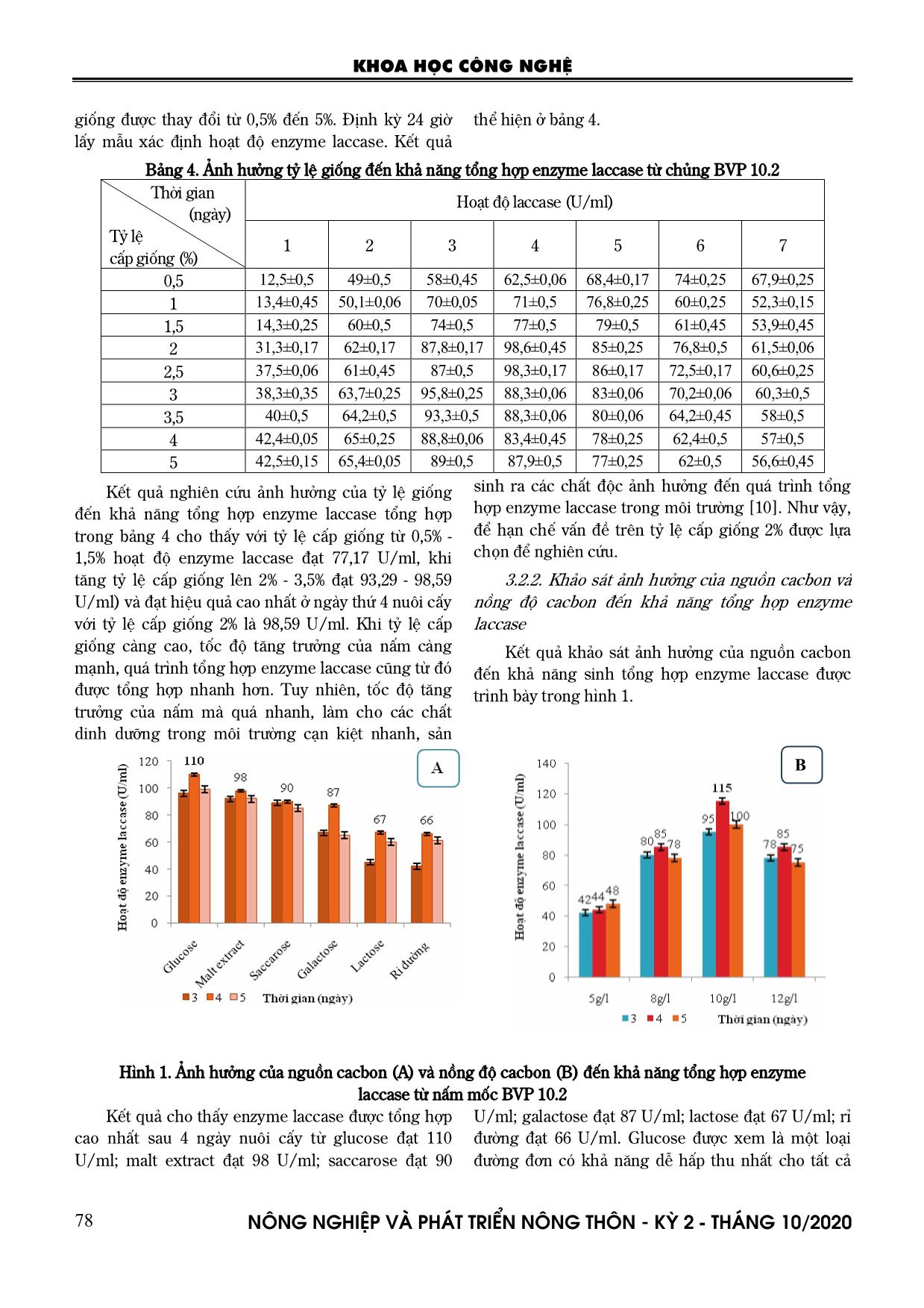
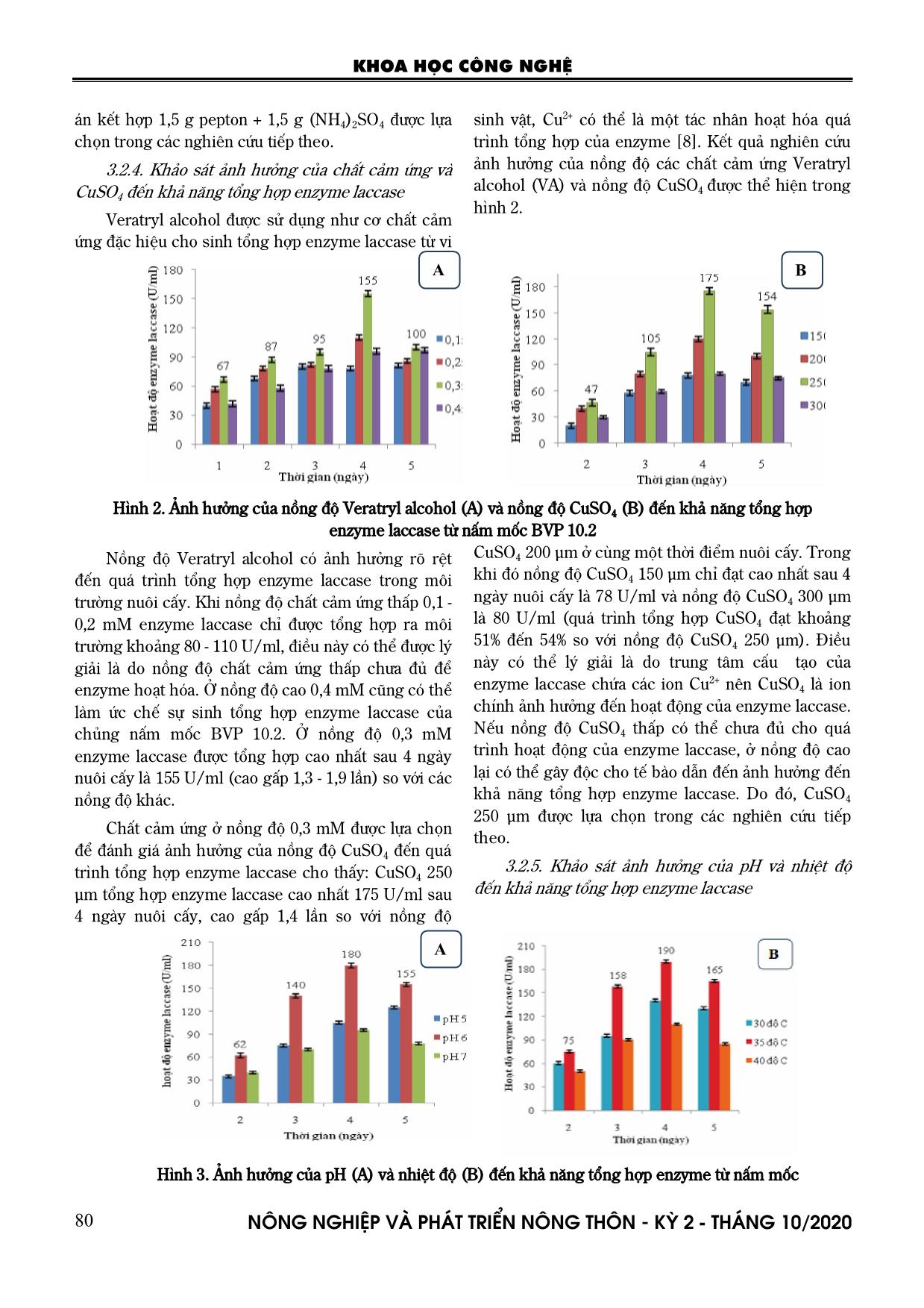
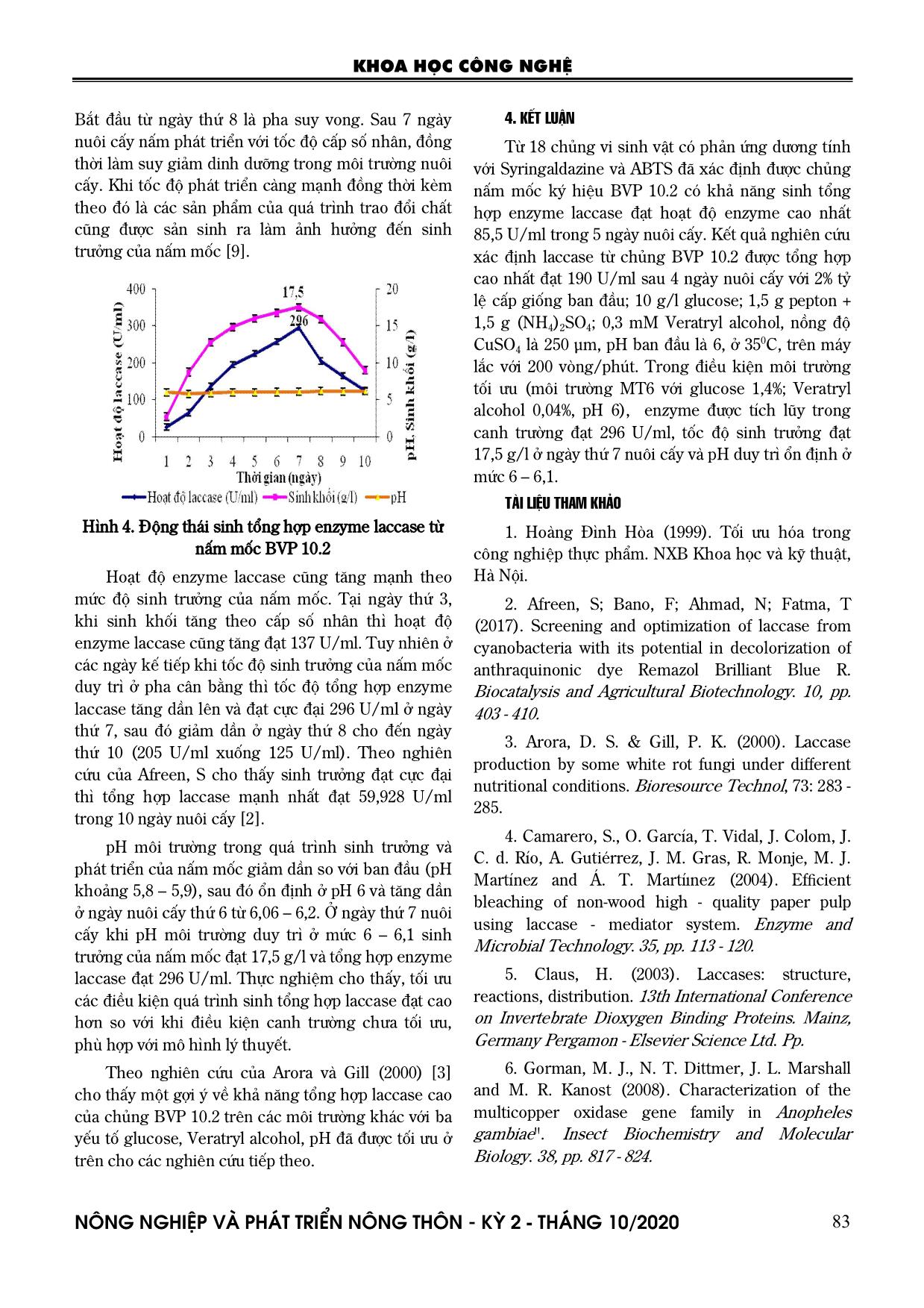
i 135 U/ml, phương án kết hợp 2 g pepton + 1 g (NH4)2SO4 enzyme laccase tổng hợp cao nhất sau 4 ngày nuôi cấy cũng chỉ đạt 109,4 U/ml. Việc bổ sung nguồn nitơ vô cơ trong môi trường nuôi cấy cũng có tác động đến môi trường nuôi cấy, vì có thể làm điều chỉnh pH của môi trường nuôi cấy làm thuận lợi cho quá trình tổng hợp enzyme laccase. Do đó, phương KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 10/2020 80 án kết hợp 1,5 g pepton + 1,5 g (NH4)2SO4 được lựa chọn trong các nghiên cứu tiếp theo. 3.2.4. Khảo sát ảnh hưởng của chất cảm ứng và CuSO4 đến khả năng tổng hợp enzyme laccase Veratryl alcohol được sử dụng như cơ chất cảm ứng đặc hiệu cho sinh tổng hợp enzyme laccase từ vi sinh vật, Cu2+ có thể là một tác nhân hoạt hóa quá trình tổng hợp của enzyme [8]. Kết quả nghiên cứu ảnh hưởng của nồng độ các chất cảm ứng Veratryl alcohol (VA) và nồng độ CuSO4 được thể hiện trong hình 2. Hình 2. Ảnh hưởng của nồng độ Veratryl alcohol (A) và nồng độ CuSO4 (B) đến khả năng tổng hợp enzyme laccase từ nấm mốc BVP 10.2 Nồng độ Veratryl alcohol có ảnh hưởng rõ rệt đến quá trình tổng hợp enzyme laccase trong môi trường nuôi cấy. Khi nồng độ chất cảm ứng thấp 0,1 - 0,2 mM enzyme laccase chỉ được tổng hợp ra môi trường khoảng 80 - 110 U/ml, điều này có thể được lý giải là do nồng độ chất cảm ứng thấp chưa đủ để enzyme hoạt hóa. Ở nồng độ cao 0,4 mM cũng có thể làm ức chế sự sinh tổng hợp enzyme laccase của chủng nấm mốc BVP 10.2. Ở nồng độ 0,3 mM enzyme laccase được tổng hợp cao nhất sau 4 ngày nuôi cấy là 155 U/ml (cao gấp 1,3 - 1,9 lần) so với các nồng độ khác. Chất cảm ứng ở nồng độ 0,3 mM được lựa chọn để đánh giá ảnh hưởng của nồng độ CuSO4 đến quá trình tổng hợp enzyme laccase cho thấy: CuSO4 250 µm tổng hợp enzyme laccase cao nhất 175 U/ml sau 4 ngày nuôi cấy, cao gấp 1,4 lần so với nồng độ CuSO4 200 µm ở cùng một thời điểm nuôi cấy. Trong khi đó nồng độ CuSO4 150 µm chỉ đạt cao nhất sau 4 ngày nuôi cấy là 78 U/ml và nồng độ CuSO4 300 µm là 80 U/ml (quá trình tổng hợp CuSO4 đạt khoảng 51% đến 54% so với nồng độ CuSO4 250 µm). Điều này có thể lý giải là do trung tâm cấu tạo của enzyme laccase chứa các ion Cu2+ nên CuSO4 là ion chính ảnh hưởng đến hoạt động của enzyme laccase. Nếu nồng độ CuSO4 thấp có thể chưa đủ cho quá trình hoạt động của enzyme laccase, ở nồng độ cao lại có thể gây độc cho tế bào dẫn đến ảnh hưởng đến khả năng tổng hợp enzyme laccase. Do đó, CuSO4 250 µm được lựa chọn trong các nghiên cứu tiếp theo. 3.2.5. Khảo sát ảnh hưởng của pH và nhiệt độ đến khả năng tổng hợp enzyme laccase Hình 3. Ảnh hưởng của pH (A) và nhiệt độ (B) đến khả năng tổng hợp enzyme từ nấm mốc A B A KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 10/2020 81 Chủng nấm mốc BVP 10.2 được nuôi cấy trên các môi trường có giá trị pH khác nhau từ 5 - 7, nhiệt độ nuôi cấy thay đổi từ 300C, 350C, 400C, tốc độ lắc 200 vòng/phút, lượng giống cấp ban đầu 2%. Định kỳ lấy mẫu xác định hoạt độ enzyme laccase. Kết quả đánh giá ảnh hưởng của pH đến khả năng tổng hợp enzyme laccase của chủng BVP 10.2 được thể hiện trong hình 3. Thông thường enzyme laccase hoạt động tốt trong môi trường axít, trong đó pH 6 cho hoạt độ enzyme laccase cao nhất đạt 180 U/ml sau 4 ngày nuôi cấy. Ở pH 6 enzyme laccase được tổng hợp nhanh sau 2 ngày nuôi cấy liên tiếp là 62 U/ml, sau đó giảm dần ở các ngày nuôi cấy thứ 5. Ở pH 5 quá trình tổng hợp enzyme laccase sau 4 ngày nuôi cấy đạt thấp 105 - 125 U/ml (tương ứng khoảng 42 - 58% so với pH 6). Trong canh trường pH 7 quá trình tổng hợp enzyme laccase giảm chỉ còn khoảng 46% (hoạt độ enzyme đạt 95 U/ml). Ảnh hưởng của nhiệt độ nuôi cấy cũng tác động rõ rệt đến khả năng tổng hợp enzyme laccase. Sau 2 ngày nuôi cấy ở khoảng nhiệt độ 300C - 350C là khá tương đồng nhau (60 - 75 U/ml). Tuy nhiên, ở các ngày nuôi cấy kế tiếp tốc độ tăng trưởng nhanh thúc đẩy quá trình tổng hợp enzyme laccase cũng tăng theo và đạt 190 U/ml sau 4 ngày nuôi cấy ở 350C (tăng gấp 1,3 lần so với 300C). Còn ở 400C tốc độ phát triển của nấm mốc chậm, tổng hợp enzyme laccase cũng bị ảnh hưởng (chỉ đạt 62%). Điều này cho thấy có khả năng enzyme laccase bị tác động bởi sự phân hủy của các sản phẩm khác trong quá trình trao đổi chất khi môi trường đã cạn kiệt nguồn dinh dưỡng và tế bào tự phân ngày càng tăng, việc duy trì quá trình tăng trưởng trong suốt quá trình nuôi cấy sẽ giúp cho sinh tổng hợp enzyme laccase đạt hiệu suất cao [8]. 3.3. Tối ưu hóa điều kiện sinh tổng hợp enzyme laccase của nấm mốc BVP 10.2 3.3.1. Xây dựng mô hình toán với 3 thông số Qua nghiên cứu khảo sát các yếu tố ảnh hưởng đến sinh tổng hợp enzyme laccase, ba thông số có ảnh hưởng lớn nhất đến khả năng sinh tổng hợp enzyme laccase được lựa chọn: nồng độ glucose (X1, %); nồng độ Veratryl alcohol (X2; %) và pH môi trường (X3). Thiết lập ma trận thực nghiệm từ 3 thông số và cho kết quả theo bảng 7. Bảng 7. Ma trận thực nghiệm và kết quả TN Mã Thực X1 X2 X3 X1 X2 X3 Y1 Y2 YTB Sj 2 1 + + + 1,4 0,04 5,5 164 162,5 163 1,25 2 + + - 1,4 0,04 6,5 170 172 171 2 3 - + + 0,6 0,04 5,5 138 136,4 137 1,36 4 - + - 0,6 0,04 6,5 157 163 160 18 5 + - + 1,4 0,02 5,5 131,5 136 134 10,25 6 + - - 1,4 0,02 6,5 142 145,5 144 6,25 7 - - + 0,6 0,02 5,5 112,5 109,5 111 4,5 8 - - - 0,6 0,02 6,5 123,4 121 122 2,96 Tổng 1140 46,57 Kiểm tra độ đồng nhất của ma trận: Gtt= 39,0 57,46 18)( 2 2 jS SjMax Kiểm tra sự có nghĩa theo tiêu chuẩn Cochran tính Gb(f1, f2) với f1=k-1=2-1=1 f2=N=8, với p=0,05 Gb=0,6789 Ta có Gtt<Gb ma trận đồng nhất, các số liệu đo với cùng độ chính xác Tính các hệ số của phương trình: Y=b0+b1X1+b2X2+b3X3 KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 10/2020 82 Vậy: 321 5,61525,105,142 XXXY Kiểm tra sự có nghĩa của các hệ số: Theo tiêu chuẩn Student, các hệ số có nghĩa nếu: bi Stb Sb là căn bậc hai của phương sai mà các hệ số gánh chịu T: chuẩn số Student Ta có: 82,5 8 57,461 2 2 N S S N j j y Phương sai trung bình: 91,2 2 82,5 2 2 K S S y y Phương sai mà các hệ số xác định 73,0 4 91,2 2 2 B S S y b B là số hệ số 85,073,0 bS Giá trị bảng tiêu chuẩn Student đối với mức ý nghĩa p = 0,05; bậc tự do là f1=N.(K-1)=8; N=8. Tra bảng ta có: tb= 1,86 Vậy: 58,185,086,1 bb St )3,1(58,1 ibi Vậy tất cả các hệ số đều có nghĩa. Kiểm tra sự tương ứng của mô hình theo tiêu chuẩn Fisher Bảng 8. Kiểm tra sự tương ứng của mô hình theo tiêu chuẩn Fisher TT Mô hình YTT YTN (YTT - YTN) 2 1 142,5 + 10,25 + 15 - 6,5 161,3 163 2,89 2 142,5 + 10,25 + 15 + 6,5 174,3 171 10,89 3 142,5 - 10,25 + 15 - 6,5 140,8 137 14,44 4 142,5 - 10,25 + 15 + 6,5 153,8 160 38,44 5 142,5 + 10,25 - 15 - 6,5 131,3 134 7,29 6 142,5 + 10,25 - 15 + 6,5 144,3 144 0,09 7 142,5 - 10,25 - 15 - 6,5 110,8 111 0,04 8 142,5 - 10,25 - 15 + 6,5 123,8 122 3,24 Tổng 77,32 22 )( 1 TTTNtu YY BN S 19,33 64,6 91,2 33,19 ),( ),( 2 2 2 tuy tuy tt SSMin SSMax F Kiểm tra sự tương thích của phương trình theo tiêu chuẩn Fisher. So sánh giá trị Ftt với Fb, trong đó p: mức ý nghĩa; f1: bậc tự do của phương sai dư f1= N-B = 4; f2: bậc tự do của phương tái hiện f2 = N(K-1) = 8. Tra bảng ta có Fb=7,01, suy ra Ftt< Fb. Vậy mô hình đã lập hoàn toàn thích ứng. 3.3.2. Tối ưu hóa theo mô hình Box- Wilson Tối ưu hóa hàm mục tiêu bằng phương pháp leo dốc, bi là hệ số hồi qui của các yếu tố tương quan, i là khoảng biến thiên của từng yếu tố, theo công thức bi.i b1.1 = 10,25 x 0,4 = 4,1. b2.2 = 12 x 0,01 = 0,12. b3.3 = -6,5 x 0,5 = 3,25. Vậy chọn X1 làm biến cơ sở, Xcs=0,4; X2= 0,01; X3= 0,5 Bảng 9. Ma trận điều kiện tối ưu TN X1 X2 X3 HĐ (U/ml) 1 0,6 0,02 5,0 129,8 2 1,0 0,03 5,5 162,2 3 1,4 0,04 6,0 249,3 4 1,8 0,05 6,5 135,6 5 2,2 0,06 7,0 118,9 Kết quả nghiên cứu xác định môi trường nuôi cấy với nồng độ glucose 1,4%; Veratryl alcohol 0,04%; pH đầu 6,0 là môi trường tối ưu để chủng nấm mốc BVP 10.2 sinh tổng hợp enzyme cao nhất đạt 249,3 U/ml. Để kiểm tra thực nghiệm các điều kiện đã được tối ưu, chủng nấm mốc BVP 10.2 được nuôi trong môi trường MT6 với glucose 1,4%, Veratryl alcohol 0,04%, pH 6, ở 350C, trên máy lắc 200 vòng/phút. Thu 100 ml canh trường sau 24 giờ để xác định sinh khối, pH và hoạt tính enzyme laccase. Kết quả chỉ ra trong hình 4. Kết quả thực nghiệm các điều kiện đã được tối ưu cho thấy nấm mốc sinh trưởng mạnh từ ngày thứ 2 - 4, với hàm lượng sinh khối đạt từ 8,75 g/l đến 14,8 g/l, sau đó chuyển sang pha cân bằng từ ngày thứ 5. KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 10/2020 83 Bắt đầu từ ngày thứ 8 là pha suy vong. Sau 7 ngày nuôi cấy nấm phát triển với tốc độ cấp số nhân, đồng thời làm suy giảm dinh dưỡng trong môi trường nuôi cấy. Khi tốc độ phát triển càng mạnh đồng thời kèm theo đó là các sản phẩm của quá trình trao đổi chất cũng được sản sinh ra làm ảnh hưởng đến sinh trưởng của nấm mốc [9]. Hình 4. Động thái sinh tổng hợp enzyme laccase từ nấm mốc BVP 10.2 Hoạt độ enzyme laccase cũng tăng mạnh theo mức độ sinh trưởng của nấm mốc. Tại ngày thứ 3, khi sinh khối tăng theo cấp số nhân thì hoạt độ enzyme laccase cũng tăng đạt 137 U/ml. Tuy nhiên ở các ngày kế tiếp khi tốc độ sinh trưởng của nấm mốc duy trì ở pha cân bằng thì tốc độ tổng hợp enzyme laccase tăng dần lên và đạt cực đại 296 U/ml ở ngày thứ 7, sau đó giảm dần ở ngày thứ 8 cho đến ngày thứ 10 (205 U/ml xuống 125 U/ml). Theo nghiên cứu của Afreen, S cho thấy sinh trưởng đạt cực đại thì tổng hợp laccase mạnh nhất đạt 59,928 U/ml trong 10 ngày nuôi cấy [2]. pH môi trường trong quá trình sinh trưởng và phát triển của nấm mốc giảm dần so với ban đầu (pH khoảng 5,8 – 5,9), sau đó ổn định ở pH 6 và tăng dần ở ngày nuôi cấy thứ 6 từ 6,06 – 6,2. Ở ngày thứ 7 nuôi cấy khi pH môi trường duy trì ở mức 6 – 6,1 sinh trưởng của nấm mốc đạt 17,5 g/l và tổng hợp enzyme laccase đạt 296 U/ml. Thực nghiệm cho thấy, tối ưu các điều kiện quá trình sinh tổng hợp laccase đạt cao hơn so với khi điều kiện canh trường chưa tối ưu, phù hợp với mô hình lý thuyết. Theo nghiên cứu của Arora và Gill (2000) [3] cho thấy một gợi ý về khả năng tổng hợp laccase cao của chủng BVP 10.2 trên các môi trường khác với ba yếu tố glucose, Veratryl alcohol, pH đã được tối ưu ở trên cho các nghiên cứu tiếp theo. 4. KẾT LUẬN Từ 18 chủng vi sinh vật có phản ứng dương tính với Syringaldazine và ABTS đã xác định được chủng nấm mốc ký hiệu BVP 10.2 có khả năng sinh tổng hợp enzyme laccase đạt hoạt độ enzyme cao nhất 85,5 U/ml trong 5 ngày nuôi cấy. Kết quả nghiên cứu xác định laccase từ chủng BVP 10.2 được tổng hợp cao nhất đạt 190 U/ml sau 4 ngày nuôi cấy với 2% tỷ lệ cấp giống ban đầu; 10 g/l glucose; 1,5 g pepton + 1,5 g (NH4)2SO4; 0,3 mM Veratryl alcohol, nồng độ CuSO4 là 250 µm, pH ban đầu là 6, ở 35 0C, trên máy lắc với 200 vòng/phút. Trong điều kiện môi trường tối ưu (môi trường MT6 với glucose 1,4%; Veratryl alcohol 0,04%, pH 6), enzyme được tích lũy trong canh trường đạt 296 U/ml, tốc độ sinh trưởng đạt 17,5 g/l ở ngày thứ 7 nuôi cấy và pH duy trì ổn định ở mức 6 – 6,1. TÀI LIỆU THAM KHẢO 1. Hoàng Đình Hòa (1999). Tối ưu hóa trong công nghiệp thực phẩm. NXB Khoa học và kỹ thuật, Hà Nội. 2. Afreen, S; Bano, F; Ahmad, N; Fatma, T (2017). Screening and optimization of laccase from cyanobacteria with its potential in decolorization of anthraquinonic dye Remazol Brilliant Blue R. Biocatalysis and Agricultural Biotechnology. 10, pp. 403 - 410. 3. Arora, D. S. & Gill, P. K. (2000). Laccase production by some white rot fungi under different nutritional conditions. Bioresource Technol, 73: 283 - 285. 4. Camarero, S., O. García, T. Vidal, J. Colom, J. C. d. Río, A. Gutiérrez, J. M. Gras, R. Monje, M. J. Martínez and Á. T. Martíınez (2004). Efficient bleaching of non-wood high - quality paper pulp using laccase - mediator system. Enzyme and Microbial Technology. 35, pp. 113 - 120. 5. Claus, H. (2003). Laccases: structure, reactions, distribution. 13th International Conference on Invertebrate Dioxygen Binding Proteins. Mainz, Germany Pergamon - Elsevier Science Ltd. Pp. 6. Gorman, M. J., N. T. Dittmer, J. L. Marshall and M. R. Kanost (2008). Characterization of the multicopper oxidase gene family in Anopheles gambiae". Insect Biochemistry and Molecular Biology. 38, pp. 817 - 824. KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 10/2020 84 7. Janusz, G., J. Rogalski, M. Barwińska and J. Szczodrak (2006). Effects of culture conditions on production of extracellular laccase by Rhizoctonia praticola. Pol J Microbiol. 55 (4), pp. 309 - 319. 8. Jung, H. C., F. Xu and K. C. Li (2002). Purification and characterization of laccase from wood-degrading fungus Trichophyton rubrum LKY- 7. Enzyme and Microbial Technology. 30, pp. 161- 168. 9. Mcneil, B. and L. M. Harvey (2008). Practical Fermentation Technology, Strathclyde Fermentation Centre, Strathclyde University, UK. 10. Shleev, S. V., O. Morozova, O. Nikitina, E. S. Gorshina, T. Rusinova, V. A. Serezhenkov, D. S. Burbaev, I. G. Gazaryan and A. I. Yaropolov (2004). Comparison of physico-chemical characteristics of four laccases from different basidiomycetes. Biochimie. 86, pp. 693-703. 11. Yoshida, H. (1883). Chemistry of lacquer (urushi). Journal Chemical Soccien. 43, pp. 472 -486. ISOLATION, EFFECTS OF CULTURE CONDITION AND OPTIMIZATION OF LACCASE FROM FUNGUS BVP 10.2 Nguyen Thi Phuong Mai, Nguyen Tuan Anh, Bui Nguyen Minh Thu Summary Enzyme laccase has the ability to catalyze the conversion of phenol compounds and oxidize them to quinones, the oxidation reaction associated with the reduction of oxygen molecules to form water. Syringaldazine and ABTS were use as substrates for screeing the highest laccase enzyme activity of 85.5 U/ml after 5 days of culture. The highest enzyme laccase reached 190 U/ml in the culture conditions with 2% of the initial seeding rate; 10 g/l glucose; 1.5 g pepton + 1.5 g (NH4)2SO4; 0.3 mM Veratryl alcohol, 250 µm CuSO4, pH 6 on shaker at 35 0C with shaking speed 200 rpm. The optimization studies revealed that the laccase yield was highes 296 U/mL when operated at the following conditions: after 7 days of incubation at 200 rpm, pH 6.0, 1.4% glucose, 0.04% Veratryl alcohol in the production medium. Keywords: Enzyme laccase, Isolation, Selection, Culture conditions for laccase, Optimization. Người phản biện: GS.TS. Phạm Văn Toản Ngày nhận bài: 28/8/2020 Ngày thông qua phản biện: 30/9/2020 Ngày duyệt đăng: 7/10/2020
File đính kèm:
 tuyen_chon_xac_dinh_dieu_kien_phu_hop_va_toi_uu_hoa_dieu_kie.pdf
tuyen_chon_xac_dinh_dieu_kien_phu_hop_va_toi_uu_hoa_dieu_kie.pdf

