Tổng hợp và hiệu quả ức chế ăn mòn đồng của muối cộng hợp Benzotriazole-Cyclohexylamine trong dung dịch NaCl
Đồng là kim loại phổ biến thứ năm trong vỏ trái đất, được sử dụng phổ biến
trong các ngành công nghiệp dưới dạng đồng nguyên chất hay đồng hợp kim vì một
số đặc tính hữu ích như khả năng chống ăn mòn khí quyển tốt, độ dẫn điện và dẫn
nhiệt cao, dễ gia công cơ học và dễ uốn [1]. Đồng và các hợp kim của đồng được
ứng dụng rộng rãi trong sản xuất dây, tấm và đường ống dẫn trong các ngành công
nghiệp điện, điện tử, vật liệu xây dựng, thiết bị trao đổi nhiệt và tháp giải nhiệt [2].
Đồng có khả năng chống ăn mòn tương đối tốt trong khí quyển và trong một
số môi trường hóa chất do sự hình thành của một lớp màng oxit thụ động bảo vệ
hoặc lớp sản phẩm ăn mòn không dẫn điện trên bề mặt của nó [3, 4]. Tuy nhiên,
trong những điều kiện môi trường khắc nghiệt khi có oxy và một số anion xâm thực
như ion clorua và sunphat thì sự ăn mòn rỗ có thể xảy ra trên bề mặt đồng [5, 6].
Theo đó, hiệu quả làm việc của các hệ thống được chế tạo từ đồng có thể bị ảnh
hưởng nghiêm trọng bởi sự ăn mòn và sự hình thành các sản phẩm ăn mòn trên bề
mặt của nó [7]. Hình 1 thể hiện sự ăn mòn các chi tiết làm từ đồng bởi môi trường

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5

Trang 6
Trang 7
Trang 8
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Tổng hợp và hiệu quả ức chế ăn mòn đồng của muối cộng hợp Benzotriazole-Cyclohexylamine trong dung dịch NaCl

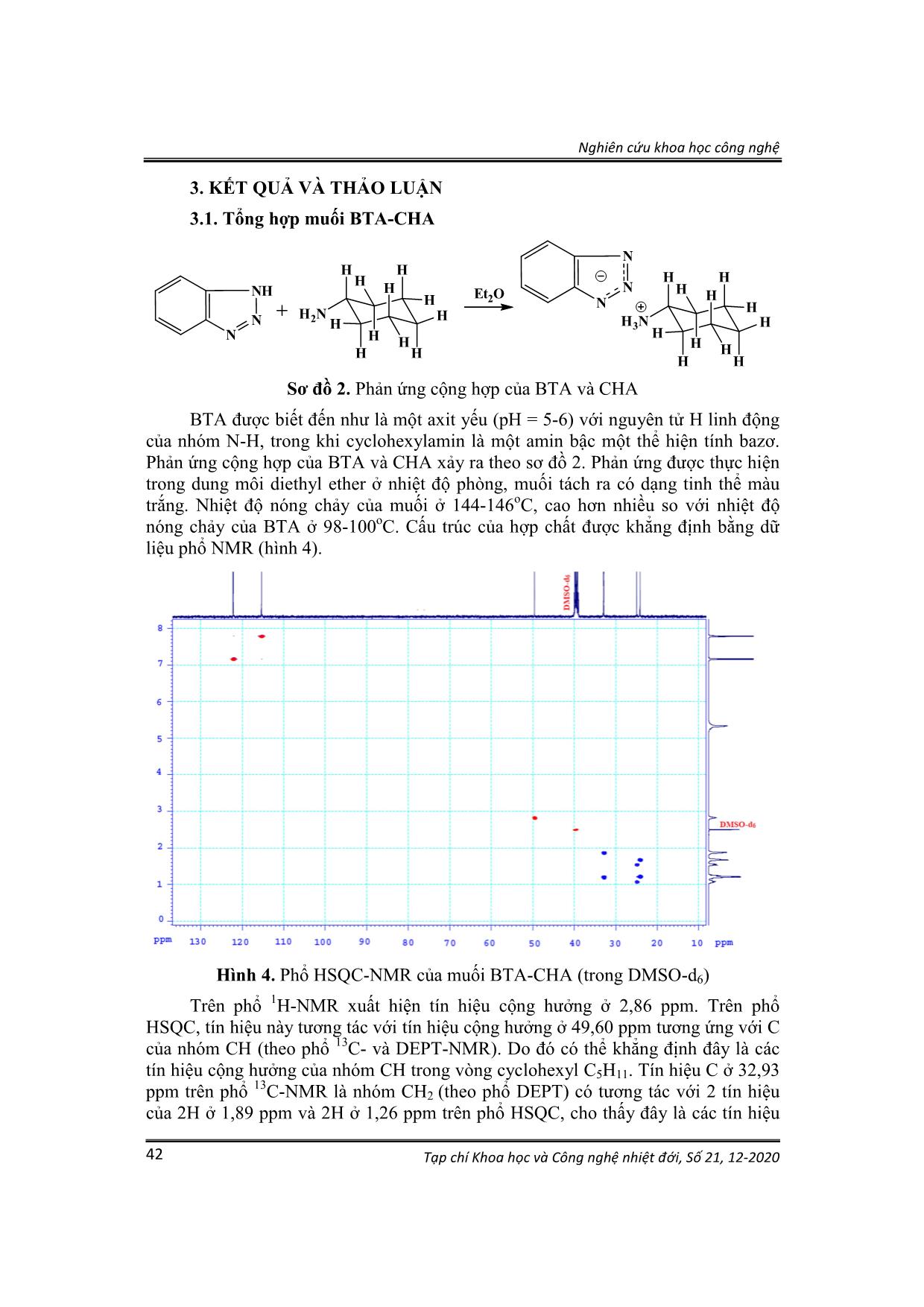
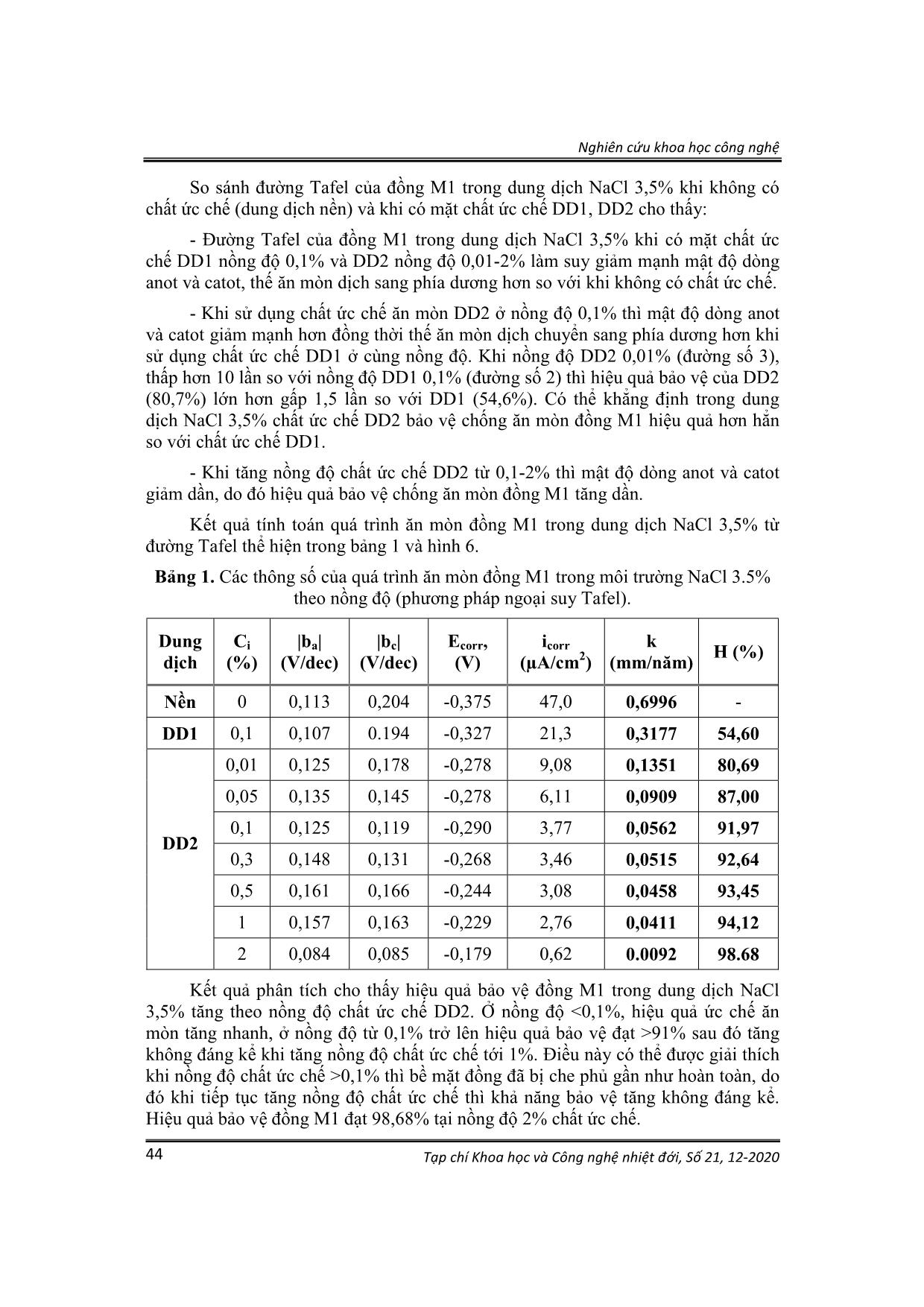
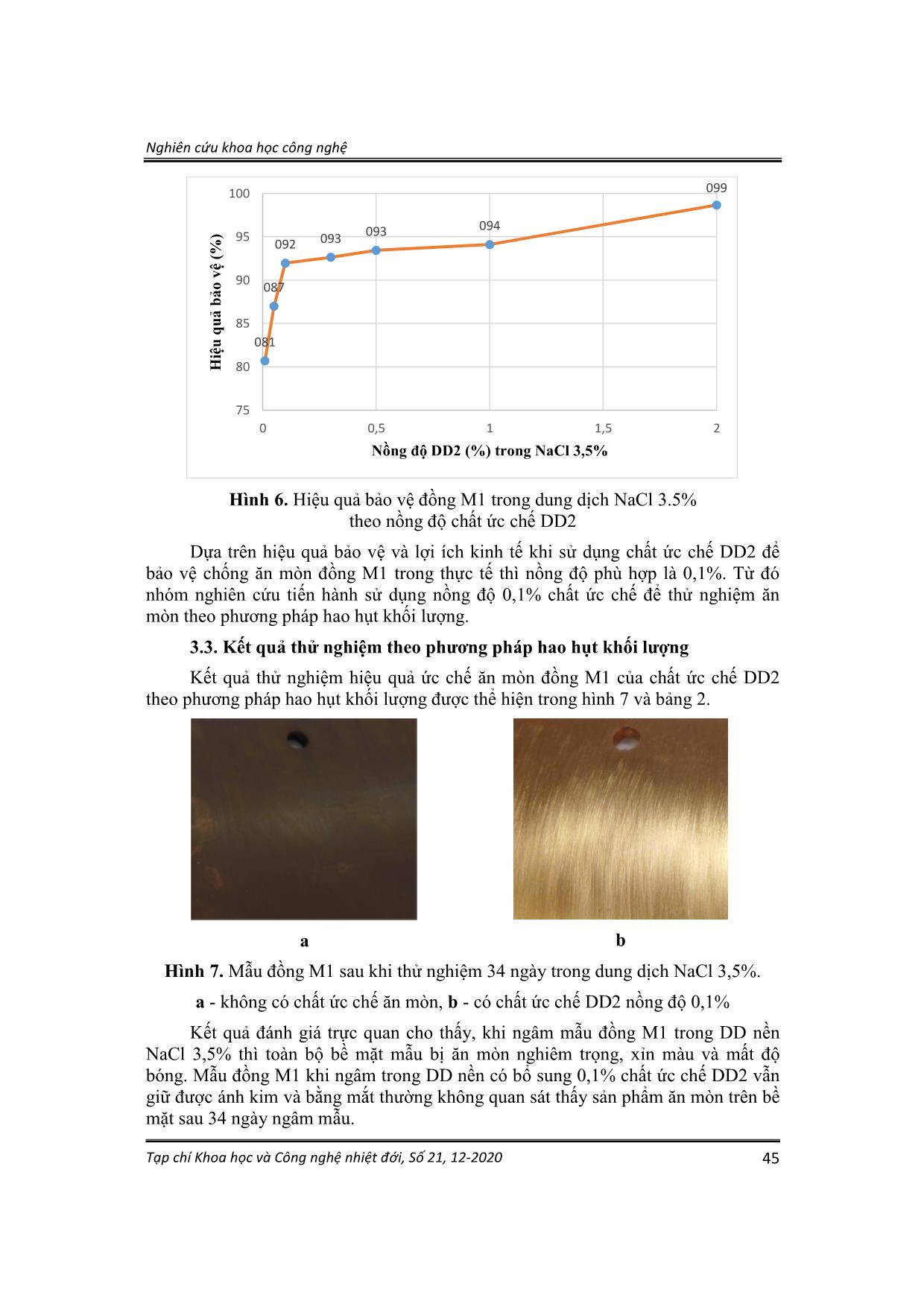
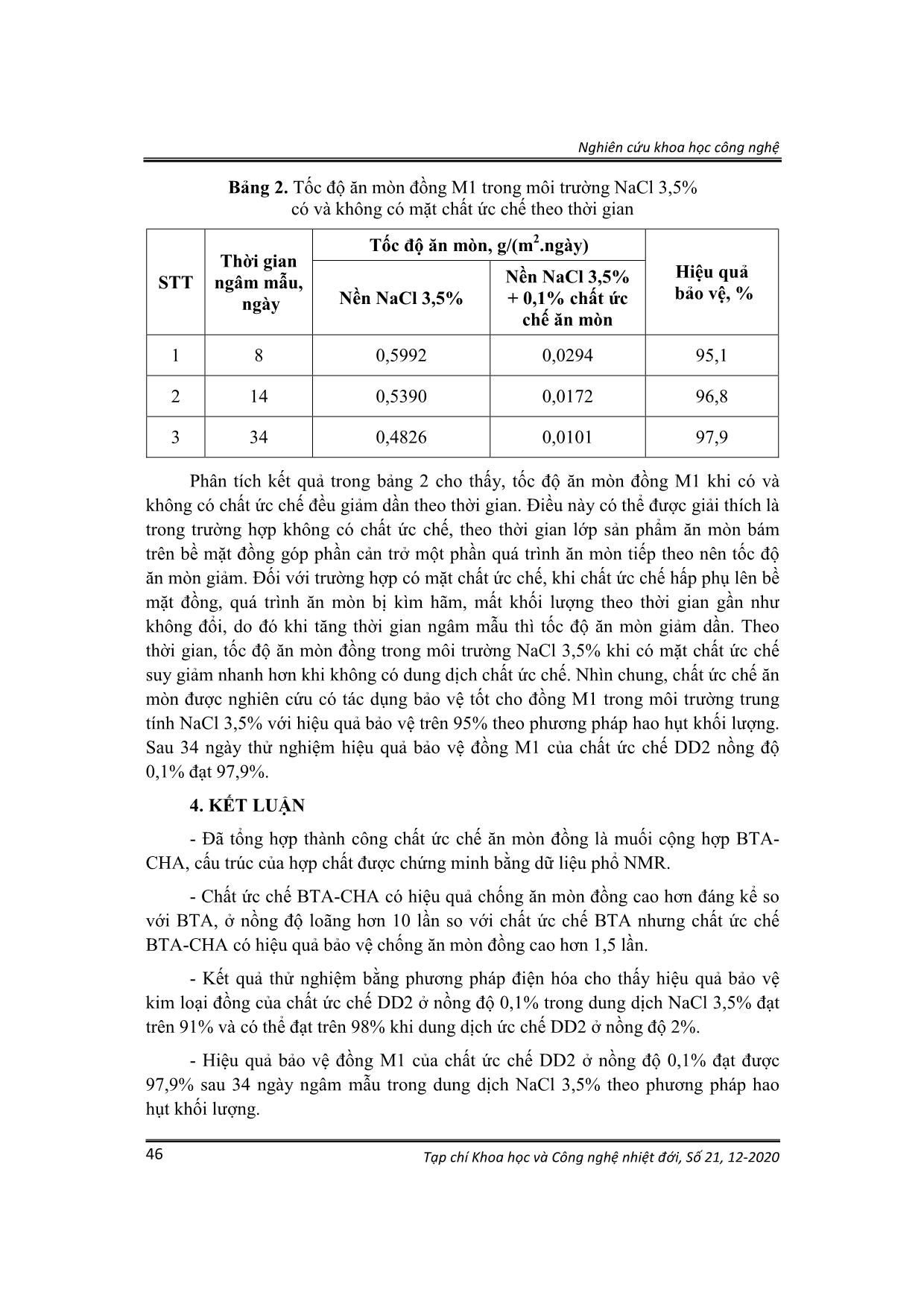
0 (3) Trong đó: v và vo tương ứng với tốc độ ăn mòn khi có và không có chất ức chế, g/(m2.ngày). 2.3. Chuẩn bị mẫu thử nghiệm a) Điều chế muối BTA-CHA Quy trình được tiến hành như sau: Hòa tan hoàn toàn 11,9 g (0,1 mol) BTA với 200 ml diethyl ether trong bình cầu 2 cổ dung tích 500 ml có gắn sinh hàn hồi lưu, sau đó cho từ từ 12 ml (0,11 mol) CHA vào bình phản ứng đồng thời khuấy ở nhiệt độ phòng. Dung dịch ban đầu trong suốt sau đó đóng rắn. Để nguội, lọc rửa bẳng 3x50 ml diethyl ether, thu được chất rắn màu trắng (20,6 g, 95%). Nhiệt độ nóng chảy 144-146oC. Phổ NMR tương ứng với sản phẩm muối cộng hợp của BTA- CHA. Dữ liệu phổ NMR như sau: Phổ 1H-NMR (δ ppm): 7,81 (m, 2H, 2CH(Ar)); 7,19 (m, 2H, 2CH(Ar); 5,35 (s, 3H, NH3+); 2,86 (m, 1H, CH, C5H11), 1,89 (m, 2H (α), C5H11); 1,69 (m, 2H (β), C5H11), 1,57 (m, 1H (γ), C5H11); 1,26 (m, 4H, 2H(α) + 2H(β), C5H11); 1,10 (m, 1H (γ), C5H11). Phổ 13C-NMR: (δ ppm): 142,24 (C, Ar); 122,21 (2CH, Ar); 115,42 (2CH, Ar); 49,60 (CH, C5H11); 32,93 (2CH2(α), C5H11); 24,97 (CH2(γ), C5H11); 24,17 (2CH2(β), C5H11). Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 41 b) Chuẩn bị các dung dịch thử nghiệm ăn mòn - Dung dịch đối chứng là dung dịch NaCl 3,5% (DD nền). - Chất ức chế ăn mòn so sánh là dung dịch chứa 3% BTA trong IPA (DD1), được pha vào dung dịch nền với tỷ lệ 0,1%. - Chất ức chế nghiên cứu là dung dịch chứa 3% BTA-CHA trong IPA (DD2), được pha vào dung dịch nền với tỷ lệ 0,01-2%. c) Chuẩn bị mẫu điện cực làm việc cho phép đo điện hóa Điện cực làm việc là mẫu đồng M1 hình trụ tròn đường kính 15 mm, dày 3 mm, được đặt vào điện cực với bề mặt làm việc có diện tích là 0,785 cm2 (hình 2). Mẫu đồng trước khi tiến hành thử nghiệm được mài bằng giấy nhám có độ nhám từ P160 đến P800, rửa sạch bằng nước cất, cồn và aceton rồi để khô trước khi lắp vào điện cực làm việc và đặt vào hệ điện hóa chứa dung dịch nghiên cứu. Hình 2. Điện cực làm việc d) Chuẩn bị mẫu thử nghiệm theo phương pháp hao hụt khối lượng Mẫu đồng M1 kích thước 50x50x3 mm (hình 3) dùng trong thử nghiệm theo phương pháp hao hụt khối lượng và phân tích bề mặt sau thời gian thử nghiệm. Các mẫu này được mài bằng giấy nhám có độ nhám từ P160 đến P600, rửa sạch bằng nước cất, cồn và aceton, làm khô, ổn định mẫu trong bình hút ẩm 24 giờ trước khi cân và ngâm mẫu. Hình 3. Mẫu thử nghiệm theo phương pháp hao hụt khối lượng Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 42 3. KẾT QUẢ VÀ THẢO LUẬN 3.1. Tổng hợp muối BTA-CHA H3N H H H H H H H H H H N N N N N NH H2N H H H H H H H H H H Et2O H H Sơ đồ 2. Phản ứng cộng hợp của BTA và CHA BTA được biết đến như là một axit yếu (pH = 5-6) với nguyên tử H linh động của nhóm N-H, trong khi cyclohexylamin là một amin bậc một thể hiện tính bazơ. Phản ứng cộng hợp của BTA và CHA xảy ra theo sơ đồ 2. Phản ứng được thực hiện trong dung môi diethyl ether ở nhiệt độ phòng, muối tách ra có dạng tinh thể màu trắng. Nhiệt độ nóng chảy của muối ở 144-146oC, cao hơn nhiều so với nhiệt độ nóng chảy của BTA ở 98-100oC. Cấu trúc của hợp chất được khẳng định bằng dữ liệu phổ NMR (hình 4). Hình 4. Phổ HSQC-NMR của muối BTA-CHA (trong DMSO-d6) Trên phổ 1H-NMR xuất hiện tín hiệu cộng hưởng ở 2,86 ppm. Trên phổ HSQC, tín hiệu này tương tác với tín hiệu cộng hưởng ở 49,60 ppm tương ứng với C của nhóm CH (theo phổ 13C- và DEPT-NMR). Do đó có thể khẳng định đây là các tín hiệu cộng hưởng của nhóm CH trong vòng cyclohexyl C5H11. Tín hiệu C ở 32,93 ppm trên phổ 13C-NMR là nhóm CH2 (theo phổ DEPT) có tương tác với 2 tín hiệu của 2H ở 1,89 ppm và 2H ở 1,26 ppm trên phổ HSQC, cho thấy đây là các tín hiệu Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 43 cộng hưởng của 2 nhóm CH2 ở vị trí α của vòng cyclohexyl. 2H ở vị trí equatorial và ở vị trí axial không đối xứng do đó không tương đương. Tín hiệu cộng hưởng ở 5,33 không tương tác với C trên phổ HSQC cho thấy đây là tín hiệu đặc trưng của 3H linh động của nhóm NH3+ ở dạng muối BTA-CHA. Đồng thời trên phổ 1H-NMR cả hai tín hiệu cộng hưởng của nhóm N-H trong BTA dạng tự do ở 15ppm và nhóm NH2 trong CHA dạng tự do ở 1,4ppm đều không xuất hiện, điều này cho thấy sự chuyển tạo thành muối BTA-CHA xảy ra hoàn toàn. Theo phổ 13C-, DEPT- và HSQC-NMR, tín hiệu cộng hưởng 24,97 ppm là của nhóm CH2, có tương tác với 1H ở 1,57 ppm và 1H ở 1,10 ppm, tương ứng với 1H vị trí equatorial và 1H ở vị trí axial của nhóm CH2 (γ) của Cyclohexyl. Tín hiệu C ở 24,17 ppm (trên phổ 13C-NMR) là nhóm CH2 (theo phổ DEPT). Tín hiệu này tương tác với 2 tín hiệu của 2H ở 1,69 ppm và 2H ở 1,26 ppm cho thấy đây là các tín hiệu cộng hưởng của 2 nhóm CH2 (β) của vòng cyclohexyl. Trên phổ 13C-NMR xuất hiện 3 tín hiệu cộng hưởng của C vùng thơm của vòng BTA ở 142,24 ppm, 122,21 ppm và 115,42 ppm. Tín hiệu 142,24 ppm không xuất hiện trên phổ DEPT và HSQC do đó nó là của C bậc 4. Các tín hiệu ở 122,21 và 115,42 ppm tương ứng với các tín hiệu nhóm CH (Phổ DEPT) vòng benzo của BTA. 3.2. Kết quả thử nghiệm theo phương pháp điện hóa Kết quả thử nghiệm điện hóa được thể hiện trong hình 5 và bảng 1. Hình 5. Đường Tafel của đồng trong dung dịch điện li NaCl 3,5% có và không có mặt chất ức chế 1- DD nền; 2- DD1 0,1%; 3, 4, 5, 6, 7, 8, 9- tương ứng với DD2 0,01%, 0,05%, 0,1%, 0,3%, 0,5%, 1%, 2%. Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 44 So sánh đường Tafel của đồng M1 trong dung dịch NaCl 3,5% khi không có chất ức chế (dung dịch nền) và khi có mặt chất ức chế DD1, DD2 cho thấy: - Đường Tafel của đồng M1 trong dung dịch NaCl 3,5% khi có mặt chất ức chế DD1 nồng độ 0,1% và DD2 nồng độ 0,01-2% làm suy giảm mạnh mật độ dòng anot và catot, thế ăn mòn dịch sang phía dương hơn so với khi không có chất ức chế. - Khi sử dụng chất ức chế ăn mòn DD2 ở nồng độ 0,1% thì mật độ dòng anot và catot giảm mạnh hơn đồng thời thế ăn mòn dịch chuyển sang phía dương hơn khi sử dụng chất ức chế DD1 ở cùng nồng độ. Khi nồng độ DD2 0,01% (đường số 3), thấp hơn 10 lần so với nồng độ DD1 0,1% (đường số 2) thì hiệu quả bảo vệ của DD2 (80,7%) lớn hơn gấp 1,5 lần so với DD1 (54,6%). Có thể khẳng định trong dung dịch NaCl 3,5% chất ức chế DD2 bảo vệ chống ăn mòn đồng M1 hiệu quả hơn hẳn so với chất ức chế DD1. - Khi tăng nồng độ chất ức chế DD2 từ 0,1-2% thì mật độ dòng anot và catot giảm dần, do đó hiệu quả bảo vệ chống ăn mòn đồng M1 tăng dần. Kết quả tính toán quá trình ăn mòn đồng M1 trong dung dịch NaCl 3,5% từ đường Tafel thể hiện trong bảng 1 và hình 6. Bảng 1. Các thông số của quá trình ăn mòn đồng M1 trong môi trường NaCl 3.5% theo nồng độ (phương pháp ngoại suy Tafel). Dung dịch Ci (%) |ba| (V/dec) |bc| (V/dec) Ecorr, (V) icorr (µA/cm2) k (mm/năm) H (%) Nền 0 0,113 0,204 -0,375 47,0 0,6996 - DD1 0,1 0,107 0.194 -0,327 21,3 0,3177 54,60 DD2 0,01 0,125 0,178 -0,278 9,08 0,1351 80,69 0,05 0,135 0,145 -0,278 6,11 0,0909 87,00 0,1 0,125 0,119 -0,290 3,77 0,0562 91,97 0,3 0,148 0,131 -0,268 3,46 0,0515 92,64 0,5 0,161 0,166 -0,244 3,08 0,0458 93,45 1 0,157 0,163 -0,229 2,76 0,0411 94,12 2 0,084 0,085 -0,179 0,62 0.0092 98.68 Kết quả phân tích cho thấy hiệu quả bảo vệ đồng M1 trong dung dịch NaCl 3,5% tăng theo nồng độ chất ức chế DD2. Ở nồng độ <0,1%, hiệu quả ức chế ăn mòn tăng nhanh, ở nồng độ từ 0,1% trở lên hiệu quả bảo vệ đạt >91% sau đó tăng không đáng kể khi tăng nồng độ chất ức chế tới 1%. Điều này có thể được giải thích khi nồng độ chất ức chế >0,1% thì bề mặt đồng đã bị che phủ gần như hoàn toàn, do đó khi tiếp tục tăng nồng độ chất ức chế thì khả năng bảo vệ tăng không đáng kể. Hiệu quả bảo vệ đồng M1 đạt 98,68% tại nồng độ 2% chất ức chế. Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 45 Hình 6. Hiệu quả bảo vệ đồng M1 trong dung dịch NaCl 3.5% theo nồng độ chất ức chế DD2 Dựa trên hiệu quả bảo vệ và lợi ích kinh tế khi sử dụng chất ức chế DD2 để bảo vệ chống ăn mòn đồng M1 trong thực tế thì nồng độ phù hợp là 0,1%. Từ đó nhóm nghiên cứu tiến hành sử dụng nồng độ 0,1% chất ức chế để thử nghiệm ăn mòn theo phương pháp hao hụt khối lượng. 3.3. Kết quả thử nghiệm theo phương pháp hao hụt khối lượng Kết quả thử nghiệm hiệu quả ức chế ăn mòn đồng M1 của chất ức chế DD2 theo phương pháp hao hụt khối lượng được thể hiện trong hình 7 và bảng 2. a b Hình 7. Mẫu đồng M1 sau khi thử nghiệm 34 ngày trong dung dịch NaCl 3,5%. a - không có chất ức chế ăn mòn, b - có chất ức chế DD2 nồng độ 0,1% Kết quả đánh giá trực quan cho thấy, khi ngâm mẫu đồng M1 trong DD nền NaCl 3,5% thì toàn bộ bề mặt mẫu bị ăn mòn nghiêm trọng, xỉn màu và mất độ bóng. Mẫu đồng M1 khi ngâm trong DD nền có bổ sung 0,1% chất ức chế DD2 vẫn giữ được ánh kim và bằng mắt thường không quan sát thấy sản phẩm ăn mòn trên bề mặt sau 34 ngày ngâm mẫu. 081 087 092 093 093 094 099 75 80 85 90 95 100 0 0,5 1 1,5 2 H iệ u qu ả bả o vệ (% ) Nồng độ DD2 (%) trong NaCl 3,5% Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 46 Bảng 2. Tốc độ ăn mòn đồng M1 trong môi trường NaCl 3,5% có và không có mặt chất ức chế theo thời gian STT Thời gian ngâm mẫu, ngày Tốc độ ăn mòn, g/(m2.ngày) Hiệu quả bảo vệ, % Nền NaCl 3,5% Nền NaCl 3,5% + 0,1% chất ức chế ăn mòn 1 8 0,5992 0,0294 95,1 2 14 0,5390 0,0172 96,8 3 34 0,4826 0,0101 97,9 Phân tích kết quả trong bảng 2 cho thấy, tốc độ ăn mòn đồng M1 khi có và không có chất ức chế đều giảm dần theo thời gian. Điều này có thể được giải thích là trong trường hợp không có chất ức chế, theo thời gian lớp sản phẩm ăn mòn bám trên bề mặt đồng góp phần cản trở một phần quá trình ăn mòn tiếp theo nên tốc độ ăn mòn giảm. Đối với trường hợp có mặt chất ức chế, khi chất ức chế hấp phụ lên bề mặt đồng, quá trình ăn mòn bị kìm hãm, mất khối lượng theo thời gian gần như không đổi, do đó khi tăng thời gian ngâm mẫu thì tốc độ ăn mòn giảm dần. Theo thời gian, tốc độ ăn mòn đồng trong môi trường NaCl 3,5% khi có mặt chất ức chế suy giảm nhanh hơn khi không có dung dịch chất ức chế. Nhìn chung, chất ức chế ăn mòn được nghiên cứu có tác dụng bảo vệ tốt cho đồng M1 trong môi trường trung tính NaCl 3,5% với hiệu quả bảo vệ trên 95% theo phương pháp hao hụt khối lượng. Sau 34 ngày thử nghiệm hiệu quả bảo vệ đồng M1 của chất ức chế DD2 nồng độ 0,1% đạt 97,9%. 4. KẾT LUẬN - Đã tổng hợp thành công chất ức chế ăn mòn đồng là muối cộng hợp BTA- CHA, cấu trúc của hợp chất được chứng minh bằng dữ liệu phổ NMR. - Chất ức chế BTA-CHA có hiệu quả chống ăn mòn đồng cao hơn đáng kể so với BTA, ở nồng độ loãng hơn 10 lần so với chất ức chế BTA nhưng chất ức chế BTA-CHA có hiệu quả bảo vệ chống ăn mòn đồng cao hơn 1,5 lần. - Kết quả thử nghiệm bằng phương pháp điện hóa cho thấy hiệu quả bảo vệ kim loại đồng của chất ức chế DD2 ở nồng độ 0,1% trong dung dịch NaCl 3,5% đạt trên 91% và có thể đạt trên 98% khi dung dịch ức chế DD2 ở nồng độ 2%. - Hiệu quả bảo vệ đồng M1 của chất ức chế DD2 ở nồng độ 0,1% đạt được 97,9% sau 34 ngày ngâm mẫu trong dung dịch NaCl 3,5% theo phương pháp hao hụt khối lượng. Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 47 TÀI LIỆU THAM KHẢO 1. Amin M.A., Khaled K., Copper corrosion inhibition in O2-saturated H2SO4 solutions, Corrosion Science, 2010, 52: 1194-1204. 2. Duran B., Bereket G., Duran, M., Electrochemical synthesis and characterization of poly(m-phenylenediamine) films on copper for corrosion protection, Progress in Organic Coatings, 2012, 73:162-168. 3. Adeloju S., Hughes H., The corrosion of copper pipes in high chloride-low carbonate mains water, Corrosion science, 1986, 26:851-870. 4. Suter T., Moser E., Bohni H., The characterization of the tarnishing of Cu- 15Ni-8Sn and Cu-5Al-5Sn alloys, Corrosion science, 1993, 34:1111-1122. 5. Habib K., In-situ monitoring of pitting corrosion of copper alloys by holographic interferometry, Corrosion science, 1998, 40:1435-1440. 6. Souto R., Sanchez M.P., Barrera M., Gonzalez S., Salvarezza R., Arvia A., The kinetics of pitting corrosion of copper in alkaline solutions containing sodium perchlorate, Electrochimica Acta, 1992, 37:1437-1443. 7. Attia A.A., Elmelegy E.M., El-Batouti M., Ahmed A.M.M., Anodic Corrosion inhibition in presence of protic solvents, Asian Journal of Chemistry, 2016, 28:267-272. 8. Quartarone G., Battilana M., Bonaldo L., Tortato T., Investigation of the inhibition effect of indole-3-carboxylic acid on the copper corrosion in 0.5M H2SO4, Corrosion Science, 2008, 50: 3467-3474. 9. Hollander O., May R.C. The chemistry of azole copper corrosion inhibitors in cooling waters, Corrosion, 1985, 41:39-45. 10. Da Costa S.L., Rubim J.C., Agostinho, S.M., Spectroelectrochemical study of the corrosion of a copper electrode in deaerated 1.0 M HCl solutions containing Fe (III): effect of the corrosion inhibitor benzotriazole, Journal of electroanalytical chemistry and interfacial electrochemistry, 1987, 220:259- 268. 11. Wu Y., Zhang P., Pickering H., Allara D., Effect of KI on improving copper corrosion inhibition efficiency of benzotriazole in sulfuric acid electrolytes, Journal of the Electrochemical Society, 1993, 40:2791-2800. 12. ГОСТ 9.907-2007, Металлы, сплавы, покрытия металлические, Методы удаления продуктов коррозии после коррозионных испытаний. Nghiên cứu khoa học công nghệ Tạp chí Khoa học và Công nghệ nhiệt đới, Số 21, 12-2020 48 SUMMARY SYNTHESIS AND CORROSION INHIBITION EFFECT OF BENZOTRIAZOLE CYCLOHEXYLAMINE COMBINED SALT ON COPPER M1 IN NaCl SOLUTION This paper presents the corrosion inhibition effect of benzotriazole cyclohexylamine salt (BTA-CHA) dissolving in isopropanol (IPA) (3 wt %) on copper M1 in 3.5% NaCl solution. Electrochemical test results showed that BTA- CHA salt in IPA had better inhibition effect on copper M1 in 3.5% NaCl solution than free BTA in IPA. The protection effect on copper M1 in 3.5% NaCl solution increased gradually with increasing inhibitor concentration and reached over 92% at concentrations of ≥ 0.1% and 98.68% at concentrations of 2%. The protection effect determined according to the weight loss method on copper M1 of 0,1% inhibitor was 97.9% after 34 days of soaking the sample in 3.5% NaCl solution. Keywords: Corrosion inhibitor, benzotriazole, cyclohexylamine, copper M1, neutral invenronment, chất ức chế ăn mòn, đồng M1, môi trường trung tính. Nhận bài ngày 07 tháng 10 năm 2020 Phản biện xong ngày 12 tháng 10 năm 2020 Hoàn thiện ngày 14 tháng 10 năm 2020 (1) Chi nhánh Phía Nam, Trung tâm Nhiệt đới Việt - Nga
File đính kèm:
 tong_hop_va_hieu_qua_uc_che_an_mon_dong_cua_muoi_cong_hop_be.pdf
tong_hop_va_hieu_qua_uc_che_an_mon_dong_cua_muoi_cong_hop_be.pdf

