Bài tập ôn thi THPT Quốc gia môn Hóa học (Phần 2) - Dương Tiến Tài
Câu 1: Công thức tổng quát của amin no, đơn chức, mạch hở là
A. CnH2n+3N (n 1). B. CnH2n-1N (n 1).
C. CnH2n+1N (n 1). D. CnH2n+2N (n 1).
Câu 2: Phản ứng hóa học nào sau đây là sai?
A. 2Cu + O2 t0 2CuO. B. 3Fe + 2O2 t0 Fe3O4.
C. 4Ag + O2 t0 2Ag2O. D. 2Na + O2 Na2O2.
Câu 3: Cho dãy các chất: glucozơ; glixerol (C3H5(OH)3); anilin; saccarozơ; etylfomat; phenyl amoniclorua
(C6H5NH3Cl); tinh bột. Số chất trong dãy làm mất màu dung dịch nước brom là
A. 2. B. 3. C. 4. D. 5.

Trang 1

Trang 2

Trang 3

Trang 4
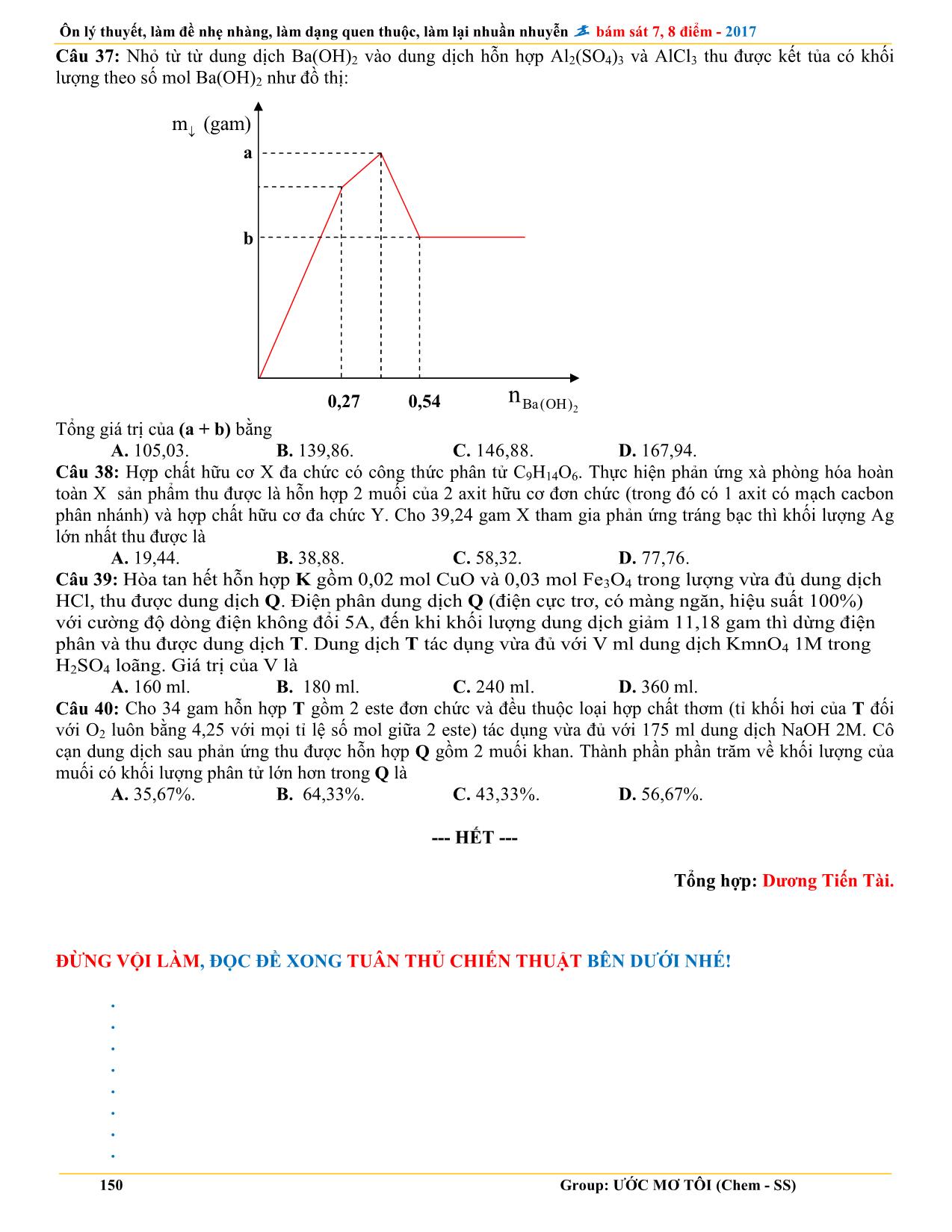
Trang 5

Trang 6

Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài tập ôn thi THPT Quốc gia môn Hóa học (Phần 2) - Dương Tiến Tài", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài tập ôn thi THPT Quốc gia môn Hóa học (Phần 2) - Dương Tiến Tài

a 22,92 gam muối. Amin X là A. H2NCH2CH2CH2NH2. B. H2NCH2CH2NH2.C. CH3CH2NHCH3. D. CH3CH2CH2NH2.Câu 3: Cho 29,4 gam axit glutamic tác dụng với dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, khối lượng muối thu được là A. 44,0 gam. B. 36,7 gam. C. 36,5 gam. D. 43,6 gam. Câu 4: Cho 0,2 mol hỗn hợp etylamin và đimetylamin tác dụng với dung dịch HNO3 loãng dư, thu được m gammuối. Giá trị của m là A. 21,6. B. 16,1. C. 16,3. D. 21,4. Câu 5: Cho 0,2 mol trimetyl amin vào dung dịch HCl loãng dư, được m gam muối. Giá trị của m là A. 13,5. B. 19,1. C. 16,3. D. 21,9. Câu 6: Cho 21,36 gam alanin tác dụng với 200 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng, thu được m gam rắn. Giá trị của m là A. 25,76 gam. B. 29,36 gam. C. 22,20 gam. D. 25,04 gam. Câu 7: Cho 10,14 gam muối mononatri glutamat tác dụng tối đa với dd HCl chứa a mol HCl. Giá trị của a là A. 0,09. B. 0,12. C. 0,06. D. 0,18. Câu 8: Đốt cháy hoàn toàn 6,18 gam hỗn hợp gồm hai amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng cần dùng 0,555 mol O2, thu được CO2, H2O và N2. Công thức của amin có khối lượng phân tử nhỏ làA. CH5N. B. C3H9N. C. C2H7N. D. C4H11N.Câu 9: Đun nóng 0,1 mol hỗn hợp X gồm tripeptit X và pentapeptit Y (đều mạch hở) cần dùng 360 ml dung dịch NaOH 1M, thu được 38,0 gam hỗn hợp gồm ba muối của glyxin, alanin và valin. Số nguyên tử hiđro (H) trong pentapeptit Y là A. 31. B. 27. C. 25. D. 29. Câu 10: Cho 0,2 mol - amino axit X tác dụng vừa đủ với 200 ml dung dịch NaOH 1M, thu được dung dịch X. Cho dung dịch HCl dư vào X, cô cạn dung dịch sau phản ứng, thu được 42,4 gam muối. Tên gọi của X là A. Glyxin. B. Alanin. C. Lysin. D. Valin. Câu 11: Cho 0,2 mol amino axit X tác dụng vừa đủ với 200 ml dung dịch HCl 1M, thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 400 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng, thu được 36,7 gam muối. Công thức phân tử của X là A. C2H5O2N. B. C3H7O2N. C. C4H9O2N. D. C5H11O2N.Câu 12: Hợp chất hữu cơ X có công thức C3H9O3N. Cho X phản ứng với dung dịch NaOH dư, đun nóng, thuđược muối Y và khí Z (có khả năng làm xanh quỳ tím ẩm). Trộn Z với trimetylamin theo tỉ lệ mol 1:1 thu được hỗn hợp khí T có tỉ khối so với He bằng 11,25. Nhận định nào sau đây là đúng? A. Chất X có công thức cấu tạo thu gọn là HO-CH2-COONH3CH3.B. Khí Z có công thức là C2H5NH2.C.Muối Y có công thức cấu tạo thu gọn là CH3-CH(OH)-COONa.D.Muối Y là hợp chất vô cơ. Câu 13: Khi thủy phân tripeptit: H2N-CH(CH3)CO-NH-CH2-CO-NH-CH2-COOH sẽ tạo ra các - a.a nào?A. H2NCH2COOH, CH3CH(NH2)COOH.B. H2NCH2CH(CH3)COOH, H2NCH2COOH.C. CH3CH(NH2)CH2COOH, H2NCH2COOH.D. H2NCH(CH3)COOH, H2NCH(NH2)COOH.Câu 14: Polime X tạo từ phản ứng trùng ngưng H2N-(CH2)5-COOH có phân tử khối bằng 282500.Số mắt xích X là A. 2973. B. 2200. C. 2500. D. 2156. Câu 15: Khi thủy phân tetrapeptit X (Gly-Ala-Val-Ala) thì thu được tối đa bao nhiêu sản phẩm chứa gốc valin mà dung dịch của nó có phản ứng màu biure? A. 1. B. 3. C. 4. D. 2. Ôn lý thuyết, làm đề nhẹ nhàng, làm dạng quen thuộc, làm lại nhuần nhuyễn bám sát 7, 8 điểm - 2017 286 Group: ƯỚC MƠ TÔI (Chem - SS) Câu 16: Pentapeptit X mạch hở được tạo bởi từ glyxin và valin có khối lượng phân tử là 471 đvC. Thủy phân hoàn toàn X, thu được x mol glyxin và y mol valin. Tỉ lệ x : y là A. 3:2. B. 1:4. C. 2:3. D. 4:1. Câu 17: Đốt cháy hoàn toàn 0,2 mol hỗn hợp X gồm glyxin và lysin bằng lượng oxi vừa đủ, thu được CO2,H2O và N2; trong đó CO2 và H2O hơn kém nhau 0,16 mol. Mặt khác lấy 35,28 gam X trên tác dụng với dungdịch HNO3 dư, thu được x gam muối. Giá trị của x làA. 61,74. B. 63,63. C. 67,41. D. 65,52. Câu 18: Thủy phân hoàn toàn m gam tripeptit mạch hở X với dung dịch NaOH vừa đủ, thu được 62,46 gam hỗn hợp gồm ba muối của glyxin, alanin và valin. Giá trị của m là A. 40,86. B. 50,58. C. 47,34. D. 44,10. Câu 19: Peptit T được tạo từ các - aminoaxit trong phân tử chỉ chứa 1 nhóm –NH2 và 1 nhóm –COOH. Chom gam T phản ứng vừa đủ với 36 gam dung dịch KOH 28% thu được 71,532 gam muối. Giá trị của m là A. 50,8. B. 64,044. C. 62,1. D. 64,692. Câu 20: Khi thủy phân hoàn toàn 0,1 mol peptit X mạch hở (X tạo bởi các amino axit có 1 nhóm amino và 1 nhóm cacboxyl) bằng một lượng dung dịch NaOH gấp đôi lượng cần phản ứng, cô cạn dung dịch thu được hỗn hợp chất rắn tăng so với khối lượng X là 78,2 gam. Số liên kết peptit trong X là A. 9. B. 10. C. 18. D. 20. --- HẾT NGÀY THỨ 13 --- Đáp án tham khảo nội dung 4. Ôn nhanh bài tập Amin, aminoaxit, peptit (20 phút) Ghi chú: Nếu làm quá thời gian 20 phút, làm sai, yêu cầu làm lại. Bao giờ đạt 20 phút thì Ok. 1D 2D 3B 4A 5B 6A 7B 8B 9B 10D 11C 12A 13A 14C 15D 16B 17D 18D 19C 20A Nguồn câu hỏi ngày về đích 13 tham khảo từ thầy Nguyễn Minh Tuấn và trong bộ 36 đề của thầy Tào Mạnh Đức. Chân thành cảm ơn các thầy! Dương Tiến Tài (Gv. THPT Sáng Sơn - Vĩnh Phúc) - https://www.facebook.com/Neil.ping - Sưu tầm và biên soạn Kẻ nào chưa từng mắc phải lỗi lầm cũng là kẻ chưa bao giờ thử làm việc gì cả! 287 Vấn đề 1: Este Định nghĩa Chức este: -COO- ; số O trong este chẵn và 2). Tổng quát đơn chức: RCOOR’ (R’ H). Este no đơn chức: CnH2nO2. Este không no, đơn chức từ 2 axit không no không thể quên: Axit acrylic: CH2=CH-COOH và Axit metacrylic: CH2=C(CH3)-COOH. Este hai chức tạo từ axit 2 chức hoặc ancol hai chức không thể quên: Axit oxalic: HOOC-COOH; Etylen glicol: C2H4(OH)2Propan-1,2- điol: HO-CH2-CH(OH)-CH3; Propan-1,3-điol: HO-CH2-CH2-CH2-OH. Este tạo từ glixerol (C3H5(OH)3) và axit béo được gọi chất béo; tên chung là: triglixerit hay triaxylglixerol. Axit béo: mạch C thẳng và tổng số C chẵn; cần nhớ 3 axit béo SGK? Este có mùi thơm Mùi hoa nhài: CH3COOCH2C6H5 (bezyl axetat). Mùi chuối chín: CH3COOCH2CH2CH(CH3)2 (isoamyl axetat). Phản ứng đặc biệt RCOOCH=CHR’ + H2O 0H , t RCOOH + R’CH2-CHO RCOOC6H4R’ + 2NaOH 0t RCOONa + R’C6H4ONa + H2O Chất béo lỏng (không no) + H2 0Ni, t chất béo rắn (no) HCOOR có khả năng tráng bạc và làm mất màu nước brom. So sánh cần nhớ Nhiệt độ sôi và độ tan trong nước (cùng số C hoặc KLPT xấp xỉ nhau) của: muối > axit > ancol > amin > este CH3COONa > CH3COOH > C2H5OH > C2H5NH2 > CH3COOCH3. Tránh nhầm lẫn Dầu ăn và dầu mỡ bôi trơn có cùng thành phần nguyên tố sai. Vấn đề 2: Cacbohiđrat Định nghĩa Nhớ: Công thức chung nhóm cacbohiđrat hay gluxit: Cn(H2O)m; luôn có chức –OH trong phân tử. Bao gồm: monosaccarit, đisaccarit, polisaccarit. Khi đốt cháy: Cn(H2O)m + nO2 nCO2 + mH2O; nhận thấy nO2 pư = nCO2. Khả năng thủy phân Monosaccarit không bị thủy phân; đi và polisaccarit bị thủy phân trong môi trường axit. So sánh cần nhớ Độ ngọt: F > S > G; vỏ bánh mì > ruột bánh mì. Tránh nhầm lẫn Tinh bột và xenlulozơ không phải đồng phân của nhau. Amilozơ và Amilopectin không phải đồng phân của nhau. Amilozơ chỉ có liên kết -1,4 glicozit. Amilopectin gồm có liên kết -1,4 glicozit và -1,6 glicozit. Xenlulozơ mạch thẳng (không nhánh, không xoắn) chỉ có liên kết -1,4 glicozit. Nhớ tiện thể về polime: amilopectin trong tinh bột và glicozen trong gan động vật ở dạng mạch nhánh. Đisaccarit và polisaccarit bị thủy phân trong môi trường bazơ sai môi trường axit. 19.6.2017 HÓA HỌC - 14 NGÀY ĐÍCH 8 ĐIỂM Ngày thứ 14: Tổng duyệt kiến thức và những sai lầm cần tránh Hãy giữ tâm lý ổn định, sắp xếp mọi thứ cho gọn gàng, chắc chắn để lên đường nhé! Ôn lý thuyết, làm đề nhẹ nhàng, làm dạng quen thuộc, làm lại nhuần nhuyễn bám sát 7, 8 điểm - 2017 288 Group: ƯỚC MƠ TÔI (Chem - SS) Vấn đề 3: Hợp chất hữu cơ chứa N Định nghĩa Amin = khi thay thế H trong NH3 bởi gốc hiđrocacbon. Aminoaxit là hợp chất hữu cơ tạp chức trong phân tử có –NH2 và –COOH. Liên kết –CO-NH- gọi chung là liên kết amit; nếu tạo từ bởi các -aminoaxit thì gọi là liên kết peptit. Từ 2 10 gốc - a.a oligopeptit; từ 11 50 polipeptit; từ 51 protein. So sánh cần nhớ Tính bazơ: CnH2n+1ONa > NaOH > amin no > NH3 > amin thơm Tính bazơ: amin bậc 2 > bậc 1, bậc 3. Tính bazơ: (CH3)2NH > CH3NH2 > (CH3)3N > NH3 > C6H5NH2 > (C6H5)2NH > (C6H5)3N. Tính bazơ: (CH3CH2)2NH > (CH3CH2)3N > CH3CH2NH2 > NH3. Tránh nhầm lẫn Amin bậc 2, bậc 3 không phản ứng được HCl sai cứ có chức amin thì 1N sẽ có 1HCl phản ứng. Anbumin (lòng trắng trứng) + HNO3 tạo kết tủa vàng. Tinh bột + I2 tạo phức xanh tím (tránh nhầm lẫn màu sắc). Từ tripeptit và protein + Cu(OH)2 tạo phức tím. Aminoaxit và đipeptit + Cu(OH)2 không phản ứng sai có phản ứng nhưng không tạo phức. Vấn đề 4: Polime Phân loại Theo nguồn gốc: Polime thiên nhiên: xuất phát từ tự nhiên. Polime hóa học: gồm polime tổng hợp và polime bán tổng hợp (chế biến một phần từ polime thiên nhiên). Phản ứng đặc biệt Polime có -CO-NH- hoặc có -COO- bị thủy phân trong môi trường axit và bazơ kém bền. Gồm poliamit nói chung (-CO-NH-): nilon -6; nilon-7; nilon-6,6; tơ tằm; len (lông cừu). Gồm polieste (-COO-): tơ lapsan. quần áo làm bằng các loại tơ này kém bền trong xà phòng có độ kiềm cao. Phương pháp điều chế Polime trùng ngưng: gồm 3 nhóm poliamit; polieste; PPF (poli (phenol-fomanđehit)). Polime trùng hợp: chất dẻo (trừ PPF), cao su nói chung, tơ olon (tơ nitron). Tránh nhầm lẫn Mạch không gian: cao su lưu hóa và nhựa bakelit (zenit). Mạch nhánh: có 2 chất amilopectin trong tinh bột và glicozen trong gan động vật ở dạng mạch nhánh. Mạch không phân nhánh: amilozơ, xenlulozơ, các polime còn lại. Cao su thiên nhiên là poilme của isopren chứ không phải là trùng hợp isopren được cao su thiên nhiên. Polime là dẫn xuất vinyl gồm: tơ clorin, tơ olon, tơ polipropilen, ... Tơ clorin: poli (vinylclorua) - (CH2-CH(Cl))n- Tơ olon hay poliacrilonnitrin - (CH2-CH(CN))n- Tơ polipropilen, ... - (CH2-CH(CH3))n- Ứng dụng quan trọng (xem thêm SGK) PVC: vật liệu cách điện, ống nhựa, ống dẫn nước, vải che mưa, ... PE: làm màng mỏng, vật liệu điện, bình chứa, ... PMM: chế tạo thủy tinh hữu cơ. Nilon - 6,6: dệt vải may mặc, vải lót săm lốp xe, dệt bít tất, bện làm dây cáp, dây dù, đan lưới, ... Tơ olon: dệt vải, may quần áo, bện thành sợi “len” đan áo rét. Cao su: có tính đàn hồi làm lốp ôtô, ... Chú ý Nilon -6 vừa được điều chế bằng phương pháp trùng hợp, vừa được điều chế bằng phương pháp trùng ngưng. Dương Tiến Tài (Gv. THPT Sáng Sơn - Vĩnh Phúc) - https://www.facebook.com/Neil.ping - Sưu tầm và biên soạn Kẻ nào chưa từng mắc phải lỗi lầm cũng là kẻ chưa bao giờ thử làm việc gì cả! 289 Vấn đề 5: Kim loại Nhắc lại một số tổng kết ở phần về đích trước 1. Điều chế kim loại: Mn+ + ne M Al: điện phân nóng chảy Al2O3 (trong criolit). Từ Mg trở về trước được điều chế bằng phương pháp điện phân nóng chảy (thường là từ MCln). Sau Al: có thể điều chế bằng phương pháp nhiệt luyện, thủy luyện, điện phân dung dịch. 2. Ăn mòn điện hóa: cần nhớ 3 điều kiện nhé! (xem kĩ SGK hoặc tham khảo phần về đích ngày 5). 3. Khi điện phân dung dịch Thứ tự khử tại catot (cực âm) xảy ra theo thứ tự ưu tiên từ phải qua trái 2H2O + 2e H2 + 2OH Thứ tự oxi hóa tại anot (cực dương) xảy ra theo thứ tự ưu tiên từ trái qua phải 4. Tính khử: .... Al > Cr > Fe > Cu .... Khi cho vào dung dịch muối kim loại khử mạnh hơn pư trước. 5. Phản ứng với axit loại 1: kim loại đứng trước hiđro trong dãy hoạt động. 6. Phản ứng với axit loại 2: hầu hết kim loại trừ Au, Pt. 7. Tính oxi hóa trong dung dịch: (H+, NO3-) > H+ có H2 dung dịch sau phản ứng hết NO3-. 8. Một số bán phản ứng cần nắm (tham khảo 1 cách cân bằng dưới đây nhé): 3 2 3+1 = aâm4 5 2(1) H NO 3e NO 4 3(1N e 1 H O N2 ) 3 2 2 2+8 = aâm 5 10 1(2) H 2NO 8e N O 5 (2N e 28H O N10 ) (3)Một số bán phản ứng khác tạo ra: NO2, N2, NH4NO3 làm tương tự. ( )Một số phương trình cân bằng ion làm hoàn toàn tương tự: theo nguyên tắc cân bằng oxi hóa khử trước, sau đó cân bằng nguyên tố và điện tích 2 vế của phương trình. ( ) Ví dụ: 3Fe2+ + 4H+ + 1NO3- 3Fe3+ + 1NO + 2H2O 9. Dung dịch có HSO4-: có tính axit tương tự axit loại 1 (HSO4- H+ + SO42-). hệ quả: bài tập 2 - SGK.Tr 134: 2Al + 6NaHSO4 Al2(SO4)3 + 3Na2SO4 + 3H2 hệ quả: Cu tan được trong dung dịc hỗn hợp NaNO3 và NaHSO4 3Cu + 8H+ + 2NO3- 3Cu2+ + 2NO + 4H2O K+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ H+ Cu2+ Fe3+ Ag+ ...... Các ion không bị điện phân trong dung dịch Các ion bị điện phân trong dung dịch H2O M S2 I Br Cl OH SO42 , NO3 , ClO4 Các ion bị điện phân trong dung dịch S2- S + 2e 2X X2 + 2e Các ion không bị điện phân trong dung dịch 2H2O O2 + 4H+ + 4e (Anot tan) 4OH O2+ 2H2O + 4eM Mn+ + ne Ôn lý thuyết, làm đề nhẹ nhàng, làm dạng quen thuộc, làm lại nhuần nhuyễn bám sát 7, 8 điểm - 2017 290 Group: ƯỚC MƠ TÔI (Chem - SS) 10. Trong dãy điện hóa từ trái sang phải: tính khử (KL) giảm; tính oxi hóa (ion) tăng. Bài tập kim loại muốn làm tốt hãy nắm chắc ý nghĩa dãy hoạt động hóa học và ý nghĩa dãy điện hóa ngay đi. 11. Ứng dụng ý nghĩa dãy điện hóa: maïnh maïnh yeáu yeáukhöû oxi hoùa oxi hoùa + khöû Ví dụ 1: Cu + Fe3+ Cu2+ + Fe2+ Ví dụ 2: Fe(NO3)2 + AgNO3 Fe(NO3)3 + Ag Tính oxi hóa: Fe3+ > Cu2+ Tính oxi hóa: Ag+ > Fe3+ Tính khử: Cu > Fe2+ Tính khử: Fe2+ > Ag. 12. Bài tập hay khai thác: thường gài bẫy kim loại Cu, Fe và ion Ag+ vào dung dịch có chứa muối sắt. Một số lưu ý quan trọng 1. Ag+, Cu2+, Zn2+, Ni2+, ... tạo phức với NH3 dư không có kết tủa của AgCl, Zn(OH)2, ... trong NH3 dư.2. Al, Fe, Cr thụ động hóa trong HNO3 hoặc H2SO4 đặc nguội.3. Al, Zn tan trong kiềm, nhưng Cr thì không. 4. Giống như Al, đơn chất Cr cũng có lớp màng oxit bảo vệ rất bền vững. 5. Cr không phản ứng ngay với dung dịch HCl, H2SO4 loãng nguội mà phải đun nóng để phá vỡ lớpmàng oxit bảo vệ. 6. S, P, C, C2H5OH bốc cháy khi tiếp xúc với CrO3.7. Nhớ cân bằng: C2O72- + H2O 2CrO42- + 2H+ thêm H+ vào muối CrO42- thì vàng sang da cam. (da cam) (vàng) 8. Màu ngọn lửa của Na+ cho màu vàng; K+ cho màu tím. Phản ứng hay nhầm lẫn FeS2 + HCl (H2SO4 loãng) không phản ứng. Fe3+ + S2- Fe2+ + S Fe3+ + I- Fe2+ + I2 Cr(OH)3 NaOH NaCrO2 2Br /NaOH Na2CrO4 CaCO3 + CO2 + H2O Ca(HCO3)2 2HSO4- + CO32- 2SO42- + CO2 + H2O HSO4- + HCO3- SO42- + CO2 + H2O KHSO4 + BaCl2 BaSO4 + K2SO4 + HCl. Zn + 2Cr3+ Zn2+ + 2Cr2+ Một số chất kém bền trong dung dịch NH4OH 2H O NH3 + H2O H2XO3 2H O XO2 + H2O (X là C, S) MgS + 2H2O Mg(OH)2 + H2S Al2S3 + 6H2O 2Al(OH)3 + 3H2S M2(CO3)3 + 3H2O 2M(OH)3 + 3CO2 (M là Fe, Al) (hoặc muối của SO32- cũng vậy). Ví dụ: 2AlCl3 + 3Na2CO3+ 3H2O 6NaCl + 2Al(OH)3 + 3CO2 hệ quả: muối Al3+ vào dung dịch Na2CO3 sau phản ứng xuất hiện cả kết tủa và khí là đúng. hệ quả: muối Fe3+ vào dung dịch Na2CO3 sau phản ứng xuất hiện cả kết tủa và khí là đúng. Thời gian cuối này hãy đi tổng hợp lý thuyết, làm lại 3 đề của bộ, bấy nhiêu đề đã làm là quá đủ rồi! Bạn nào đang đuối, muốn chống liệt thì cày lý thuyết và làm lại các phần về đích trước đó nhé! Tạm biệt! - Dương Tiến Tài -
File đính kèm:
 bai_tap_on_thi_thpt_quoc_gia_mon_hoa_hoc_phan_2_duong_tien_t.pdf
bai_tap_on_thi_thpt_quoc_gia_mon_hoa_hoc_phan_2_duong_tien_t.pdf

