Tuyển chọn tổ hợp các vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng hại cà phê
Nhằm kiểm soát nấm bệnh, tuyến trùng hại cà phê, đã tập trung nghiên cứu tuyển chọn để xác định tổ hợp
các vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng hại cà phê. Kết quả đã tuyển chọn được 3 chủng vi
sinh vật đối kháng nấm bệnh và 02 chủng vi sinh vật diệt tuyến trùng, xác định tổ hợp các vi sinh vật đối
kháng nấm bệnh, tiêu diệt tuyến trùng có hiệu quả kiểm soát nấm bệnh, diệt tuyến trùng cao hơn các
chủng đơn lẻ và có ảnh hưởng tốt đến sinh trưởng phát triển của cây cà phê. Mật độ các vi sinh vật tuyển
chọn trong điều kiện tổ hợp không khác biệt so với điều kiện đơn chủng. Các chủng nấm ký hiệu TQHT01
và Pae được định danh là Chaetomium cochliodes TQHT01 và Purpureocillium lilacinum Pae thuộc nhóm vi
sinh vật an toàn sinh học cấp độ 1.

Trang 1

Trang 2

Trang 3
Trang 4

Trang 5

Trang 6

Trang 7

Trang 8
Tóm tắt nội dung tài liệu: Tuyển chọn tổ hợp các vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng hại cà phê

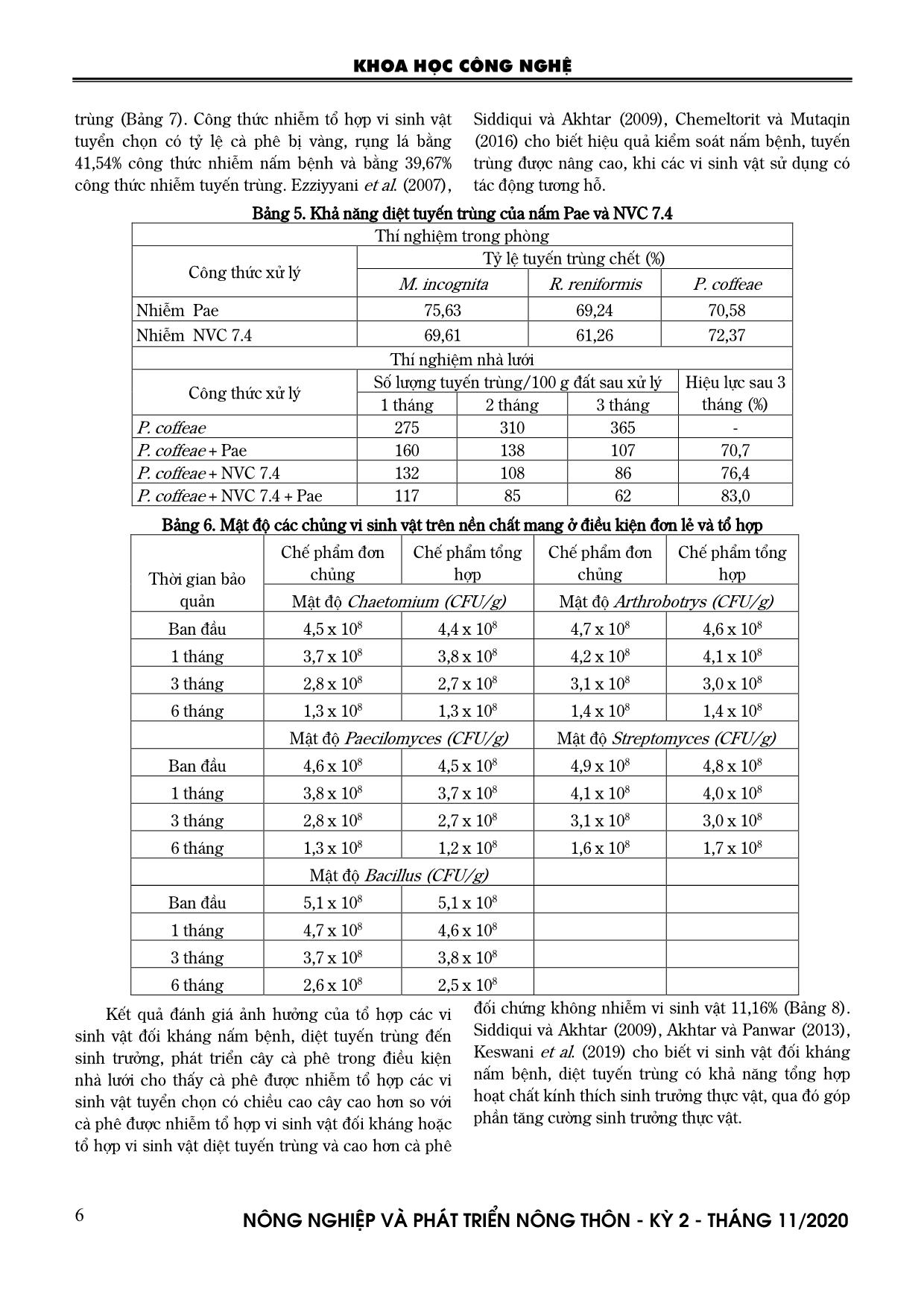
yến trùng Kết quả thử nghiệm nuôi cấy đồng thời các vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng trên đĩa petri xác định các chủng nấm, vi khuẩn, xạ khuẩn không có biểu hiện đối kháng tại các điểm tiếp xúc. Kết quả đánh giá khả năng tương tác của các vi sinh vật tuyển chọn, xác định mật độ các vi sinh vật không có sai khác đáng kể trong điều kiện đơn lẻ và tổ hợp (Bảng 6). Hiệu lực kiểm soát bệnh vàng, rụng lá cà phê của tổ hợp các vi sinh vật cao hơn tổ hợp chỉ gồm vi sinh vật đối kháng hoặc nấm diệt tuyến KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 11/2020 6 trùng (Bảng 7). Công thức nhiễm tổ hợp vi sinh vật tuyển chọn có tỷ lệ cà phê bị vàng, rụng lá bằng 41,54% công thức nhiễm nấm bệnh và bằng 39,67% công thức nhiễm tuyến trùng. Ezziyyani et al. (2007), Siddiqui và Akhtar (2009), Chemeltorit và Mutaqin (2016) cho biết hiệu quả kiểm soát nấm bệnh, tuyến trùng được nâng cao, khi các vi sinh vật sử dụng có tác động tương hỗ. Bảng 5. Khả năng diệt tuyến trùng của nấm Pae và NVC 7.4 Thí nghiệm trong phòng Tỷ lệ tuyến trùng chết (%) Công thức xử lý M. incognita R. reniformis P. coffeae Nhiễm Pae 75,63 69,24 70,58 Nhiễm NVC 7.4 69,61 61,26 72,37 Thí nghiệm nhà lưới Số lượng tuyến trùng/100 g đất sau xử lý Công thức xử lý 1 tháng 2 tháng 3 tháng Hiệu lực sau 3 tháng (%) P. coffeae 275 310 365 - P. coffeae + Pae 160 138 107 70,7 P. coffeae + NVC 7.4 132 108 86 76,4 P. coffeae + NVC 7.4 + Pae 117 85 62 83,0 Bảng 6. Mật độ các chủng vi sinh vật trên nền chất mang ở điều kiện đơn lẻ và tổ hợp Chế phẩm đơn chủng Chế phẩm tổng hợp Chế phẩm đơn chủng Chế phẩm tổng hợp Thời gian bảo quản Mật độ Chaetomium (CFU/g) Mật độ Arthrobotrys (CFU/g) Ban đầu 4,5 x 108 4,4 x 108 4,7 x 108 4,6 x 108 1 tháng 3,7 x 108 3,8 x 108 4,2 x 108 4,1 x 108 3 tháng 2,8 x 108 2,7 x 108 3,1 x 108 3,0 x 108 6 tháng 1,3 x 108 1,3 x 108 1,4 x 108 1,4 x 108 Mật độ Paecilomyces (CFU/g) Mật độ Streptomyces (CFU/g) Ban đầu 4,6 x 108 4,5 x 108 4,9 x 108 4,8 x 108 1 tháng 3,8 x 108 3,7 x 108 4,1 x 108 4,0 x 108 3 tháng 2,8 x 108 2,7 x 108 3,1 x 108 3,0 x 108 6 tháng 1,3 x 108 1,2 x 108 1,6 x 108 1,7 x 108 Mật độ Bacillus (CFU/g) Ban đầu 5,1 x 108 5,1 x 108 1 tháng 4,7 x 108 4,6 x 108 3 tháng 3,7 x 108 3,8 x 108 6 tháng 2,6 x 108 2,5 x 108 Kết quả đánh giá ảnh hưởng của tổ hợp các vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng đến sinh trưởng, phát triển cây cà phê trong điều kiện nhà lưới cho thấy cà phê được nhiễm tổ hợp các vi sinh vật tuyển chọn có chiều cao cây cao hơn so với cà phê được nhiễm tổ hợp vi sinh vật đối kháng hoặc tổ hợp vi sinh vật diệt tuyến trùng và cao hơn cà phê đối chứng không nhiễm vi sinh vật 11,16% (Bảng 8). Siddiqui và Akhtar (2009), Akhtar và Panwar (2013), Keswani et al. (2019) cho biết vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng có khả năng tổng hợp hoạt chất kính thích sinh trưởng thực vật, qua đó góp phần tăng cường sinh trưởng thực vật. KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 11/2020 7 Bảng 7. Khả năng kiểm soát bệnh vàng, rụng lá cà phê của tổ hợp vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng % cây cà phê bị bệnh sau thí nghiệm Công thức thí nghiệm 1 tháng 3 tháng 6 tháng F. oxysporum 27,54 35,26 43,57 P. coffeae 28,67 34,74 44,06 F. oxysporum + P. coffeae + Pae + NVC 7.4 18,36 19,36 20,35 F. oxysporum + P. coffeae + TQHT01+ 2P + P9.1 13,62 14,02 14,36 F. oxysporum + P. coffeae + 2P + P9.1+ TQHT01+ Pae + NVC 7.4 13,15 13,86 14,05 CV (%) 6,4 4,4 2,9 LSD 0,05 0,63 0,77 0,75 Bảng 8. Ảnh hưởng của tổ hợp các vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng đến sinh trưởng phát triển cây cà phê trong điều kiện nhà lưới Chiều cao cây cà phê (cm) sau thí nghiệm Công thức thí nghiệm 1 tháng 2 tháng 3 tháng F. oxysporum 24,90 31,13 36,43 P. coffeae 25,60 32,03 37,46 F. oxysporum + P. coffeae + Pae + NVC 7.4 26,80 33,76 39,97 F. oxysporum + P. coffeae + TQHT01+ 2P + P9.1 31,56 37,07 42,60 F. oxysporum + P. coffeae +2P + P9.1+ TQHT01+ Pae + NVC 7.4 32,27 38,16 43,83 Đối chứng không lây nhiễm 29,96 34,73 39,43 CV (%) 2,6 1,6 1,6 LSD 0,05 1,27 0,97 1,13 3.4. Định danh các chủng vi sinh Bằng kỹ thuật sinh học phân tử, đã xác định trình tự gen rARN vùng ITS và 28S (đoạn D1D2) của chủng TQHT01 tương đồng 99,9% với Chaetomium cochliodes, trình tự gen rARN vùng ITS của chủng Pae tương đồng 99,8% với loài Purpureocillium lilacinum (tên gọi khác: Paecilomyces lilacinus) thuộc nhóm vi sinh vật an toàn sinh học cấp độ 1 theo TRBA 460, 466 của Cộng hòa Liên bang Đức (Hình 1-2). Các chủng vi sinh vật đối kháng nấm bệnh 2P, P9 và chủng nấm bẫy tuyến trùng NVC 7.4 được Hà Minh Thanh và cộng sự (2020) định danh là Bacillus velezensis P9.1, Streptomyces enissocaesilis 2P và Arthrobotrys oligospora NVC7.4. Hình 1. Cây phát sinh dựa trên trình tự gen ARNr của chủng TQHT01 với các loài có quan hệ họ hàng gần Hình 2. Cây phát sinh dựa trên trình tự gen ARNr của chủng Pae với các loài có quan hệ họ hàng gần KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 11/2020 8 4. KẾT LUẬN Các chủng vi khuẩn, xạ khuẩn, nấm đối kháng nấm bệnh ký hiệu P9.1. 2P, TQHT01 tạo vòng đối kháng và kiểm soát > 70% nấm Fusarium oxysporum > 50% nấm Rhizoctonia solani trong điều kiện phòng thí nghiệm. Trong điều kiện nhà lưới các chủng vi khuẩn, xạ khuẩn, nấm đối kháng riêng lẻ có tác dụng hạn chế mật độ nấm bệnh trong đất trồng cà phê và thể hiện hiệu lực kiểm soát nấm bệnh, tỷ lệ cà phê bị vàng, rụng lá tốt hơn khi được tổ hợp cùng nhau. Chủng nấm ký hiệu NVC 7.4 và Pae có khả năng diệt 69,61 - 75,63% Meloidogyne incognita, 61,26 - 69,24% Rotylenchulus reniformis và 70,58 - 72,37% Pratylenchus coffeae trong điều kiện phòng thí nghiệm. Tổ hợp các chủng nấm NVC 7.4 và Pae kiểm soát được 83% mật độ tuyến trùng Pratylenchus coffeae trong đất trồng cà phê trong nhà lưới. Tổ hợp các vi sinh vật đối kháng nấm bệnh, diệt tuyến trùng có tác dụng kiểm soát mật độ tuyến trùng, nấm bệnh hại cà phê cao hơn tổ hợp vi sinh vật đối kháng hoặc tổ hợp nấm diệt tuyến trùng và có tác dụng tích cực đến sinh trưởng, phát triển cây cà phê trong điều kiện nhà lưới. Chủng vi sinh vật đối kháng ký hiệu TQHT01 và vi sinh vật diệt tuyến trùng ký hiệu Pae được định danh là, Chaetomium cochliodes TQHT01 và Purpureocillium lilacinum Pae thuộc nhóm vi sinh vật an toàn sinh học cấp độ 1. TÀI LIỆU THAM KHẢO 1. Ahmad RZ., Sidi BB., Endrawati D., Ekawasti F. and Chaerani (2019). Paecilomyces lilacinus and P.variotii as a predator of nematode and trematode eggs. IOP Conf. Series: Earth and Environmental Science 299(2019) 012056, doi:10.1088/1755- 1315/299/1/012056. 2. Akhtar MS., Panwar J. (2013) Efficacy of root- associated fungi and the growth of Pisum sativum (Arkil) and reproduction of root-knot nematode Meloidogyne incognita. J Basic Microbiol 53:318–326. 3. Azam T., Akhtar MS., Hisamuddin A. (2013) Histological interactions of Paecilomyces lilacinus with root-knot nematodeMeloidogyne incognitaand their effect on the growth of tomato. Adv Sci Eng 5:335–341. 4. Bakr RA., Mahdy ME. and Mousa EM. (2014). Biological control of root knot nematode meloidogyne incognita by Arthrobotrys oligospora. Egyptian Journal of Crop Protection, 9(1), 1-11. 5. Bubici G. (2018). Streptomyces spp. as biocontrol agents against Fusarium species. CAB Reviews 13, No. 050. 6. Burgess LW., Knight TE., Tesoriero L. và Phan Thúy Hiền (2009). Cẩm nang chẩn đoán bệnh cây ở Việt Nam. Trung tâm Nghiên cứu Nông nghiệp Quốc tế Australia – ACIAR, 2009. 7. Chemeltorit P P. and Mutaqin KH. (2016). Combining Trichoderma hamatum THSW13 and Pseudomonas aeruginosa BJ10-86: A synergistic chili pepper seed treatment for Phytophthora capsici infested soil. European Journal of Plant Pathology, 2016, 1-10. https://doi.org/10.1007/s10658-016-0988- 5. 8. Ezziyyani M., Requena ME., Egea-Gilabert C., Candela ME. (2007). Biological control of phytophthora root rot of pepper using Trichoderma harzianum and Streptomyces rochei in Combination. J Phytopathol. junho de 155(6):342–349. 9. Nguyễn Viết Hiệp, Nguyễn Thu Hà (2014). Nghiên cứu khả năng bẫy tuyến trùng của một số chủng nấm vòng được phân lập từ đất trồng cà phê và hồ tiêu tại Việt Nam. Tạp chí Khoa học và Công nghệ Nông nghiệp Việt Nam, số 4(50), tr. 90 - 96. 10. Nguyen Viet Hiep, Nguyen Thu Ha, Tran Thi Thanh Thuy and Pham Van Toan (2019). Isolation and selection of Arthrobotrys nematophagous fungi to control the nematodes on coffee and black pepper plants in Vietnam. Archives of Phytopathology and Plant Protection Volume 52 Numbers 7–8 2019, 825- 843. 11. Keswani C., Singh HB., Hermosa R., G.Estrada C., Caradus J., He YW., Aichour SM., Glare TR., Borriss R., Vinale F. and Sansinenea E. (2019). Antimicrobial secondary metabolites from agriculturally important fungi as next biocontrol agents. Applied Microbiology and Biotechnology volume 103, 9287–9303. KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 11/2020 9 12. Lê Đức Khánh, 2015. Nghiên cứu tuyến trùng hại cây hồ tiêu, cà phê và các giải pháp khoa học và công nghệ phòng trừ hiệu quả ở các vùng sản xuất trọng điểm. Báo cáo nghiệm thu đề tài cấp Bộ. 13. Mardanova AM., Hadieva GF., Lutfullin MT., Khilyas IV., Minnullina LF., Gilyazeva, AG., Bogomolnaya LM. and Sharipova MR. (2017). Bacillus subtilis strains with antifungal activity against the phytopathogenic Fungi. Agricultural Sciences, 8, 1-20. 14. Niu XM. and Zhang KQ. (2011). Arthrobotrys oligospora: a model organism for understanding the interaction between fungi and nematodes, Mycology, 2:2, 59-78, DOI: 10.1080/21501203.2011.562559. 15. Pal KK. and Gardener BMcS. (2006). Biological Control of Plant Pathogens. The Plant Health Instructor. DOI: 10.1094/PHI-A-2006-1117-02. P1-25. 16. Pau CG., Leong CTS., Wong SK., Eng L., Jiwan M., Kundat FR., Aziz ZFBA., Ahmed OH., Majid NM. (2012). Isolation of indigenous strains of Paecilomyces lilacinus with antagonistic activity against Meloidogyne incognita. Int. J. Agricul. Biology 14:197–203. 17. Ramírez-Delgado E., Luna-Ruíz1 JJ., Moreno-Rico O., Quiroz-Velásquesz JDC. and Hernández-Mendoza JL. (2018). Effect of Trichoderma on Growth and Sporangia Production of Phytophthora capsici. Journal of Agricultural Science, Vol. 10, No. 6, 8-15. 18. Rupela OP., Gopalakrishnan S., Krajewski M., Sriveni M. (2003). A novel method for identification and enummeration of microorganisms with potential for suppressing fungal plant pathogens. Biol.Fertil.Soils 39, 131-134. 19. Siddiqui ZA. and Akhtar MS. (2009). Effects of antagonistic fungi and plant growth-promoting rhizobacteria on growth of tomato and reproduction of the root-knot nematode, Meloidogyne incognita. Australasian Plant Pathology, 2009, 38, 22–28. 20. Singh UB., Sahu A., Sahu N., Singh RK., Renu S., Singh DP., Manna MC., Sarma BK., Singh HB., Singh KP. (2012). Arthrobotrys oligospora mediated biological control of diseases of tomato (Lycopersicon esculentum Mill.) caused by Meloidogyne incognita and Rhizoctonia solani. https://doi.org/10.1111/jam.12009. 21. Singh HB., Singh A. and Sarma BK. (2014). Trichoderma viride 2% WP (Strain No. BHU-2953) formulation suppresses tomato wilt caused by Fusarium oxysporum f. sp. lycopersici and chilli damping-off caused by Pythium aphanidermatum effectively under different agroclimatic conditions. International Journal of Agriculture, Environment and Biotechnology 7, 313–320. 22. Nguyễn Văn Thiệp, Nguyễn Hữu La, Phạm Huy Quang, Nguyễn Thị Thu Hà (2016). Nghiên cứu khả năng ức chế nấm Chaetomium globosum đối với một số loại nấm gây bệnh chính trên chè. Kỷ yếu hội thảo Quốc gia về Khoa học cây trồng lần thứ 2. Nhà xuất bản Nông nghiệp, 1003-1007. 23. Hà Minh Thanh, Trần Ngọc Khánh, Vũ Phương Bình, Nguyễn Thu Hà, Hồ Hạnh, Lương Hữu Thành, Phạm Hồng Hiển, Phạm Văn Toản (2020). Nghiên cứu sản xuất và ứng dụng chế phẩm sinh học tổng hợp kiểm soát nấm bệnh, tuyến trùng hại hồ tiêu. Nông nghiệp và PTNT kỳ 1, tháng 3/2020; 13-21. 24. Tsay TT., Chen PC., Wu WS. (2006). A New Method for Isolating and Selecting Agents with High Antagonistic Ability Against Plant Parasitic Nematodes. Plant Pathology Bulletin 15: 9-16. 25. Nguyễn Văn Tuất (2017). Nghiên cứu nguyên nhân chính gây chết cà phê tái canh và đề xuất giải pháp khắc phục. Báo cáo nghiệm thu đề tài cấp Bộ. 26. Zhang KQ. and Hyde KD. (2014). Nematode- Trapping Fungi. Fungal Diversity Research Series. Volume 23. Springer Dordrecht Heidelberg New York London. 27. TRBA 460 "Einstufung von Pilzen in Risikogruppen" Ausgabe Juli 2016. portal.de/VorschriftenRegeln/VorschriftenRegeln.ht ml. 28. TRBA 466 "Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen", Ausgabe KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 2 - TH¸NG 11/2020 10 August 2015. portal.de/VorschriftenRegeln/VorschriftenRegeln.ht ml. 29. Thông tư số 10/2019/TT-BNNPTNT ngày 20 tháng 9 năm 2019 của Bộ trưởng Bộ Nông nghiệp và PTNT ban hành Danh mục thuốc bảo vệ thực vật được phép sử dụng, cấm sử dụng tại Việt Nam. SELECTION TO DETERMINING THE CONSORTIUM OF MICROORGANISMS ANTAGONISTIC TO COFFEE PATHOGEN FUNGI AND PARASITIC NEMATODE Nguyen Thi Hong Minh, Dao Thi Thu Hang, Nguyen Duc Thanh, Nguyen The Quyet, Dao Huu Hien, Ho Hanh, Tran Ngoc Khanh, Nguyen Thu Ha, Vu Thuy Nga, Pham Van Toan Summary Aimed to control pathogen fungi and phytoparasitic nematode damaged coffee, the paper focus on the selection to determining a consortium of antagonistic microorganism to the coffee pathogen fungi and parasitic nematode. As results, 3 antagonistic microorganisms to pathogen fungi and 02 fungal strains killing phytoparasitic nematode are selected. The microbial consortium are able to control the coffee pathogen fungi and parasitic nematode more efficiency than the single strain and having a positive effect on growth of coffee plant. The density of selected microorganism under mixing condition showed no difference to it under single condition. The fungal strains TQHT01 and Pae are identified as Chaetomium cochliodes TQHT01 and Purpureocillium lilacinum Pae belonging to the microorganisms of biosafety class 1. Keywords: Cofeee, Phytonematode, Pathogen fungi, Streptomyces enissocaesilis, Chaetomium cochliodes, Purpureocillium lilacinum, Arthrobotrys oligospora, microbial consortium. Người phản biện: GS.TS. Nguyễn Văn Tuất Ngày nhận bài: 7/8/2020 Ngày thông qua phản biện: 7/9/2020 Ngày duyệt đăng: 14/9/2020
File đính kèm:
 tuyen_chon_to_hop_cac_vi_sinh_vat_doi_khang_nam_benh_diet_tu.pdf
tuyen_chon_to_hop_cac_vi_sinh_vat_doi_khang_nam_benh_diet_tu.pdf

