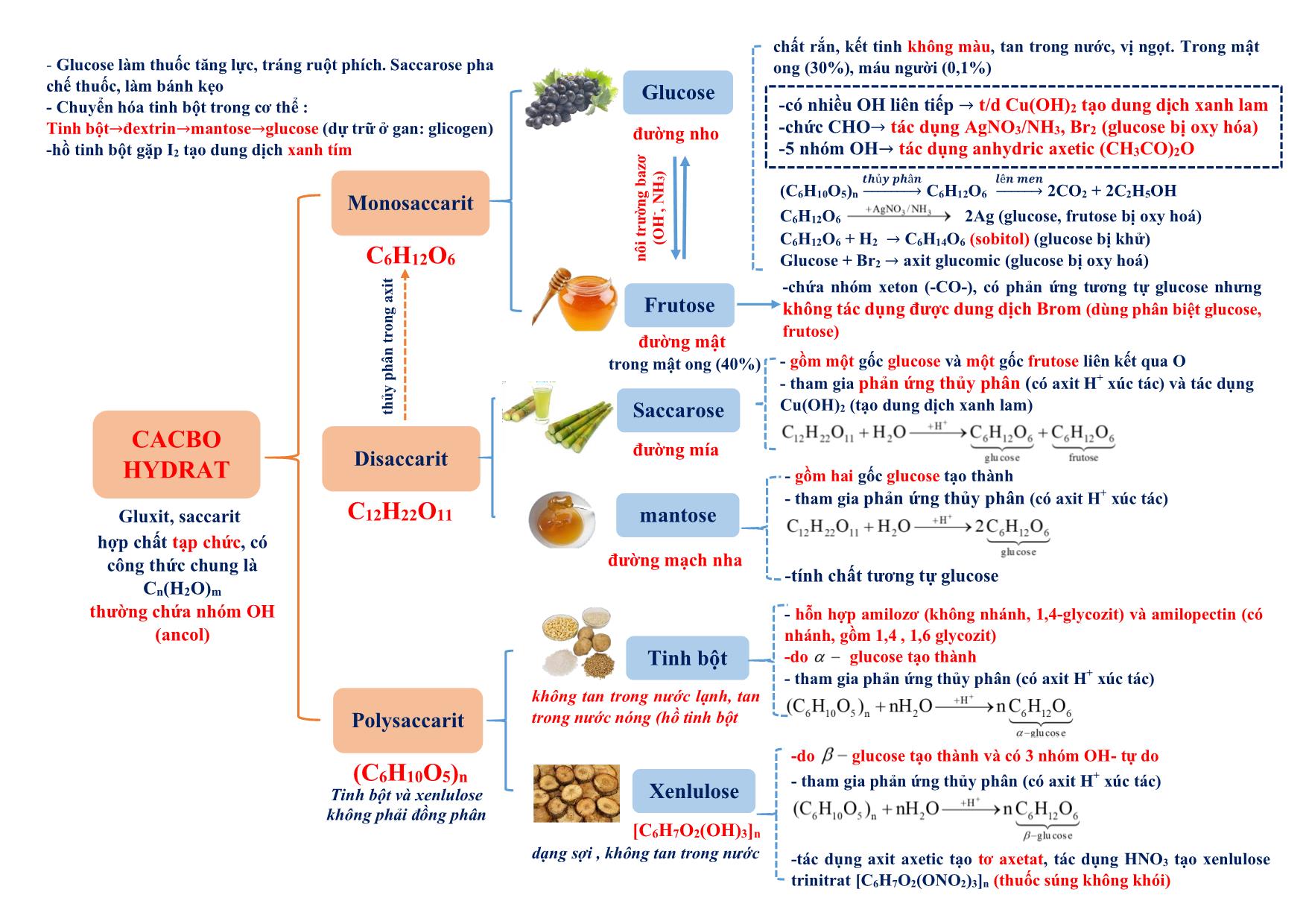
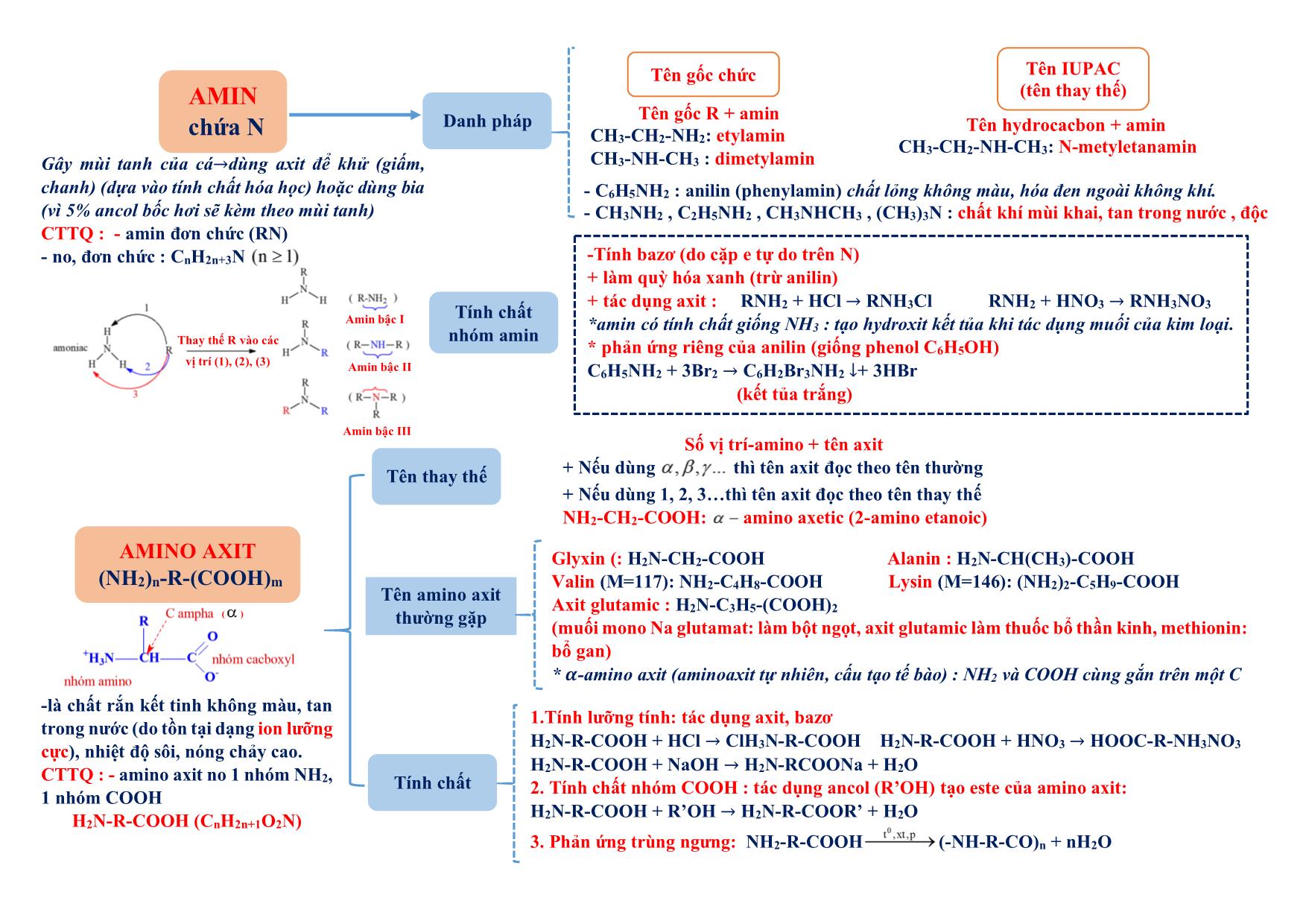
Tóm tắt lý thuyết Hóa học Lớp 12
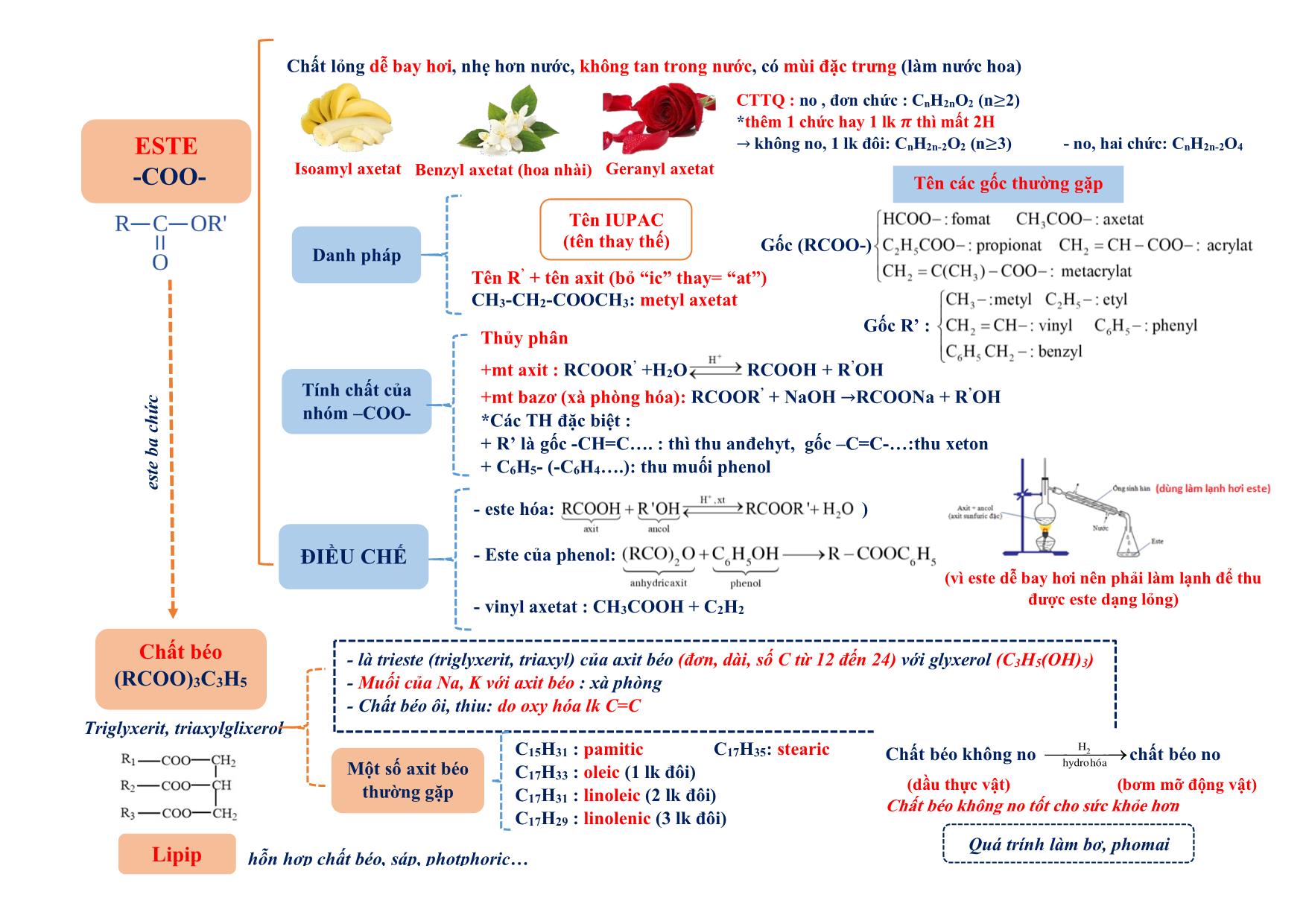
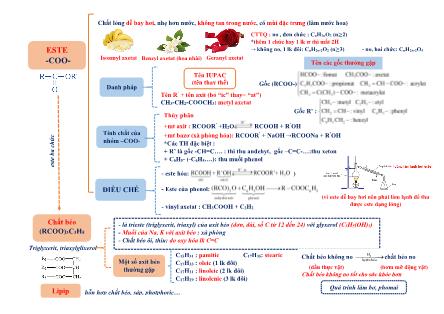
Chất lỏng dễ bay hơi, nhẹ hơn nước, không tan trong nước, có mùi đặc trưng (làm nước hoa)
Isoamyl axetat Benzyl axetat (hoa nhài) Geranyl axetat
Lipip hỗn hợp chất béo, sáp, photphoric
Chất béo
(RCOO)3C3H5
Triglyxerit, triaxylglixerol
C15H31 : pamitic C17H35: stearic
C17H33 : oleic (1 lk đôi)
C17H31 : linoleic (2 lk đôi)
C17H29 : linolenic (3 lk đôi)
- là trieste (triglyxerit, triaxyl) của axit béo (đơn, dài, số C từ 12 đến 24) với glyxerol (C3H5(OH)3)
- Muối của Na, K với axit béo : xà phòng
- Chất béo ôi, thiu: do oxy hóa lk C=C
CTTQ : no , đơn chức : CnH2nO2 (n≥2)
*thêm 1 chức hay 1 lk 𝝅 thì mất 2H
→ không no, 1 lk đôi: CnH2n-2O2 (n≥3) - no, hai chức: CnH2n-2O4
(vì este dễ bay hơi nên phải làm lạnh để thu
được este dạng lỏng)
Thủy phân
+mt axit : RCOOR’ +H2O RCOOH + R’OH
+mt bazơ (xà phòng hóa): RCOOR’ + NaOH →RCOONa + R’OH
*Các TH đặc biệt :
+ R’ là gốc -CH=C . : thì thu anđehyt, gốc –C=C- :thu xeton
+ C6H5- (-C6H4 .): thu muối phenol
Trang 1
Trang 2
Trang 3

Trang 4

Trang 5
Trang 6
Trang 7
Trang 8
Trang 9
Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Tóm tắt lý thuyết Hóa học Lớp 12
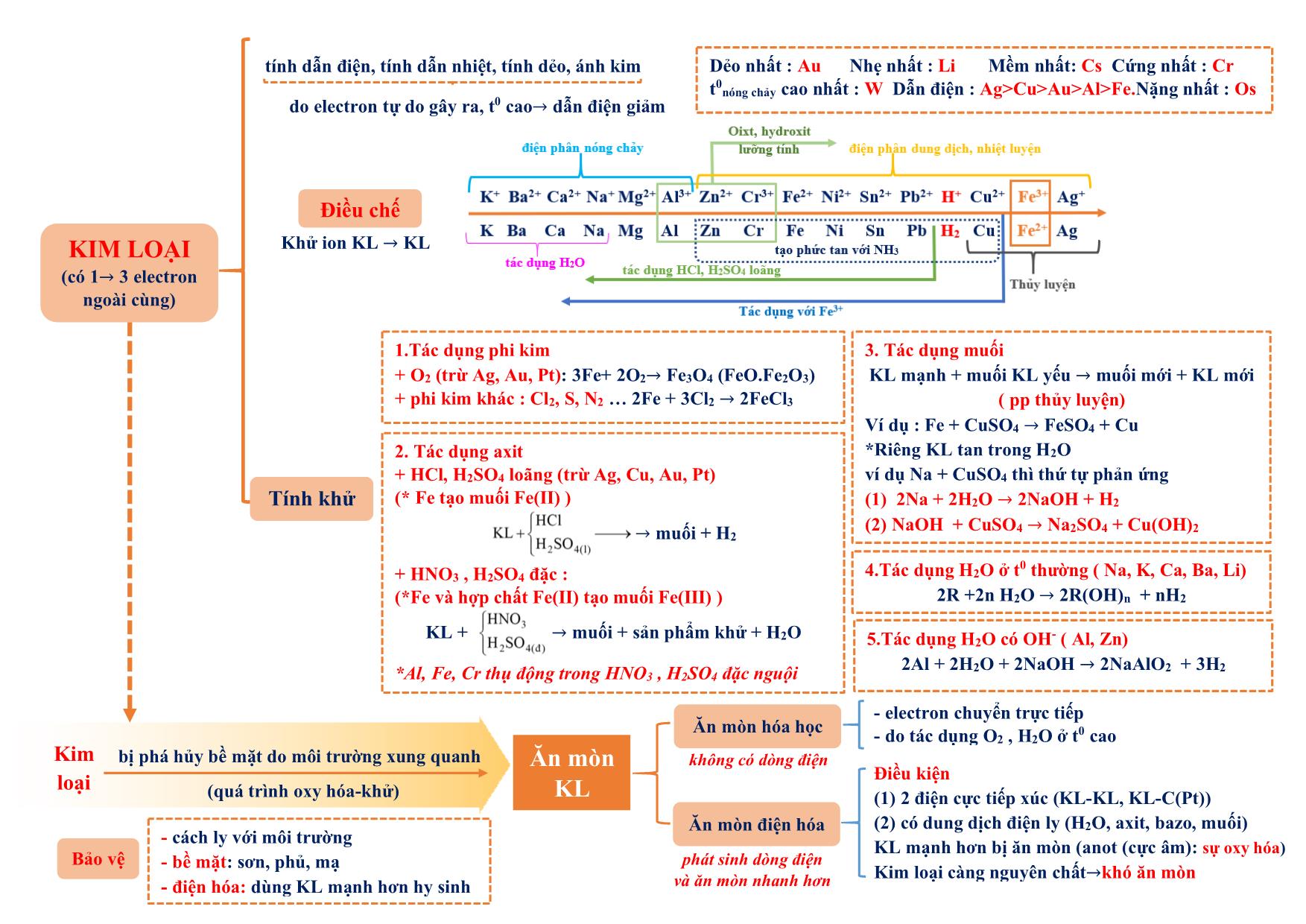
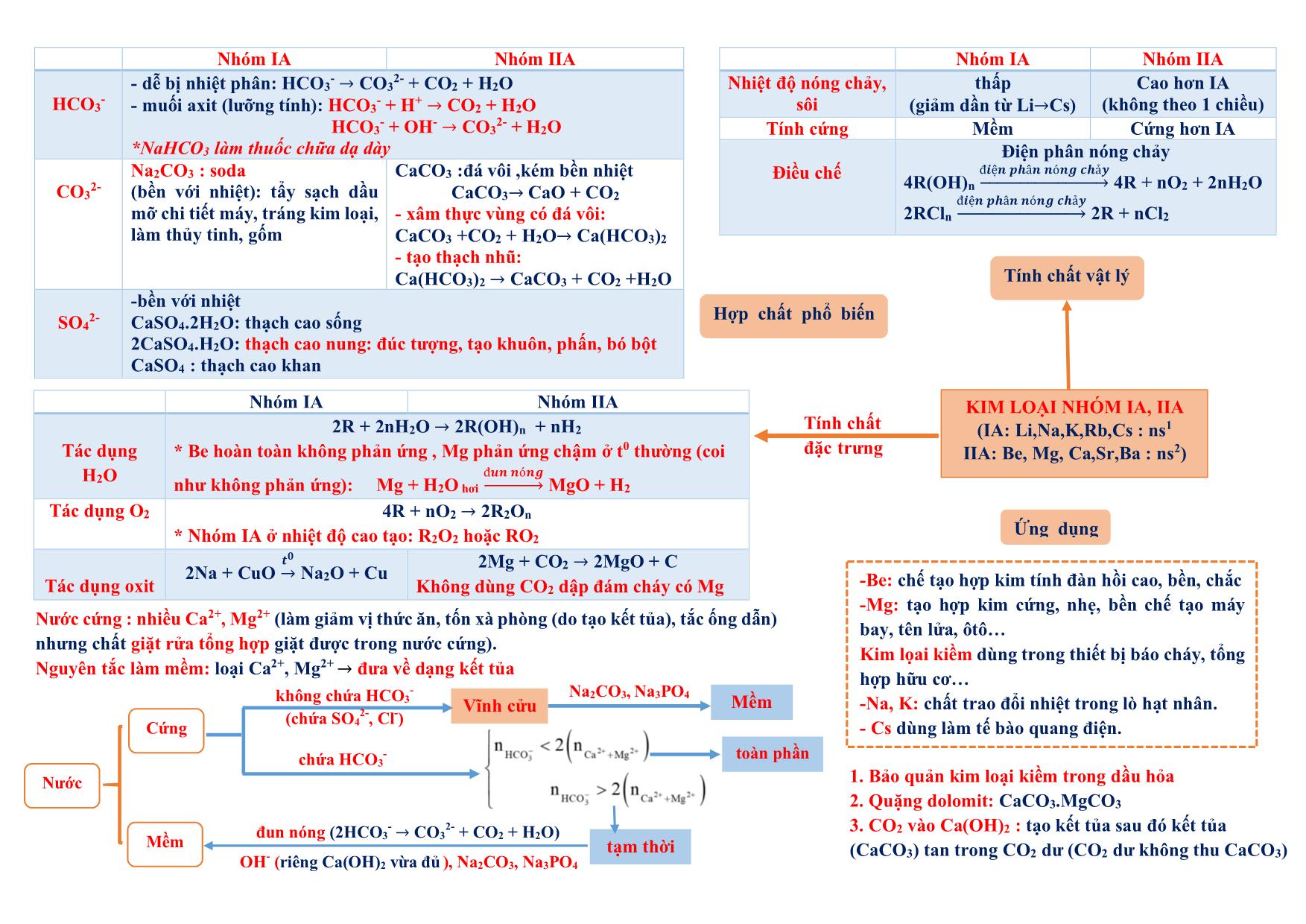
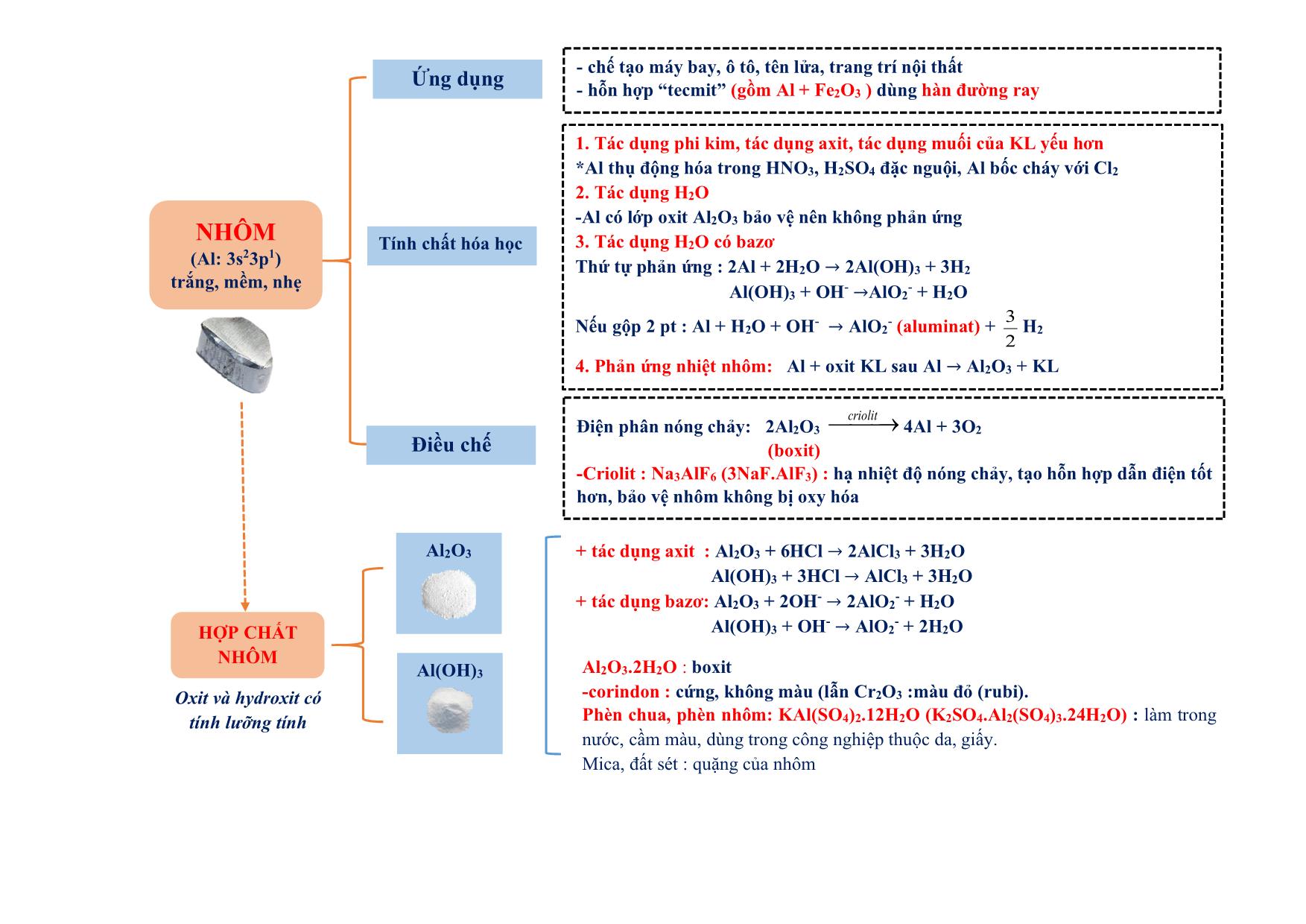
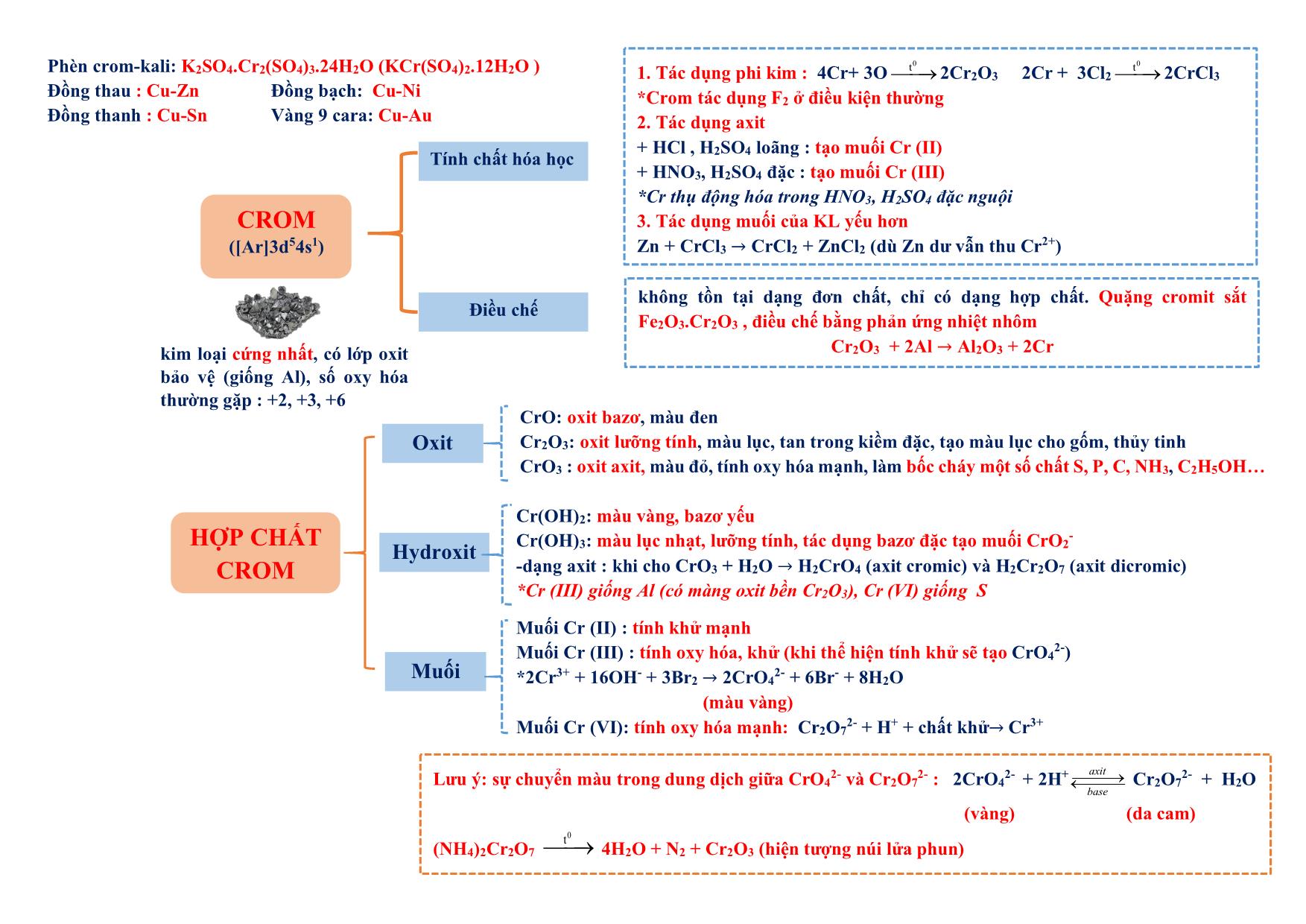
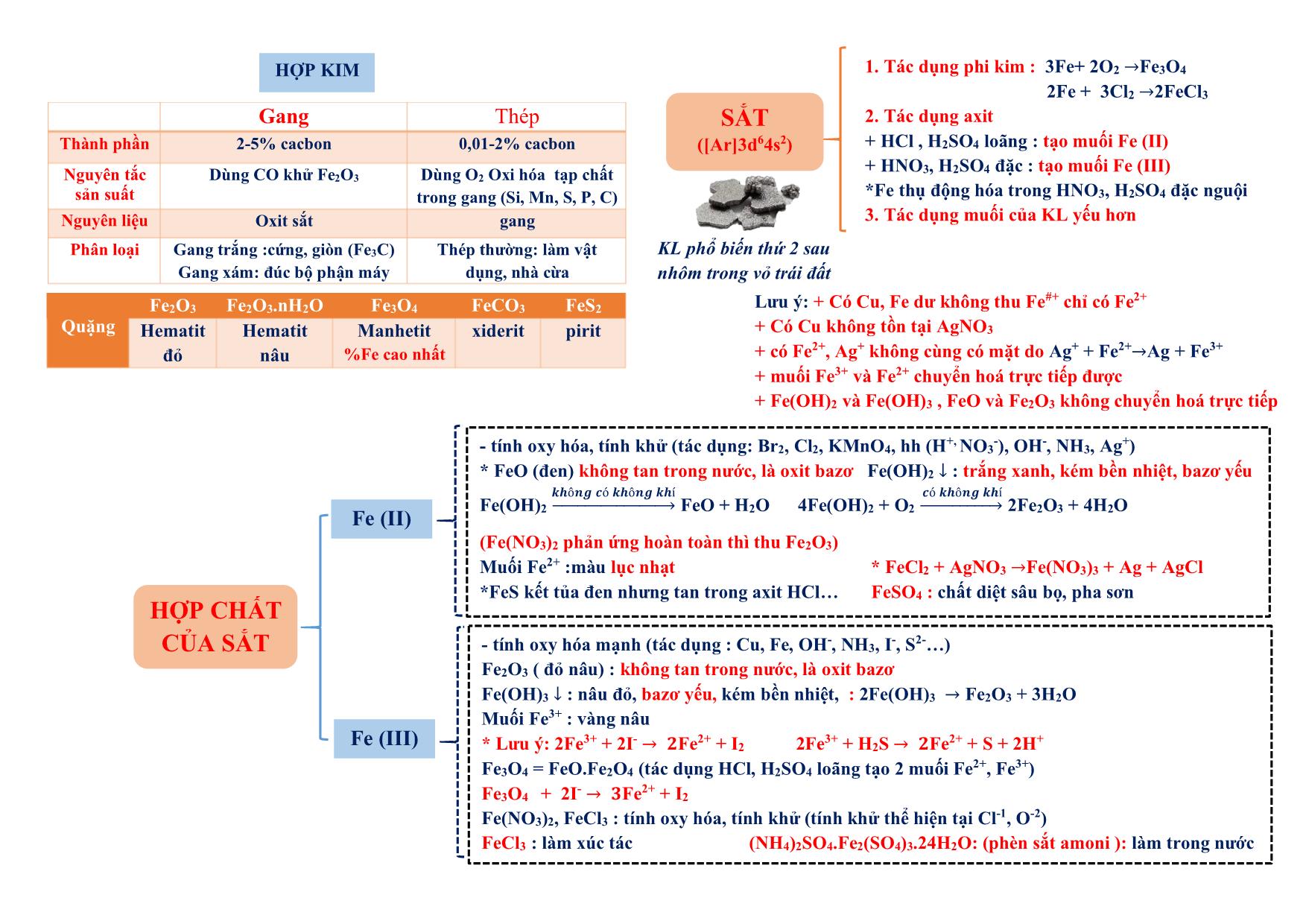
h iệt đ ộ , a x it, b a zơ , m u ố i tan không tan dạng cầu : hồng cầu. dạng sợi: tóc, lông, móng Tác dụng được với H2 PEPTIT- PROTEIN - Do 𝜶-amino axit tạo thành qua liên kết peptit (CO-NH) - Trong peptit: Aminoaxit đầu (Đầu N : chứa NH2), aminoaxit đuôi (đầu C: chứa COOH) - Tên : tên gốc axyl (đầu N) + tên aminoaxit đuôi C (giữ nguyên) Ví dụ: NH2-CH2-CONH-CH2-COOH : GlyxylGlyxin (Gly-Gly) 1.Phản ứng thủy phân + mt axit : peptit + H2O 𝜶-amino axit + mt bazơ : peptit + NaOH → muối 𝜶-amino axit + H2O 2. Phản ứng màu biure Peptit + Cu(OH)2 tạo sản phẩm màu tím (trừ đipeptit) + HNO3 tạo sản phẩm màu vàng Oligopeptit: từ 2-10 gốc −amino axit Polypeptit: từ 11- 50 gốc −amino axit Protein: từ trên 50 gốc −amino axit Có n gốc −amino axit thì có (n-1) liên kết peptit - Trùng hợp : có nối đôi hoặc vòng kém bền *chất có nối đôi: tên có “en”, vinyl, acry, clopren.. (trừ benzen, toluen, xilen, cumen, etylen glycol (terephtalat). Axetilen (CH≡CH) vẫn trùng hợp được Đồng trùng hợp: cao su buna-S (S là stiren), buna- N (N là acronitrin) - Trùng ngưng : có giải phóng H2O Điều kiện: có 2 nhóm chức có khả năng tạo liên kết với nhau (NH2 và COOH) hoặc (OH và COOH) Đồng trùng ngưng: nilon 6,6 , tơ lapsan Theo cấu trúc mạch + Mạch phân nhánh : amilopectin, glicogen + Mạch mạng lưới. :cao su lưu hóa, nhựa bakelit Theo cách tổng hợp - Trùng hợp : các loại nhựa, cao su (trừ nhựa phenolformandehyt hay novolac là trùng ngưng) - Trùng ngưng : các loại tơ (trừ tơ nitron (olon, nitrin, acronitrin, vinylcianua là trùng hợp), tơ capron (đi từ caprolactam)) Theo nguồn gốc - polyme tự nhiên : tinh bột, xenlulozơ, tre, nứa, bông, len, tơ tằm (glyxin), protein - polyme hóa học + polyme bán tổng hợp (nhân tạo) : tơ visco (từ xenlulozơ) , tơ axetat (xenlulozơ axetat) + polyme tổng hợp :các loại còn lại Polyeste (lapsan), tơ polyamit (nilon), tơ clopren poly este, tơ polyamit (nilon). Tinh bột, xenlulozơ POLYME (Mlớn, do nhiều mắt xích tạo thành) CÁCH TỔNG HỢP (cộng hợp phân tử nhỏ giống hay tương tự nhau ) Phản ứng thủy phân a x it b a zơ * Axit axetic không tham gia phản ứng trùng ngưng * Nhựa phenolformandehyt (PPF) : trùng ngưng từ phenol + andehyt fomic * Tên polyme : poly + tên monome (nếu tên monome từ 2 từ hoặc đi từ 2 monome thì tên monome để trong ngoặc): Ví dụ : CH2=CH2 → -(CH2-CH2-)n CH2=CH2 : monome , -CH2-CH2- : mắt xích , n : hệ số polyme, số mắc xích (1) Chất dẻo: +PE (polyetylen) làm màng mỏng, túi đựng: nCH2=CH2→ (-CH2-CH2-)n + Telflon (tetraflo etylen):chất chống dính, bền: nCF2=CF2 → (-CF2-CF2-)n + Poly vinyl ancol: thủy phân trong NaOH từ poly vinlyl axetat (PVA). + PS (polystiren) : C6H5-CH=CH2 + PVC (poly vinyl clorua): CH2=CH-Cl + PMMA (poly metyl metacrylic): + PP (polypropilen): CH2=CH-CH3 thủy tinh hữu cơ (flexilat) (2) Cao su: +Cao su buna (C4H6)n : đi từ buta-1,3-đien: nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n Cao su thiên nhiên : (C5H8)n mắc xích là isopren (2-metyl buta-1,3-dien) , tuy nhiên cao su isopren không phải cao su thiên nhiên. (3) Tơ polyamit: + nilon 7 (tơ enang) : + nilon 6: Nilon 6,6: hexametylendiamin + axit adipic : (4) Tơ vinylic (tơ nitron,nitrin, olon, len nhân tạo): (5) Tơ lapan (polyeste): etylen glycol + axit terephtalic KIM LOẠI (có 1→ 3 electron ngoài cùng) Điều chế Khử ion KL → KL Dẻo nhất : Au Nhẹ nhất : Li Mềm nhất: Cs Cứng nhất : Cr t0nóng chảy cao nhất : W Dẫn điện : Ag>Cu>Au>Al>Fe.Nặng nhất : Os Tính khử 1.Tác dụng phi kim + O2 (trừ Ag, Au, Pt): 3Fe+ 2O2→ Fe3O4 (FeO.Fe2O3) + phi kim khác : Cl2, S, N2 2Fe + 3Cl2 → 2FeCl3 3. Tác dụng muối KL mạnh + muối KL yếu → muối mới + KL mới ( pp thủy luyện) Ví dụ : Fe + CuSO4 → FeSO4 + Cu *Riêng KL tan trong H2O ví dụ Na + CuSO4 thì thứ tự phản ứng (1) 2Na + 2H2O → 2NaOH + H2 (2) NaOH + CuSO4 → Na2SO4 + Cu(OH)2 2. Tác dụng axit + HCl, H2SO4 loãng (trừ Ag, Cu, Au, Pt) (* Fe tạo muối Fe(II) ) → muối + H2 + HNO3 , H2SO4 đặc : (*Fe và hợp chất Fe(II) tạo muối Fe(III) ) KL + → muối + sản phẩm khử + H2O *Al, Fe, Cr thụ động trong HNO3 , H2SO4 đặc nguội 4.Tác dụng H2O ở t0 thường ( Na, K, Ca, Ba, Li) 2R +2n H2O → 2R(OH)n + nH2 5.Tác dụng H2O có OH- ( Al, Zn) 2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2 Ăn mòn KL Kim loại bị phá hủy bề mặt do môi trường xung quanh (quá trình oxy hóa-khử) Bảo vệ - cách ly với môi trường - bề mặt: sơn, phủ, mạ - điện hóa: dùng KL mạnh hơn hy sinh Điều kiện (1) 2 điện cực tiếp xúc (KL-KL, KL-C(Pt)) (2) có dung dịch điện ly (H2O, axit, bazo, muối) KL mạnh hơn bị ăn mòn (anot (cực âm): sự oxy hóa) Kim loại càng nguyên chất→khó ăn mòn - electron chuyển trực tiếp - do tác dụng O2 , H2O ở t0 cao Ăn mòn điện hóa phát sinh dòng điện và ăn mòn nhanh hơn Ăn mòn hóa học không có dòng điện tính dẫn điện, tính dẫn nhiệt, tính dẻo, ánh kim do electron tự do gây ra, t0 cao→ dẫn điện giảm Ứng dụng Tính chất vật lý Hợp chất phổ biến Tính chất đặc trưng 1. Bảo quản kim loại kiềm trong dầu hỏa 2. Quặng dolomit: CaCO3.MgCO3 3. CO2 vào Ca(OH)2 : tạo kết tủa sau đó kết tủa (CaCO3) tan trong CO2 dư (CO2 dư không thu CaCO3) -Be: chế tạo hợp kim tính đàn hồi cao, bền, chắc -Mg: tạo hợp kim cứng, nhẹ, bền chế tạo máy bay, tên lửa, ôtô Kim lọai kiềm dùng trong thiết bị báo cháy, tổng hợp hữu cơ -Na, K: chất trao đổi nhiệt trong lò hạt nhân. - Cs dùng làm tế bào quang điện. Nhóm IA Nhóm IIA HCO3 - - dễ bị nhiệt phân: HCO3- → CO32- + CO2 + H2O - muối axit (lưỡng tính): HCO3- + H+ → CO2 + H2O HCO3 - + OH- → CO32- + H2O *NaHCO3 làm thuốc chữa dạ dày CO3 2- Na2CO3 : soda (bền với nhiệt): tẩy sạch dầu mỡ chi tiết máy, tráng kim loại, làm thủy tinh, gốm CaCO3 :đá vôi ,kém bền nhiệt CaCO3→ CaO + CO2 - xâm thực vùng có đá vôi: CaCO3 +CO2 + H2O→ Ca(HCO3)2 - tạo thạch nhũ: Ca(HCO3)2 → CaCO3 + CO2 +H2O SO4 2- -bền với nhiệt CaSO4.2H2O: thạch cao sống 2CaSO4.H2O: thạch cao nung: đúc tượng, tạo khuôn, phấn, bó bột CaSO4 : thạch cao khan Nhóm IA Nhóm IIA Nhiệt độ nóng chảy, sôi thấp (giảm dần từ Li→Cs) Cao hơn IA (không theo 1 chiều) Tính cứng Mềm Cứng hơn IA Điều chế Điện phân nóng chảy 4R(OH)n đ𝒊ệ𝒏 𝒑𝒉â𝒏 𝒏ó𝒏𝒈 𝒄𝒉ả𝒚 ሱۛ ۛۛ ۛۛ ۛۛ ۛۛ ۛۛ ۛۛ ሮۛ 4R + nO2 + 2nH2O 2RCln đ𝒊ệ𝒏 𝒑𝒉â𝒏 𝒏ó𝒏𝒈 𝒄𝒉ả𝒚 ሱۛ ۛۛ ۛۛ ۛۛ ۛۛ ۛۛ ۛۛ ሮۛ 2R + nCl2 Nhóm IA Nhóm IIA Tác dụng H2O 2R + 2nH2O → 2R(OH)n + nH2 * Be hoàn toàn không phản ứng , Mg phản ứng chậm ở t0 thường (coi như không phản ứng): Mg + H2O hơi đ𝒖𝒏 𝒏ó𝒏𝒈 ሱۛ ۛۛ ۛۛ ሮ MgO + H2 Tác dụng O2 4R + nO2 → 2R2On * Nhóm IA ở nhiệt độ cao tạo: R2O2 hoặc RO2 Tác dụng oxit 2Na + CuO 𝒕𝟎 → Na2O + Cu 2Mg + CO2 → 2MgO + C Không dùng CO2 dập đám cháy có Mg Nước cứng : nhiều Ca2+, Mg2+ (làm giảm vị thức ăn, tốn xà phòng (do tạo kết tủa), tắc ống dẫn) nhưng chất giặt rửa tổng hợp giặt được trong nước cứng). Nguyên tắc làm mềm: loại Ca2+, Mg2+ → đưa về dạng kết tủa KIM LOẠI NHÓM IA, IIA (IA: Li,Na,K,Rb,Cs : ns1 IIA: Be, Mg, Ca,Sr,Ba : ns2) Na2CO3, Na3PO4 Nước chứa HCO3 - Cứng Mềm OH - (riêng Ca(OH)2 vừa đủ ), Na2CO3, Na3PO4 đun nóng (2HCO3 - → CO3 2- + CO2 + H2O) toàn phần tạm thời Mềm không chứa HCO3 - (chứa SO4 2- , Cl - ) Vĩnh cửu NHÔM (Al: 3s23p1) trắng, mềm, nhẹ - chế tạo máy bay, ô tô, tên lửa, trang trí nội thất - hỗn hợp “tecmit” (gồm Al + Fe2O3 ) dùng hàn đường ray 1. Tác dụng phi kim, tác dụng axit, tác dụng muối của KL yếu hơn *Al thụ động hóa trong HNO3, H2SO4 đặc nguội, Al bốc cháy với Cl2 2. Tác dụng H2O -Al có lớp oxit Al2O3 bảo vệ nên không phản ứng 3. Tác dụng H2O có bazơ Thứ tự phản ứng : 2Al + 2H2O → 2Al(OH)3 + 3H2 Al(OH)3 + OH - →AlO2- + H2O Nếu gộp 2 pt : Al + H2O + OH- → AlO2- (aluminat) + 3 2 H2 4. Phản ứng nhiệt nhôm: Al + oxit KL sau Al → Al2O3 + KL Điện phân nóng chảy: 2Al2O3 criolit⎯⎯⎯→ 4Al + 3O2 (boxit) -Criolit : Na3AlF6 (3NaF.AlF3) : hạ nhiệt độ nóng chảy, tạo hỗn hợp dẫn điện tốt hơn, bảo vệ nhôm không bị oxy hóa Tính chất hóa học Điều chế + tác dụng axit : Al2O3 + 6HCl → 2AlCl3 + 3H2O Al(OH)3 + 3HCl → AlCl3 + 3H2O + tác dụng bazơ: Al2O3 + 2OH- → 2AlO2- + H2O Al(OH)3 + OH - → AlO2- + 2H2O Al2O3.2H2O : boxit -corindon : cứng, không màu (lẫn Cr2O3 :màu đỏ (rubi). Phèn chua, phèn nhôm: KAl(SO4)2.12H2O (K2SO4.Al2(SO4)3.24H2O) : làm trong nước, cầm màu, dùng trong công nghiệp thuộc da, giấy. Mica, đất sét : quặng của nhôm HỢP CHẤT NHÔM Oxit và hydroxit có tính lưỡng tính Al2O3 Al(OH)3 Ứng dụng HỢP CHẤT CROM 1. Tác dụng phi kim : 4Cr+ 3O 0t⎯⎯→ 2Cr2O3 2Cr + 3Cl2 0t⎯⎯→ 2CrCl3 *Crom tác dụng F2 ở điều kiện thường 2. Tác dụng axit + HCl , H2SO4 loãng : tạo muối Cr (II) + HNO3, H2SO4 đặc : tạo muối Cr (III) *Cr thụ động hóa trong HNO3, H2SO4 đặc nguội 3. Tác dụng muối của KL yếu hơn Zn + CrCl3 → CrCl2 + ZnCl2 (dù Zn dư vẫn thu Cr2+) không tồn tại dạng đơn chất, chỉ có dạng hợp chất. Quặng cromit sắt Fe2O3.Cr2O3 , điều chế bằng phản ứng nhiệt nhôm Cr2O3 + 2Al → Al2O3 + 2Cr Tính chất hóa học Điều chế Oxit Hydroxit Muối Lưu ý: sự chuyển màu trong dung dịch giữa CrO42- và Cr2O72- : 2CrO42- + 2H+⎯⎯⎯→⎯⎯ axit base Cr2O7 2- + H2O (vàng) (da cam) (NH4)2Cr2O7 0t⎯⎯→ 4H2O + N2 + Cr2O3 (hiện tượng núi lửa phun) Phèn crom-kali: K2SO4.Cr2(SO4)3.24H2O (KCr(SO4)2.12H2O ) Đồng thau : Cu-Zn Đồng bạch: Cu-Ni Đồng thanh : Cu-Sn Vàng 9 cara: Cu-Au CROM ([Ar]3d54s1) kim loại cứng nhất, có lớp oxit bảo vệ (giống Al), số oxy hóa thường gặp : +2, +3, +6 Muối Cr (II) : tính khử mạnh Muối Cr (III) : tính oxy hóa, khử (khi thể hiện tính khử sẽ tạo CrO42-) *2Cr3+ + 16OH- + 3Br2 → 2CrO42- + 6Br- + 8H2O (màu vàng) Muối Cr (VI): tính oxy hóa mạnh: Cr2O72- + H+ + chất khử→ Cr3+ Cr(OH)2: màu vàng, bazơ yếu Cr(OH)3: màu lục nhạt, lưỡng tính, tác dụng bazơ đặc tạo muối CrO2- -dạng axit : khi cho CrO3 + H2O → H2CrO4 (axit cromic) và H2Cr2O7 (axit dicromic) *Cr (III) giống Al (có màng oxit bền Cr2O3), Cr (VI) giống S CrO: oxit bazơ, màu đen Cr2O3: oxit lưỡng tính, màu lục, tan trong kiềm đặc, tạo màu lục cho gốm, thủy tinh CrO3 : oxit axit, màu đỏ, tính oxy hóa mạnh, làm bốc cháy một số chất S, P, C, NH3, C2H5OH HỢP CHẤT CỦA SẮT Quặng Fe2O3 Fe2O3.nH2O Fe3O4 FeCO3 FeS2 Hematit đỏ Hematit nâu Manhetit %Fe cao nhất xiderit pirit Gang Thép Thành phần 2-5% cacbon 0,01-2% cacbon Nguyên tắc sản suất Dùng CO khử Fe2O3 Dùng O2 Oxi hóa tạp chất trong gang (Si, Mn, S, P, C) Nguyên liệu Oxit sắt gang Phân loại Gang trắng :cứng, giòn (Fe3C) Gang xám: đúc bộ phận máy Thép thường: làm vật dụng, nhà cừa 1. Tác dụng phi kim : 3Fe+ 2O2 →Fe3O4 2Fe + 3Cl2 →2FeCl3 2. Tác dụng axit + HCl , H2SO4 loãng : tạo muối Fe (II) + HNO3, H2SO4 đặc : tạo muối Fe (III) *Fe thụ động hóa trong HNO3, H2SO4 đặc nguội 3. Tác dụng muối của KL yếu hơn - tính oxy hóa, tính khử (tác dụng: Br2, Cl2, KMnO4, hh (H+, NO3-), OH-, NH3, Ag+) * FeO (đen) không tan trong nước, là oxit bazơ Fe(OH)2 ↓ : trắng xanh, kém bền nhiệt, bazơ yếu Fe(OH)2 𝒌𝒉ô𝒏𝒈 𝒄ó 𝒌𝒉ô𝒏𝒈 𝒌𝒉í ሱۛ ۛۛ ۛۛ ۛۛ ۛۛ ۛۛ ۛۛ ሮ FeO + H2O 4Fe(OH)2 + O2 𝒄ó 𝒌𝒉ô𝒏𝒈 𝒌𝒉í ሱۛ ۛۛ ۛۛ ۛۛ ۛሮ 2Fe2O3 + 4H2O (Fe(NO3)2 phản ứng hoàn toàn thì thu Fe2O3) Muối Fe2+ :màu lục nhạt * FeCl2 + AgNO3 →Fe(NO3)3 + Ag + AgCl *FeS kết tủa đen nhưng tan trong axit HCl FeSO4 : chất diệt sâu bọ, pha sơn - tính oxy hóa mạnh (tác dụng : Cu, Fe, OH-, NH3, I-, S2-) Fe2O3 ( đỏ nâu) : không tan trong nước, là oxit bazơ Fe(OH)3 ↓ : nâu đỏ, bazơ yếu, kém bền nhiệt, : 2Fe(OH)3 → Fe2O3 + 3H2O Muối Fe3+ : vàng nâu * Lưu ý: 2Fe3+ + 2I- → 𝟐Fe2+ + I2 2Fe3+ + H2S → 𝟐Fe2+ + S + 2H+ Fe3O4 = FeO.Fe2O4 (tác dụng HCl, H2SO4 loãng tạo 2 muối Fe2+, Fe3+) Fe3O4 + 2I - → 𝟑Fe2+ + I2 Fe(NO3)2, FeCl3 : tính oxy hóa, tính khử (tính khử thể hiện tại Cl-1, O-2) FeCl3 : làm xúc tác (NH4)2SO4.Fe2(SO4)3.24H2O: (phèn sắt amoni ): làm trong nước SẮT ([Ar]3d64s2) KL phổ biến thứ 2 sau nhôm trong vỏ trái đất Fe (II) Fe (III) Lưu ý: + Có Cu, Fe dư không thu Fe#+ chỉ có Fe2+ + Có Cu không tồn tại AgNO3 + có Fe2+, Ag+ không cùng có mặt do Ag+ + Fe2+→Ag + Fe3+ + muối Fe3+ và Fe2+ chuyển hoá trực tiếp được + Fe(OH)2 và Fe(OH)3 , FeO và Fe2O3 không chuyển hoá trực tiếp HỢP KIM HÌNH VẼ THÍ NGHIỆM Chất gây nghiện Ô nhiễm nước, đất Ô nhiễm không khí - heroin, cocain, hassish (cần sa) Amphetamin, cafein Các ion KL nặng : Pb2+, Hg2+, Cr 3+ , Cd 2+ , thuốc bảo vệ thực vật, anion Cl-, SO4 2- , NO3 - Mưa axit: SO2, NO2 Hiệu ứng nhà kính : CO2 (chính), CH4 Suy giảm ozon: CFC, freon (hợp chất Clo) - mocphin, seduxen : thuốc an thần penixilin, ampixilin, erthyromixin : thuốc kháng sinh - nicotin : trong thuốc lá Khí Chất phản ứng Phương trình phản ứng Chất lỏng Chất lỏng N2 NH4Cl bão hòa NaNO2 bão hòa NH4Cl + NaNO2 →N2 + NaCl + 2H2O CO HCOOH H2SO4 đặc HCOOH 𝑯𝟐𝑺𝑶𝟒 đặ𝒄 ሱۛ ۛۛ ۛۛ ሮۛ CO + H2O C2H4 C2H5OH H2SO4 đặc, C2H5OH 𝑯𝟐𝑺𝑶𝟒 đặ𝒄 ሱۛ ۛۛ ۛۛ ሮۛ CH2=CH2 + H2O Khí Chất phản ứng Phương trình phản ứng Chất lỏng Chất rắn CO2 HCl CaCO3 2HCl + CaCO3 → CaCl2 + CO2 + H2O C2H2 H2O CaC2 2H2O + CaC2 → C2H2 + Ca(OH)2 H2S HCl FeS 2HCl + FeS → FeCl2 + H2S HCl SO2 HNO3 Phương pháp sunfat NaCl (rắn)+ H2SO4 (đặc) → NaHSO4 + HCl H2SO4 + Na2SO3 (rắn) → Na2SO4 + SO2 + H2O H2SO4 + NaNO3 → HNO3 + NaHSO4 Chất rắn + Chất rắn (ống nghiệm chứa hóa chất nằm ngang, miệng hơi trút xuống) Khí Chất phản ứng Phương trình phản ứng Chất rắn Chất rắn NH3 NH4Cl Ca(OH)2 hoặc NaOH 2NH4Cl(r) + Ca(OH)2 (r) →2NH3 + 2H2O + CaCl2 CH4 CH3COONa NaOH/CaO (vôi tôi xút) CH3COONa + NaOH 𝑪𝒂𝑶,𝒕𝟎 ሱۛ ۛۛ ሮCH4 + Na2CO3 1. Nhận biết : muối (phần Rn+) + dùng Ba hay Ba(OH)2 + ion KL IA : màu ngọn lửa 2. Nhận biết ion NO3- dung Cu, H+ (HCl, H2SO4) 3. Nhận biết : CO2, SO2 + Dùng Ca(OH)2 , Ba(OH)2 + Riêng SO2 có thể dùng Br2 4. Nhận biết Cl- : dùng AgNO3 5. Nhận biết (NH4)2CO3 (NH4)2SO4 Dùng Ba(OH)2 Tính tan trong nước Không tan hoặc ít tan Tan vừa phải Tan nhiều N2, H2, O2, CO2, CH4, H2S, C2H4, C2H2 Cl2 SO2, HCl, NH3 Làm khô (hấp thu H2O mà không pứ chất làm khô) H2SO4 đặc, P2O5 : làm khô Cl2, O2, SO2, N2, CO2 CuSO4 khan, màu trắng +𝑯𝟐𝑶 ሱۛ ሮۛ CuSO4.5H2O (màu xanh) : phát hiện H trong HCHC). Ca(OH)2 phát hiện C NaOH, CaO, KOH: làm khô NH3, H2, O2, N2... Xử lý khí NaOH, Ca(OH)2 : hấp thụ NO2, CO2, H2S, SO2 NaCl bão hòa: hấp thụ HCl Cl2 hấp thụ NH3 Cu(NO3)2, Pb(NO3)2: xử lý H2S, muối S 2- (tạo kết tủa đen) Đẩy nước (thu khí không tác dụng H2O không tan, ít tan trong nước) Đẩy không khí (thu khí không tác dụng không khí) O2, H2, CO2, N2, C2H4, CH4 Khí nặng hơn không khí : Cl2, O2, SO2, NO.. Khí nhẹ hơn không khí: NH3, H2
File đính kèm:
 tom_tat_ly_thuyet_hoa_hoc_lop_12.pdf
tom_tat_ly_thuyet_hoa_hoc_lop_12.pdf

