Nghiên cứu quy trình thủy phân tế bào nấm men thu nhận beta glucan từ bã men bia khô
TÓM TẮT
β-glucan là hợp chất tự nhiên có tác dụng kích thích miễn dịch một cách hiệu quả lên động vật thủy
sản. Trong các nguồn thu nhận thì tế bào nấm men Saccharomyces cerevisiae được xem là nguồn
β-glucan dồi dào từ công nghiệp sản xuất rượu bia. Các phương pháp trích ly đã được áp dụng sao
cho sản phẩm đạt được hàm lượng β-glucan cao nhất. Phương pháp enzyme được sử dụng trong
bài báo này dùng để tinh sạch β-glucan từ các thành phần trong bã men bia. Hai loại enzyme gồm
protease PA 3.000 và α-amylase Licuamil được sử dụng trong thí nghiệm lần lượt thủy phân protein
và α-glucan sau công đoạn phá vỡ vách tế bào. Kết quả thủy phân cho thấy hàm lượng protein giảm
đáng kể khoảng 6 lần so với trước khi thủy phân. Nồng độ protease tối ưu là 15 U/ml. Đối với quá
trình thủy phân α-glucan, nồng độ α-amylase tối ưu là 3 U/ml khi hàm lượng α-glucan giảm khoảng
8 lần so với trước khi thủy phân. Các kết quả trên dẫn đến hàm lượng β-glucan tăng lên đáng kể với
hàm lượng cao nhất là 67,70 % tính theo vật chất khô.

Trang 1

Trang 2
Trang 3

Trang 4
Trang 5

Trang 6

Trang 7

Trang 8
Tóm tắt nội dung tài liệu: Nghiên cứu quy trình thủy phân tế bào nấm men thu nhận beta glucan từ bã men bia khô

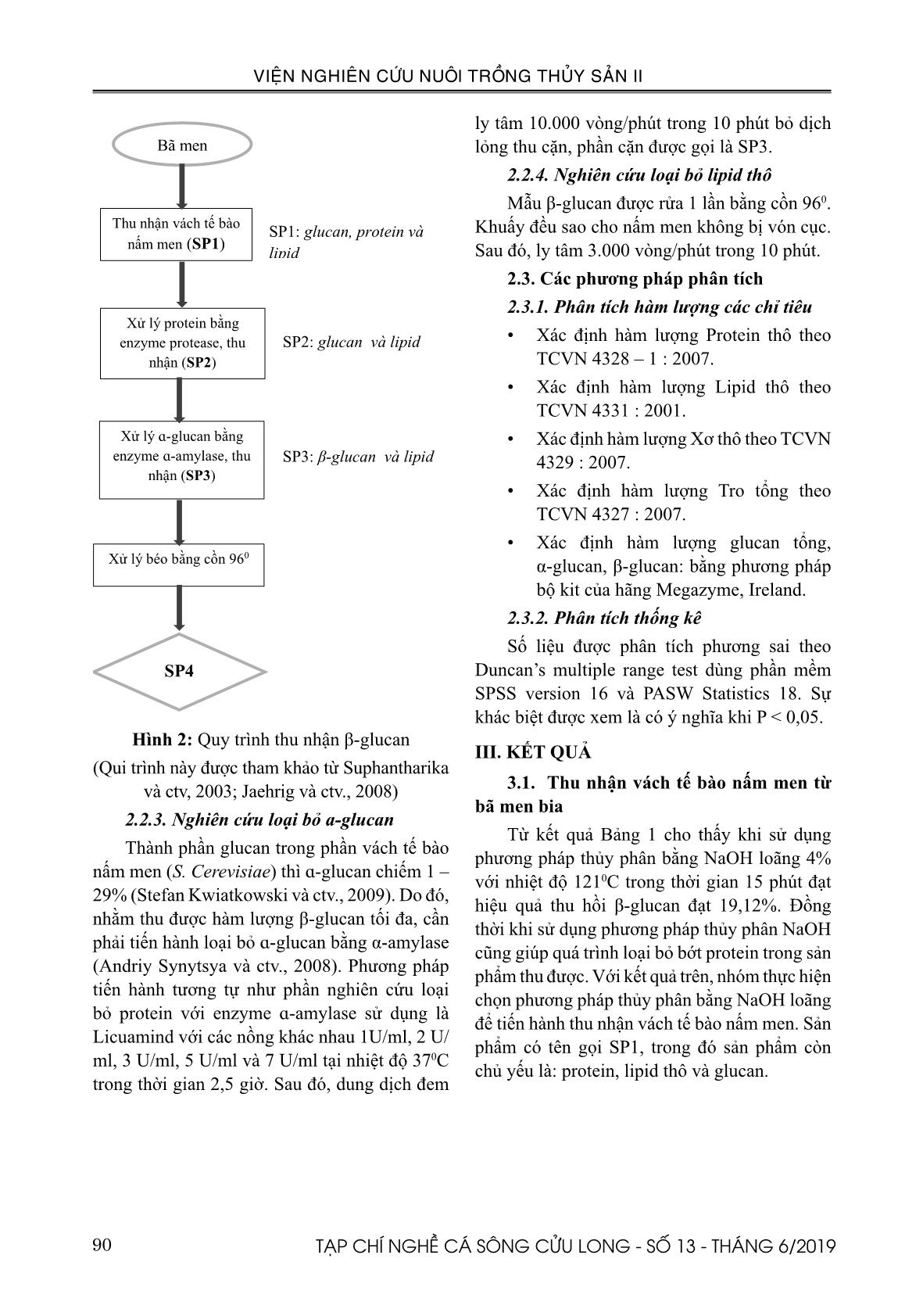
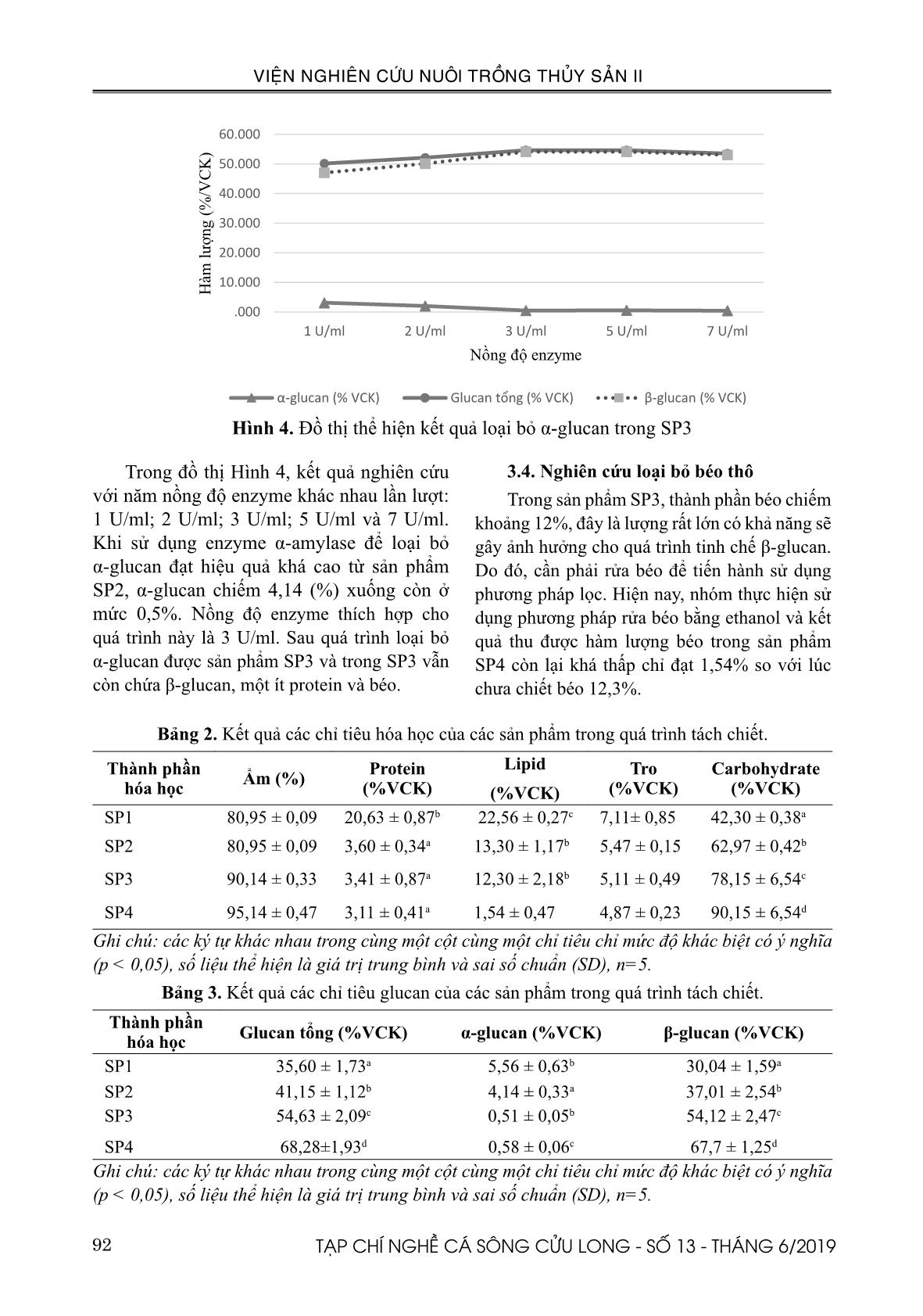
c sản phẩm SP2. 3.3. Nghiên cứu loại bỏ α-glucan Theo như nghiên cứu của Andriy Synytsya và ctv., (2008) thì α-glucan có khả năng sẽ được loại bỏ bằng enzyme α-amylase. Quá trình thủy phân loại bỏ protein sử dụng nồng độ enzyme protease 15 U/ml. Kết quả nghiên cứu với 05 nồng độ enzyme khác nhau lần lượt: 1 U/ml; 2 U/ml; 3 U/ml; 5 U/ml và 7 U/ml và kết quả thu được như Hình 4 (n=5). .000 5.000 10.000 15.000 20.000 25.000 30.000 35.000 40.000 45.000 5 U/ml 10 U/ml 15 U/ml 20 U/ml H àm l ư ợ n g ( % /V C K ) Nồng độ enzyme Protein (% VCK) Glucan tổng (% VCK) Beta glucan (% VCK) .000 10.000 20.000 30.000 40.000 50.000 60.000 1 U/ml 2 U/ml 3 U/ml 5 U/ml 7 U/ml H àm l ư ợ n g ( % /V C K ) Nồng độ enzyme α-glucan (% VCK) Glucan tổng (% VCK) β-glucan (% VCK) Hình 4. Đồ thị thể hiện kết quả loại bỏ α-glucan trong SP3 Trong đồ thị Hình 4, kết quả nghiên cứu với năm nồng độ enzyme khác nhau lần lượt: 1 U/ml; 2 U/ml; 3 U/ml; 5 U/ml và 7 U/ml. Khi sử dụng enzyme α-amylase để loại bỏ α-glucan đạt hiệu quả khá cao từ sản phẩm SP2, α-glucan chiếm 4,14 (%) xuống còn ở mức 0,5%. Nồng độ enzyme thích hợp cho quá trình này là 3 U/ml. Sau quá trình loại bỏ α-glucan được sản phẩm SP3 và trong SP3 vẫn còn chứa β-glucan, một ít protein và béo. 3.4. Nghiên cứu loại bỏ béo thô Trong sản phẩm SP3, thành phần béo chiếm khoảng 12%, đây là lượng rất lớn có khả năng sẽ gây ảnh hưởng cho quá trình tinh chế β-glucan. Do đó, cần phải rửa béo để tiến hành sử dụng phương pháp lọc. Hiện nay, nhóm thực hiện sử dụng phương pháp rửa béo bằng ethanol và kết quả thu được hàm lượng béo trong sản phẩm SP4 còn lại khá thấp chỉ đạt 1,54% so với lúc chưa chiết béo 12,3%. Bảng 2. Kết quả các chỉ tiêu hóa học của các sản phẩm trong quá trình tách chiết. Thành phần hóa học Ẩm (%) Protein (%VCK) Lipid (%VCK) Tro (%VCK) Carbohydrate (%VCK) SP1 80,95 ± 0,09 20,63 ± 0,87b 22,56 ± 0,27c 7,11± 0,85 42,30 ± 0,38a SP2 80,95 ± 0,09 3,60 ± 0,34a 13,30 ± 1,17b 5,47 ± 0,15 62,97 ± 0,42b SP3 90,14 ± 0,33 3,41 ± 0,87a 12,30 ± 2,18b 5,11 ± 0,49 78,15 ± 6,54c SP4 95,14 ± 0,47 3,11 ± 0,41a 1,54 ± 0,47 4,87 ± 0,23 90,15 ± 6,54d Ghi chú: các ký tự khác nhau trong cùng một cột cùng một chỉ tiêu chỉ mức độ khác biệt có ý nghĩa (p < 0,05), số liệu thể hiện là giá trị trung bình và sai số chuẩn (SD), n=5. Bảng 3. Kết quả các chỉ tiêu glucan của các sản phẩm trong quá trình tách chiết. Thành phần hóa học Glucan tổng (%VCK) α-glucan (%VCK) β-glucan (%VCK) SP1 35,60 ± 1,73a 5,56 ± 0,63b 30,04 ± 1,59a SP2 41,15 ± 1,12b 4,14 ± 0,33a 37,01 ± 2,54b SP3 54,63 ± 2,09c 0,51 ± 0,05b 54,12 ± 2,47c SP4 68,28±1,93d 0,58 ± 0,06c 67,7 ± 1,25d Ghi chú: các ký tự khác nhau trong cùng một cột cùng một chỉ tiêu chỉ mức độ khác biệt có ý nghĩa (p < 0,05), số liệu thể hiện là giá trị trung bình và sai số chuẩn (SD), n=5. 93TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II Theo Bảng 2 và 3 thì khi hàm lượng các protein và α-glucan sau khi xử lý sẽ giảm đi thì hàm lượng của β-glucan sẽ tăng lên trong quá trình tinh sạch sản phẩm. Hàm lượng protein giảm đáng kể (khoảng 6 lần) dần theo thứ tự SP1 > SP2, kéo theo hàm lượng carbohydrate tăng theo 1,5 lần (Bảng 2). Đồng thời thu nhận được hàm lượng β-glucan đạt 67,7%. IV. THẢO LUẬN Trong nghiên cứu của Xiao-Yong Liu và ctv., (2008), hàm lượng mannanprotein trong nấm men trước xử lý protein là 40% và glucan chiếm 60%. Sau khi thủy phân bằng enzyme protamex ở điều kiện 55OC, pH = 7,5, thời gian 5 giờ cho hàm lượng mannanprotein giảm đáng kể 0,27% mannan và 2,99% protein, hàm lượng β-glucan tăng lên 93,12%. Protease loại bỏ mananprotein theo cơ chế phá hủy phức chất giữa mannan và protein làm cho mannan và protein hòa tan trong dung dịch. Riêng β-glucan không tan được giữ lại. Tương tự trong nghiên cứu của Asif Ahmad và ctv., (2009) khi enzyme protease tỏ ra hiệu quả trong loại bỏ protein trong lúa mạch khi cho hàm lượng protein thấp nhất so với các phương pháp trích ly acid, base và nước nóng. Ở Hình 3, nồng độ enzyme 15 U/ml và 20 U/ml cho khả năng thủy phân protein cao nhất, lúc đó hàm lượng protein chỉ còn dưới 5%, thấp nhất 3,60 ± 0,34 % ở 15 U/ml (Bảng 2). Tuy nhiên, hàm lượng glucan ở 20 U/ml lại giảm dưới 40% so với 15 U/ml. Tỉ lệ nghịch với hàm lượng protein thì hàm lượng glucan tổng số và β-glucan cao nhất ở nồng độ 15 U/ml lần lượt là 41,15 ± 1,12 (%) và 37,01 ± 2,54 (Bảng 3). Đối với thí nghiệm thủy phân α-glucan, theo nghiên cứu của Andriy Synytsya và ctv., (2008), enzyme α-amylase có khả năng thủy phân α-glucan. Theo đó, với 2 mẫu nấm sò và nấm bào ngư Nhật, Andriy Synytsya và ctv., (2008) nhận thấy sau khi xử lý α-glucan bằng α-amylase ở điều kiện nồng độ 1/500 (v/v) ở pH = 7 trong 30 phút thì hàm lượng tinh bột (α-glucan) thấp nhất chỉ phát hiện hàm lượng hầu như không có và chỉ theo dạng vết so với nguyên liệu ban đầu là 1,2-2,6%. Tương tự đối với nguyên liệu lúa mạch, sau khi xử lý α-amylase (40OC/3 giờ) trong phương pháp enzyme khi so sánh với các phương pháp trích ly acid, base và nước nóng. Phương pháp enzyme cho hàm lượng tinh bột thấp nhất (Asif Ahmad và ctv., 2009). Do đó, trong Hình 4, nồng độ enzyme thích hợp cho quá trình này là 3 U/ml. Sau quá trình loại bỏ α-glucan được sản phẩm SP3 và trong SP3 vẫn còn chứa β-glucan, một ít protein và béo (Bảng 2 và 3). Với số liệu từ Bảng 2 và 3, khi hàm lượng các thành phần tạp chất giảm đi và được loại bỏ thì hàm lượng β-glucan trong sản phẩm đạt độ tinh sạch càng cao. Hàm lượng β-glucan cao nhất là SP3 với hàm lượng 54,12 ± 2,47 (Bảng 3) sau khi xử lý α-glucan. α-Glucan giảm từ 4,14 đến 0,51% tương ứng với hàm lượng β-glucan tăng đáng kể khoảng 1,5 lần. Khi khi sản phẩm được tách béo thì hàm lượng β-glucan đạt 67,7%. Theo Silke C. Jaehrig và ctv., (2007), quá trình xử lý protein theo phương pháp enzyme cho thấy sự khác biệt đáng kể khi so sánh giữa trước và sau khi xử lý với enzyme Savinase khi hàm lượng protein giảm gần 9 lần, tỉ lệ nghịch với hàm lượng β-glucan theo khối lượng khô tăng gần gấp đôi. Cũng theo Stefan Freimund và ctv., (2003) thì vách tế bào sau khi xử lý bằng enzyme protease trong 5 giờ, ở 45OC/ pH = 10,5 thu phần cặn thì hàm lượng protein xác định cho thấy hiệu quả của protease khi kết quả cho thấy lượng protein chỉ còn 5%. Nghĩa là protease đã thủy phân hết 75% hàm lượng protein trong vách tế bào và β-Glucan được tinh sạch lên đến 92%. V. KẾT LUẬN Phương pháp enzyme cho hiệu quả tinh sạch sản phẩm β-glucan khi loại bỏ phần lớn hàm lượng protein, α-glucan và béo trong mẫu. Trong đó, nồng độ enzyme protease và α-amylase sử dụng lần lượt là 15 U/ml và 3 U/ ml. Đồng thời loại bỏ béo bằng Ethanol 960. Kết quả là hàm lượng β-glucan cuối cùng tính 94 TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II theo vật chất khô là 67,7 ± 1,52%. Từ đó, đã xây dựng được qui trình thu nhận β-glucan đạt mức >60% bằng enzyme (Hình 5). Hình 5. β-glucan thu nhận từ bã men bia TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Đỗ Phương Thảo, 2017. Câu chuyện thoái vốn Nhà Nước và diện mạo mới cho ngành bia Việt Nam. Báo cáo ngành bia. Tài liệu tiếng Anh Andriy Synytsya, Katerina Mícková, Alla Synytsya, Ivan Jablonsky, Jirí Spevácekc, Vladimír Erban, Eliška Kováríková, Jana Copíková, 2009. Glucans from fruit bodies of cultivated mushrooms Pleurotus ostreatus and Pleurotus eryngii: Structure and potential prebiotic activity; Carbohydrate Polymers, 76, 548–556. Artūras Javmen, Saulius Grigiškis, Raimonda Gliebutė, 2012. β-glucan extraction from Saccharomyces cerevisiae yeast using Actinomyces rutgersensis 88 yeast lyzing enzymatic complex; BIOLOGIJA, 58(2),51-59. Asif Ahmad, Faqir Muhammad Anjum, Tahir Zahoor, Haq Nawaz & Ahmad Din, 2009. Physicochemical and functional properties of barley β-glucan as affected by different extraction procedures; International Journal of Food Science and Technology, 44, 181–187. Clare Kerby and Frank Vriesekoop, 2017. An Overview of the Utilisation of Brewery By- Products as Generated by British Craft Breweries; Beverages, 3, 24, 1-12 Freimund S., Sauter M., Kappeli O. and Dutler H., 2003. A new non-degrading isolation process for 1,3-β-D-glucan of high purity from baker’s yeast Saccharomyces cerevisiae, Carbohydrate Polymers, 54, 159–171. Kim K.S. and Yun H.S., (2006). Production of soluble-glucan from the cell wall of Saccharomyces cerevisiae; Enzyme and Microbial Technology, 39, 496–500. Liu D., Zeng X.A., Sun D.W., Han Z., 2013. Disruption and protein release by ultrasonication of yeast cells, Innovative Food Science and Emerging Technologies, 18, 132–137. Suphantharika, P. Khunrae, P. Thanardkit, C. Verduyn, 2003. Preparation of spent brewers yeast β-glucans with a potential application as an immunostimulant for black tiger shrimp, Penaeus monodon. Bioresource Technology, 88, 55-60. Meena D.K., Das P., Kumar S., Mandal S.C., Prusty A.K., Singh S.K., Akhtar M.S., Behera B.K., Kumar K., Pal A.K. and Mukherjee S.C., 2013. Beta-glucan: an ideal immunostimulant in aquaculture (a review)”, Fish Physiology and Biochemistry, 39, 431-457. Milic T.V., Rakin M. and Marinkovic S.S., 2007. Utilization of baker’s yeast (Saccharomyces cerevisiae) for the production of yeast extract: effects of different enzymatic treatments on solid, protein and carbohydrate recovery”, Journal of the Serbian Chemical Society, 72(5), 451–457. Stefan Freimunda, Martin Sautera, Othmar Kappelib, Hans Dutler, 2003. A new non-degrading isolation process for 1,3-β-D-glucan of high purity from baker’s yeast Saccharomyces cerevisiae, Carbohydrate Polymers, 54, 159–171. Stefan Kwiatkowski, Ursula Thielen, Phyllis Glenney and Colm Moran, 2009. A Study of Saccharomyces cerevisiae Cell Wall Glucans, The Institute of Brewing & Distilling, 115(2), 151-158. Thammakiti S., Suphantharika M., Phaesuwan T. and Verduyn C., 2004. Preparation of spent brewer’s yeast β-glucans for potential applications in the food industry”, International Journal of Food Science and Technology, 39, 21–29. Wenger M.D., DePhillips P., and Bracewell D.G., 2008. A Microscale Yeast Cell Disruption Technique for Integrated Process Development Strategies”, Biotechnology Progress, 24, 606-614. Xiao-Yong Liua, Qiang Wang, Steve W. Cuic, Hong- Zhi Liu, 2008. A new isolation method of β-D-glucans from spent yeast Saccharomyces cerevisiae”, Food Hydrocolloids, 22, 239–247. Yong-guang Bi, Yu-min Li, 2015. Optimization of Enzymatic Extraction Barley Polysaccharides Orthogonal Test Method”, International Symposium on Material, Energy and Environment Engineering, 121-124. Zhu F., Du B., Xu B., 2016. A critical review on production and industrial applications of betaglucans, Food Hydrocolloids, 52, 275-288. Hình 5. β-glucan thu nhận từ bã men bia 0,51% tương ứng với hàm lượng β-glucan tăng đáng kể khoảng 1,5 lần. Khi khi sản phẩm được tách béo thì hàm lượng β-glucan đạt 67,7%. Theo Silke C. Jaehrig và ctv., (2007), quá trình xử lý protein theo phương pháp enzyme cho thấy sự khác biệt đáng kể khi so sánh giữa trước và sau khi xử lý với enzyme Savinase khi hàm lượng protein giảm gần 9 lần, tỉ lệ nghịch với hàm lượng β-glucan theo khối lượng khô tăng gần gấp đôi. Cũng theo Stefan Freimund và ctv., (2003) thì vách tế bào sau khi xử lý bằng enzyme protease trong 5 giờ, ở 45OC/ pH = 10,5 thu phần cặn thì hàm lượng protein xác định cho thấy hiệu quả của protease khi kết quả cho thấy lượng protein chỉ còn 5%. Nghĩa là protease đã thủy phân hết 75% hàm lượng protein trong vách tế bào và β-Glucan được tinh sạch lên đến 92%. V. KẾT LUẬN Phương pháp enzyme cho hiệu quả tinh sạch sản phẩm β- glucan khi loại bỏ phần lớn hàm lượng protein, α-glucan và béo trong mẫu. Trong đó, nồng độ enzyme protease và α-amylase sử dụng lần lượt là 15 U/ml và 3 U/ml. Đồng thời loại bỏ béo bằng Ethanol 960. Kết quả là hàm lượng β-glucan cuối cùng tính theo vật chất khô là 67,7 ± 1,52%. Từ đó, đã xây dựng được qui trình thu nhận β-glucan đạt mức >60% bằng enzyme (Hình 5). TÀI LIỆU THAM KHẢO Tài liệu tiếng Việt Đỗ Phương Thảo, 2017. Câu chuyện thoái vốn Nhà Nước và diện mạo mới cho ngành bia Việt Nam. Báo cáo ngành bia. Tài liệu tiếng Anh Andriy Synytsya, Katerina Mícková, Alla Synytsya, Ivan Jablonsky, Jirí Spevácekc, Vladimír Erban, Eliška Kováríková, Jana Copíková, 2009. Glucans from fruit bodies of cultivated mushrooms Pleurotus ostreatus and Pleurotus eryngii: Structure and potential prebiotic activity; Carbohydrate Polymers, 76, 548–556. Artūras Javmen, Saulius Grigiškis, Raimonda Gliebutė, 2012. β-glucan extraction from Saccharomyces cerevisiae yeast using Actinomyces rutgersensis 88 yeast lyzing enzymatic complex; BIOLOGIJA, 58(2),51-59. Asif Ahmad, Faqir Muhammad Anjum, Tahir Zahoor, Haq Nawaz & hmad Din, 2009. Physicochemical and functional properties of barley β-glucan as affected by different extraction procedures; International Journal of Food Science and Technology, 44, 181–187. 95TẠP CHÍ NGHỀ CÁ SÔNG CỬU LONG - SỐ 13 - THÁNG 6/2019 VIỆN NGHIÊN CỨU NUÔI TRỒNG THỦY SẢN II OPTIMIZATION OF YEAST CELLS HYDROLYSATION TO OBTAIN BETA-GLUCAN FROM SPENT BREWER’S YEAST RESIDUE Pham Duy Hai1*, Nguyen Quoc Cuong1, Ly Huu Toan1, Nguyen Van Nguyen1 ABSTRACT β-glucan is a natural compound that stimulates non-specific immunity in aquatic animals. Among various sources of β-glucan, Saccharomyces cerevisiae is considered a rich and affordable source of β-glucan from beverage industry. Many methods of extraction have been applied to obtain the highest quantity of purified β-glucan. In this study, enzyme method was used to purify β-glucan from other components in spent brewer’s yeast residue. Two kinds of hydrolyzing enzymes, protease PA 3000 and α-amylase Licuamil, were tested on the capacity to degrade protein and α-glucan molecule respectively, after cell wall destruction step. The results showed that protein content after hydrolysation decreased about 6 times. Optimal concentration of protease was 15 U/ml. In addition, optimal α-amylase concentration was 3 U/ml when α-glucan content dropped about 8 times. This treatment has lead to the final β-glucan content as high as 67.70 % on dry weight basis. Keywords: β-glucan, enzyme method, hydrolysation, spent brewer’s yeast residue. Người phản biện: TS. Nguyễn Hoàng Nam Kha Ngày nhận bài: 15/5/2019 Ngày thông qua phản biện: 26/6/2019 Ngày duyệt đăng: 28/6/2019 1 Research Center for Aqua-Feed Nutrition and Fishery Post-Harvest Technology, Research Institute for Aquaculture No.2 *Email: duyhaipp@gmail.com
File đính kèm:
 nghien_cuu_quy_trinh_thuy_phan_te_bao_nam_men_thu_nhan_beta.pdf
nghien_cuu_quy_trinh_thuy_phan_te_bao_nam_men_thu_nhan_beta.pdf

