Nghiên cứu bào chế gel in situ chứa Ranitidin Hydroclorid nổi trong dạ dày
Ranitidin là một thuốc kháng histamin H2 có tác dụng giảm lượng acid dạ dày chỉ định trong trường
hợp loét dạ dày – tá tràng, trào ngược dạ dày thực quản. Ranitidin có cửa sổ hấp thu hẹp và bị
phân hủy ở ruột già. Dạng bào chế nổi giúp thuốc tăng thời gian lưu trong dạ dày và giải phóng
hoạt chất từ từ giúp cải thiện sinh khả dụng. Ngoài ra dạng bào chế này còn tạo thành lớp màng
ngăn cách cơ học trên mặt dịch vị giúp làm giảm sự trào ngược. Nghiên cứu này được thực hiện
nhằm xây dựng công thức gel in situ chứa ranitidin nổi trong dạ dày dựa trên các chỉ tiêu về cảm
quan, thời gian nổi tiềm thời và tổng cộng, thời gian hình thành gel và độ giải phóng hoạt chất. Kết
quả thu được công thức gel in situ chứa ranitidin nổi trong dạ dày có thành phần tá dược
natri alginat 2%, pectin 1%, HPMC 0,5%, natri citrat 0,25%, calci carbonat 1% đạt các tiêu chí đề ra
bao gồm: cảm quan, thời gian nổi tiềm thời, thời gian nổi tổng cộng, thời gian hình thành gel và
đặc tính giải phóng hoạt chất.

Trang 1

Trang 2

Trang 3
Trang 4
Trang 5
Trang 6

Trang 7

Trang 8
Tóm tắt nội dung tài liệu: Nghiên cứu bào chế gel in situ chứa Ranitidin Hydroclorid nổi trong dạ dày

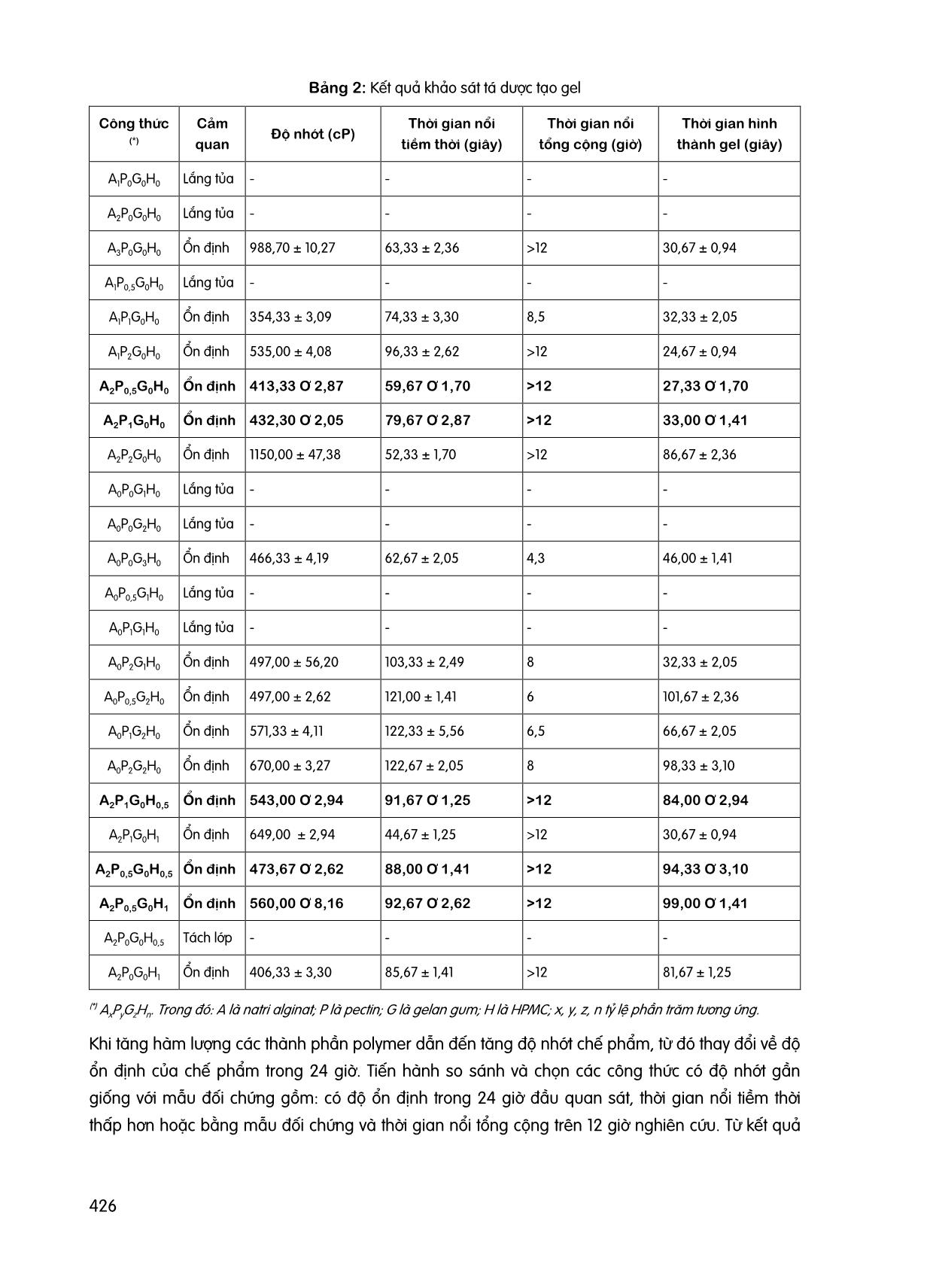
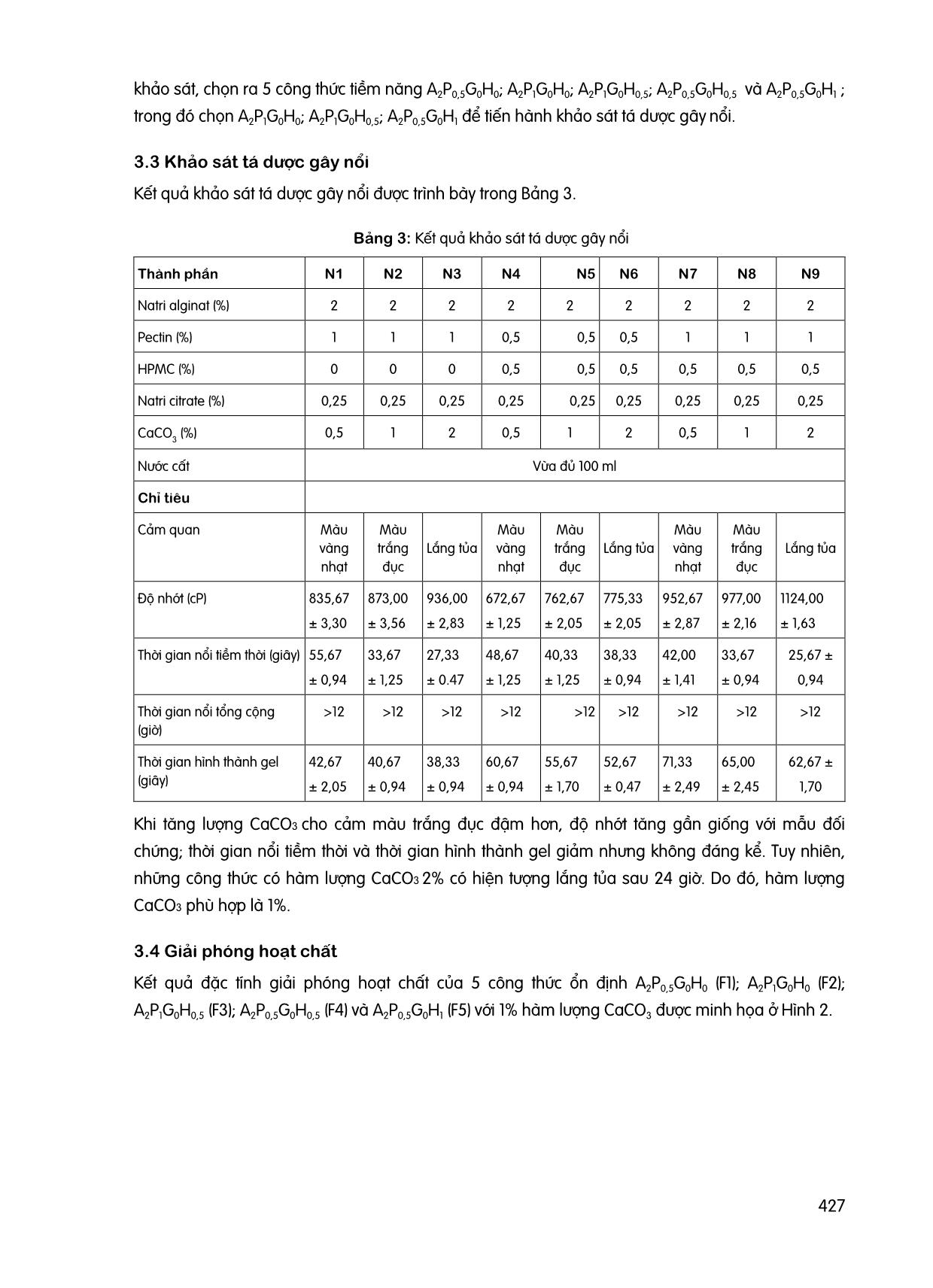
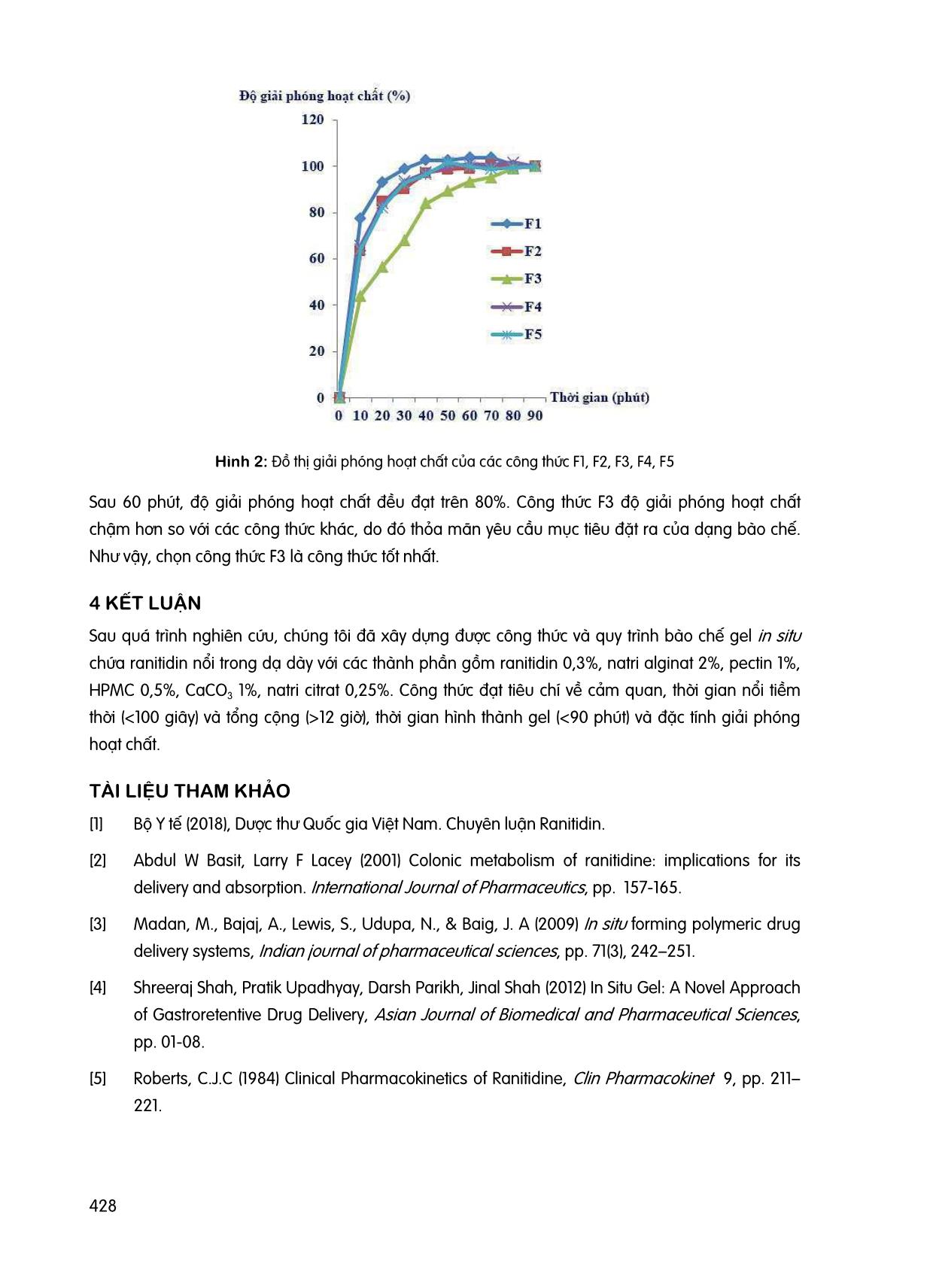
423 NGHIÊN CỨU BÀO CHẾ GEL IN SITU CHỨA RANITIDIN HYDROCLORID NỔI TRONG DẠ DÀY Trần Quang Huy, Lê Bá Ánh, Phạm Hoài Hoàng Lan Khoa Dược, Trường Đại học Công Nghệ TP. Hồ Chí Minh GVHD: ThS.DS. Nguyễn Hữu Phước TÓM TẮT Ranitidin là một thuốc kháng histamin H2 có tác dụng giảm lượng acid dạ dày chỉ định trong trường hợp loét dạ dày – tá tràng, trào ngược dạ dày thực quản. Ranitidin có cửa sổ hấp thu hẹp và bị phân hủy ở ruột già. Dạng bào chế nổi giúp thuốc tăng thời gian lưu trong dạ dày và giải phóng hoạt chất từ từ giúp cải thiện sinh khả dụng. Ngoài ra dạng bào chế này còn tạo thành lớp màng ngăn cách cơ học trên mặt dịch vị giúp làm giảm sự trào ngược. Nghiên cứu này được thực hiện nhằm xây dựng công thức gel in situ chứa ranitidin nổi trong dạ dày dựa trên các chỉ tiêu về cảm quan, thời gian nổi tiềm thời và tổng cộng, thời gian hình thành gel và độ giải phóng hoạt chất. Kết quả thu được công thức gel in situ chứa ranitidin nổi trong dạ dày có thành phần tá dược natri alginat 2%, pectin 1%, HPMC 0,5%, natri citrat 0,25%, calci carbonat 1% đạt các tiêu chí đề ra bao gồm: cảm quan, thời gian nổi tiềm thời, thời gian nổi tổng cộng, thời gian hình thành gel và đặc tính giải phóng hoạt chất. Từ khóa: Gel in situ, ranitidin, loét dạ dày – tá tràng. 1 ĐẶT VẤN ĐỀ Ranitidin được chỉ định trong các trường hợp loét dạ dày – tá tràng, trào ngược dạ dày thực quản, có cửa sổ hấp thu hẹp và dễ bị phân hủy ở ruột già [1] [2] [5]. Dạng bào chế gel nổi giúp tăng thời gian lưu trữ tại dạ dày, từ đó giúp cải thiện sinh khả dụng của thuốc [4]. Dạng bào chế này tồn tại ở dạng “sol” trước khi vào cơ thể và hình thành “gel” tại dạ dày. Sự hình thành gel phụ thuộc vào nhiều yếu tố như: nhiệt độ, pH, sự hiện diện của các ion trong môi trường dịch vị, [3]. Trong nghiên cứu này, chúng tôi tiến hành khảo sát tỷ lệ các tá dược gây nổi và tạo gel dựa trên các tiêu chí như: cảm quan, thời gian nổi tiềm thời và tổng cộng, thời gian hình thành gel và đặc tính giải phóng hoạt chất để tìm ra công thức gel in situ nổi trong dạ dày chứa ranitidin tốt nhất. 2 PHƯƠNG PHÁP NGHIÊN CỨU 2.1 Đối tượng nghiên cứu Đối tượng khảo sát: hỗn hợp tạo gel in situ chứa ranitidin nổi trong dạ dày. Nguyên liệu: Ranitidin Hydroclorid (Trung Quốc, TCCS). Mẫu đối chứng: Gaviscon. 424 Hóa chất và thuốc thử: Natri citrat, natri alginat, pectin, calci carbonat (CaCO3), hydroxypropyl methylcellulose (HPMC), gellan gum, acid hydroclorid đậm đặc (HClđđ), natri hydroxyd (NaOH), ranitidin hydroclorid đạt chuẩn phân tích. Trang thiết bị: Cân phân tích ML204 (Mettler Toledo), máy khuấy đũa IKA RW 20 Digital (Ministar), máy đo pH GLP-21 (Crison), máy quang phổ UV-Vis (Hitachi), máy đo độ nhớt (Brookfield), cân kỹ thuật (Ohaus), máy đo độ hòa tan (Copley). 2.2 Nội dung nghiên cứu 2.2.1 Khảo sát tính chất cơ lý hóa của mẫu đối chứng (Gaviscon) Thời gian hình thành gel: Cho 2 ml Gaviscon vào 10 ml dung dịch dạ dày nhân tạo (không enzyme) (Theo Dược điển Việt Nam V). Thời gian hình thành gel được tính từ khi bắt đầu cho Gaviscon đến khi hình thành lớp màng gel. Độ nhớt: Cho 2 ml Gaviscon vào máy đo độ nhớt Brookfield cone & plate sử dụng spindle CPA-41Z. Đo trong 2 phút với tốc độ quay 10 vòng/phút ở 25 OC. Thời gian nổi tiềm thời: Cho 10 ml Gaviscon vào 900 ml dung dịch dạ dày nhân tạo (pH=1,2) trong cốc của máy thử độ hòa tan (tốc độ quay 50 vòng/phút, nhiệt độ 37 ± 0,5 OC). Thời gian nổi tiềm thời được tính từ khi cho mẫu thuốc khảo sát vào môi trường thử nghiệm đến khi gel bắt đầu nổi trên bề mặt. Thời gian nổi tổng cộng: Thời gian nổi tổng cộng được tính bằng thời gian kể từ lúc bắt đầu dạng bào chế nổi đến khi gel biến mất hoặc chìm xuống hoàn toàn trong thí nghiệm đo thời gian nổi tiềm thời. Tất cả các tiêu chí tiến hành trên 3 mẫu và lấy giá trị trung bình. 2.2.2 Xây dựng quy trình bào chế Quy trình bào chế gel in situ được minh họa theo sơ đồ Hình 1. Hình 1: Lưu đồ bào chế 100 ml gel in situ chứa ranitidin 425 2.2.3 Khảo sát tá dược tạo gel Thử nghiệm 24 công thức, trong đó thay đổi tỷ lệ các thành phần tá dược natri alginat 1%, 2%, 3%; pectin 0%, 0,5%, 1%, 2%; gellan gum 0%, 1%, 2%, 3%; HPMC 0%, 0,5%, 1%; natri citrat 0,25%, CaCO3 1%. Chọn các công thức ổn định dựa trên tiêu chí cảm quan (màu sắc, không bị tách lớp trong 24 giờ), độ nhớt, thời gian hình thành gel, thời gian nổi tiềm thời, thời gian nổi tổng cộng và dựa trên kết quả so sánh với mẫu đối chứng. 2.2.4 Khảo sát tá dược gây nổi Các công thức ổn định được lựa chọn từ bước nghiên cứu trước được sử dụng để khảo sát tỷ lệ CaCO3 theo tỷ lệ lần lượt là 0,5%, 1%, 2%. 2.2.5 Đặc tính giải phóng hoạt chất Chọn ra các công thức tốt nhất và tiến hành đo độ giải phóng hoạt chất. Tiến hành cân 1 lượng gel in situ chứa ranitidin tương ứng với 0,01 g ranitidin và cho vào 900 ml dung dịch dạ dày nhân tạo trong máy đo độ hòa tan (tốc độ quay 50 vòng/phút, nhiệt độ 37 ± 0,5 oC). Mỗi công thức tiến hành trên 3 cốc đo độ hòa tan khác nhau. Hút 10 ml ở từng cốc đo mỗi 10 phút, tiến hành đo độ hấp thu tại bước sóng 318 nm. Sau mỗi lần lấy mẫu bổ sung 10 ml dung dịch dạ dày nhân tạo vào cốc đo độ hòa tan. Tính lượng hoạt chất phóng thích tại từng thời điểm dựa vào độ hấp thu. 2.3 Phân tích dữ liệu Trình bày và thu thập dữ liệu dưới dạng Mean ± SD, sử dụng phần mềm Excel 2016 để xử lý thống kê và vẽ đồ thị. 3 KẾT QUẢ VÀ BÀN LUẬN 3.1 Tính chất cơ lý của mẫu đối chứng Kết quả tính chất cơ lý của mẫu đối chứng được trình bày trong Bảng 1. Bảng 1: Kết quả khảo sát tính chất cơ lý của Gaviscon Chỉ tiêu Kết quả Cảm quan Hỗn dịch trắng đục, đồng nhất Độ nhớt (cP) 398,67 ± 1,89 Thời gian nổi tiềm thời (giây) 298,67 ± 13,10 Thời gian nổi tổng cộng (giờ) >12 Thời gian hình thành gel (giây) 156,67 ± 2,36 3.2 Lựa chọn tá dược tạo gel Kết quả lựa chọn tá dược tạo gel được trình bày trong Bảng 2. 426 Bảng 2: Kết quả khảo sát tá dược tạo gel Công thức (*) Cảm quan Độ nhớt (cP) Thời gian nổi tiềm thời (giây) Thời gian nổi tổng cộng (giờ) Thời gian hình thành gel (giây) A1P0G0H0 Lắng tủa - - - - A2P0G0H0 Lắng tủa - - - - A3P0G0H0 Ổn định 988,70 ± 10,27 63,33 ± 2,36 >12 30,67 ± 0,94 A1P0,5G0H0 Lắng tủa - - - - A1P1G0H0 Ổn định 354,33 ± 3,09 74,33 ± 3,30 8,5 32,33 ± 2,05 A1P2G0H0 Ổn định 535,00 ± 4,08 96,33 ± 2,62 >12 24,67 ± 0,94 A2P0,5G0H0 Ổn định 413,33 ± 2,87 59,67 ± 1,70 >12 27,33 ± 1,70 A2P1G0H0 Ổn định 432,30 ± 2,05 79,67 ± 2,87 >12 33,00 ± 1,41 A2P2G0H0 Ổn định 1150,00 ± 47,38 52,33 ± 1,70 >12 86,67 ± 2,36 A0P0G1H0 Lắng tủa - - - - A0P0G2H0 Lắng tủa - - - - A0P0G3H0 Ổn định 466,33 ± 4,19 62,67 ± 2,05 4,3 46,00 ± 1,41 A0P0,5G1H0 Lắng tủa - - - - A0P1G1H0 Lắng tủa - - - - A0P2G1H0 Ổn định 497,00 ± 56,20 103,33 ± 2,49 8 32,33 ± 2,05 A0P0,5G2H0 Ổn định 497,00 ± 2,62 121,00 ± 1,41 6 101,67 ± 2,36 A0P1G2H0 Ổn định 571,33 ± 4,11 122,33 ± 5,56 6,5 66,67 ± 2,05 A0P2G2H0 Ổn định 670,00 ± 3,27 122,67 ± 2,05 8 98,33 ± 3,10 A2P1G0H0,5 Ổn định 543,00 ± 2,94 91,67 ± 1,25 >12 84,00 ± 2,94 A2P1G0H1 Ổn định 649,00 ± 2,94 44,67 ± 1,25 >12 30,67 ± 0,94 A2P0,5G0H0,5 Ổn định 473,67 ± 2,62 88,00 ± 1,41 >12 94,33 ± 3,10 A2P0,5G0H1 Ổn định 560,00 ± 8,16 92,67 ± 2,62 >12 99,00 ± 1,41 A2P0G0H0,5 Tách lớp - - - - A2P0G0H1 Ổn định 406,33 ± 3,30 85,67 ± 1,41 >12 81,67 ± 1,25 (*) AxPyGzHn. Trong đó: A là natri alginat; P là pectin; G là gelan gum; H là HPMC; x, y, z, n tỷ lệ phần trăm tương ứng. Khi tăng hàm lượng các thành phần polymer dẫn đến tăng độ nhớt chế phẩm, từ đó thay đổi về độ ổn định của chế phẩm trong 24 giờ. Tiến hành so sánh và chọn các công thức có độ nhớt gần giống với mẫu đối chứng gồm: có độ ổn định trong 24 giờ đầu quan sát, thời gian nổi tiềm thời thấp hơn hoặc bằng mẫu đối chứng và thời gian nổi tổng cộng trên 12 giờ nghiên cứu. Từ kết quả 427 khảo sát, chọn ra 5 công thức tiềm năng A2P0,5G0H0; A2P1G0H0; A2P1G0H0,5; A2P0,5G0H0,5 và A2P0,5G0H1 ; trong đó chọn A2P1G0H0; A2P1G0H0,5; A2P0,5G0H1 để tiến hành khảo sát tá dược gây nổi. 3.3 Khảo sát tá dược gây nổi Kết quả khảo sát tá dược gây nổi được trình bày trong Bảng 3. Bảng 3: Kết quả khảo sát tá dược gây nổi Thành phần N1 N2 N3 N4 N5 N6 N7 N8 N9 Natri alginat (%) 2 2 2 2 2 2 2 2 2 Pectin (%) 1 1 1 0,5 0,5 0,5 1 1 1 HPMC (%) 0 0 0 0,5 0,5 0,5 0,5 0,5 0,5 Natri citrate (%) 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 CaCO 3 (%) 0,5 1 2 0,5 1 2 0,5 1 2 Nước cất Vừa đủ 100 ml Chỉ tiêu Cảm quan Màu vàng nhạt Màu trắng đục Lắng tủa Màu vàng nhạt Màu trắng đục Lắng tủa Màu vàng nhạt Màu trắng đục Lắng tủa Độ nhớt (cP) 835,67 ± 3,30 873,00 ± 3,56 936,00 ± 2,83 672,67 ± 1,25 762,67 ± 2,05 775,33 ± 2,05 952,67 ± 2,87 977,00 ± 2,16 1124,00 ± 1,63 Thời gian nổi tiềm thời (giây) 55,67 ± 0,94 33,67 ± 1,25 27,33 ± 0.47 48,67 ± 1,25 40,33 ± 1,25 38,33 ± 0,94 42,00 ± 1,41 33,67 ± 0,94 25,67 ± 0,94 Thời gian nổi tổng cộng (giờ) >12 >12 >12 >12 >12 >12 >12 >12 >12 Thời gian hình thành gel (giây) 42,67 ± 2,05 40,67 ± 0,94 38,33 ± 0,94 60,67 ± 0,94 55,67 ± 1,70 52,67 ± 0,47 71,33 ± 2,49 65,00 ± 2,45 62,67 ± 1,70 Khi tăng lượng CaCO3 cho cảm màu trắng đục đậm hơn, độ nhớt tăng gần giống với mẫu đối chứng; thời gian nổi tiềm thời và thời gian hình thành gel giảm nhưng không đáng kể. Tuy nhiên, những công thức có hàm lượng CaCO3 2% có hiện tượng lắng tủa sau 24 giờ. Do đó, hàm lượng CaCO3 phù hợp là 1%. 3.4 Giải phóng hoạt chất Kết quả đặc tính giải phóng hoạt chất của 5 công thức ổn định A2P0,5G0H0 (F1); A2P1G0H0 (F2); A2P1G0H0,5 (F3); A2P0,5G0H0,5 (F4) và A2P0,5G0H1 (F5) với 1% hàm lượng CaCO3 được minh họa ở Hình 2. 428 Hình 2: Đồ thị giải phóng hoạt chất của các công thức F1, F2, F3, F4, F5 Sau 60 phút, độ giải phóng hoạt chất đều đạt trên 80%. Công thức F3 độ giải phóng hoạt chất chậm hơn so với các công thức khác, do đó thỏa mãn yêu cầu mục tiêu đặt ra của dạng bào chế. Như vậy, chọn công thức F3 là công thức tốt nhất. 4 KẾT LUẬN Sau quá trình nghiên cứu, chúng tôi đã xây dựng được công thức và quy trình bào chế gel in situ chứa ranitidin nổi trong dạ dày với các thành phần gồm ranitidin 0,3%, natri alginat 2%, pectin 1%, HPMC 0,5%, CaCO3 1%, natri citrat 0,25%. Công thức đạt tiêu chí về cảm quan, thời gian nổi tiềm thời (12 giờ), thời gian hình thành gel (<90 phút) và đặc tính giải phóng hoạt chất. TÀI LIỆU THAM KHẢO [1] Bộ Y tế (2018), Dược thư Quốc gia Việt Nam. Chuyên luận Ranitidin. [2] Abdul W Basit, Larry F Lacey (2001) Colonic metabolism of ranitidine: implications for its delivery and absorption. International Journal of Pharmaceutics, pp. 157-165. [3] Madan, M., Bajaj, A., Lewis, S., Udupa, N., & Baig, J. A (2009) In situ forming polymeric drug delivery systems, Indian journal of pharmaceutical sciences, pp. 71(3), 242–251. [4] Shreeraj Shah, Pratik Upadhyay, Darsh Parikh, Jinal Shah (2012) In Situ Gel: A Novel Approach of Gastroretentive Drug Delivery, Asian Journal of Biomedical and Pharmaceutical Sciences, pp. 01-08. [5] Roberts, C.J.C (1984) Clinical Pharmacokinetics of Ranitidine, Clin Pharmacokinet 9, pp. 211– 221. Khoa XÂY DỰNG
File đính kèm:
 nghien_cuu_bao_che_gel_in_situ_chua_ranitidin_hydroclorid_no.pdf
nghien_cuu_bao_che_gel_in_situ_chua_ranitidin_hydroclorid_no.pdf

