Chọn lọc các dòng bông (Gossypium hirsutum L.) chuyển gen bar chống chịu thuốc
Basta-herbicide was tested at a concentration of 0.6 kg ai./ha for
confirming resistance of 116 bar transgenic T1 lines; many lines with
tolerance were obtained. Evaluation of selected lines using PCR, the
integration and expression of transgenes in genome of transgenic plants
was determined by southern blot and northern blot techniques. The
combination of molecular and biological assessments resulted in the
selection of 5 lines, i.e., B1, B6, B9, B18, and BF17 contained 01
target-gene copy which expressed transcription activities and showed
uniform growth and best tolerance to glufosinate. Two T2 transgenic
cotton lines, i.e., B9 and BF17, carried one copy of the gene which
transmitted to the next generation according to the Mendel’s rules
of inheritance. These transgenic lines were highly resistant to Basta
herbicide at a concentration of 0.6 kg ai./ha and had no difference
in botanical characteristics and disease resistance in comparison with
original non-transgenic Coker310 cotton plant.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6
Trang 7

Trang 8

Trang 9
Tóm tắt nội dung tài liệu: Chọn lọc các dòng bông (Gossypium hirsutum L.) chuyển gen bar chống chịu thuốc

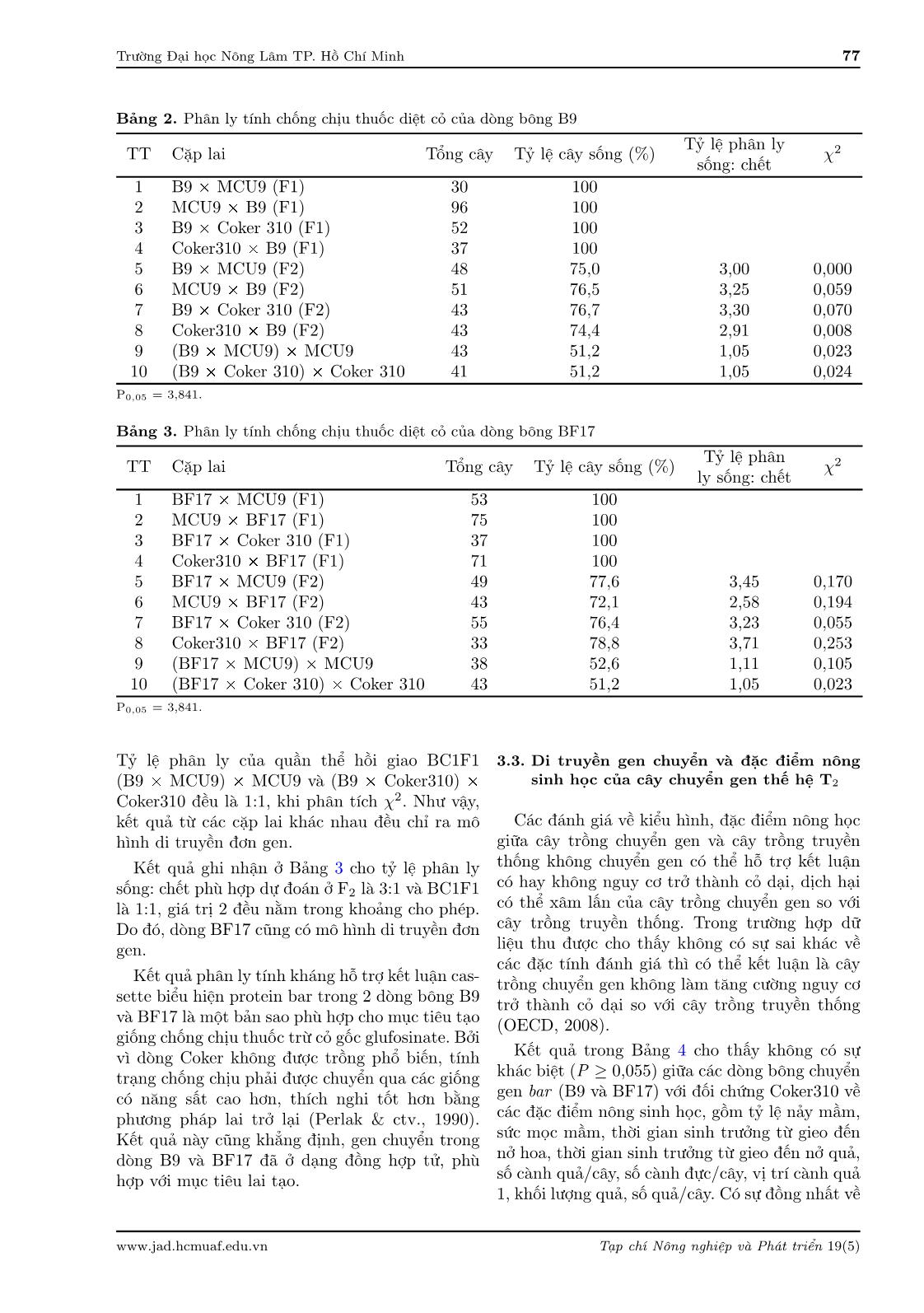
- 25% diện tích lá bị hoại tử Chống chịu kém (++): > 25 - 50% diện tích lá bị hoại tử Chống chịu rất kém (+): > 50% diện tích lá bị hoại tử 2.2.7. Di truyền tính chống chịu thuốc diệt cỏ trong cây bông chuyển gen Dòng bông chuyển gen bar B9 và BF17 được lai tạo F1, F2 và BC1F1 qua 2 bước: Bước 1, hai dòng được lai với MCU9 (giống thuần thường dùng làm mẹ cho các giống lai) tạo F1, sau đó tự thụ tạo F2 và lai trở lại với MCU9 tạo BC1F11. Bước 2, B9 và BF17 được lai với giống nền không chuyển gen Coker310, sau đó tự thụ tạo F1, F2 và lai tạo BC1 được tạo tương tự như trên. Phun Basta (0,6 kg ai./ha) lên cây con ở giai đoạn 7 - 8 lá. Theo dõi cây con sống/chết ở giai đoạn 7 ngày sau phun, tỷ lệ sống: chết được dùng để phân tích sự phân ly của gen chuyển. 2.2.8. Đặc điểm nông sinh học và hình thái Thu thập theo phương pháp IPGRI và quy phạm khảo nghiệm DUS của ngành bông, so sánh với đặc điểm giống gốc. Trong đó, thời gian phát dục qua các giai đoạn, tỷ lệ mọc, sức nảy mầm và các đặc điểm hình thái được theo dõi 20 cây/hàng/dòng. Các chỉ tiêu còn lại được theo dõi 10 cây trong số 20 cây trên (đo đếm cách cây, trừ cây đầu hàng và cây mất ngọn). 3. Kết Quả và Thảo Luận 3.1. Chọn lọc các dòng chuyển gen bar thế hệ T1 Bảng 1 thể hiện kết quả của 17 dòng bông chọn được từ 116 dòng bằng thử tính chống chịu thuốc diệt cỏ (Hình 1). Các cây bông chọn được đánh giá sự hiện diện của gen chuyển bảng PCR (Hình 2A), xác định số bản sao gen chuyển bằng South- ern blot (Hình 2B, C) và xác định sự biểu hiện của gen chuyển bằng Northern blot (Hình 2D). Xử lý Basta 15SL (nồng độ 0,6 kg ai./ha) ở giai đoạn 4 - 5 lá cho 47 dòng mang gen pCB301: bar thu được 18 dòng có cây chống chịu glufosinate, nhưng tỷ lệ cây sống rất thấp. Mức độ chống chịu của các dòng đều từ yếu - trung bình (cây có khả năng phục hồi). Năm dòng chọn CB3, CB15, CFB2, CFB6 và CFB18 có tỷ lệ sống 7,1 - 21,4% (Bảng 1) và mức độ chống chịu tốt hơn cả và cây dễ hồi phục (Hình 1E). Xử lý Basta 15SL (nồng độ 0,6 kg ai./ha) ở giai đoạn 4 - 5 lá cho 69 dòng T1 chuyển gen pCAMBIA: bar thu được 48 có cây chống chịu glufosinate ở mức trung bình- rất cao. 12 dòng chọn (Bảng 1) có tỷ lệ cây sống 32,4 - 81,4%, cây chống chịu rất cao (Hình 1F). Đối với các dòng có tỷ lệ sống: chết xấp xỉ 3:1 tương đương tỷ lệ dự kiến cho một gen trội duy nhất trong quần thể tự thụ phấn. Việc áp dụng một loại thuốc diệt cỏ như glu- fosinate có thể gây ra các phản ứng nhạy cảm khác nhau trong cỏ dại, chủ yếu là do tính biến đổi di truyền rộng của chúng. Sự nhạy cảm khác nhau có thể được giải thích bằng sự khác biệt trong chuyển vị, hấp thu và chuyển hóa thuốc diệt cỏ (Everman & ctv., 2009). Bên cạnh đó, các yếu tố dẫn đến di truyền phi Mendel là kiểu gen cây biến đổi do phương pháp chuyển gen, bất thường nhiễm sắc thể, allen không tương đồng, do sự tích hợp gen chuyển không ổn định hoặc im lặng gen chuyển, có thể do tương tác giữa gen chuyển và genome cây nhận (truyền gen kém, trao đổi chéo, không tương hợp nên không có đồng hợp tử) (Zhang & ctv., 2005). Để chắc chắn tính chống chịu thuốc diệt cỏ Basta được tạo ra bởi gen chuyển cần kiểm tra sự có mặt của gen bar, kết quả là gen bar có mặt trong cây chuyển gen thế hệ T1 (Hình 2A). Kiểm tra sự gắn kết của gen chuyển bằng Southern blot cho thấy 10 dòng chuyển gen giả định là CB3, CB15, CFB2, CFB6, CFB16, B1, B6, B9, B18 và BF17 mang 1 bản sao, 2 dòng B2, B4 mang 2 bản sao. Trên đối chứng không chuyển gen Coker310, không phát hiện băng lai (Hình 2B, C). Kết quả này cũng xác nhận kết quả PCR và chỉ ra sự tích hợp của vùng T-DNA trong gemome cây chuyển gen. Sự xuất hiện băng lai giữa mẫu dò là cDNA từ cây chuyển gen với RNA tổng số của 6 dòng CB3, CB5, B2, B8, B9 và BF17 (Hình 2D) cho thấy có hoạt động phiên mã của gen chuyển. Thử nghiệm sinh học về khả năng chịu thuốc diệt cỏ ở cả cây chuyển gen và không chuyển gen thế hệ T2 cũng được áp dụng với Basta 15SL. Lá của những cây không được biến đổi gen bị cháy (Hình 3C), trong khi những cây của cây biến đổi gen không có triệu chứng như vậy (Hình 3B). Hình 3A cho thấy, trước khi phun thuốc cây Tạp chí Nông nghiệp và Phát triển 19(5) www.jad.hcmuaf.edu.vn Trường Đại học Nông Lâm TP. Hồ Chí Minh 75 Bảng 1. Số cây mọc, số cây sống, tỷ lệ (%) cây chống chịu Basta 15SL của 12 dòng bông chọn TT Dòng bông Số cây mọc Số cây sống Tỷ lệ cây sống (%) Mức độ 1 CB3 112 8 7,1 +++ 2 CB15 95 11 11,6 +++ 3 CFB2 73 11 15,1 +++ 4 CFB6 107 15 14,0 +++ 5 CFB18 42 9 21,4 +++ 1 B1 132 82 62,1 +++++ 2 B2 16 13 81,3 ++++ 3 B3 84 59 70,2 +++++ 4 B4 42 34 81,4 ++++ 5 B6 66 45 68,2 ++++ 6 B9 198 142 71,7 +++++ 7 B18 111 36 32,4 +++++ 8 B20 36 32 62,8 ++++ 9 BF8 102 52 51,0 +++++ 10 BF12 91 36 39,6 ++++ 11 BF17 82 42 51,2 +++++ 12 BF25 42 30 71,4 +++ Coker310 35 0 0 - Hình 1. Cây bông chuyển gen bar thế hệ T1 trước và sau khi xử lý thuốc diệt cỏ cỏ Basta 15SL (nồng độ 0,6 kg ai./ha), triệu chứng sau xử lý 5 ngày ở giai đoạn 4 - 5 lá. A: Trước khi xử lý; B: Sau xử lý thuốc diệt cỏ; C: Cây không chống chịu; D, E: Cây chống chịu thuốc diệt cỏ ở mức kém; F: Cây chống chịu thuốc diệt cỏ ở mức cao; và G: đối chứng không chống chịu. bông và cỏ phát triển rất tốt, sau phun Basta với nồng độ 0,6 kg ai./ha làm cho cỏ và đối chứng là Coker310 chết hoàn toàn (Hình 3C) và cây bông không bị ảnh hưởng (Hình 3B). Mức độ chống chịu của các dòng có khác nhau, chống chịu cao (Hình 3D) và chống chịu trung bình (Hình 3E). www.jad.hcmuaf.edu.vn Tạp chí Nông nghiệp và Phát triển 19(5) 76 Trường Đại học Nông Lâm TP. Hồ Chí Minh Hình 2. Đánh giá các dòng bông chuyển gen bằng kỹ thuật sinh học phân tử. A: Sản phẩn PCR gen bar trong cây chuyển gen. M: thang DNA chuẩn; (+): plasmid pCAMBIA1300: bar ; (-): Coker310; 1-24 cây chuyển gen. B: Southern blot. (M): thang DNA chuẩn 1kb; P: plasmid pCB301: bar/PstI (+) EcoRI; 1: (-) Coker310; CB3, CB15, CFB2, CFB6 và CFB18: dòng chuyển gen. C: Southern blot. (M): thang DNA chuẩn; P: plasmid pCAMBIA: bar/PstI (+) EcoRI; B1, B2, B4, B6, B9, B18 và BF17: dòng chuyển gen; (-): Coker310. D: Northern blot. (M): thang RNA chuẩn 0,5 kb; CB3, CB5, B2, B8, B9 và BF17: dòng chuyển gen; (-): Coker310. Hình 3. Dòng bông chuyển gen bar thế hệ T2 xử lý Basta ở giai đoạn 7 - 8 lá, liều lượng 0,6 kg a.i/ha. (A) trước khi phun, (B) sau phun 7 ngày. Năm dòng B1, B9, B18 và BF8, BF17 thể hiện mức độ chống chịu cao và ổn định. 3.2. Di truyền tính chống chịu thuốc diệt cỏ của các dòng chuyển gen bar Để làm sáng tỏ sự di truyền tính trạng chịu thuốc diệt cỏ của dòng B9 và BF17, phân tích di truyền cho tính trạng này đã được thực hiện. Các tổ hợp lai F1 được tạo ra là B9ÖMCU9, MCU9ÖB9, B9ÖCoker310 và Coker 310ÖB9 chống chịu hoàn toàn với glufosinate (Bảng 2). Chứng tỏ rằng tính trạng chống chịu là trội và không bị ảnh hưởng bởi di truyền theo dòng mẹ (Zhang & ctv., 2005). Quần thể F2 B9ÖMCU9 phân ly theo tỷ lệ chuẩn 3:1. Phân ly sống chết ở quần thể F2 từ cặp lai Coker310 ÖB9 cũng đã xác nhận tỷ lệ xấp xỉ 3:1 (χ2 = 0.008). Tạp chí Nông nghiệp và Phát triển 19(5) www.jad.hcmuaf.edu.vn Trường Đại học Nông Lâm TP. Hồ Chí Minh 77 Bảng 2. Phân ly tính chống chịu thuốc diệt cỏ của dòng bông B9 TT Cặp lai Tổng cây Tỷ lệ cây sống (%) Tỷ lệ phân ly sống: chết χ2 1 B9 Ö MCU9 (F1) 30 100 2 MCU9 Ö B9 (F1) 96 100 3 B9 Ö Coker 310 (F1) 52 100 4 Coker310 Ö B9 (F1) 37 100 5 B9 Ö MCU9 (F2) 48 75,0 3,00 0,000 6 MCU9 Ö B9 (F2) 51 76,5 3,25 0,059 7 B9 Ö Coker 310 (F2) 43 76,7 3,30 0,070 8 Coker310 Ö B9 (F2) 43 74,4 2,91 0,008 9 (B9 Ö MCU9) Ö MCU9 43 51,2 1,05 0,023 10 (B9 Ö Coker 310) Ö Coker 310 41 51,2 1,05 0,024 P0,05 = 3,841. Bảng 3. Phân ly tính chống chịu thuốc diệt cỏ của dòng bông BF17 TT Cặp lai Tổng cây Tỷ lệ cây sống (%) Tỷ lệ phân ly sống: chết χ2 1 BF17 Ö MCU9 (F1) 53 100 2 MCU9 Ö BF17 (F1) 75 100 3 BF17 Ö Coker 310 (F1) 37 100 4 Coker310 Ö BF17 (F1) 71 100 5 BF17 Ö MCU9 (F2) 49 77,6 3,45 0,170 6 MCU9 Ö BF17 (F2) 43 72,1 2,58 0,194 7 BF17 Ö Coker 310 (F2) 55 76,4 3,23 0,055 8 Coker310 Ö BF17 (F2) 33 78,8 3,71 0,253 9 (BF17 Ö MCU9) Ö MCU9 38 52,6 1,11 0,105 10 (BF17 Ö Coker 310) Ö Coker 310 43 51,2 1,05 0,023 P0,05 = 3,841. Tỷ lệ phân ly của quần thể hồi giao BC1F1 (B9 Ö MCU9) Ö MCU9 và (B9 Ö Coker310) Ö Coker310 đều là 1:1, khi phân tích χ2. Như vậy, kết quả từ các cặp lai khác nhau đều chỉ ra mô hình di truyền đơn gen. Kết quả ghi nhận ở Bảng 3 cho tỷ lệ phân ly sống: chết phù hợp dự đoán ở F2 là 3:1 và BC1F1 là 1:1, giá trị 2 đều nằm trong khoảng cho phép. Do đó, dòng BF17 cũng có mô hình di truyền đơn gen. Kết quả phân ly tính kháng hỗ trợ kết luận cas- sette biểu hiện protein bar trong 2 dòng bông B9 và BF17 là một bản sao phù hợp cho mục tiêu tạo giống chống chịu thuốc trừ cỏ gốc glufosinate. Bởi vì dòng Coker không được trồng phổ biến, tính trạng chống chịu phải được chuyển qua các giống có năng sất cao hơn, thích nghi tốt hơn bằng phương pháp lai trở lại (Perlak & ctv., 1990). Kết quả này cũng khẳng định, gen chuyển trong dòng B9 và BF17 đã ở dạng đồng hợp tử, phù hợp với mục tiêu lai tạo. 3.3. Di truyền gen chuyển và đặc điểm nông sinh học của cây chuyển gen thế hệ T2 Các đánh giá về kiểu hình, đặc điểm nông học giữa cây trồng chuyển gen và cây trồng truyền thống không chuyển gen có thể hỗ trợ kết luận có hay không nguy cơ trở thành cỏ dại, dịch hại có thể xâm lấn của cây trồng chuyển gen so với cây trồng truyền thống. Trong trường hợp dữ liệu thu được cho thấy không có sự sai khác về các đặc tính đánh giá thì có thể kết luận là cây trồng chuyển gen không làm tăng cường nguy cơ trở thành cỏ dại so với cây trồng truyền thống (OECD, 2008). Kết quả trong Bảng 4 cho thấy không có sự khác biệt (P ≥ 0,055) giữa các dòng bông chuyển gen bar (B9 và BF17) với đối chứng Coker310 về các đặc điểm nông sinh học, gồm tỷ lệ nảy mầm, sức mọc mầm, thời gian sinh trưởng từ gieo đến nở hoa, thời gian sinh trưởng từ gieo đến nở quả, số cành quả/cây, số cành đực/cây, vị trí cành quả 1, khối lượng quả, số quả/cây. Có sự đồng nhất về www.jad.hcmuaf.edu.vn Tạp chí Nông nghiệp và Phát triển 19(5) 78 Trường Đại học Nông Lâm TP. Hồ Chí Minh Bảng 4. Đặc điểm nông học, hình thái và tính mẫn cảm với bệnh hại của các dòng bông chuyển gen bar với giống bông nền Coker310 TT Chỉ tiêu theo dõi B9 BF17 Coker310 P 1 Tỷ lệ nảy mầm (%) 90,4 92,7 90,4 0,678 2 Thời gian từ gieo đến nở quả (ngày) 102,3 104,3 104,0 0,089 3 Số cành quả/cây 8,9 8,9 9,5 0,148 4 Số cành đực/cây 1,6 2,0 2,0 0,084 5 Chiều cao cây (cm) 115,5 120,5 112,5 0,061 6 Hình dạng thân Hình tháp Hình tháp Hình tháp - 7 Màu sắc thân Xanh nhạt Xanh nhạt Xanh nhạt - 8 Màu sắc lá Xanh TB Xanh TB Xanh TB - 9 Màu sắc cánh hoa Trắng ngà Trắng ngà Trắng ngà - 10 Màu sắc phấn hoa Trắng ngà Trắng ngà Trắng ngà - 11 Khối lượng quả (g) 4,9 5,0 4,9 0,289 12 Số quả/cây 10,4 10,6 11,6 0,148 các đặc điểm hình thái (chiều cao cây, hình dạng thân, màu sắc thân, hình dạng lá, màu sắc lá, màu sắc cánh hoa, màu sắc phấn hoa, hình dạng quả) giữa các dòng bông chuyển gen bar với giống nền Coker310. Trong nghiên cứu này, phân tích PCR và Southern blot chứng minh đã tích hợp thành công gen bar vào genome Coker310, phân tích Northern blot khẳng định có sự biểu hiện của gen chuyển. Thử Basta cho thấy các dòng bông chuyển gen có mức độ chống chịu cao với glufos- inate. Đánh giá thêm các đặc điểm thực vật và nông học trong cả B9, BF17 và giống nền chỉ ra không có sự khác biệt đáng kể. Ngoài ra, nghiên cứu phân tích tính di truyền đã xác nhận rằng gen bar phân ly theo quy luật Mendel cho đơn tính trạng. Phát hiện này phù hợp với (Khan & ctv., 2009; Perlak & ctv., 1990; Zhang & ctv., 2005). 4. Kết Luận Tính chống chịu thuốc diệt cỏ glufosinate của các dòng bông chuyển gen được duy trì qua các thế hệ T1 và T2. Chọn được 5 dòng T2 chuyển gen bar B1, B9, B18 và BF8, BF17 mang 1 bản sao, có hoạt động phiên mã của gen chuyển, cây sinh trưởng đồng đều và có mức độ chống chịu thuốc diệt cỏ glu- fosinate cao (0,6 kg ai./ha). Hai dòng bông chuyển gen T2 là B9 và BF17 mang 01 bản sao gen, di truyền gen chuyển theo quy luật Mendel, chống chịu cao với thuốc trừ cỏ Basta ở nồng độ 0,6 kg ai./ha, không sai khác về đặc điểm thực vật học so với giống bông nền Coker310 không chuyển gen. Lời Cam Đoan Chúng tôi cam đoan không có bất kỳ mâu thuẫn nào giữa các tác giả. Lời Cảm Ơn Nghiên cứu này được tài trợ bởi đề tài “Nghiên cứu tạo giống bông kháng sâu và chịu thuốc trừ cỏ bằng kỹ thuật chuyển gen”, mã số KC.06.11/11- 15. Tài Liệu Tham Khảo (References) Elbaidouri, M., Chaparro, C., & Panaud, O. (2013). Use of next generation sequencing (NGS) technologies for the genome-wide detection of transposition. Methods in Molecular Biology 1057, 265-274. Everman, W. J., Thomas, W. E., Burton, J. D., York, A. C., & Wilcut, J. W. (2009). Absorption, translo- cation, and metabolism of glufosinate in transgenic and nontransgenic cotton, Palmer amaranth (Amaran- thus palmeri), and pitted morning glory (Ipomoea la- cunosa). Weed Science 57(4), 357-361. FAO (Food and Agriculture Organization of the United Nations). (2018). Cotton area harvested and pro- duction quality. Retrieved June 12, 2020, from ageID=567. Khan, D., Variath, M., Ali, S., Jamil, M., Khan, M., Shafi, M., & Shuijin, Z. (2009). Genetic transformation of bar gene and its inheritance and segregation behavior in the resultant transgenic cotton germplasm (BR001). Pakistan Journal of Botany 41, 2167-2178. Li, H., Luo, J., Hemphill, J. K., Wang, J. T., & Gould, J. H. (2001). A rapid and high yielding DNA miniprep for cotton (Gossypium spp.). Plant Molecular Biology Reporter 19, 1-5. Tạp chí Nông nghiệp và Phát triển 19(5) www.jad.hcmuaf.edu.vn Trường Đại học Nông Lâm TP. Hồ Chí Minh 79 Nha, T. N., Anh, T. V. T., Trang, T. X. V., Trinh, N. U. N., Hai, H. P., Ngoc, B. P., Tri, M. B., Kiem, T. P., & Hop, M. T. (2016). Efficiency of herbicide resis- tant gene transformation via A. tumefaciens in cotton plant (Gossypium hirsutum L.). Sciene and Technol- ogy Journal of Agriculture and Rural Development 16, 10-19. OECD (Organization for Economic Cooperation and Development). (2008). Consensus document on the biology of cotton (Gossypium spp.). Paris, France: Organization for Economic Cooperation and Develop- ment. Perlak, F. J., Deaton, R. W., Armstrong, T. A., Fuchs, R. L., Sims, S. R., Greenplate, J. T., & Fischhoff, D. A. (1990). Insect resistant cotton plants. Bio/Technology 8(10), 939-943. USDA (United States Department of Agriculture). (2019). Cotton sector at a glance. Retrieved February 12, 2020, from https://www.ers.usda.gov/. Zhang, Y., Yin, X., Yang, A., Li, G., & Zhang, J. (2005). Stability of inheritance of transgenes in maize (Zea mays L.) lines produced using different transformation methods. Euphytica 144(1), 11-22. www.jad.hcmuaf.edu.vn Tạp chí Nông nghiệp và Phát triển 19(5)
File đính kèm:
 chon_loc_cac_dong_bong_gossypium_hirsutum_l_chuyen_gen_bar_c.pdf
chon_loc_cac_dong_bong_gossypium_hirsutum_l_chuyen_gen_bar_c.pdf

