Cải biến và thiết kế vector biểu hiện các gen cry1Ia có hoạt tính kháng sâu đục quả đậu tương Etiella zinkenella
Đậu tương (Glycine max L.) là một trong những cây trồng quan trọng có giá trị kinh tế cao. Tuy nhiên, năng
suất và chất lượng đậu tương bị ảnh hưởng nghiêm trọng bởi sự gây hại của sâu đục quả Etiella zinkenella
Treitschke. Hiện nay, mặc dù có nhiều nghiên cứu đã đánh giá ảnh hưởng của độc tố Cry tới sâu đục quả
trên nhiều đối tượng cây trồng khác nhau, nhưng trên cây đậu tương còn hạn chế. Trong nghiên cứu này,
đã cải biến thành công gen cry1Ia đồng thời thiết kế các cấu trúc vector biểu hiện gen cry1Ia dạng dại và cải
biến từ chủng Bacillus thuringiensis TH19 phân lập ở Việt Nam. Nghiên cứu này cung cấp các vật liệu phục
vụ cho việc chuyển gen cry1Ia dạng dại và cải biến vào cây đậu tương nhằm tăng khả năng kháng sâu đục
quả Etiella zinkenella.

Trang 1

Trang 2

Trang 3

Trang 4
Trang 5
Trang 6
Trang 7

Trang 8
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Cải biến và thiết kế vector biểu hiện các gen cry1Ia có hoạt tính kháng sâu đục quả đậu tương Etiella zinkenella

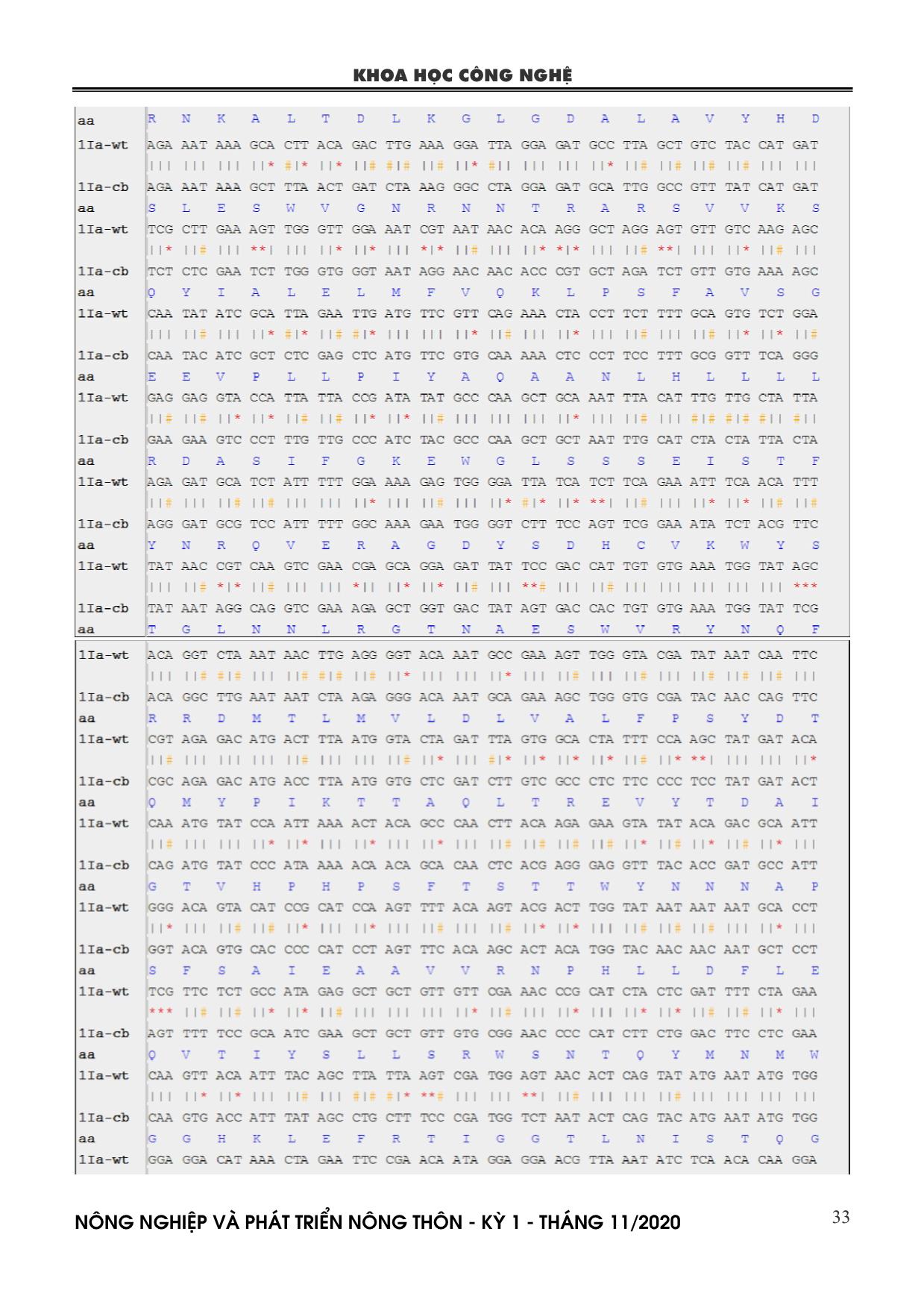
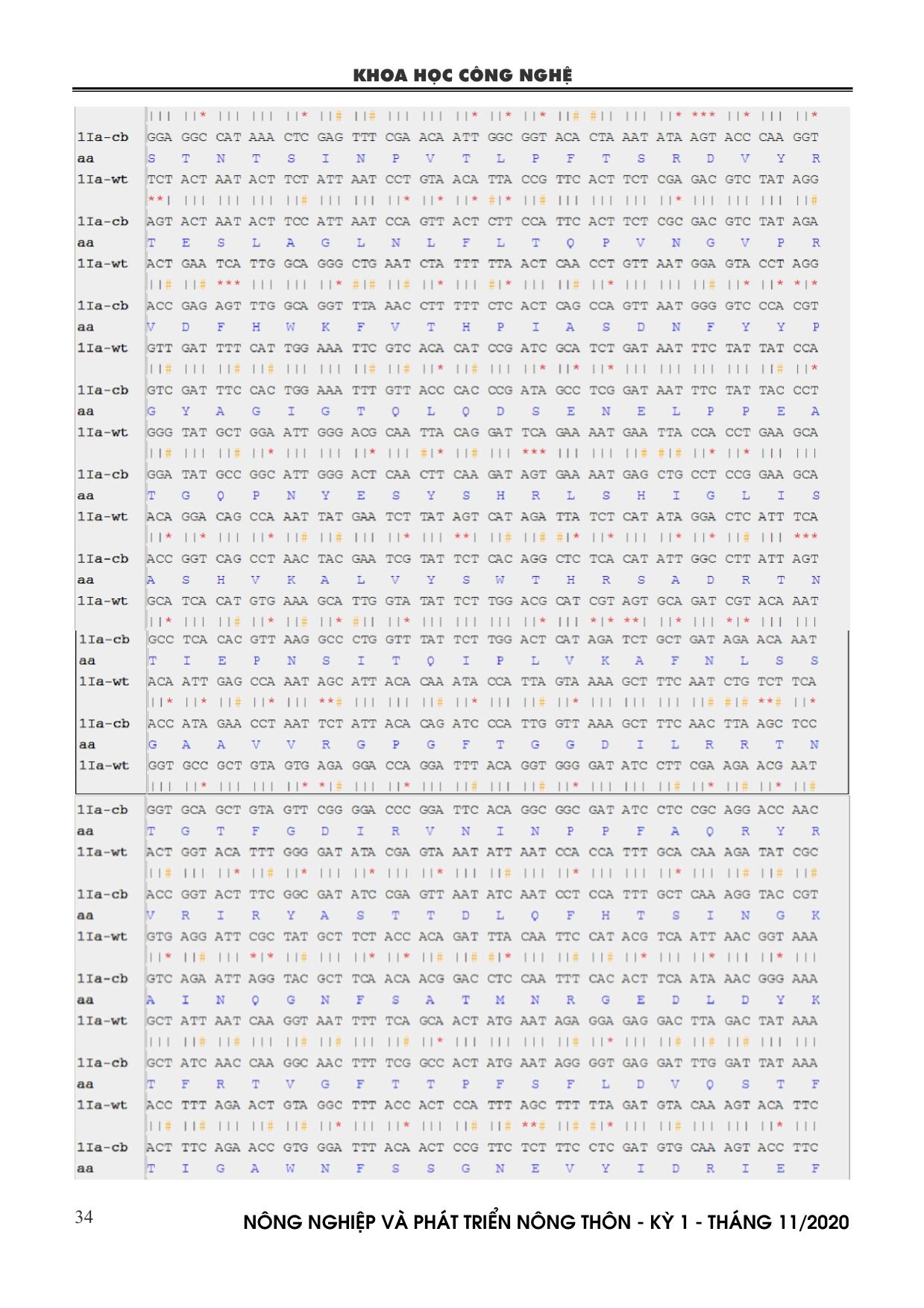
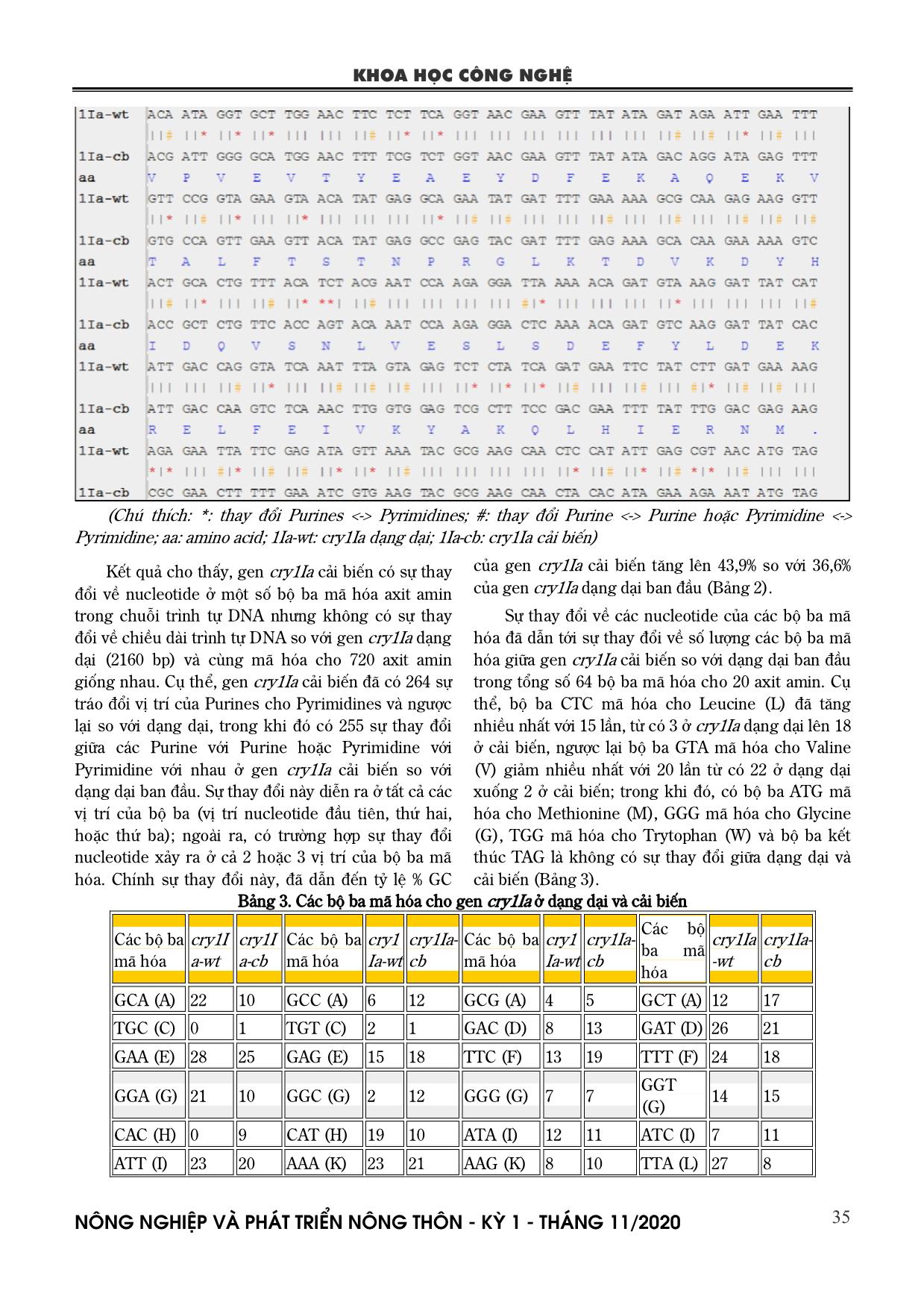
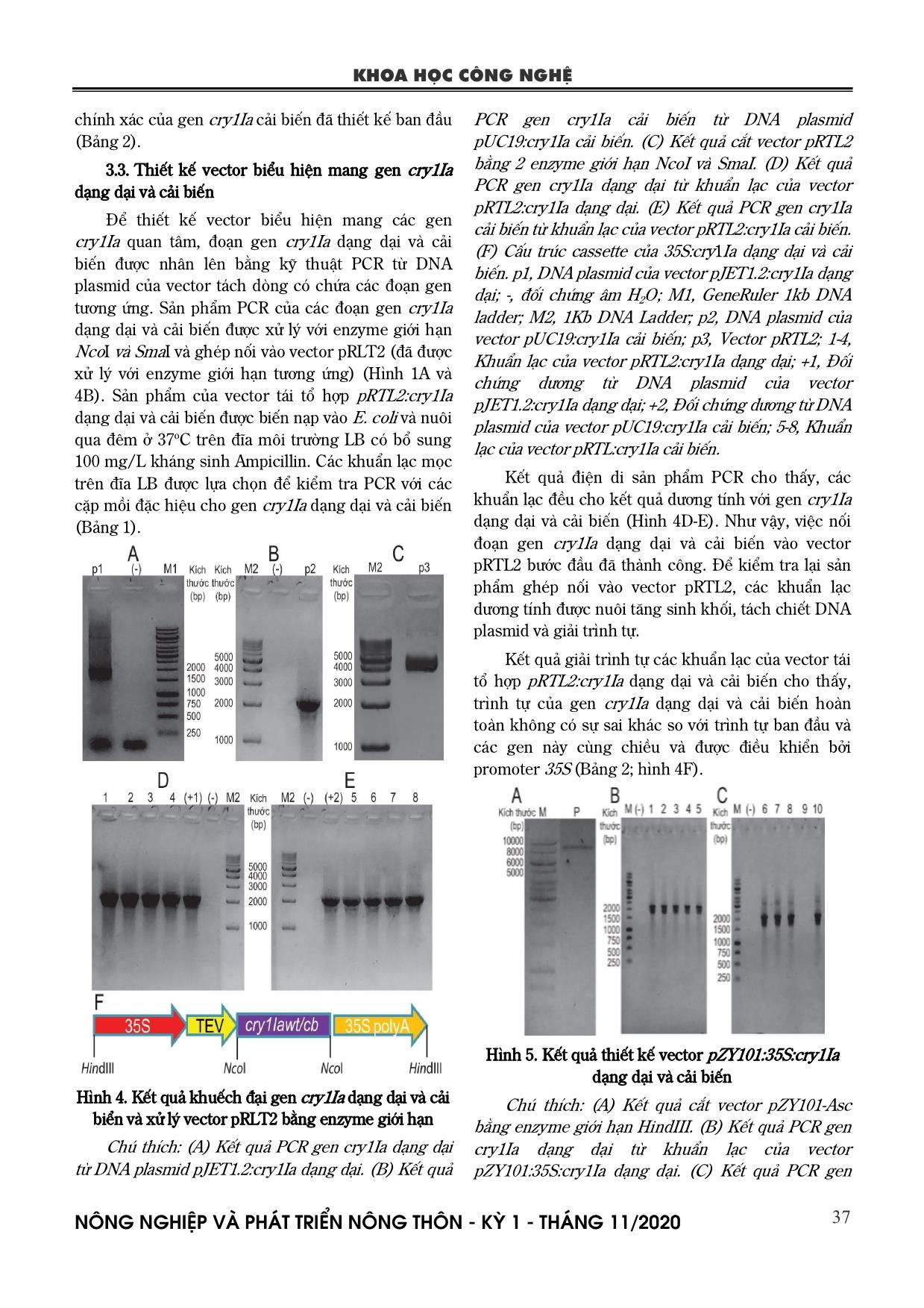
mã hóa cry1Ia -wt cry1Ia- cb GCA (A) 22 10 GCC (A) 6 12 GCG (A) 4 5 GCT (A) 12 17 TGC (C) 0 1 TGT (C) 2 1 GAC (D) 8 13 GAT (D) 26 21 GAA (E) 28 25 GAG (E) 15 18 TTC (F) 13 19 TTT (F) 24 18 GGA (G) 21 10 GGC (G) 2 12 GGG (G) 7 7 GGT (G) 14 15 CAC (H) 0 9 CAT (H) 19 10 ATA (I) 12 11 ATC (I) 7 11 ATT (I) 23 20 AAA (K) 23 21 AAG (K) 8 10 TTA (L) 27 8 KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 11/2020 36 TTG (L) 8 10 CTA (L) 14 8 CTC (L) 3 18 CTG (L) 3 5 CTT (L) 7 13 ATG (M) 11 11 AAC (N) 10 21 AAT (N) 37 26 CCA (P) 14 9 CCC (P) 0 8 CCG (P) 7 3 CCT (P) 8 9 CAA (Q) 24 18 CAG (Q) 5 11 AGA (R) 13 12 AGG (R) 6 10 CGA (R) 8 4 CGC (R) 2 4 CGG (R) 0 2 CGT (R) 6 3 AGC (S) 7 6 AGT (S) 14 14 TCA (S) 17 8 TCC (S) 1 11 TCG (S) 2 7 TCT (S) 20 15 ACA (T) 31 18 ACC (T) 4 16 ACG (T) 8 4 ACT (T) 15 20 GTA (V) 22 2 GTC (V) 5 11 GTG (V) 6 16 GTT (V) 14 18 TGG (W) 12 12 TAC (Y) 3 13 TAT (Y) 29 19 TAA (.) 0 0 TGA (.) 0 0 TAG (.) 1 1 Ngoài ra, khi phân tích các vùng bảo thủ (conserved domains) của cả gen cry1Ia dạng dại và cải biến đều cho thấy sự tương đồng về vùng bảo thủ endotoxin_N, endotoxin_M, và delta_endotoxin_C của chúng (Hình 2). Điều này cho thấy, gen cry1Ia dạng dại và cải biến tuy có sự sai khác về các bộ ba mã hóa nhưng trình tự và đặc tính của protein cry1Ia không thay đổi. Gen cry1Ia dạng dại và cải biến được sử dụng để thiết kế các vector biểu hiện thực vật phục vụ công tác chuyển gen vào cây đậu tương. Hình 2. Kết quả phân tích các vùng bảo thủ của gen cry1Ia dạng dại và cải biến 3.2. Tổng hợp nhân tạo và tách dòng gen cry1Ia cải biến Hình 3. Kết quả tách dòng gen cry1Ia cải biến Chú thích: (A) Kết quả PCR khuẩn lạc của vector tách dòng pUC19 chứa gen cry1Ia cải biến. M, PSA DNA Ladder; 1-12: sản phẩm PCR của 12 khuẩn lạc Gen cry1Ia sau khi cải biến thành công và bổ sung thêm vị trí của enzyme giới hạn NcoI và SmaI lần lượt vào phía trước đầu 5’ và 3’ được tổng hợp nhân tạo theo quy trình và phương pháp của Công ty Sinh hóa Phù Sa. Sản phẩm khuếch đại của gen cry1Ia cải biến sau khi tổng hợp nhân tạo được gắn vào vector pUC19. Tiếp theo, vector tách dòng pUC19 có chứa đoạn gen cry1Ia cải biến được biến nạp vào E. coli. Các khuẩn lạc mọc trên đĩa môi trường LB đặc có chứa 100 mg/L kháng sinh Ampicillin được lựa chọn để kiểm tra bằng PCR với cặp mồi pUC19-F/R (Bảng 1). Kết quả PCR khuẩn lạc cho thấy, trong tổng số 12 khuẩn lạc đã được lựa chọn có 3 khuẩn lạc cho kết quả dương tính với cặp mồi của vector pUC19 và có kích thước khoảng 2100 bp tương ứng với kích thước dựa đoán của gen cry1Ia cải biến ban đầu (Hình 3). Các khuẩn lạc dương tính với PCR được sử dụng để giải trình tự. Kết quả cho thấy, cả 3 khuẩn lạc có chứa plasmid tái tổ hợp với vùng trình tự hoàn toàn KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 11/2020 37 chính xác của gen cry1Ia cải biến đã thiết kế ban đầu (Bảng 2). 3.3. Thiết kế vector biểu hiện mang gen cry1Ia dạng dại và cải biến Để thiết kế vector biểu hiện mang các gen cry1Ia quan tâm, đoạn gen cry1Ia dạng dại và cải biến được nhân lên bằng kỹ thuật PCR từ DNA plasmid của vector tách dòng có chứa các đoạn gen tương ứng. Sản phẩm PCR của các đoạn gen cry1Ia dạng dại và cải biến được xử lý với enzyme giới hạn NcoI và SmaI và ghép nối vào vector pRLT2 (đã được xử lý với enzyme giới hạn tương ứng) (Hình 1A và 4B). Sản phẩm của vector tái tổ hợp pRTL2:cry1Ia dạng dại và cải biến được biến nạp vào E. coli và nuôi qua đêm ở 37oC trên đĩa môi trường LB có bổ sung 100 mg/L kháng sinh Ampicillin. Các khuẩn lạc mọc trên đĩa LB được lựa chọn để kiểm tra PCR với các cặp mồi đặc hiệu cho gen cry1Ia dạng dại và cải biến (Bảng 1). Hình 4. Kết quả khuếch đại gen cry1Ia dạng dại và cải biển và xử lý vector pRLT2 bằng enzyme giới hạn Chú thích: (A) Kết quả PCR gen cry1Ia dạng dại từ DNA plasmid pJET1.2:cry1Ia dạng dại. (B) Kết quả PCR gen cry1Ia cải biến từ DNA plasmid pUC19:cry1Ia cải biến. (C) Kết quả cắt vector pRTL2 bằng 2 enzyme giới hạn NcoI và SmaI. (D) Kết quả PCR gen cry1Ia dạng dại từ khuẩn lạc của vector pRTL2:cry1Ia dạng dại. (E) Kết quả PCR gen cry1Ia cải biến từ khuẩn lạc của vector pRTL2:cry1Ia cải biến. (F) Cấu trúc cassette của 35S:cry1Ia dạng dại và cải biến. p1, DNA plasmid của vector pJET1.2:cry1Ia dạng dại; -, đối chứng âm H2O; M1, GeneRuler 1kb DNA ladder; M2, 1Kb DNA Ladder; p2, DNA plasmid của vector pUC19:cry1Ia cải biến; p3, Vector pRTL2; 1-4, Khuẩn lạc của vector pRTL2:cry1Ia dạng dại; +1, Đối chứng dương từ DNA plasmid của vector pJET1.2:cry1Ia dạng dại; +2, Đối chứng dương từ DNA plasmid của vector pUC19:cry1Ia cải biến; 5-8, Khuẩn lạc của vector pRTL:cry1Ia cải biến. Kết quả điện di sản phẩm PCR cho thấy, các khuẩn lạc đều cho kết quả dương tính với gen cry1Ia dạng dại và cải biến (Hình 4D-E). Như vậy, việc nối đoạn gen cry1Ia dạng dại và cải biến vào vector pRTL2 bước đầu đã thành công. Để kiểm tra lại sản phẩm ghép nối vào vector pRTL2, các khuẩn lạc dương tính được nuôi tăng sinh khối, tách chiết DNA plasmid và giải trình tự. Kết quả giải trình tự các khuẩn lạc của vector tái tổ hợp pRTL2:cry1Ia dạng dại và cải biến cho thấy, trình tự của gen cry1Ia dạng dại và cải biến hoàn toàn không có sự sai khác so với trình tự ban đầu và các gen này cùng chiều và được điều khiển bởi promoter 35S (Bảng 2; hình 4F). Hình 5. Kết quả thiết kế vector pZY101:35S:cry1Ia dạng dại và cải biến Chú thích: (A) Kết quả cắt vector pZY101-Asc bằng enzyme giới hạn HindIII. (B) Kết quả PCR gen cry1Ia dạng dại từ khuẩn lạc của vector pZY101:35S:cry1Ia dạng dại. (C) Kết quả PCR gen KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 11/2020 38 cry1Ia cải biến từ khuẩn lạc của vector pZY101:35S:cry1Ia cải biến. M, GeneRuler 1kb DNA ladder; P, vector pZY101-Asc cắt; (-), Đối chứng âm H2O; 1, Đối chứng dương từ DNA plasmid của vector pJET1.2:cry1Ia dạng dại; 2-5, Khuẩn lạc của vector pZY101:35S:cry1Ia dạng dại; 6, Đối chứng dương từ DNA plasmid của vector pUC19:cry1Ia cải biến; 7-10, Khuẩn lạc của vector pZY101:35S:cry1Ia cải biến. Sau khi chuyển thành công đoạn gen cry1Ia dạng dại và cải biến vào vector pRTL2, các cấu trúc 35S:cry1Ia dạng dại và cải biến được cắt từ từ vector tái tổ hợp pRTL2:cry1Ia dạng dại và cải biến bằng enzyme giới hạn HindIII và ghép nối vào vector biểu hiện thực vật pZY101-Asc (cũng đã cắt mở vòng và xử lý ở cùng vị trí enzyme giới hạn) (Hình 1B và 5A) bằng enzyme T4 DNA ligase. Sản phẩm nối của vector tái tổ hợp pZY101:35S:cry1Ia dạng dại và cải biến được biến nạp vào chủng vi khuẩn E. coli Top10 và nuôi qua đêm trên đĩa môi trường LB có bổ sung kháng sinh Spectinomycin 50 mg/L và Streptomycin 50 mg/L ở 37oC. Các khuẩn lạc mọc trên môi trường LB có bổ sung kháng sinh được lựa chọn để kiểm tra bằng PCR với các cặp mồi đặc hiệu 1Iawt-NcoI- F/1Iawt-SmaI-R và 1Iacb-NcoI-F/1Iacb-SmaI-R cho gen cry1Ia dạng dại và cải biến (Bảng 1). Kết quả cho thấy, hầu hết các khuẩn lạc đều cho kết quả dương tính với các cặp mồi đặc hiệu của gen cry1Ia dạng dại và cải biến (Hình 5B-C). Như vậy, đã bước đầu thiết kế thành công vector biểu hiện pZY101:35S:cry1Ia dạng dại và cải biến. Sau đó, các vector tái tổ hợp này tiếp tục được kiểm tra và biến nạp vào các chủng vi khuẩn A. tumefaciens nhằm phục vụ cho công tác chuyển gen vào đậu tương. Hiện nay, sâu đục quả được biết tới là một trong những loại côn trùng gây hại ảnh hưởng nghiêm trọng tới các cây trồng quan trọng nói chung và cây đậu tương nói riêng. Để đối phó với tình hình sâu hại này, cho đến nay đã có nhiều các công trình nghiên cứu cho thấy các gen được phân lập từ các chủng vi khuẩn Bt có khả năng diệt được loại sâu tương đối đa dạng. Trong đó, một số nghiên cứu chỉ ra rằng, sự biểu hiện của gen cry1Ia trong cây bông chuyển gen đã giúp cho chúng có khả năng tiêu diệt một số loài sâu bọ cánh cứng đục quả và sâu keo mùa thu trên cây bông (de-Oliveira et al., 2016; Silva et al., 2016; Tounsi et al., 2003). Tuy nhiên, chưa có nghiên cứu đánh giá chức năng của độc tố do gen cry1Ia mã hóa trên đối tượng sâu đục quả ở cây đậu tương. Do vậy, trong nghiên cứu này đã tiến hành cải biến gen cry1Ia từ dạng dại ban đầu được phân lập từ chủng Bt TH19 ở Việt Nam và thiết kế thành công các vector biểu hiện pZY101:35S:cry1Ia dạng dại và cải biến. Với việc thiết kế thành công vector biểu hiện pZY101:35S:cry1Ia dạng dại và cải biến này, hy vọng rằng có thể sử dụng các cấu trúc véc tơ này để tạo các giống đậu tương chuyển gen không chỉ được tăng cường khả năng tiêu diệt sâu đục quả mà còn cả với các đối tượng sâu hại khác. 4. KẾT LUẬN Các kết quả trong nghiên cứu cho thấy, gen cry1Ia dạng dại đã được cải biến bằng việc chỉnh sửa các bộ ba mã hóa của các axit amin nhưng không làm thay đổi cấu trúc và chức năng của protein Cry1Ia dạng dại ban đầu. Các cấu trúc vector biểu hiện pZY101:35S:cry1Ia dạng dại và cải biến đã được thiết kế thành công sẽ thích hợp cho biến nạp gen vào cây đậu tương nhằm tăng cường khả năng diệt sâu đục quả. LỜI CẢM ƠN Công trình nghiên cứu được thực hiện trong khuôn khổ đề tài “Phân lập thiết kế gen kháng sâu tạo giống đậu tương biến đổi gen” theo Quyết định số 4495/QĐ-BNN-KHCN ngày 31/10/2016 của Bộ trưởng Bộ Nông nghiệp và PTNT về việc Phê duyệt danh mục các nhiệm vụ khoa học và công nghệ thực hiện từ năm 2017 thuộc Chương trình CNSH Nông nghiệp – Thủy sản. TÀI LIỆU THAM KHẢO 1. Berg V. D., Shepard B. M., Nasikin (1998). Response of soybean to attack by stemfly KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 11/2020 39 Melagagromyza sofiae in farmers’ fields in Indonesia. Journal of Applied Ecology, 35: 514-522. 2. Crickmore N., Zeigler D. R., Schnepf E., van Rie J., Lereclus D., Baum J., Bravo A., Dean D. H. (2013). Bacillus thuringiensis Toxin Nomenclature. Available online: sussex.ac.uk/Home/Neil_Crickmore/Bt/. 3. de-Oliveira R. S., Oliveira-Neto O. B., Moura H. F., de Macedo L. L., Arraes F. B., Lucena W. A., Lourenco-Tessutti I. T., de Deus Barbosa A. A., da Silva M. C., Grossi-de-Sa M. F. (2016). Transgenic Cotton Plants Expressing Cry1Ia12 Toxin Confer Resistance to Fall Armyworm (Spodoptera frugiperda) and Cotton Boll Weevil (Anthonomus grandis). Front Plant Sci, 7: 165. 4. Erickson B (2008). Corn/soybean rotation literature summary. Purdue Univ West Lafayetter IN. 5. FAOSTAT (2019). Food and agriculture organization of the United Nations (FAO) statistical databases, Available at: Retrieved 10 august 2019. 6. Froger A. and Hall J. E (2007). Transformation of plasmid DNA into E. coli using the heat shock method. Journal of visualized experiments, JoVE(6): 253-253. 7. Gain U (2018). Vietnam—oilseeds and products annual 2018, Global agricultural information network (Gain) report VM8018, USDA Gain, Hanoi, Vietnam. 8. Hudson L., Bost K., Piller K. (2011). Optimizing Recombinant Protein Expression in Soybean, Soybean - Molecular Aspects of Breeding, Aleksandra Sudaric, IntechOpen, DOI: 10.5772/15111. Available from: https://www.intechopen.com/books/soybean- molecular-aspects-of-breeding/optimizing- recombinant-protein-expression-in-soybean 9. Kumar S., Chandra A., Pandey K. C. (2008). Bacillus thuringiensis (Bt) transgenic crop: an environment friendly insectpest management strategy. J Environ Biol, 29(5):64-153. 10. Morrison M. J., Cober E. R., Gregorich E. G., Voldeng H. D., Ma B., Topp G. C. (2017). Tillage and crop rotation effects on the yield of corn, soybean, and wheat in eastern Canada. Can. J. Plant Sci, 98: 183-191. 11. Mourtzinis S., Marburger D., Gaska J., Diallo T., Lauer J. G., Conley S. (2017). Corn, soybean, and wheat yield response to crop rotation, nitrogen rates, and foliar fungicide application. Crop Sci, 57: 983-992. 12. Murray E. E., Lotzer J., Eberle M. (1989). Codon usage in plant genes. Nucleic Acids Res, 17(2): 477-498. 13. Silva C. R., Monnerat R., Lima L. M., Martins E. S., Melo Filho P. A., Pinheiro M. P., Santos R. C. (2016). Stable integration and expression of a cry1Ia gene conferring resistance to fall armyworm and boll weevil in cotton plants. Pest Manag Sci, 72(8): 1549- 1557. 14. Tabata J., Yokosuka T., Hattori M., Ohashi M., Noguchi H., Sugie H. (2008). Sex attractant pheromone of the limabean pod borer, Etiella zinckenella (Treitschke) (Lepidoptera: Pyralidae), in Japan. Appl. Entomol. Zool, 43 (3): 351–358. 15. Tounsi S., Zouari N., Jaoua S. (2003). Cloning and study of the expression of a novel cry1Ia-type gene from Bacillus thuringiensis subsp. kurstaki. J Appl Microbiol, 95(1): 23-28. 16. USDA (2012). Field Release of Aphelinus glycinis (Hymenoptera: Aphelinidae) for Biological Control of the Soybean Aphid, Aphis glycines (Hemiptera: Aphididae), in the Continental United States. Environmental Assessment. 17. Zhang L., Guo Y., Luo L., Wang Y. P., Dong Z. M., Sun S. H., Qiu L. J. (2011). Analysis of Nuclear Gene Codon Bias on Soybean Genome and Transcriptome. Acta Agronomica Sinica, 37(6): 965- 974. KHOA HỌC CÔNG NGHỆ N«ng nghiÖp vµ ph¸t triÓn n«ng th«n - KỲ 1 - TH¸NG 11/2020 40 MODIFICATION AND CONSTRUCTION OF EXPRESSION VECTOR CARRYING cry1Ia GENES CONFERRING RESISTANCE TO SOYBEAN POD BORER Etiella zinkenella Nguyen Huu Kien1, Nguyen Thi Hoa1, Le Thi Mai Huong1, Nguyen Trung Anh1, Nguyen Tuan Minh1, Dinh Thi Mai Thu1, Tong Thi Huong1, Dinh Thi Thu Ngan1, Nguyen Nhat Linh1, Nguyen Anh Vu1, Le Thi Thu Hien2, Nguyen Van Dong1* 1Agricultural Genetics Institute, Vietnam Academy of Agricultural Sciences 2Institute of Genome Research, Vietnam Academy of Science and Technology Email: dongjircas@yahoo.com Summary Soybean (Glycine max L.) is one of the most economically important crops. However, the yield and quality of soybean are seriously affected by the infestation of pod borer Etiella zinkenella Treitschke. Recently, numerous studies have evaluated effects of Cry toxin on pod borer Etiella zinkenella on different crops but studying on soybean is still limited. In this study, we modified the cry1Ia gene and constructed the expression vectors carrying the wild- and modified-cry1Ia genes from the isolated Bacillus thuringiensis strain TH19 in Vietnam. Our present study provides materials for transforming the wild- and modified- cry1Ia genes into soybean to increase resistance to pod borer Etiella zinkenella. Keywords: Bacillus thuringiensis, cry1Ia, Etiella zinkenella, pZY101-Asc vector, soybean. Người phản biện: PGS.TS. Hà Viết Cường Ngày nhận bài: 19/5/2020 Ngày thông qua phản biện: 19/6/2020 Ngày duyệt đăng: 26/6/2020
File đính kèm:
 cai_bien_va_thiet_ke_vector_bieu_hien_cac_gen_cry1ia_co_hoat.pdf
cai_bien_va_thiet_ke_vector_bieu_hien_cac_gen_cry1ia_co_hoat.pdf

